Цитология, 2021, T. 63, № 6, стр. 557-567
Метод одновременного выявления глиальных клеток и скоплений амилоида на светооптическом уровне
О. И. Носова 1, *, В. В. Гусельникова 1, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: nosova@neuro.nnov.ru
Поступила в редакцию 30.06.2021
После доработки 13.07.2021
Принята к публикации 22.07.2021
Аннотация
Тесная пространственная взаимосвязь клеток глии (астроглии и микроглии) с амилоидными бляшками является одним из гистопатологических проявлений болезни Альцгеймера. Цель работы состояла в разработке простого и информативного метода для одновременного выявления амилоидных бляшек и клеток глии, основанного на сочетании гистохимического метода выявления амилоида и нефлуоресцентных иммуногистохимических методов выявления глиальных клеток. Материалом для исследования служили образцы коры головного мозга пожилых людей (n = 8) и образцы головного мозга трансгенных мышей линии 5×FAD (n = 6). Суть предложенного методического подхода состоит в постановке иммуногистохимической реакции на маркерный белок микроглии или астроглии с последующим окрашиванием срезов фталоцианиновым красителем альциановым синим. Предложенный подход характеризуется простотой и хорошей воспроизводимостью, позволяя выявлять ассоциацию клеток глии с амилоидными бляшками. Было отмечено, что постановка иммуногистохимической реакции на кальций-связывающий белок Iba-1 (маркер микроглии) и глиальный фибриллярный кислый белок GFAP (маркер астроглии) позволяет наиболее эффективно идентифицировать микроглиоциты и астроциты соответственно, а также подходит для оценки функционального статуса этих клеток. Последующая подкраска срезов альциановым синим по отработанному протоколу позволяет получить высокую интенсивность окраски амилоида, делая амилоидные бляшки хорошо различимыми. По сравнению с альтернативной методикой одновременного выявления клеток глии и амилоидных бляшек, предполагающей постановку двойной иммунофлуоресцентной реакции, разработанный метод прост в реализации и требует наличия только светового микроскопа, что делает его доступным большинству научно-исследовательских и клинико-диагностических лабораторий.
Селективная идентификация глиальных клеток – астроцитов и микроглиоцитов – затруднительна при использовании классических методов гистологической окраски. Использование современных иммуногистохимических методик позволяет достаточно полно выявлять эти клеточные популяции и дает возможность оценить их функциональное состояние при моделировании патологических процессов. Одним из интенсивно исследуемых патологических процессов является болезнь Альцгеймера (БА) – прогрессирующее нейродегенеративное заболевание, которое сопровождается снижением когнитивных функций и потерей памяти (Mucke, 2009; Acosta et al., 2017). Основными гистопатологическими признаками, регистрируемыми в головном мозге при развитии БА, являются внутриклеточные нейрофибриллярные клубки, состоящие из гиперфосфорилированного тау-белка, и амилоидные бляшки, представляющие собой внеклеточные отложения бета-амилоидных фибрилл (Acosta et al., 2017). Механизм формирования амилоидных отложений, участие глиальных клеток в формировании амилоидных бляшек и потенциальные возможности резорбции амилоида являются актуальными направлениями в изучении данного заболевания, для анализа патогенеза которого разработаны и используются различные экспериментальные модели (Stepanichev et al., 2006; Chumasov et al., 2012; LaFerla, Green, 2012).
В последнее время все более очевидной становится ключевая роль глии в развитии и прогрессировании БА. При этом представления о функциях клеток глии при развитии БА продолжают оставаться противоречивыми (Olabarria et al., 2010; Condello et al., 2015; Kelly et al., 2018; Habib et al., 2020). Многими исследователями отмечается тесная пространственная взаимосвязь клеток астроглии и микроглии с амилоидными бляшками при БА (Rodríguez-Arellano et al., 2016; Ferrer, 2017; Hansen et al., 2018; Verkhratsky et al., 2019). Для визуализации такого рода взаимосвязи обычно применяется метод двойного иммунофлуоресцентного маркирования в сочетании с конфокальной микроскопией. Однако, эта методика сложна для использования в масштабных скрининговых исследованиях и не всегда удобна для проведения микроанатомического анализа. В связи с этим, актуальным представляется разработка более простой и доступной методики, позволяющей эффективно визуализировать амилоидные бляшки и глиальные клетки головного мозга.
Целью работы стала разработка простого и информативного метода для одновременного выявления амилоидных бляшек и клеток глии, основанного на сочетании гистохимического метода выявления амилоида и нефлуоресцентных иммуногистохимических методов выявления глиальных клеток.
МАТЕРИАЛ И МЕТОДИКА
Исследования проводили с использованием срезов коры головного мозга людей обоих полов (79–98 лет, n = 8) и срезов головного мозга трансгенных мышей линии 5×FAD (самцов и самок, n = 6) в возрасте 8 мес. Материал получен из архива Отдела общей и частной морфологии ФГБНУ “ИЭМ”. Все исследования проведены в полном соответствии с этическими принципами и правилами Европейской Конвенции ЕТ/S 129 (1986) и директивами 2010/63/EU, а также в соответствии с заключениями локального этического комитета № 58-9/1-654 от 11.12.2009 г и № 3/18 от 22.11.2018 г.
Линия 5×FAD (5 Familiar Alzheimer’s Disease, MMRC, #34840) является общепринятой моделью наследственной формы БА и представляет собой линию трансгенных мышей с пятью мутациями: три в генах APP-белка (Swedish (K670N/M671L), Florida (I716V), London (V717I)) и две в генах пресенилина 1 (M146L, L286V). Эта линия воспроизводит основные признаки амилоидоза, характерного для БА. Патологический фенотип включает образование амилоидных бляшек в коре, гиппокампе и стриатуме головного мозга, начиная с 2-х месячного возраста, а также глиоз, нейродегенерацию, нарушения памяти (Oakley et al., 2006).
Образцы коры головного мозга человека были зафиксированы в 10%-ном формалине. Образцы головного мозга мышей 5×FAD были зафиксированы в цинк-этанол-формальдегиде (Korzhevskii et al., 2015) и после стандартной гистологической проводки были залиты в парафин по описанной ранее методике (Носова и др., 2021). С парафиновых блоков изготавливали срезы толщиной 10 мкм, которые наклеивали на предметные стекла с адгезивным покрытием (Thermo Fisher Scientific, США) и высушивали в термостате при 37°С в течение 48 ч.
Для скрининга архивных образцов головного мозга животных и человека на наличие/отсутствие амилоида использовали краситель Конго красный и кроличьи поликлональные OC-антитела к конформационным эпитопам амилоидных фибрилл (Sigma-Aldrich, США).
В табл. 1 приведен перечень первичных антител, использованных в исследовании.
Таблица 1.
Перечень использованных первичных антител
| Антитела | Фирма, страна | Использованное разведение | Выявляемые клетки/структуры | |
|---|---|---|---|---|
| 1. | Кроличьи поликлональные антитела против глиального фибриллярного кислого белка, GFAP | Agilent, США | Ready-to-use (разведение производителя) | Астроциты (в тканях головного мозга мыши) |
| 2. | Мышиные моноклональные (клон GA5) антитела против GFAP | Monosan, Нидерланды | Ready-to-use (разведение производителя) | Астроциты (в тканях головного мозга человека) |
| 3. | Кроличьи поликлональные антитела против белка S100beta | Agilent, США | 1 : 900 | Астроциты |
| 4. | Кроличьи поликлональные антитела против Iba-1 | Biocare medical, США | 1 : 900 | Микроглия |
| 5. | Кроличьи поликлональные антитела против глутамат-декарбоксилазы, GAD67 | Spring Bioscience, США | 1 : 300 | ГАМК-ергические интернейроны Астроциты (?) |
В качестве вторичных реагентов в случае использования кроличьих первичных антител применяли набор Reveal Polyvalent HRP DAB Detection System (Spring Bioscience, США). В случае использования мышиных моноклональных антител против GFAP, которые были применены только при исследовании коры головного мозга человека, в качестве вторичных реагентов использовали набор MACH2 Universal HRP Polymer Kit for mouse or rabbit (Biocare Medical, США).
Разработанный протокол окраски препаратов:
1. Срезы депарафинировать в ксилолах и регидратировать в спиртах стандартным способом.
2. Промыть препараты в дистиллированной воде в течение 5 мин.
3. Поместить препараты в предварительно нагретый до 60°С модифицированный цитратный буфер S1700 (Agilent, США) и нагревать в пароварке в течение 23 мин.
4. Остывшие предметные стекла со срезами промыть в дистиллированной воде (5 мин) и поместить в 3%-ный раствор перекиси водорода на 10 мин (для блокировки активности эндогенной пероксидазы).
5. Последовательно промыть препараты в дистиллированной воде (5 мин) и 0.01 М фосфатно-солевом буферном растворе (PBS, 5 мин).
6. Нанести на срезы блокировочный раствор Protein Block (Spring Bioscience, США) и инкубировать 10 мин при комнатной температуре.
7. Удалить блокировочный раствор со срезов и, не промывая препараты, нанести на них раствор первичных антител в необходимом разведении (см. табл. 1). Препараты поместить во влажные камеры и оставить в термостате при температуре 27.5°С на 18 ч.
8. Удалить со срезов раствор первичных антител и промыть препараты в PBS в течение 10 мин.
9. Нанести на срезы раствор вторичных антител, конъюгированных с пероксидазой хрена, поместить препараты во влажные камеры и инкубировать при температуре 27.5°С в течение 25 мин.
10. Удалить со срезов раствор вторичных антител и последовательно промыть препараты в PBS (5 мин) и дистиллированной воде (5 мин).
11. Нанести на срезы рабочий раствор 3,3'-диаминобензидина из набора DAB+ (Agilent, США). Контролируя процесс образования коричневого продукта иммуногистохимической реакции под микроскопом, остановить реакцию в момент достижения оптимального соотношения сигнал/фон, удалив раствор DAB со срезов и промыв препараты в двух сменах дистиллированной воды (по 5 мин каждая).
12. Нанести на срезы раствор красителя альцианового синего (BioVitrum, Россия) и инкубировать препараты во влажных камерах в термостате при температуре 40°С в течение 40 мин.
13. Удалив раствор красителя со срезов, промыть препараты в дистиллированной воде (5 мин), обезводить и просветлить в спиртах и ксилолах по стандартной схеме и заключить в перманентную среду Cytoseal 60 (Thermo Fisher Scientific, США).
Полученные препараты анализировали с помощью светового микроскопа Leica DM750 (Германия) и фотографировали с использованием фотокамеры ICC50 (Leica, Германия). Анализ полученных изображений проводили в компьютерной программе LAS EZ (Leica, Германия).
РЕЗУЛЬТАТЫ
Результаты применения разработанного протокола представлены на рис. 1–4.
Рис. 1.
Одновременное выявление амилоидных бляшек и микроглии в коре (а, б) и гиппокампе (в, г) головного мозга 5×FAD мышей. Рамкой на фрагменте в обозначена зона, которая показана на фрагменте г при большем увеличении. Иммуногистохимическая реакция на Iba-1 с подкраской альциановым синим. Масштабный отрезок равен 50 мкм (а, в) и 20 мкм (б, г).
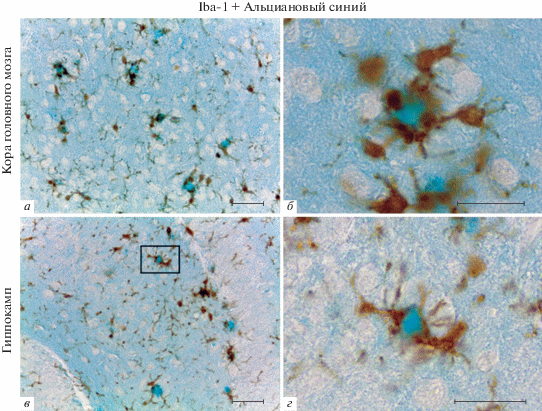
Рис. 2.
Одновременное выявление скоплений амилоида и астроцитарного белка промежуточных филаментов GFAP в коре (а, б) и гиппокампе (в, г) мозга мышей линии 5×FAD. Иммуногистохимическая реакция на GFAP с подкраской альциановым синим. Масштабный отрезок равен 50 мкм (а, в) и 20 мкм (б, г).
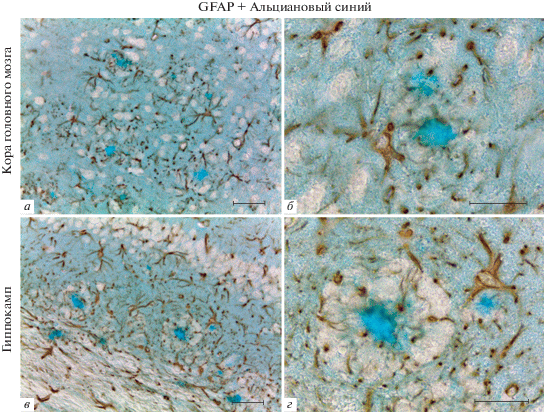
Рис. 3.
Одновременное выявление скоплений амилоида и астроцитарного белка промежуточных филаментов GFAP в коре головного мозга человека. Иммуногистохимическая реакция на GFAP с подкраской альциановым синим. Масштабный отрезок равен 200 мкм (а) и 50 мкм (б–г).
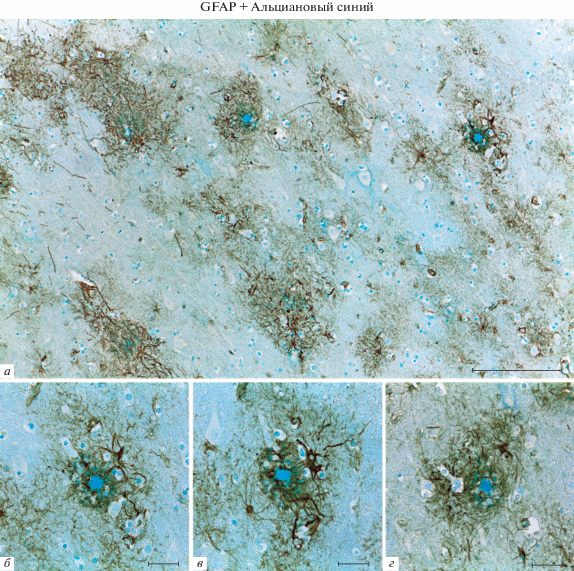
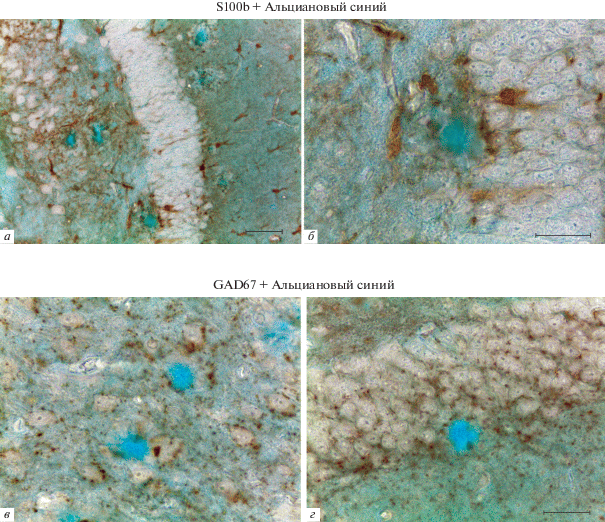
Рис. 4.
Одновременное выявление амилоидных бляшек/S100beta-иммунопозитивных астроцитов (а, б) и амилоидных бляшек/GAD67-иммунопозитивных структур в головном мозге мышей линии 5×FAD. Иммуногистохимическая реакция на белок S100beta (а, б) и GAD67 (в, г) с подкраской альциановым синим. а, б, г – Зубчатая фасция гиппокампа, в – участок коры головного мозга. Масштабный отрезок равен 50 мкм (а) и 20 мкм (б–г).
Во всех исследованных образцах головного мозга 5×FAD мышей нами были выявлены скопления амилоида, окрашенные альциановым синим в насыщенный синий цвет (рис. 1–4). Полученная при использовании предложенного протокола интенсивность окраски амилоида позволяет легко визуализировать бляшки, которые четко выявляются на фоне других структур (рис. 1–4). Мы не обнаружили морфологических различий между амилоидными бляшками, локализованными в разных отделах головного мозга 5×FAD мышей. Все выявленные бляшки характеризовались интенсивной окраской и выглядели как компактные образования округлой формы с волокнистой структурой.
Метод одновременного выявления амилоидных бляшек и микроглии. Постановка иммуногистохимической реакции на Iba-1 с последующей подкраской срезов альциановым синим позволяет одновременно выявлять микроглиоциты и амилоидные бляшки в коре и гиппокампе 5×FAD мышей (рис. 1). При анализе препаратов была отмечена пространственная ассоциация Iba-1-иммунопозитивных клеток микроглии со скоплениями амилоида, окрашенными альциановым синим (рис. 1). Клетки микроглии, окружающие амилоидные бляшки, характеризовались наличием признаков активации, среди которых увеличение размеров тел, укорочение и утолщение отростков. Было отмечено, что отростки активированных микроглиоцитов тянутся в направлении амилоидных бляшек и окружают их по периферии, формируя крупные, темноокрашенные расширения на концах (рис. 1). Микроглия вне амилоидных бляшек имела нормальную разветвленную морфологию.
Метод одновременного выявления амилоидных бляшек и астроцитов с применением антител против GFAP. При использовании антител против GFAP с последующей подкраской срезов альциановым синим иммунопозитивные клетки с морфологией астроцитов и амилоидные бляшки, окрашенные в синий цвет альциановым синим, были идентифицированы на всех проанализированных препаратах (рис. 2а–г). Одновременное окрашивание этих структур позволило выявить пространственную ассоциацию GFAP-иммунопозитивных отростков астроцитов с амилоидными бляшками. На концах отростков, контактирующих с бляшками, часто присутствуют небольшие GFAP-иммунопозитивные утолщения, локализованные по периферии амилоидного скопления (рис. 2б, г). Вблизи некоторых амилоидных бляшек обнаруживались тела астроцитов. Было отмечено присутствие морфологических признаков реактивной активации астроцитов, среди которых увеличение размеров тел и утолщение отростков (рис. 2б, г).
Аналогичные результаты были получены при применении метода GFAP/альциановый синий для окраски срезов головного мозга человека (рис. 3). Интересно, что в данном случае ассоциация активированных астроцитов с амилоидными бляшками имела более выраженный характер по сравнению с препаратами головного мозга 5×FAD мышей. В коре головного мозга человека на малом увеличении микроскопа (×10) четко просматривается характерная “пятнистость”, обусловленная концентрированием GFAP-иммунопозитивных астроцитов вокруг скоплений амилоида (рис. 3а). Астроциты, окружающие амилоидные скопления, характеризуются выраженной гипертрофией тел и отростков и высокоинтенсивной реакцией на GFAP (рис. 3б–г). В области амилоидных бляшек наблюдается высокая плотность GFAP-иммунопозитивных отростков астроцитов, в то время как в участках ткани между амилоидными бляшками плотность GFAP-иммунопозитивных элементов визуально ниже. Это и создает эффект “пятнистости”, наблюдаемый на препаратах коры головного мозга человека после использования метода GFAP/альциановый синий. Ранее нами было отмечено, что постановка иммуногистохимической реакции на GFAP может быть использована для предварительного анализа имеющихся образцов головного мозга человека на наличие или отсутствие амилоидных скоплений (Guselnikova et al., 2019).
Метод одновременного выявления амилоидных бляшек и астроцитов с применением антител против S100beta. Для одновременного выявления астроцитов и амилоидных бляшек также может быть использована иммуногистохимическая реакция на белок S100beta с последующей подкраской срезов альциановым синим. Результаты применения этой методики представлены на рис. 4а, б. В этом случае выявляются астроциты с признаками активации, ассоциированные с амилоидными бляшками. Активированные астроциты располагаются по периферии скоплений амилоида и характеризуются высоким уровнем экспрессии белка S100beta. При этом контуры S100beta-иммунопозитивных тел и отростков астроцитов очерчены нечетко, ветвление отростков плохо прослеживается.
В случае использования антител против S100beta на срезах присутствует небольшое фоновое окрашивание ткани, из-за которого скопления амилоида приобретают более бирюзовый оттенок (рис. 4а, б). Интенсивность окраски при этом не снижается, что позволяет легко идентифицировать амилоидные бляшки, в том числе на малом увеличении микроскопа.
Метод одновременного выявления амилоидных бляшек и GAD67-иммунопозитивных структур. При использовании антител против GAD67 интенсивная реакция на этот белок была выявлена в исследованных отделах мозга 5×FAD мышей (рис. 4в, г). При этом, ни в одном из исследованных случаев нами не было обнаружено иммуноокрашивания отростчатых клеток, которые могли бы быть идентифицированы как астроциты. Продукт иммуногистохимической реакции на GAD67 был распределен в пределах среза в виде мелких дискретных скоплений с концентрированием вокруг сомы нейронов (рис. 4в, г). Нами не было выявлено пространственной ассоциации GAD67-иммунопозитивных структур с амилоидными бляшками.
ОБСУЖДЕНИЕ
Активация клеток глии (астроглии и микроглии) является важным нейрогистологическим признаком БА (Orellana et al., 2011; Verkhratsky et al., 2016; Hansen et al., 2018). Многочисленными исследователями было отмечено присутствие активированных астроцитов и микроглиоцитов в непосредственной близости от скоплений амилоида, представляющих собой внеклеточные агрегаты нерастворимых белковых фибрилл (Condello et al., 2015; Garwood et al., 2017; Tzioras et al., 2019; Katsouri et al., 2020). Изучение этой пространственной ассоциации является целью многочисленных нейробиологических исследований, что актуализирует проблему поиска новых способов для ее визуализации. В рамках проведенного исследования нами был предложен новый методический подход, позволяющий одновременно выявлять клетки глии и амилоидные скопления с применением только световой микроскопии. Данный подход заключается в иммуногистохимическом выявлении одного из маркерных белков глиальных клеток с последующей подкраской срезов гистохимическим красителем альциановым синим.
Способность альцианового синего окрашивать скопления амилоида известна давно (Pomerance et al., 1976). Молекулы этого красителя способны взаимодействовать с полианионами кислых гликозамингликанов, которые вовлечены в процесс агрегации бета-амилоида в нерастворимые фибриллы (Snow et al., 1987). В результате этого взаимодействия в местах присутствия амилоидных фибрилл при реакции с альциановым синим происходит формирование синего осадка (Snow et al., 1994). Ранее нами была продемонстрирована эффективность использования альцианового синего для выявления амилоидных бляшек в коре головного мозга человека (Guselnikova et al., 2019).
В рамках представленной работы нами был отработан оптимальный режим обработки препаратов альциановым синим, который позволил получить высокую интенсивность окраски амилоидных бляшек, делая их хорошо различимыми. Возможно, наблюдаемая высокая интенсивность окраски амилоида альциановым синим связана с предварительным проведением процедуры тепловой обработки срезов в цитратном буфере. Эта процедура направлена на восстановление нативной структуры белка, измененной в результате коагуляции белков и образования перекрестных сшивок при воздействии альдегидных фиксаторов. Конформационные изменения, которые претерпевают тканевые антигены в процессе фиксации, во многих случаях приводят к маскировке антигенных детерминант, с которыми должны взаимодействовать антитела. Восстановить антигенные детерминанты, которые были изменены при взаимодействии с формальдегидом, позволяет тепловое демаскирование – высокотемпературная обработка срезов в водных буферных растворах (Коржевский и др., 2014). Вероятно, такая обработка оказывает влияние также на конформацию амилоидных фибрилл, делая их более доступными для взаимодействия с красителем.
Согласно результатам проведенных нами исследований, для одновременного выявления амилоидных бляшек и микроглии может быть рекомендовано использование методики Iba-1/альциановый синий. Кальций-связывающий белок Iba-1 (от англ. Iionized calcium-binding adapter molecule 1) является на сегодняшний день наиболее широко используемым маркерным белком микроглиальных клеток. Показано, что Iba-1 играет роль в сшивании актиновых филаментов и регуляции конфигурации плазматической мембраны клеток микроглии, позволяя изучать сложную организацию отростков этих клеток (Alekseeva et al., 2019). Окраска микроглии после постановки иммуногистохимической реакции на Iba-1 характеризуется высокой интенсивностью, позволяя легко идентифицировать эту клеточную популяцию. Присутствие Iba-1 в теле и отростках как покоящейся (рамифицированной), так и активированной (амебоидной) микроглии делает этот белок удобным маркером для проведения морфофункциональных исследований (Kirik et al., 2011; Hopperton et al., 2018). Отсутствие фонового окрашивания ткани обеспечивает высокую контрастность выявления амилоидных бляшек, окрашенных альциановым синим.
Применение методики Iba-1/альциановый синий позволило визуализировать пространственную взаимосвязь активированной микроглии с амилоидными бляшками в коре и гиппокампе мышей линии 5×AD. Функциональное значение ассоциации микроглии с амилоидными бляшками остается в настоящее время предметом дискуссий. С одной стороны, показано, что бета-амилоид постоянно активирует микроглию, что приводит к выработке этими клетками провоспалительных медиаторов, потенциально токсичных для нейронов (Halle et al., 2008). С другой стороны, недавние данные свидетельствуют о том, что микроглия может выполнять протекторную функцию, формируя своеобразный защитный барьер вокруг амилоидных отложений. Так, полагают, что микроглиоциты способны поглощать и утилизировать растворимые формы бета-амилоида, фагоцитировать нерастворимые фибриллярные отложения, уплотнять протофибриллярные формы бета-амилоида в центральный кор бляшки, уменьшая таким образом количество олигомерного бета-амилоида, который оказывает наибольшее токсическое воздействие на нейроны. За счет этого микроглия ограничивает нейротоксичность амилоидных отложений и уменьшает аксональную дистрофию в соседнем нейропиле (Condello et al., 2015; Hansen et al., 2018).
Недостаточная изученность функций микроглии в отношении амилоидных скоплений при БА делает одновременное выявление этих структур актуальной задачей. До настоящего времени единственным способом решения этой задачи была постановка двойной иммунофлуоресцентной реакции на один из маркерных белков микроглии и бета-амилоид (Keren-Shaul et al., 2017). Данная методика является трудоемкой и дорогостоящей. Кроме того, она требует наличия в лаборатории конфокального лазерного микроскопа. Предложенный нами подход для одновременного выявления микроглии и амилоидных бляшек предполагает использование методов гистохимии и световой иммуногистохимии, которые являются значительно более дешевыми и простыми в реализации по сравнению с иммунофлуоресцентным методом. Анализ препаратов после окраски Iba-1/альциановый синий проводится с применением только светового микроскопа, что делает разработанную нами методику окраски более доступной.
Для одновременного выявления астроцитов и амилоидных бляшек, согласно результатам наших исследований, наиболее подходящей является методика GFAP/альциановый синий. GFAP – главный белок промежуточных филаментов цитоскелета астроцитов. Он обеспечивает стабильность морфологии их тел и отростков, участвует в регуляции объема астроцитов и модуляции их движения (Poliakova et al., 2018; Korzhevskii et al., 2019). GFAP также является важным функциональным маркером астроглии. Увеличение экспрессии этого белка наблюдается при разных патологиях центральной нервной системы, в том числе при нейродегенеративных заболеваниях (Yeh et al., 2011; Kamphuis et al., 2012; Katsouri et al., 2020).
Из данных литературы хорошо известно, что активированные астроциты часто ассоциированы со скоплениями амилоида в мозге 5×FAD мышей и людей с болезнью Альцгеймера (Boom et al., 2004; Orellana et al., 2011). Согласно современным представлениям, астроциты участвуют в удалении и разрушении бета-амилоида (Guénette, 2003; Nicoll, Weller, 2003; Verkhratsky et al., 2010), а также в формировании барьера между нейронами и скоплениями амилоида (Simpson et al., 2010). Исследователи описывают случаи обнаружения бета-амилоида внутри отростков астроцитов, что может свидетельствовать о фагоцитировании амилоидных скоплений этими клетками (Nagele et al., 2003).
Как и в случае с микроглией, существующие методики одновременного выявления астроцитов и амилоидных бляшек основаны на постановке двойной иммунофлуоресцентной реакции и использовании метода конфокальной лазерной микроскопии (Olabarria et al., 2010; Rodríguez-Arellano et al., 2016; Kelly et al., 2018; Katsouri et al., 2020; Li et al., 2020). Разработанный нами метод окраски GFAP/альциановый синий позволяет легко идентифицировать астроциты и скопления амилоида с помощью световой микроскопии.
Методика S100beta/альциановый синий менее эффективна для одновременного выявления астроцитов и амилоидных бляшек. Белок S100beta, еще один широко используемый маркер астроцитов, принадлежит к семейству кальций-связывающих белков и имеет множество внутри- и внеклеточных функций (Brozzi et al., 2009). Внутри астроцитарных клеток S100beta диффузно распределен в цитоплазме и ассоциирован с мембранами и элементами цитоскелета. Он участвует в регуляции состояния сборки микротрубочек и промежуточных филаментов, активности некоторых ферментов и пролиферации клеток (Donato, 2003). Иммуногистохимическая реакция на s100beta позволяет выявлять астроцитарные клетки, однако в этом случае их тела и отростки просматриваются менее четко по сравнению с использованием GFAP. Кроме того, при использовании антител против белка S100beta наблюдается небольшое фоновое окрашивание нервной ткани. Это может быть обусловлено способностью S100-белков секретироваться во внеклеточное пространство, где они проявляют свойства цитокинов и взаимодействуют с особыми рецепторами на поверхности нейронов, микроглиоцитов, астроцитов (Donato, 2003; Steiner et al., 2007). Наконец, помимо астроцитов, S100beta экспрессируется также (в меньшем количестве) в нейронах и олигодендроцитах. Из-за присутствия фонового окрашивания амилоидные бляшки при окраске альциановым синим смотрятся менее контрастно, чем в случае использования метода GFAP/альциановый синий.
В литературе имеются единичные сообщения о присутствии в реактивных астроцитах белка GAD67 (глутаматдекарбоксилаза, изоформа 67) (Jo et al., 2014; Wu et al., 2014). В связи с этим, мы использовали антитела против GAD67 в рамках проведенного исследования с целью решить вопрос о том, могут ли эти антитела применяться для визуализации астроцитов. Протестированная нами методика окраски GAD67/альциановый синий по качеству получаемых препаратов сопоставима с окраской GFAP/альциановый синий и Iba-1/альциановый синий. Однако данный метод оказался неэффективным для одновременного выявления астроцитов и амилоидных бляшек. GAD67 является ферментом, обеспечивающим превращение глутамата в ГАМК (гамма-аминомасляную кислоту), и потому служит маркерным белком ГАМК-ергических интернейронов (Korzhevskii et al., 2015; Dossi et al., 2018). Постановка иммуногистохимической реакции на GAD67 по предложенному нами протоколу позволяет четко выявлять иммунопозитивные структуры, которые, вероятно, являются элементами ГАМК-ергических нейронов. Отмеченное нами дискретное распределение продукта иммуногистохимической реакции на GAD67 может быть обусловлено его концентрированием в синаптических терминалях отростков этих клеток (Fong et al., 2005; Разенкова, Коржевский, 2021). Нельзя исключать того, что часть выявляемого GAD67 находится в отростках астроцитов. В литературе имеются данные об экспрессии GAD67 в реактивных астроцитах при БА (Jo et al., 2014; Wu et al., 2014; Garaschuk, Verkhratsky, 2019). Авторы рассматривают этот феномен в качестве возможной компенсации снижения уровня глутаминсинтетазы для переработки излишков глутамата, накапливаемого астроцитами при развитии этого заболевания (Olabarria et al., 2011; Wu et al., 2014; Garaschuk, Verkhratsky, 2019). Однако, при применении антител против GAD67 нами не было обнаружено иммунопозитивных клеток, сходных по морфологии с астроцитами. Это свидетельствует о том, что использование этих антител не позволяет выявлять астроциты и GAD67 не может служить маркерным белком этих клеток.
Таким образом, в рамках представленной работы нами был разработан новый подход, позволяющий одновременно выявлять клетки глии и амилоидные бляшки. Предложенный подход характеризуется простотой и хорошей воспроизводимостью, позволяя выявлять ассоциацию клеток глии с амилоидными бляшками с применением световой микроскопии. Результатом применения разработанной методики является получение препаратов высокого качества, которые, в отличие от препаратов с иммунофлуоресцентой меткой, не выцветают и могут храниться длительное время. Применение разработанных нами методов окраски препаратов позволяет впоследствии проводить их количественную обработку с использованием общедоступной программы обработки изображений ImageJ (США). Это делает возможным получение количественных характеристик изучаемых объектов (амилоидных бляшек и иммунопозитивных структур).
Список литературы
Коржевский Д.Э., Кирик О.В., Петрова Е.С., Карпенко М.Н., Григорьев И.П., Сухорукова Е.Г., Колос Е.А., Гиляров А.В. Теоретические основы и практическое применение методов иммуногистохимии. Под ред. Д. Э. Коржевского. 2-е изд., испр. и доп. Санкт-Петербург: СпецЛит, 2014. 119 с. (Korzhevskii D.E., Kirik O.V., Petrova E.S., Karpenko M.N., Grigoriev I.P., Sukhorukova E.G., Kolos E.A., Gilyarov A.V. Theoretical foundations and practical application of methods of immunohistochemistry. Ed. D.E. Korzhevsky. 2nd ed., Rev. and add. St. Petersburg: SpetsLit, 2014. 119 p.)
Носова О.И., Суфиева Д.А., Коржевский Д.Э. 2021. Использование конфокальной микроскопии и программных методов 2d и 3d анализа для изучения стуктурной организации астроцитов. Цитология. Т. 63. № 1. С. 80. https://doi.org/10.31857/S0041377121010077 (Nosova O.I., Sufieva D.A., Korzhevskii D.E. 2021. An astrocyte structural organization analysis based on fluorescent microscopy with 2D and 3D quantitative approaches. Cell Tiss. Biol. V. 15. P. 273. https://doi.org/10.1134/S1990519X21030081)
Разенкова В.А., Коржевский Д.Э. 2021. ГАМК-ергические аксосоматические синапсы нейронов коры головного мозга крысы. Цитология. Т. 62. № 11. С. 815. https://doi.org/10.31857/S0041377120110097 (Razenkova V.A., Korzhevskii D.E. 2021. GABAergic axosomatic synapses of rat brain cortex. Cell Tiss. Biol. V. 15. P. 267. https://doi.org/10.1134/S1990519X21030093)
Acosta C., Anderson H.D., Anderson C.M. 2017. Astrocyte dysfunction in Alzheimer disease. J. Neurosci. Res. V. 95. P. 2430. https://doi.org/10.1002/jnr.24075
Alekseeva O.S., Kirik O.V., Gilerovich E.G., Korzhevskii D.E. 2019. Microglia of the brain: Origin, structure, functions. J. Evol. Biochem. Physiol. V. 55. P. 257. https://doi.org/10.1134/S002209301904001X
Boom A., Pochet R., Authelet M., Pradier L., Borghgraef P., Van Leuven F., Heizmann C.W., Brion J.-P. 2004. Astrocytic calcium/zinc binding protein S100A6 over expression in Alzheimer’s disease and in PS1/APP transgenic mice models. Biochimica et Biophysica Acta (BBA) – Molecular Cell Research. V. 1742. P. 161. https://doi.org/10.1016/j.bbamcr.2004.09.011
Brozzi F., Arcuri C., Giambanco I., Donato R. 2009. S100B protein regulates astrocyte shape and migration via interaction with Src kinase. J. Biol. Chem. V. 284. P. 8797. https://doi.org/10.1074/jbc.M805897200
Chumasov E.I., Korzhevskii D.E., Petrova E.S., Kuznetsova N.N., Sapronov N.S. 2012. Glial reaction of the subventricular zone of the telencephalon of the rat brain on modeling of Alzheimer’s disease. Neurosci. Behav. Physiol. V. 42. P. 67. https://doi.org/10.1007/s11055-011-9535-1
Condello C., Yuan P., Schain A., Grutzendler J. 2015. Microglia constitute a barrier that prevents neurotoxic protofibrillar Aβ42 hotspots around plaques. Nature Commun. V. 6. P. 6176. https://doi.org/10.1038/ncomms7176
Donato R. 2003. Intracellular and extracellular roles of S100 proteins. Microsc. Res. Techn. V. 60. P. 540. https://doi.org/10.1002/jemt.10296
Dossi E., Vasile F., Rouach N. 2018. Human astrocytes in the diseased brain. Brain Res. Bull. V. 136. P. 139. https://doi.org/10.1016/j.brainresbull.2017.02.001
Ferrer I. 2017. Diversity of astroglial responses across human neurodegenerative disorders and brain aging. Brain Pathol. V. 27. P. 645. https://doi.org/10.1111/bpa.12538
Fong A.Y., Stornetta R.L., Foley C.M., Potts J.T. 2005. Immunohistochemical localization of GAD67-expressing neurons and processes in the rat brainstem: Subregional distribution in the nucleus tractus solitarius. J. Comp. Neurol. V. 493. P. 274. https://doi.org/10.1002/cne.20758
Garaschuk O., Verkhratsky A. 2019. GABAergic astrocytes in Alzheimer’s disease. Aging. V. 11. P. 1602. https://doi.org/10.18632/aging.101870
Garwood C.J., Ratcliffe L.E., Simpson J.E., Heath P.R., Ince P.G., Wharton S.B. 2017. Review: Astrocytes in Alzheimer’s disease and other age-associated dementias: A supporting player with a central role. Neuropathol. Appl. Neurobiol. V. 43. P. 281. https://doi.org/10.1111/nan.12338
Guénette S.Y. 2003. Astrocytes: A cellular player in Aβ clearance and degradation. Trends Mol. Med. V. 9. P. 279. https://doi.org/10.1016/S1471-4914(03)00112-6
Guselnikova V., Antipova M.V., Fedorova E.A., Safray A.E., Rukavishnikova A.A., Mikhailova E.V., Korzhevskii D.E. 2019. Distinctive features of histochemical and immunohistochemical techniques for amyloid plaque detection in the human cerebral cortex. J. Anat. Histopathol. V. 8. P. 91. https://doi.org/10.18499/2225-7357-2019-8-2-91-99
Habib N., McCabe C., Medina S., Varshavsky M., Kitsberg D., Dvir-Szternfeld R., Green G., Dionne D., Nguyen L., Marshall J.L., Chen F., Zhang F., Kaplan T., Regev A., Schwartz M. 2020. Disease-associated astrocytes in Alzheimer’s disease and aging. Nature Neuroscience. V. 23. P. 701. https://doi.org/10.1038/s41593-020-0624-8
Halle A., Hornung V., Petzold G.C., Stewart C.R., Monks B.G., Reinheckel T., Fitzgerald K.A., Latz E., Moore K.J., Golenbock D.T. 2008. The NALP3 inflammasome is involved in the innate immune response to amyloid-β. Nature Immunology. V. 9. P. 857. https://doi.org/10.1038/ni.1636
Hansen D.V, Hanson J.E., Sheng M. 2018. Microglia in Alzheimer’s disease. J. Cell Biol. V. 217. P. 459. https://doi.org/10.1083/jcb.201709069
Hopperton K.E., Mohammad D., Trépanier M.O., Giuliano V., Bazinet R.P. 2018. Markers of microglia in post-mortem brain samples from patients with Alzheimer’s disease: A systematic review. Mol. Psychiatry. V. 23. P. 177. https://doi.org/10.1038/mp.2017.246
Jo S., Yarishkin O., Hwang Y.J., Chun Y.E., Park M., Woo D.H., Bae J.Y., Kim T., Lee J., Chun H., Park H.J., Lee D.Y., Hong J., Kim H.Y., Oh S.J.,et al. 2014. GABA from reactive astrocytes impairs memory in mouse models of Alzheimer’s disease. Nature Medicine. V. 20. P. 886. https://doi.org/10.1038/nm.3639
Kamphuis W., Mamber C., Moeton M., Kooijman L., Sluijs J.A., Jansen A.H.P., Verveer M., de Groot L.R., Smith V.D., Rangarajan S., Rodríguez J.J., Orre M., Hol E.M. 2012. GFAP isoforms in adult mouse brain with a focus on neurogenic astrocytes and reactive astrogliosis in mouse models of Alzheimer disease. PLoS One. V. 7. e42823. https://doi.org/10.1371/journal.pone.0042823
Katsouri L., Birch A.M., Renziehausen A.W.J., Zach C., Aman Y., Steeds H., Bonsu A., Palmer E.O.C., Mirzaei N., Ries M., Sastre M. 2020. Ablation of reactive astrocytes exacerbates disease pathology in a model of Alzheimer’s disease. Glia. V. 68. P. 1017. https://doi.org/10.1002/glia.23759
Kelly P., Hudry E., Hou S.S., Bacskai B.J. 2018. In vivo two photon imaging of astrocytic structure and function in Alzheimer’s disease. Front. Aging Neurosci. V. 10. 219. https://doi.org/10.3389/fnagi.2018.00219
Keren-Shaul H., Spinrad A., Weiner A., Matcovitch-Natan O., Dvir-Szternfeld R., Ulland T.K., David E., Baruch K., Lara-Astaiso D., Toth B., Itzkovitz S., Colonna M., Schwartz M., Amit I. 2017. A unique microglia type associated with restricting development of Alzheimer’s disease. Cell. V. 169. P. 1276. https://doi.org/10.1016/j.cell.2017.05.018
Kirik O.V., Sukhorukova E.G., Korzhevskii D.E. 2011. Calcium-binding protein Iba-1/AIF-1 in rat brain cells. Neurosci. Behav. Physiol. V. 41. P. 149. https://doi.org/10.1007/s11055-011-9391-z
Korzhevskii D.E., Grigor’ev I.P., Gusel’nikova V.V., Kolos E.A., Petrova E.S., Kirik O.V., Sufieva D.A., Razenkova V.A., Antipova M.V., Chernysh M.V. 2019. Immunohistochemical markers for neurobiology. Medical Acad. Journal. V. 19. P. 7. https://doi.org/10.17816/MAJ16548
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Grigorev I.P. 2015. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde. Eur. J. Histochem. V. 59. P. 5. https://doi.org/10.4081/ejh.2015.2530
LaFerla F.M., Green K.N. 2012. Animal models of Alzheimer disease. Cold Spring Harbor Persp. Med. V. 2. a006320. https://doi.org/10.1101/cshperspect.a006320
Li K.-Y., Gong P., Li J., Xu N., Qin S. 2020. Morphological and molecular alterations of reactive astrocytes without proliferation in cerebral cortex of an APP/PS1 transgenic mouse model and Alzheimer’s patients. Glia. V. 68. P. 2361. https://doi.org/10.1002/glia.23845
Mucke L. 2009. Alzheimer’s disease. Nature. V. 461. P. 895. https://doi.org/10.1038/461895a
Nagele R.G., D’Andrea M.R., Lee H., Venkataraman V., Wang H.-Y. 2003. Astrocytes accumulate Aβ42 and give rise to astrocytic amyloid plaques in Alzheimer disease brains. Brain Res. V. 971. P. 197. https://doi.org/10.1016/S0006-8993(03)02361-8
Nicoll J.A.R., Weller R.O. 2003. A new role for astrocytes: β-amyloid homeostasis and degradation. Trends Mol. Med. V. 9. P. 281. https://doi.org/10.1016/S1471-4914(03)00109-6
Oakley H., Cole S.L., Logan S., Maus E., Shao P., Craft J., Guillozet-Bongaarts A., Ohno M., Disterhoft J., Van Eldik L., Berry R., Vassar R. 2006. Intraneuronal beta-amyloid aggregates, meurodegeneration, and meuron loss in transgenic mice with five familial Alzheimer’s disease mutations: Potential factors in amyloid plaque formation. J. Neurosci. V. 26. P. 10129. https://doi.org/10.1523/JNEUROSCI.1202-06.2006
Olabarria M., Noristani H.N., Verkhratsky A., Rodríguez J.J. 2010. Concomitant astroglial atrophy and astrogliosis in a triple transgenic animal model of Alzheimer’s disease. Glia. V. 58. P. 831. https://doi.org/10.1002/glia.20967
Olabarria M., Noristani H.N., Verkhratsky A., Rodríguez J.J. 2011. Age-dependent decrease in glutamine synthetase expression in the hippocampal astroglia of the triple transgenic Alzheimer’s disease mouse model: Mechanism for deficient glutamatergic transmission? Mol. Neurodegeneration. V. 6. P. 55. https://doi.org/10.1186/1750-1326-6-55
Orellana J.A., Shoji K.F., Abudara V., Ezan P., Amigou E., Saez P.J., Jiang J.X., Naus C.C., Saez J.C., Giaume C. 2011. Amyloid-induced death in neurons involves glial and neuronal hemichannels. J. Neurosci. V. 31. P. 4962. https://doi.org/10.1523/JNEUROSCI.6417-10.2011
Poliakova A.A., Semernin E.N., Sitnikova M.Y., Avagyan K.L., Grozov R. V., Pyko S.A., Krutikov A.N., Davydova V.G., Khmelnitskaya K.A., Shavloskii M.M., Korzhevskii D.E., Gudkova A.Y. 2018. Transthyretin amyloidosis in a cohort of old and very old patients with chronic heart failure. Kardiologiya. V. 58. P. 12. https://doi.org/10.18087/cardio.2390
Pomerance A., Slavin G., McWatt J. 1976. Experience with the sodium sulphate-Alcian Blue stain for amyloid in cardiac pathology. J. Clin. Pathol. V. 29. P. 22. https://doi.org/10.1136/jcp.29.1.22
Rodríguez-Arellano J.J., Parpura V., Zorec R., Verkhratsky A. 2016. Astrocytes in physiological aging and Alzheimer’s disease. Neuroscience. V. 323. P. 170. https://doi.org/10.1016/j.neuroscience.2015.01.007
Simpson J.E., Ince P.G., Lace G., Forster G., Shaw P.J., Matthews F., Savva G., Brayne C., Wharton S.B. 2010. Astrocyte phenotype in relation to Alzheimer-type pathology in the ageing brain. Neurobiol. Aging. V. 31. P. 578. https://doi.org/10.1016/j.neurobiolaging.2008.05.015
Snow A.D., Sekiguchi R.T., Nochlin D., Kalaria R.N., Kimata K. 1994. Heparan sulfate proteoglycan in diffuse plaques of hippocampus but not of cerebellum in Alzheimer’s disease brain. Am. J. Pathol. V. 144. P. 337. http://www.ncbi.nlm.nih.gov/pubmed/8311117
Snow P., Patel N., Harrelson A., Goodman C. 1987. Neural-specific carbohydrate moiety shared by many surface glycoproteins in Drosophila and grasshopper embryos. J. Neurosci. V. 7. P. 4137. https://doi.org/10.1523/JNEUROSCI.07-12-04137.1987
Steiner J., Bernstein H.-G., Bielau H., Berndt A., Brisch R., Mawrin C., Keilhoff G., Bogerts B. 2007. Evidence for a wide extra-astrocytic distribution of S100B in human brain. BMC Neuroscience. V. 8. P. 2. https://doi.org/10.1186/1471-2202-8-2
Stepanichev M.Y., Zdobnova I.M., Zarubenko I.I., Lazareva N.A., Gulyaeva N. V. 2006. Studies of the effects of central administration of β-amyloid peptide (25–35): Pathomorphological changes in the hippocampus and impairment of spatial memory. Neurosci. Behav.l Physiol. V. 36. P. 101. https://doi.org/10.1007/s11055-005-0167-1
Tzioras M., Davies C., Newman A., Jackson R., Spires-Jones T. 2019. APOE at the interface of inflammation, neurodegeneration and pathological protein spread in Alzheimer’s disease. Neuropathol. Appl. Neurobiol. V. 45. P. 327. https://doi.org/10.1111/nan.12529
Verkhratsky A., Olabarria M., Noristani H.N., Yeh C., Rodriguez J.J. 2010. Astrocytes in Alzheimer’s disease. Neurotherapeutics. V. 7. P. 399. https://doi.org/10.1016/j.nurt.2010.05.017
Verkhratsky A., Rodrigues J.J., Pivoriunas A., Zorec R., Semyanov A. 2019. Astroglial atrophy in Alzheimer’s disease. Pflügers Archiv – European Journal of Physiology. V. 471. P. 1247. https://doi.org/10.1007/s00424-019-02310-2
Verkhratsky A., Zorec R., Rodriguez J.J., Parpura V. 2016. Pathobiology of neurodegeneration: The role for astroglia. Opera Medica & Physiologica. V. 1. P. 13. https://doi.org/10.20388/OMP2016.001.0019
Wu Z., Guo Z., Gearing M., Chen G. 2014. Tonic inhibition in dentate gyrus impairs long-term potentiation and memory in an Alzheimer’s disease model. Nat. Commun. V. 5. P. 4159. https://doi.org/10.1038/ncomms5159
Yeh C.-Y., Vadhwana B., Verkhratsky A., Rodríguez J.J. 2011. Early astrocytic atrophy in the entorhinal cortex of a triple transgenic animal model of Alzheimer’s disease. ASN Neuro. V. 3. P. 272. https://doi.org/10.1042/AN20110025
Дополнительные материалы отсутствуют.


