Цитология, 2022, T. 64, № 2, стр. 150-158
Особенности локализации белка LIMCH1 в опухолевых клетках при раке молочной железы
В. В. Алифанов 1, *, Л. А. Таширева 1, М. В. Завьялова 1, В. М. Перельмутер 1
1 Научно-исследовательский институт онкологии Томского научно-исследовательского медицинского центра
634028 Томск, Россия
* E-mail: alifanov.vl@yandex.ru
Поступила в редакцию 16.11.2021
После доработки 03.01.2022
Принята к публикации 10.01.2022
- EDN: HHHZIM
- DOI: 10.31857/S004137712202002X
Аннотация
Белок LIMCH1 снижает клеточную подвижность, регулируя активность NM-IIA, что может быть критически важным для инвазии опухолевых клеток. В настоящее время роль белка LIMCH1 при злокачественных новообразованиях изучена недостаточно. Настоящая работа посвящена изучению особенностей локализации доменов белка LIMCH1 в различных компартментах опухолевых клеток больных инвазивной карциномой молочной железы неспецифического типа (ИКНТ) и участию доменов белка LIMCH1 в коллективной или индивидуальной миграции опухолевых клеток. В качестве модельной системы в работе использован феномен морфологической гетерогенности опухоли. Наиболее часто домен LIM белка LIMCH1 имел ядерную и субмембранную локализацию, другой домен белка LIMCH1 – кальпонин – наиболее часто имел субмембранную и цитоплазматическую локализацию. Ядерная локализация белка LIMCH1 в опухолевых клетках позволяет предполагать, что функции белка LIMCH1 в опухолевых клетках не ограничены влиянием на клеточную подвижность. Значительно чаще белок LIMCH1 обнаруживался в цитоплазме одиночных опухолевых клеток, по сравнению с многоклеточными структурами, что можно расценить как индикатор амебоидного типа движения, учитывая сопряженность одиночных опухолевых клеток с гематогенным метастазированием. Можно предположить, что основной функцией белка LIMCH1 в многоклеточных структурах является обеспечение межклеточной адгезии.
Актиновый аппарат участвует в реализации нескольких важных функций в клетках: клеточной подвижности, поддержании и изменении формы клетки, внутриклеточном транспорте, а также адгезии с внеклеточным матриксом и межклеточной адгезии (Spiliotis, Nakos, 2021). Функционирование актинового аппарата клетки регулируется множеством белков, одним из которых является LIMCH1. Белок LIMCH1 (LIM and calponin-homology domains 1) состоит из двух доменов: LIM-домена, который участвует в формировании белок-белковых соединений, и кальпонинового домена, который является кальций-связывающим, благодаря чему может участвовать в активации кальций-зависимых белков (Lin et al., 2017). Кроме того, было показано, что в клетке могут присутствовать изоформы белка LIMCH1 с различными сочетаниями доменов (García et al., 2016).
В клетке белок LIMCH1 колокализуется с актиновыми волокнами, где он взаимодействует с немышечным миозином 2A типа (NM-IIA). В клетке выделяют кортикальные, перинуклеарные волокна актина и волокна напряжения актина. При этом наиболее подробно изучена роль белка LIMCH1, который колокализован с волокнами напряжения, где он способен напрямую связываться с NM-IIA, что приводит к ретроградному току актина в ламеллоподиях и снижает клеточную подвижность. В свою очередь экспериментальное истощение LIMCH1 в клетках HeLa приводило к увеличению способности к миграции клеток (Lin et al., 2017). Таким образом, белок LIMCH1 выступает в роли ингибитора миграции клеток. Однако в литературе отсутствуют данные о функциях белка LIMCH1, когда он колокализован с кортикальными волокнами актина и имеет субмембранную локализацию, а также когда он колокализован с перинуклеарными волокнами актина.
Способность к миграции является одним из критических свойств опухолевых клеток и может существенно ограничивать прогрессию злокачественных новообразований. Было показано, что в опухолевых клетках больных немелкоклеточным раком легкого уровень белка LIMCH1 значительно снижен по сравнению с нормальной тканью (Zhang et al., 2019). Также было показано, что низкий уровень LIMCH1 характерен для опухолевых клеток при тройной негативной инвазивной карциноме неспецифического типа (ИКНТ) молочной железы более продвинутых стадий (Bersini et al., 2020). Исследования, посвященные изучению роли белка LIMCH1 при злокачественных новообразованиях, немногочисленны, клиническое и прогностическое значение белка LIMCH1 у пациентов с ИКНТ остается наименее изученным.
Удобной моделью для изучения инвазивных свойств опухолевых клеток больных ИКНТ может служить морфологическая гетерогенность. При раке молочной железы описаны одиночные опухолевые клетки, являющиеся примером индивидуальной инвазии. Наличие одиночных опухолевых клеток с эпителиальной морфологией ассоциировано с большим риском развития гематогенных метастазов (Tashireva et al., 2020). Примером коллективной инвазии могут служить трабекулярные структуры, а также многоклеточные структуры с ракетообразной морфологией (Gerashchenko et al., 2019). Можно выделить структуры, морфология которых не имеет явных проявлений инвазивного роста, к таковым относятся тубулярные и альвеолярные структуры. Опухоли молочной железы с альвеолярными структурами характеризуются высокой частотой метастазирования в лимфатические узлы. При неоадъювантной химиотерапии (НАХТ) опухоли с альвеолярными или трабекулярными структурами часто демонстрируют плохой ответ на проводимую терапию и ассоциированы с повышенным риском гематогенных метастазов, а также с меньшей безметастатической выживаемостью (Gerashchenko et al., 2017). Таким образом, очевидно, что выраженная внутриопухолевая гетерогенность не является случайным явлением, а тесно связана с прогнозом заболевания и эффективностью терапии, что позволяет использовать ее в качестве надежной модели для изучения инвазивных свойств опухолевых клеток.
В связи с гетерогенностью карцином молочной железы можно ожидать что локализация LIMCH1 должна быть неодинаковой в разных клеточных структурах опухоли. Кроме этого, разная локализация LIMCH1 внутри клетки связана с разными функциональными эффектами. Между тем в литературе отсутствуют данные о внутриклеточной локализации белка LIMCH1 и его изоформ в опухолевых клетках больных ИКНТ.
Цель настоящего исследования заключалась в изучении особенностей локализации доменов белка LIMCH1 в различных компартментах опухолевых клеток больных ИКНТ и участия доменов белка LIMCH1 в коллективной или индивидуальной миграции опухолевых клеток.
МАТЕРИАЛ И МЕТОДИКА
Материал для исследования. В исследование было включено 89 больных с диагнозом инвазивной карциномы неспецифического типа молочной железы, проходивших лечение в клиниках НИИ онкологии Томского НИМЦ с 2007 по 2018 гг. Данный диагноз был установлен в соответствии с рекомендациями ВОЗ на основании клинических, морфологических и иммуногистохимических критериев (WHO classification of tumours, 2019). В группе исследуемых больных были представлены все молекулярно-генетические типы (люминальный А, люминальный Б, HER2neu-позитивный и трижды негативный), НАХТ проводили у 41.6% больных. Средний возраст больных составил 52.2 ± 13.7 лет. По классификации TNM среди больных были представлены стадии T1-4N0-3M0. У всех обследованных лиц было получено добровольное информированное согласие на проведение необходимых для исследования манипуляций в соответствии с требованиями локального этического комитета НИИ онкологии Томского НИМЦ (протокол № 7 от 24 мая 2021 г.).
Материалом для исследования служили фрагменты опухоли (операционный материал), фиксированные в 10%-ном нейтральном формалине и заключенные в парафин. Проводка материала и изготовление гистологических препаратов осуществлялись по стандартной методике.
Иммуногистохимия. Оценка локализации доменов белка LIMCH1 в опухолевых клетках проводилась с помощью иммуногистохимии. Использовали антитела (Sigma Aldrich, Германия) против домена LIM (SAB2700402) и домена кальпонин (HPA004184) в разведении 1 : 1000. Визуализацию проводили с помощью системы детекции EnVision (Dako, Agilent, США). Затем срезы окрашивали гематоксилином и заключали в среду Витрогель (Биовитрум, Россия). Наличие доменов белка LIMCH1 в трeх компартментах клетки (ядре, цитоплазме и мембране) оценивали с помощью световой микроскопии (AxioScope A1, Zeiss, Германия).
Статистическая обработка. Статистическую обработку данных проводили с помощью пакета программ Statistica 10.0. Оценку различий частот встречаемости осуществляли при помощи двустороннего точного критерия Фишера. Различия считали достоверными при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ
Локализация доменов белка LIMCH1. Только в 21.3% опухолей белок LIMCH1 отсутствовал. В остальных случаях наблюдали присутствие как минимум одного из доменов белка LIMCH1 (LIM или кальпонин) в ядре, цитоплазме или субмембранном пространстве (рис. 1, 2).
Рис. 1.
Локализация белка LIMCH1 (домен LIM) в опухолевых клетках больных с ИКНТ молочной железы: а – мембранная (м), б – цитоплазматическая (ц), в – ядерная (я). На врезках показано фотоувеличение выделенного участка. Иммуногистохимическое окрашивание. Увел. об.: 40×.
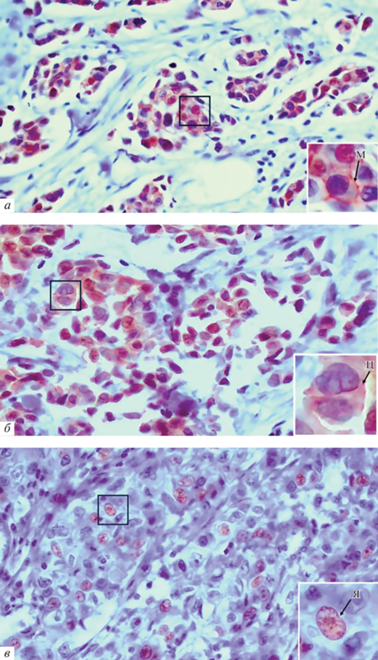
Рис. 2.
Локализация белка LIMCH1 (домен кальпонин) в опухолевых клетках больных ИКНТ молочной железы: а – мембранная (м), б – цитоплазматическая (ц), в – ядерная (я). На врезках показано фотоувеличение выделенного участка. Иммуногистохимическое окрашивание. Увел. об.: 40×.
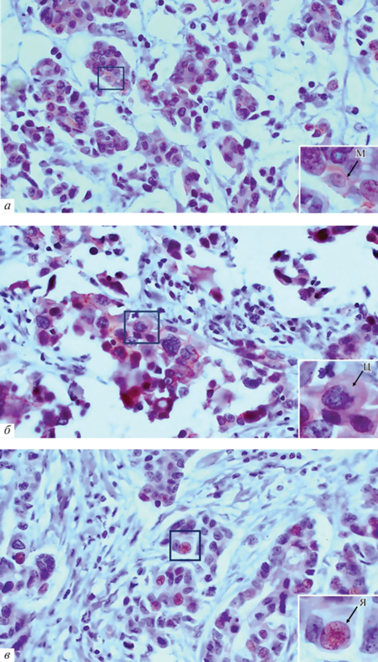
Наиболее часто домен LIM белка LIMCH1 имел ядерную и субмембранную локализацию (38 и 34% соответственно). Для другого домена белка LIMCH1 – кальпонин – наиболее характерной была субмембранная и цитоплазматическая локализация (51 и 47% соответственно). Стоит отметить, что в цитоплазме чаще встречался домен кальпонин по сравнению с доменом LIM (47 против 7% соответственно, р = 0.0000). В других компартментах частоты встречаемости обоих доменов были сопоставимы (рис. 3).
Рис. 3.
Частоты встречаемости доменов белка LIMCH1(LIM и кальпонин) в клеточных компартментах опухолевых клеток у больных ИНКТ молочной железы.
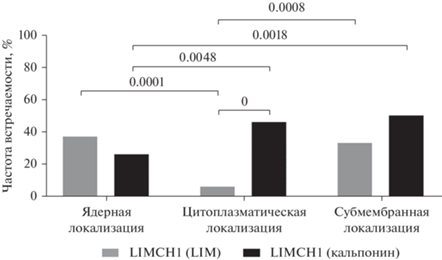
Далее определяли, насколько часто присутствие доменов белка LIMCH1 в клеточных компартментах опухолевых клеток одного больного совпадает (табл. 1). Совместное присутствие двух доменов белка LIMCH1 (LIM и кальпонин) в ядре и субмембранном пространстве опухолевых клеток у больных ИКНТ, по сравнению с цитоплазмой, обнаруживалось чаще. Наличие домена LIM было наименее характерно для больных ИКНТ и чаще всего LIM домен локализовался в ядре, по сравнению с другими компартментами. Примерно у четверти пациентов в цитоплазме и субмембранном пространстве обнаруживали присутствие только домена кальпонин.
Таблица 1.
Частота встречаемости различных вариантов сочетания доменов белка LIMCH1 в клеточных компартментах опухолевых клеток у больных ИКНТ молочной железы
| Сочетания доменов LIMCH1 | Локализация, % (абс.) | ||
|---|---|---|---|
| ядерная | цитоплазматическая | субмембранная | |
| LIM+/кальпонин+ | 23.6% (21 из 89) | 3.4% (3 из 89) p1 = 0.0001 |
20.2% (18 из 89) p1 = 0.7174 p2 = 0.0008 |
| LIM+/кальпонин− | 10.1% (9 из 89) | 2.2% (2 из 89) p1 = 0.0573 |
1.1% (1 из 89) p1 = 0.0181 p2 = 1.0000 |
| LIM−/кальпонин+ | 3.4% (3 из 89) | 25.8% (23 из 89) p1 = 0.0000 |
29.2% (26 из 89) p1 = 0.0000 p2 = 0.7374 |
Локализация белка LIMCH1 в опухолевых клетках больных с наличием и отсутствием НАХТ. На следующем этапе был проведен сравнительный анализ локализации белка LIMCH1 в опухолевых клетках в группах больных с наличием и отсутствием НАХТ. Ядерная локализация белка LIMCH1 в опухолевых клетках обнаруживалась у 52.8% больных в группе без применения НАХТ и у 47.2% больных, p = 0.07128, в группе с применением НАХТ. Локализацию белка LIMCH1 в цитоплазме наблюдали у 77.8 и 22.2%, p = 0.23775, а субмембранную – у 41.7 и 58.3%, p = 0.19480 в группах без применения и с применением НАХТ соответственно. Таким образом, не было выявлено статистически значимых различий локализации белка LIMCH1 в опухолевых клетках в группах больных с наличием и отсутствием НАХТ.
Локализация домена LIM в опухолевых клетках различных морфологических структур. Далее мы оценивали локализацию доменов белка LIMCH1 в опухолевых клетках различных морфологических структур (тубулярных, альвеолярных, солидных и трабекулярных), а также в одиночных опухолевых клетках и инвазивном фронте ракетообразных структур (табл. 2).
Таблица 2.
Частота встречаемости разной локализации домена LIM белка LIMCH1 в опухолевых клетках морфологических образований больных ИКНТ молочной железы
| Морфологические образования | Частота встречаемости домена LIM белка LIMCH1, % (абс.) | |||
|---|---|---|---|---|
| ядерная | цитоплазматическая | субмембранная | ||
| Тубулярные | 1 | 7.4% (2 из 27) p1–2 = 0.0104 p1–3 = 0.0192 p1–5 = 0.0298 |
3.7% (1 из 27) p1–6 = 0.0324 |
7.4% (2 из 27) p1–6 = 0.0492 |
| Альвеолярные | 2 | 33.3% (26 из 78) | 5.1% (4 из 78) | 19.2% (15 из 78) |
| Солидные | 3 | 29.9% (23 из 77) | 5.2% (4 из 77) | 20.8% (16 из 77) |
| Инвазивный фронт ракет, связанных с солидными структурами | 4 | 15.8% (3 из 19) | 10.5% (2 из 19) | 21.1% (4 из 19) |
| Трабекулярные | 5 | 29% (20 из 69) | 7.2% (5 из 69) | 17.4% (12 из 69) |
| Одиночные опухолевые клетки | 6 | 7.8% (5 из 64) p6–2 = 0.0002 p6–3 = 0.0012 p6–5 = 0.0019 |
23.4% (15 из 64) p6–1= 0.0324 p6–2= 0.0022 p6–3= 0.0023 p6–5= 0.0139 |
26.6% (17 из 64) p6–1 = 0.0492 |
В табл. 2 и 3: p – вероятность различий между вариантами, указанными цифрами.
Среди всех морфологических образований, наиболее редко домен LIM встречался в опухолевых клетках тубулярных структур независимо от внутриклеточной локализации. Частота встречаемости домена LIM в ядре была значительно выше в многоклеточных образованиях (альвеолярных, солидных и трабекулярных), чем в одиночных опухолевых клетках и тубулярных структурах. В случае цитоплазматической локализации наблюдали обратную ситуацию: чаще она встречалась в одиночных опухолевых клетках, чем в опухолевых клетках многоклеточных морфологических образований. Частоты встречаемости субмембранной локализации не различались между морфологическими структурами (р < 0.05). Частоты встречаемости домена LIM, вне зависимости от клеточного компартмента, не различались между инвазивным фронтом ракет, связанных с солидными структурами, и другими морфологическими структурами (р < 0.05).
Локализация домена кальпонин в опухолевых клетках различных морфологических структур. Далее мы оценили локализацию домена кальпонин белка LIMCH1 в разных морфологических структурах (табл. 3). Реже всего ядерная локализация домена кальпонин обнаруживалась в одиночных опухолевых клетках по сравнению с альвеолярными, трабекулярными и солидными структурами. Частоты встречаемости домена кальпонин в цитоплазме и субмембранном пространстве опухолевых клеток, формирующих различные морфологические структуры, не различались (р < 0.05). Частоты встречаемости домена кальпонин, вне зависимости от клеточного компартмента, не различались между инвазивным фронтом ракет, связанных с солидными структурами, и другими морфологическими структурами (р < 0.05).
Таблица 3.
Частота встречаемости разной локализации домена кальпонин белка LIMCH1 в опухолевых клетках морфологических образований больных ИКНТ молочной железы
| Морфологические структуры | Частота встречаемости домена кальпонин белка LIMCH1, % (абс.) | |||
|---|---|---|---|---|
| ядерная | цитоплазматическая | субмембранная | ||
| Тубулярные | 1 | 11.1% (3 из 27) p1–2 = 0.0442 p1–3 = 0.0242 |
14.8% (4 из 27) | 37% (10 из 27) |
| Альвеолярные | 2 | 21.8% (17 из 78) | 14.1% (11 из 78) | 37.2% (29 из 78) |
| Солидные | 3 | 20.8% (16 из 77) | 18.2% (14 из 77) | 40.3% (31 из 77) |
| Инвазивный фронт ракет, связанных с солидными структурами | 4 | 5.3% (1 из 19) | 10.5% (2 из 19) | 21.1% (4 из 19) |
| Трабекулярные | 5 | 15.9% (11 из 69) | 20.3% (14 из 69) | 37.7% (26 из 69) |
| Одиночные опухолевые клетки | 6 | 3.1% (2 из 64) p6–2 = 0.0008 p6–3 = 0.0004 p6–5 = 0.0004 |
23.4% (15 из 64) | 25% (16 из 64) |
ОБСУЖДЕНИЕ
В настоящей работе впервые были изучены особенности локализации белка LIMCH1 в опухолевых клетках. Выполнение белком в клетке своих функций тесно связано с его клеточной локализацией. Основной функцией белка LIMCH1, описанной в литературе, является торможение клеточной подвижности, благодаря формированию фокальных спаек и активации NM-IIA (Lin et al., 2017). Эта функция белка связана с его цитоплазматической локализацией. Однако нами было показано, что локализация белка LIMCH1 в клетке может быть не только цитоплазматической, он обнаруживается во всех клеточных компартментах. Это позволяет предполагать, что белок LIMCH1 имеет ряд других функций.
Как говорилось ранее, белок LIMCH1 имеет доменное строение и в клетке могут находиться его изоформы с различными сочетаниями доменов (García et al., 2016). Домен LIM участвует в формировании белок-белковых взаимодействий, а также связывает белок LIMCH1 с NM-IIA. В опухолевых клетках домен LIM встречается наиболее редко. Значительно чаще встречается домен кальпонин, который преимущественно локализуется в цитоплазме и субмембранном пространстве. Домен кальпонин является кальций-связывающим, что позволяет ему активировать кальций-зависимые белки. Изоформа белка LIMCH1 с доменом кальпонин благодаря своей локализации может участвовать в формировании спаек адгезии, а также во многих сигнальных путях, активируя кальций-зависимые белки. Сочетанная локализация доменов отражает способность белка LIMCH1 выполнять полный спектр своих функций, и такой вариант наиболее часто встречался в ядре и субмембранном пространстве в сравнении с цитоплазмой. Ядерная локализация белка LIMCH1 позволяет предполагать, что он может участвовать в регуляции экспрессии генов (Kadrmas, Beckerle, 2004).
Отдельно стоит отметить, что сравнение локализации белка LIMCH1 опухолевыми клетками в группах пациентов с наличием и отсутствием НАХТ не показало статистически значимых различий. Вероятно, проведение НАХТ не влияет на локализацию белка LIMCH1 в опухолевых клетках.
Важной характеристикой рака молочной железы является его морфологическая гетерогенность. Опухолевые клетки различных структур отличаются по своим свойствам, а преобладание в опухоли определенных структур связано с чувствительностью к химиотерапии, а также прогрессией заболевания (Gerashchenko et al., 2017). Анализ корреляций между характером локализации доменов белка LIMCH1 и морфологической гетерогенностью опухоли привел к выводам о том, что локализация доменов белка LIMCH1 опухолевыми клетками в морфологических образованиях является гетерогенной.
Так, цитоплазматическая локализация домена LIM белка LIMCH1 чаще всего обнаруживалась в одиночных опухолевых клетках, по сравнению с опухолевыми клетками многоклеточных морфологических структур. Известно, что для одиночных опухолевых клеток характерен индивидуальный тип инвазии. На первый взгляд, основная функция белка LIMCH1, описанная в литературе, а именно торможение миграции клеток, противоречит полученным данным. Однако, ламеллоподии, в которых LIMCH1, связываясь с NM-IIA, тормозит подвижность, формируются при мезенхимном варианте миграции. Это означает, что в одиночных опухолевых клетках в большей степени, чем в других структурах опухоли, происходит торможение мезенхимного типа инвазии. Однако опухолевые клетки обладают высокой пластичностью, мезенхимный тип инвазии переходит в амебовидный и наоборот в зависимости от структуры стромы опухоли (Zavyalova et al., 2019). Из этого следует, что часть одиночных клеток способна к амебовидному типу инвазии, который также участвует в интравазации и других этапах метастазирования. Это вполне согласуется с высокой степенью ассоциации наличия в ИКНТ одиночных клеток с развитием гематогенных метастазов (Tashireva et al., 2020).
Кроме того, известно, что белок LIMCH1 участвует во многих сигнальных путях, в том числе WNT, который приводит к повышению клеточной подвижности, что и характерно для одиночных опухолевых клеток (Cizkova et al., 2010). Ядерная локализация не может быть связана с клеточной адгезией. Достоверно меньшая частота случаев с локализацией в ядрах одиночных клеток доменов LIM и кальпонин подчеркивает особый статус одиночных клеток по регуляторному влиянию этих белков на геном клеток. Изучение регуляторных функций белка LIMCH1 при локализации в ядрах требует специальных исследований.
Частоты встречаемости доменов белка LIMCH1 не различались в инвазивном фронте структур, для которых характерен коллективный тип инвазии, и структур, для которых не характерны проявления инвазивного роста. Вероятно, в многоклеточных структурах белок LIMCH1 в меньшей степени связан с инвазией, по сравнению с одиночными опухолевыми клетками. Можно предположить, что основной функцией белка LIMCH1 в многоклеточных структурах является обеспечение межклеточной адгезии.
ЗАКЛЮЧЕНИЕ
Локализация доменов белка LIMCH1 в опухолевых клетках рака молочной железы гетерогенна и обнаруживается во всех клеточных компартментах. На модели морфологической гетерогенности было показано, что цитоплазматическая локализация домена LIM в одиночных клетках опухоли может быть связана с разными вариантами индивидуального типа инвазии. Функции белка LIMCH1 в опухолевых клетках не ограничены влиянием на клеточную подвижность, ядерная локализация домена LIM в опухолевых клетках может быть связана с регуляторной функцией белка.
Список литературы
Bersini S., Lytle N.K., Schulte R., Huang L., Wahl G.M., Hetzer M.W. 2020. Nup93 regulates breast tumor growth by modulating cell proliferation and actin cytoskeleton remodeling. Life Sci. Alliance. V. 3. P. e201900623. https://doi.org/10.26508/lsa.201900623
Cizkova M., Cizeron-Clairac G., Vacher S., Susini A., Andrieu C., Lidereau R., Bièche I. 2010. Gene expression profiling reveals new aspects of PIK3CA mutation in ERalpha-positive breast cancer: Major implication of the Wnt signaling pathway. PloS One. V. 5. P. e15647. https://doi.org/10.1371/journal.pone.0015647
García D., Ordenes P., Benítez J., González A., García-Robles M.A., López V., Carvajal N., Uribe E. 2016. Cloning of two LIMCH1 isoforms: Characterization of their distribution in rat brain and their agmatinase activity. Histochem. Cell Biol. V. 145. P. 305. https://doi.org/10.1007/s00418-015-1389-0
Gerashchenko T.S., Novikov N.M., Krakhmal N.V., Zolotaryova S.Y., Zavyalova M.V., Cherdyntseva N.V., Denisov E.V., Perelmuter V.M. 2019. Markers of cancer cell invasion: are they good enough? J. Clin. Med. V. 8. P. 1092. https://doi.org/10.3390/jcm8081092
Gerashchenko T.S., Zavyalova M.V., Denisov E.V., Krakhmal N.V., Pautova D.N., Litviakov N.V., Vtorushin S.V., Cherdyntseva N.V. Perelmuter V.M. 2017. Intratumoral morphological heterogeneity of breast cancer as an indicator of the metastatic potential and tumor chemosensitivity. Acta Naturae. V. 9. P. 32. https://doi.org/10.32607/20758251-2017-9-1-56-67
Kadrmas J.L., Beckerle M.C. 2004. The LIM domain: From the cytoskeleton to the nucleus. Nat. Rev. Mol. Cell Biol. V. 5. P. 920. https://doi.org/10.1038/nrm1499
Lin Y.H., Zhen Y.Y., Chien K.Y., Lee I.C., Lin W.C., Chen M.Y., Pai L.M. 2017. LIMCH1 regulates nonmuscle myosin-II activity and suppresses cell migration. Mol. Biol. Cell. V. 28. P. 1054. https://doi.org/10.1091/mbc.e15-04-0218
Spiliotis E.T., Nakos K. 2021. Cellular functions of actin-and microtubule-associated septins. Curr. Biol. V. 31. P. R651. https://doi.org/10.1016/j.cub.2021.03.064
Tashireva L.A., Zavyalova M.V., Savelieva O.E., Gerashchenko T.S., Kaigorodova E.V., Denisov E.V., Perelmuter V.M. 2020. Single tumor cells with epithelial-like morphology are associated with breast cancer metastasis. Front. Oncol. V. 10. P. 50. https://dx.doi.org/10.3389%2Ffonc.2020.00050
WHO Classification of Tumours . Breast, 5th edn. Lyon: IARC Publications. 2019.
Zavyalova M.V., Denisov E.V., Tashireva L.A., Savelieva O.E., Kaigorodova E.V., Krakhmal N. V., Perelmuter V.M. 2019. Intravasation as a key step in cancer metastasis. Biochem. (Moscow). V. 84. P.762. https://doi.org/10.1134/S0006297919070071
Zhang Y., Zhang Y., Xu H. 2019. LIMCH1 suppress the growth of lung cancer by interacting with HUWE1 to sustain p53 stability. Gene. V. 712. P.143963. https://doi.org/10.1016/j.gene.2019.143963
Дополнительные материалы отсутствуют.


