Цитология, 2022, T. 64, № 2, стр. 141-149
Особенности структуры миокарда левого желудочка преждевременно рожденных крыс в раннем постнатальном периоде онтогенеза
В. В. Иванова 1, *, И. В. Мильто 1, О. Н. Серебрякова 1, И. В. Суходоло 1
1 Кафедра морфологии и общей патологии Сибирского государственного медицинского университета Минздрава России
634050 Томск, Россия
* E-mail: ivvera92@rambler.ru
Поступила в редакцию 08.11.2021
После доработки 10.12.2021
Принята к публикации 23.12.2021
- EDN: LIAZSQ
- DOI: 10.31857/S0041377122020031
Аннотация
Преждевременное рождение положительно коррелирует с предрасположенностью к развитию во взрослом возрасте заболеваний сердечно-сосудистой системы. Выявление морфофункциональных изменений сердца у преждевременно рожденных детей в раннем постнатальном периоде онтогенеза является приоритетной задачей, так как позволит предупредить или скорректировать развитие у них отдаленных негативных эффектов недоношенности на сердечно-сосудистую систему. Проведен гистологический и морфометрический анализ миокарда левого желудочка сердца крыс линии Вистар, рожденных на 21 и 21.5 сут беременности (полный срок беременности составляет 22 сут). Показано, что преждевременное рождение приводит к увеличению удельного объема стромы миокарда крыс в раннем постнатальном периоде онтогенеза. Преждевременное рождение не приводит к изменению количества и коэффициента дегрануляции тучных клеток в миокарде левого желудочка сердца крыс. Морфологические изменения миокарда преждевременно рожденных крыс более выражены при меньшем сроке беременности (21 сут беременности).
В мире преждевременное рождение (ранее 37 полных нед. беременности) встречается в 5–15% случаев (Harrison, Goldenberg, 2016). Совершенствование неонатального ухода позволяет сохранить жизнь детям, рожденным ранее 28 нед. беременности, однако меньший срок гестации ассоциирован с большей структурной и функциональной незрелостью внутренних органов на момент рождения. Рождение является фактором, оказывающим существенное влияние на развитие структурно и функционально незрелых внутренних органов преждевременно рожденных детей. На основании клинических наблюдений можно констатировать, что адаптивное ремоделирование сердца вследствие преждевременного рождения приводит к формированию его структурных и функциональных особенностей, которые определяются с первых месяцев после рождения (Erickson et al., 2019) и на всем протяжении постнатального периода онтогенеза (Cox et al., 2019; Goss et al., 2020; Telles et al., 2020; Barton et al., 2021). Морфологические особенности сердца и функциональные изменения сердечной деятельности преждевременно рожденных детей могут служить предпосылками для развития патологических изменений в сердце (Sullivan et al., 2019). Известно, что преждевременное рождение сочетается со снижением миокардиального резерва (Huckstep et al., 2018), является риском раннего развития ишемической болезни сердца (Crump et al., 2019), гипертонической болезни и сердечной недостаточности (Carr et al., 2017). Проведение эксперимента, позволяющего изучить влияние преждевременного рождения на строение и функционирование сердца является актуальной задачей.
Для изучения последствий преждевременного рождения на морфофункциональное состояние сердца перспективно проведение исследований на грызунах ввиду их высокой плодовитости и короткой продолжительности жизни. Одной из наиболее популярных моделей недоношенности у крыс является содержание крыс в раннем постнатальном периоде онтогенеза в гипероксических условиях (Bertagnolli et al., 2014; Benni et al., 2020; Cohen et al., 2021). Однако данная модель позволяет оценить, главным образом, влияние окислительного стресса на развитие морфофункциональных особенностей органов недоношенных животных и не воссоздает всех аспектов преждевременного рождения.
Продолжительность пренатального периода онтогенеза контрольных крыс составляет 22 сут, что соответствует полному сроку беременности крыс Вистар. Период с 18 по 22 сут эмбриогенеза крыс Вистар соответствует третьему триместру беременности у человека. В данный промежуток времени плод крысы стремительно растет, органы претерпевают значительные структурные перестройки (Toyono et al., 1999). Получение потомства крыс, рожденных на 12 или 24 ч ранее полного срока, является экспериментальной моделью преждевременного рождения, применимой для биомедицинских целей (Tanswell et al., 1989; Li et al., 2013; Grases-Pintó et al., 2019).
Целью данного исследования является определение влияния преждевременного рождения на структуру левого желудочка сердца крыс в раннем постнатальном периоде онтогенеза. Для достижения цели сформулированы задачи: изучить гистологическое строение стенки левого желудочка; провести количественный морфометрический анализ миокарда левого желудочка преждевременно рожденных крыс в динамике (1–21 сут постнатального периода онтогенеза).
МАТЕРИАЛ И МЕТОДИКА
Дизайн исследования. В эксперименте использовано 72 крысы Вистар обоего пола, из которых были сформированы 3 группы: контрольная группа (доношенные животные, 22 сут беременности, n = 24), группа 1 (недоношенные крысы, 21.5 сут беременности, n = 24) и группа 2 (недоношенные крысы, 21 сут беременности, n = 24). Для получения потомства, самцов крыс Вистар (2-х месячные весом 180 ± 20 г) подсаживали на ночь к самкам крыс Вистар (3-х месячные весом 180 ± 20 г), находившимся на стадии проэструса полового цикла. Утром следующего дня анализировали влагалищные мазки самок крыс. При обнаружении во влагалищном мазке сперматозоидов, считали этот день первым днем беременности. Индукцию преждевременных родов осуществляли подкожным введением самкам крыс мифепристона (1 мл, 10 мг на 1 кг массы тела; Sigma-Aldrich, США) за 24 ч до предполагаемого срока родов (Dudley et al., 1996). Крыс содержали в стандартных условиях вивария. Беременные крысы получали полнорационный корм для беременных животных ЛбК 120 Р-22 (Дельта Фидс, Россия). Выведение потомства из эксперимента осуществляли на 1, 7, 14 и 21 сут постнатального периода онтогенеза асфиксией CO2. Сердца крыс фиксировали в 10%-ном формалине (рН 7.4) (БиоВитрум, Россия) в течение 24 ч для последующего гистологического и морфометрического исследования.
Гистологическое исследование. После фиксации в формалине сердца промывали в проточной воде, проводили через Isoprep (БиоВитрум, Россия) и заливали в парафиновую смесь HISTOMIX (БиоВитрум, Россия). Парафиновые срезы толщиной 5 мкм, полученные на автоматическом микротоме HM355S (Thermo Fisher Scientific, Китай), окрашивали по методу Массона (БиоВитрум, Россия) и метиленовым синим. Анализ гистологических препаратов проводили на световом микроскопе Axioscope 40 (Zeiss, Германия), при увеличении объектива ×40, фотосъемку проводили при помощи цифровой камеры CanonG5 (Canon, Китай).
Морфометрия и статистическая обработка данных. На продольных срезах стенка левого желудочка может быть условно разделена на три части: базальная треть, средняя треть и верхушечная треть. Морфометрический анализ миокарда проведен в средней трети боковой стенки левого желудочка экспериментальных животных.
На гистологических препаратах сердца крыс, окрашенных по методу Массона, при помощи программы ImageJ 1.48 (NIH, США) измеряли диаметр сократительных кардиомиоцитов, а также методом точечного счета определяли удельный объем коллагеновых волокон в стенке левого желудочка.
Диаметр измеряли в продольно срезанных кардиомиоцитах на уровне ядра. Для каждого животного на фотографиях миокарда левого желудочка измеряли диаметр 50 кардиомиоцитов, не менее чем в 5 полях зрения.
Для каждого животного удельный объем коллагеновых волокон в миокарде левого желудочка определяли на фотографиях не менее чем в 5 полях зрения.
В случае, когда малые размеры сердца экспериментальных животных не позволяли получить фотографии 5 различных полей зрения средней трети боковой стенки левого желудочка, анализировали серийные срезы.
На окрашенных метиленовым синим препаратах сердца крыс подсчитывали количество тучных клеток в миокарде средней трети боковой стенки левого желудочка. Подсчет количества тучных клеток проводили в 5 различных полях зрения для каждого животного, показатель представлен в перерасчете на 1 мм2 среза. Коэффициент дегрануляции определяли как отношение количества тучных клеток с явными признаками дегрануляции к общему количеству подсчитанных тучных клеток на препарате, выраженное в процентах.
Анализ морфометрических показателей проводили при помощи SPSS 16.0 (IBM, США) с использованием критериев Шапиро–Уилка и Манна–Уитни. Данные представлены в виде медианы, нижнего и верхнего квартилей – Ме (Q1; Q3). Различия между показателями считали достоверными при уровне значимости p ≤ 0.01. Различий рассматриваемых морфометрических показателей между аналогичными параметрами самцов и самок крыс в экспериментальные сроки не обнаружено, поэтому гистологическое описание и морфометрические показатели в таблицах даны без разделения по полу крыс.
РЕЗУЛЬТАТЫ
Получение преждевременно рожденного потомства. Подкожное введение беременным крысам Вистар на 20 или 20.5 сут от начала беременности мифепристона приводит к преждевременным родам на 21 или 21.5 сут соответственно. Помет составляет в среднем 12 ± 2 особей. Среди крыс контрольной группы и группы 1 (недоношенные крысы, 21.5 сут беременности) гибели в исследуемые сроки не наблюдается. Среди крыс группы 2 (недоношенные крысы, 21 сут беременности) в первые сутки постнатального периода онтогенеза наблюдается гибель 1–2 животных в помете.
Анализ сократительных кардиомиоцитов в стенке левого желудочка крыс. Толщина стенки левого желудочка сердца крыс во всех исследованных группах визуально увеличивается в ходе эксперимента. Диаметр сократительных кардиомиоцитов левого желудочка крыс всех исследуемых групп также возрастает в ходе эксперимента (рис. 1). На 1 сут постнатального периода онтогенеза диаметр сократительных кардиомиоцитов левого желудочка крыс группы 2 превосходит таковой у крыс контрольной группы. Диаметр сократительных кардиомиоцитов левого желудочка крыс группы 1 и группы 2 меньше соответствующего показателя контрольных животных на 7 и 14 сут постнатального периода онтогенеза. На 21 сут постнатального периода онтогенеза исследуемый показатель у крыс группы 1 выше, чем у крыс группы 2 и крыс контрольной группы.
Рис. 1.
Динамика диаметра сократительных кардиомиоцитов и удельного объема коллагеновых волокон миокарда левого желудочка доношенных крыс (контрольная группа) и недоношенных, рожденных через 21.5 сут (группа 1) и 21 сут (группа 2), в течение 21 сут постнатального периода онтогенеза. Результаты представлены в виде медианы (Me), нижнего (Q1) и верхнего (Q3) квартилей, крестики показывают среднее значение показателя. Различия достоверны при р < 0.01 при сравнении с соответствующим показателем (а) на предыдущем сроке, (б) в контрольной группе и (в) в группе 1.
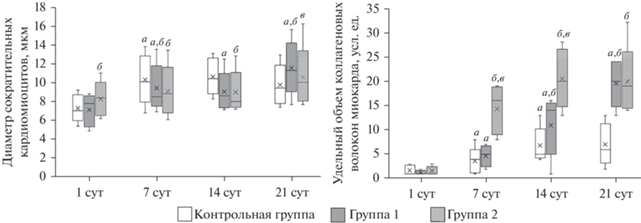
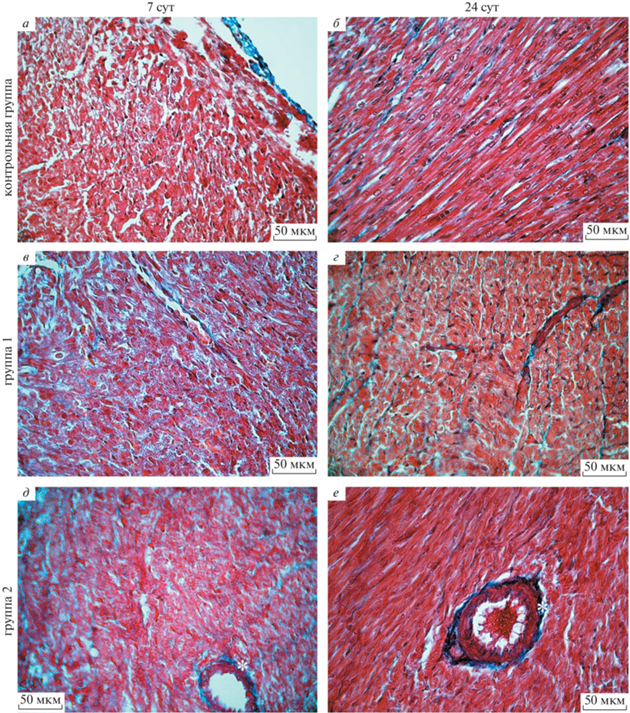
Удельный объем коллагеновых волокон в миокарде левого желудочка крыс. Строму миокарда составляют прослойки соединительной ткани – эндомизий и перимизий. Строма миокарда несет в своем составе сосуды и нервы, помимо этого соединительная ткань замещает погибшие кардиомиоциты. Основным компонентом стромы миокарда в постнатальном периоде онтогенеза являются коллагеновые волокна, образованные коллагенами I и III типов. Окрашивание гистологических срезов сердца по методу Массона позволяет селективно выявлять на препаратах коллагеновые волокна. В ходе эксперимента у крыс всех исследуемых групп в стенке левого желудочка наблюдается увеличение удельного объема коллагеновых волокон (рис. 2), которое носит диффузный, а не очаговый характер. У преждевременно рожденных животных удельный объем коллагеновых волокон в миокарде левого желудочка превышает аналогичный показатель сердца крыс контрольной группы с 14 сут (группа 1) и с 7 сут (группа 2) постнатального периода онтогенеза (рис. 1). Удельный объем коллагеновых волокон в стенке левого желудочка преждевременно рожденных крыс остается повышенным, по сравнению с таковым у животных контрольной группы, до конца эксперимента. Стоит отметить, что удельный объем коллагеновых волокон в строме миокарда левого желудочка быстрее увеличивается в группе 2, чем в группе 1.
Рис. 2.
Стенка левого желудочка крысы на 7 и 21 сут постнатального периода онтогенеза. а, б – Контрольная группа (животные, рожденные на 22 сут беременности); в, г – группа 1 (животные, рожденные на 21.5 сут беременности); д, е – группа 2 (животные, рожденные на 21 сут беременности). Окраска по методу Массона. Наблюдается увеличение выраженности диффузного фиброза миокарда левого желудочка у преждевременно рожденных крыс, в сравнении с доношенными животными, а также периваскулярный фиброз (д, е). Коллагеновые волокна окрашены анилиновым синим. Звездочками отмечены зоны развития периваскулярного фиброза.
Количество тучных клеток в стенке левого желудочка крыс. Тучные клетки в миокарде левого желудочка локализуются в периваскулярной соединительной ткани, а также между кардиомиоцитами (рис. 3). Тучные клетки в миокарде крыс всех исследуемых групп на 1 и 7 сут постнатального периода онтогенеза практические не определяются (табл. 1). Количество тучных клеток в 1 мм2 площади миокарда левого желудочка крыс контрольной, 1-ой и 2-ой групп увеличивается в ходе постнатального периода онтогенеза (табл. 1). В исследуемые сроки не обнаружено отличий количества тучных клеток и показателя коэффициента дегрануляции тучных клеток в миокарде левого желудочка доношенных и преждевременно рожденных крыс (табл. 1).
Рис. 3.
Стенка левого желудочка крысы на 21 сут постнатального периода онтогенеза. а – Контрольная группа (животные, рожденные на 22 сут беременности); б – группа 1 (животные, рожденные на 21.5 сут беременности); в – группа 2 (животные, рожденные на 21 сут беременности). Окраска метиленовым синим. Стрелки указывают на тучные клетки с признаками дегрануляции. Головками стрелок показаны тучные клетки без признаков дегрануляции.
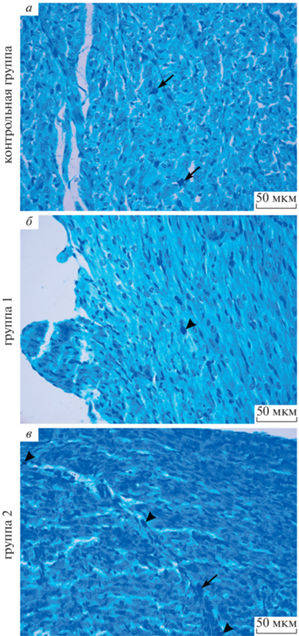
Таблица 1.
Динамика морфофункциональных показателей тучных клеток в миокарде левого желудочка крыс контрольной группы (рожденных на 22 сут беременности) и преждевременно рожденных на 21.5 сут беременности (группа 1) и на 21 сут беременности (группа 2).
| Группа | Срок эксперимента, сут | |||
|---|---|---|---|---|
| 1 | 7 | 14 | 21 | |
| Количество тучных клеток на 1 мм2 срезов миокарда левого желудочка, Me (Q1; Q3) | ||||
| Контрольная | 0.0 (0.0; 0.0) | 0.0 (0.0; 0.0) | 0.0 (0.0; 9.4) | 9.4 (0.0; 18.8) |
| 1 | 0.0 (0.0; 0.0) | 0.0 (0.0; 1.6) | 6.3 (4.7; 18.8) а | 6.3 (0.0; 20.3) |
| 2 | 0.0 (0.0; 0.0) | 0.0 (0.0; 0.0) | 6.3 (0.0; 14.1) а | 15.6 (0.0; 23.4) |
| Коэффициент дегрануляции тучных клеток, %, Me (Q1; Q3) | ||||
| Контрольная | – | – | 48.0 (35.0; 63.5) | 40.0 (36.0; 60.0) |
| 1 | – | – | 40.0 (34.7; 52.0) | 64.7 (45.0; 67.5)а |
| 2 | – | – | 50.0 (40.0; 65.0) | 50.0 (43.5; 58.5) |
ОБСУЖДЕНИЕ
Недоношенность характеризуется низкой массой тела при рождении и структурной незрелостью внутренних органов, что оказывает влияние на процесс постнатальной адаптации сердца и кровеносных сосудов (Филюшкина и др., 2014). Структурные изменения сердца, вызванные преждевременным рождением, носят персистирующий характер: определяются в детском, подростковом и взрослом возрасте (Bensley et al., 2010; Telles et al., 2020). Морфологические особенности сердца преждевременно рожденных детей, такие как увеличение толщины стенки и массы левого желудочка, меньший объем полостей сердца, смещение верхушки сердца (Lewandowski et al., 2021), могут служить предпосылкой более раннего развития у этой категории людей заболеваний сердечно-сосудистой системы (Bensley et al., 2010). Установление морфофункциональных изменений сердца у преждевременно рожденных детей в раннем постнатальном периоде онтогенеза является приоритетной задачей, так как позволит предупредить или скорректировать развитие у них отдаленных негативных эффектов недоношенности на сердечно-сосудистую систему.
Адаптация сердца к возрастающим нагрузкам в ходе раннего постнатального периода онтогенеза заключается как в клеточных реакциях, так и в перестройке межклеточного вещества. В ходе постнатального периода онтогенеза показано увеличение удельного объема стромы миокарда крыс, что согласуется с данными (Carver et al., 1993). Распространение стромы между кардиомиоцитами в ходе увеличения размеров сердца обусловлено, в том числе, развитием сосудов и происходит одновременно с переходом кардиомиоцитов от гиперплазии к гипертрофии (Carver et al., 1993). Известно, что компоненты межклеточного вещества выполняют не только структурную, но и морфогенетическую функцию. Увеличение после рождения ригидности межклеточного вещества стромы миокарда, обусловленное накоплением коллагенов I и III типов, коррелирует с увеличением упорядоченности организации миофибрилл кардиомиоцитов, а также со снижением пролиферативной активности кардиомиоцитов и их переходом в G0 период клеточного цикла (Carver et al., 1993; Yahalom-Ronen et al., 2015; Silva et al., 2021).
Изменение удельного объема коллагеновых волокон в строме миокарда левого желудочка у преждевременно рожденных крыс развивается уже к 7–14 сут постнатального периода онтогенеза. Аналогично, содержание крыс в гипероксических условиях с 3 по 10 сут после рождения (модель преждевременного рождения) приводит к фиброзу миокарда, а также увеличению массового индекса левого желудочка и активации ренин-ангиотензиновой системы в возрасте 1 мес (Bertagnolli et al., 2014; Mian et al., 2019). Структурные изменения миокарда сопровождаются снижением фракции выброса и индекса сердечного выброса и носят персистирующий характер (Mian et al., 2019). Напротив, Голдинг с соавторами (Golding et al., 2020) сообщают, что содержание крыс с 1 по 14 сут после рождения в условиях гипероксии не только не приводит к 21 сут постнатального периода онтогенеза к фиброзу миокарда левого желудочка, но и сопряжено с уменьшением удельного объема соединительной ткани в миокарде правого желудочка.
Увеличение удельного объема межклеточного вещества за счет повышения экспрессии коллагена клетками стромы миокарда желудочков и межжелудочковой перегородки продемонстрировано в раннем постнатальном периоде онтогенеза (2 мес) у преждевременно рожденных овец (Bensley et al., 2010; Le et al., 2020). Наше исследование не выявило корреляции между изменением диаметра сократительных кардиомиоцитов и увеличением удельного объема стромы миокарда, тогда как другие авторы (Bensley et al., 2010) установили, что фиброз миокарда преждевременно рожденных животных сопровождается гипертрофией кардиомиоцитов.
Полученные в эксперименте сведения, вероятно, повторяют закономерности морфогенеза сердца в ответ на преждевременное рождение у человека. На основании косвенных данных, сделан вывод о развитии диффузного фиброза миокарда левого желудочка у преждевременно рожденных детей (Lewandowski et al., 2021). Ввиду того, что гадолиний медленнее накапливается в межклеточном веществе, магнитно-резонансная томография с использованием гадолиний-содержащих контрастных агентов позволяет оценить удельный объем межклеточного вещества в миокарде. Показано, что у преждевременно рожденных детей к 22–23 годам определяется больший удельный объем межклеточного вещества в миокарде левого желудочка, а также снижены конечный диастолический объем и ударный объем левого желудочка, по сравнению с аналогичными показателями у доношенных сверстников (Lewandowski et al., 2021). Интересным представляется изучение удельного объема межклеточного вещества миокарда при помощи магнитно-резонансной томографии у преждевременно рожденных детей более ранних возрастных групп, так как известно, что уже в возрасте 6 лет у преждевременно рожденных детей наряду с изменением формы и размера левого желудочка наблюдается повышенная жесткость стенки левого желудочка, по сравнению с таковой у доношенных сверстников (Mohlkert et al., 2018).
Показано, что тучные клетки, посредством секреции триптазы, химазы, TGF-β1, TNF и IL-1β, могут быть вовлечены в развитие фиброза в различных органах, в том числе в сердце (Bradding, Pejler, 2018; Гриценко и др., 2020). Результаты настоящего исследования не позволяют предположить участие тучных клеток в развитии диффузного фиброза миокарда преждевременно рожденных крыс в раннем постнатальном периоде (1–21 сут), что, однако, не исключает возможность их профибротического действия в отдаленном постнатальном периоде онтогенеза.
Увеличение экспрессии коллагена в миокарде преждевременно рожденных крыс наблюдается уже к 7 сут постнатального периода онтогенеза и может быть причиной более раннего перехода кардиомиоцитов в G0 период клеточного цикла и, как следствие, снижения миокардиального резерва. Кроме того, диффузный фиброз способствует увеличению жесткости миокарда и является причиной развития систолической и диастолической дисфункции (Conrad et al., 1995; Rockey et al., 2015). По данным клинических исследований, фиброз миокарда является предиктором негативных исходов заболеваний сердечно-сосудистой системы (Assomull et al., 2006; Kwon et al., 2009).
Стоит отметить, что на сегодняшний день у человека структурная незрелость органов, как правило, не является изолированным фактором, а сопровождается различными терапевтическими воздействиями (механическая вентиляция легких, введение глюкокортикостероидных препаратов и др.), которые также оказывают влияние на постнатальную адаптацию сердца преждевременно рожденных детей. Показано, что введение дексаметазона доношенным новорожденным крысам приводит к гипертрофии кардиомиоцитов и повышенному накоплению коллагеновых волокон в строме миокарда взрослых крыс (Bal et al., 2009). Антенатальная терапия глюкокортикостероидами приводит к увеличению толщины стенки левого желудочка и межжелудочковой перегородки новорожденных детей (Evans, 1994; Vrselja et al., 2021). Возможно, сопутствующая терапия может усугублять структурно-функциональные изменения миокарда, вызванные преждевременным рождением (Le et al., 2018).
Таким образом, преждевременное рождение приводит к увеличению удельного объема стромы миокарда в раннем постнатальном периоде онтогенеза, которое может быть одним из начальных звеньев патогенеза заболеваний сердечно-сосудистой системы. Коррекция постнатального ремоделирования сердца преждевременно рожденных детей может снизить риск развития сердечно-сосудистых заболеваний у лиц данной категории.
Список литературы
Гриценко О.В., Чумакова Г.А., Шевляков И.В., Веселовская Н.Г. 2020. Внеклеточный матрикс сердца и его изменения при фиброзе миокарда. Кардиология. Т. 60. С. 107. (Gritsenko O.V., Chumakova G.A., Shevlyakov I.V., Veselovskaya N.G. 2020. Extracellular matrix of the heart and its changes in myocardial fibrosis. Kardiologiia. V. 60. P. 107.)
Филюшкина М.Н., Тарасова А.А., Ефимов М.С., Чабаидзе Ж.Л., Эрлих А.Л. 2014. Особенности морфофункционального состояния сердца у недоношенных детей (обзор литературы). Вестник Российского научного центра рентгенорадиологии Минздрава России. Т. 3. С. 4. (Filyushkina M.N., Tarasova А.А., Efimov M.S., Chabaidze J.L., Erlikh А.L. 2014. The unique features of morphofunctional condition of the heart in premature infants. Literature review. Vestnik of the Russian Scientific Center of Roentgenoradiology. V. 3. P. 4.)
Assomull R.G., Prasad S.K., Lyne J., Smith G., Burman E.D., Khan M., Sheppard M.N., Poole-Wilson P.A., Pennell D.J. 2006. Cardiovascular magnetic resonance, fibrosis, and prognosis in dilated cardiomyopathy. J. Am. Coll. Cardiol. V. 48. P. 1977.
Bal M.P., de Vries W.B., Steendijk P., Homoet-van der Kraak P., van der Leij F.R., Baan J., van Oosterhout M.F., van Bel F. 2009. Histopathological changes of the heart after neonatal dexamethasone treatment: studies in 4-, 8-, and 50-week-old rats. Pediatr. Res. V. 66. P. 74.
Barton G.P., Corrado P.A., Francois C.J., Chesler N.C., Eldridge M.W., Wieben O., Goss K.N. 2021. Exaggerated cardiac contractile response to hypoxia in adults born preterm. J. Clin. Med. V. 10. P. 1166.
Benny M., Hernandez D.R., Sharma M., Yousefi K., Kulandavelu S., Batlahally S., Zambrano R., Chen P., Martinez E.C., Schmidt A.F., Shehadeh L.A., Vasquez-Padron R.I., Wu S., Velazquez O.C., Young K.C. 2020. Neonatal hyperoxia exposure induces aortic biomechanical alterations and cardiac dysfunction in juvenile rats. Physiol. Rep. V. 8 e14334.
Bensley J.G., Stacy V.K., De Matteo R., Harding R., Black M.J. 2010. Cardiac remodelling as a result of pre-term birth: implications for future cardiovascular disease. Eur. Heart J. V. 31. P. 2058.
Bertagnolli M., Huyard F., Cloutier A., Anstey Z., Huot-Marchand J.É., Fallaha C., Paradis P., Schiffrin E.L., Deblois D., Nuyt A.M. 2014. Transient neonatal high oxygen exposure leads to early adult cardiac dysfunction, remodeling, and activation of the renin-angiotensin system. Hypertension. V. 63. P. 143.
Bradding P., Pejler G. 2018. The controversial role of mast cells in fibrosis. Immunological Reviews. V. 282. P. 198.
Carr H., Cnattingius S., Granath F., Ludvigsson J.F., Edstedt Bonamy A.K. 2017. Preterm birth and risk of heart failure up to early adulthood. J. Am. Coll. Cardiol. V. 69. P. 2634.
Carver W., Terracio L., Borg T.K. 1993. Expression and accumulation of interstitial collagen in the neonatal rat heart. Anat. Rec. V. 236. P. 511.
Cohen E.D., Yee M., Porter G.A. Jr., Ritzer E., McDavid A.N., Brookes P.S., Pryhuber G.S., O’Reilly M.A. 2021. Neonatal hyperoxia inhibits proliferation and survival of atrial cardiomyocytes by suppressing fatty acid synthesis. J.C.I. Insight. V. 6. e140785.
Conrad C.H., Brooks W.W., Hayes J.A., Sen S., Robinson K.G., Bing O.H. 1995. Myocardial fibrosis and stiffness with hypertrophy and heart failure in the spontaneously hypertensive rat. Circulation. V. 91. P. 161.
Cox D.J., Bai W., Price A.N., Edwards A.D., Rueckert D., Groves A.M. 2019. Ventricular remodeling in preterm infants: computational cardiac magnetic resonance atlasing shows significant early remodeling of the left ventricle. P-ediatr. Res. V. 85. P. 807.
Crump C., Howell E.A., Stroustrup A., McLaughlin M.A., Sundquist J., Sundquist K. 2019. Association of preterm birth with risk of ischemic heart disease in adulthood. JAMA Pediatr. V. 173. P. 736.
Dudley D.J., Branch D.W., Edwin S.S., Mitchell M.D. 1996. Induction of preterm birth in mice by RU486. Biol. Reprod. V. 55. P.992.
Erickson C.T., Patel M.D., Choudhry S., Bisselou K.S., Sekarski T., Craft M., Li L., Khuffash A. E., Hamvas A., Kutty S., Singh G.K., Levy P.T. 2019. Persistence of right ventricular dysfunction and altered morphometry in asymptomatic preterm Infants through one year of age: Cardiac phenotype of prematurity. Cardiol. Young. V. 29. P. 945.
Evans N. 1994. Cardiovascular effects of dexamethasone in the preterm infant. Arch. Dis. Child Fetal Neonatal Ed. V. 70. F. 25.
Golding R., Braun R., Kumari S., Goss K. 2020. Differing collagen responses in the right and left ventricle following postnatal hyperoxia exposure. The FASEB Journal. V. 34. P. 1.
Goss K.N., Haraldsdottir K., Beshish A.G., Barton G.P., Watson A.M., Palta M., Chesler N.C., Francois C.J., Wieben O., Eldridge M.W. 2020. Association between preterm birth and arrested cardiac growth in adolescents and young adults. JAMA Cardiol. V. 5. P. 910.
Grases-Pintó B., Torres-Castro P., Abril-Gil M., Castell M., Rodríguez-Lagunas M.J., Pérez-Cano F.J., Franch À. 2019. A preterm rat model for immunonutritional studies. Nutrients. V. 11. P. 999.
Harrison M.S., Goldenberg R.L. 2016. Global burden of prematurity. Semin. Fetal Neonatal Med. V. 21. P. 74.
Huckstep O.J., Williamson W., Telles F., Burchert H., Bertagnolli M., Herdman C., Arnold L., Smillie R., Mohamed A., Boardman H., McCormick K., Neubauer S., Leeson P., Lewandowski A.J. 2018. Physiological stress elicits impaired left ventricular function in preterm-born adults. J. Am. Coll. Cardiol. V. 71. P. 1347.
Kwon D.H., Halley C.M., Popovic Z.B., Carrigan T.P., Zysek V., Setser R., Schoenhagen P., Flamm S.D., Starling R.C., Desai M.Y. 2009. Gender differences in survival in patients with severe left ventricular dysfunction despite similar extent of myocardial scar measured on cardiac magnetic resonance. Eur. J. Heart Fail. V. 11. P. 937.
Le B., Dahl M.J., Albertine K.H., Sutherland M.R., Black M.J. 2020. Preterm birth with neonatal interventions accelerates collagen deposition in the left ventricle of lambs without affecting cardiomyocyte development. CJC Open. V. 3. P. 574.
Le B., Sutherland M.R., Black M.J. 2018. Maladaptive structural remodelling of the heart following preterm birth. Curr. Opin. Physiol. V. 1. P. 89.
Lewandowski A.J., Raman B., Bertagnolli M., Mohamed A., Williamson W., Pelado J.L., McCance A., Lapidaire W., Neubauer S., Leeson P. 2021. Association of preterm birth with myocardial fibrosis and diastolic dysfunction in young adulthood. J. Am. Coll. Cardiol. V. 78. P. 683.
Li R., Yang X., Wang Y., Chu Z., Liu T., Zhu T., Gao X., Ma Z. 2013. Effects of preterm birth on normal retinal vascular development and oxygen-induced retinopathy in the neonatal rat. Curr. Eye Res. V. 38. P. 1266.
Mian M.O.R., He Y., Bertagnolli M., Mai-Vo T.A., Fernandes R.O., Boudreau F., Cloutier A., Luu T.M., Nuyt A.M. 2019. TLR (Toll-like receptor) 4 antagonism prevents left ventricular hypertrophy and dysfunction caused by neonatal hyperoxia exposure in rats. Hypertension. V. 74. P. 843.
Mohlkert L.A., Hallberg J., Broberg O., Rydberg A., Halvorsen C.P., Liuba P., Fellman V., Domellöf M., Sjöberg G., Norman M. 2018. The preterm heart in childhood: left ventricular structure, geometry, and function assessed by echocardiography in 6-year-old survivors of periviable births. J. Am. Heart Assoc. V. 7. e007742.
Rockey D.C., Bell P.D., Hill J.A. 2015. Fibrosis-a common pathway to organ injury and failure. N. Engl. J. Med. V. 372. P. 1138.
Silva A.C., Pereira C., Fonseca A.C.R.G., Pinto-do-Ó P., Nascimento D.S. 2021. Bearing my heart: the role of extracellular matrix on cardiac development, homeostasis, and injury response. Front. Cell Dev. Biol. V. 8. e621644.
Sullivan M.C., Winchester S.B., Msall M.E. 2019. Prematurity and cardiovascular risk at early adulthood. Child Care Health Dev. V. 45. P. 71.
Tanswell A.K., Wong L., Possmayer F., Freeman B.A. 1989. The preterm rat: a model for studies of acute and chronic neonatal lung disease. Pediatr. Res. V. 25. P. 525.
Telles F., McNamara N., Nanayakkara S., Doyle M.P., Williams M., Yaeger L., Marwick T.H., Leeson P., Levy P.T., Lewandowski A.J. 2020. Changes in the preterm heart from birth to young adulthood: a meta-analysis. Pediatrics. V. 146. e20200146.
Toyono M., Ito T., Harada K., Tamura M., Takada G. 1999. Morphological adaptation of the cardiovascular system in fetal rats during late gestation. Tohoku J. Exp. Med. V. 188. P. 299.
Vrselja A., Pillow J.J., Black M.J. 2021. Effect of preterm birth on cardiac and cardiomyocyte growth and the consequences of antenatal and postnatal glucocorticoid treatment. J. Clin. Med. V. 10. P. 3896.
Yahalom-Ronen Y., Rajchman D., Sarig R., Geiger B., Tzahor E. 2015. Reduced matrix rigidity promotes neonatal cardiomyocyte dedifferentiation, proliferation and clonal expansion. Elife. V. 4. e07455.
Дополнительные материалы отсутствуют.


