Цитология, 2022, T. 64, № 3, стр. 216-225
Поиск низкомолекулярных химических соединений, специфически взаимодействующих с прокаспазой-8 в сигнальном комплексе DISC
Й. Эспе 1, Н. В. Иванисенко 2, Л. К. Хиллерт-Рихтер 1, В. А. Иванисенко 2, И. Н. Лаврик 1, 2, *
1 Отдел прикладных исследований воспаления Медицинского факультета Центра динамических систем
Университета Отто фон Гeрике
Магдебург, Германия
2 Институт цитологии и генетики СО РАН
630090 Новосибирск, Россия
* E-mail: inna.lavrik@med.ovgu.de
Поступила в редакцию 25.02.2022
После доработки 09.03.2022
Принята к публикации 09.03.2022
- EDN: PSBTYY
- DOI: 10.31857/S0041377122030026
Аннотация
Рационально сконструированные низкомолекулярные химические соединения широко применяются для исследования молекулярных механизмов активации сигнальных путей. Активация внешнего пути апоптоза через рецепторы CD95/Fas или TRAIL-R1/2 инициируется образованием сигнального комплекса, индуцирующего гибель (DISC). Активация прокаспазы-8 в комплексе DISC является центральным событием, запускающим внешний путь апоптоза. Активация прокаспазы-8 происходит при ее димеризации в филаментах, образованныx эффекторными доменами смерти (DED) данного белка. Образование DED филаментов происходит в составе комплекса DISC. В связи с этим, направленное воздействие на филаменты DED может позволить как выявить тонкие молекулярные механизмы активации комплекса DISC, так и осуществлять фармакологическое воздействие на внешний путь апоптоза. В настоящей работе мы разработали ряд низкомолекулярных химических соединений, с помощью скрининга in silico для направленного воздействия на прокаспазу-8 в составе филаментов DED. Далее мы осуществлили экспериментальную проверку активности данных соединений и отобрали соедиения, обладающие наибольшей эффективностью. Представленная работа описывает разработку новых химических соединений, которые предназначены для направленного воздействия на прокаспазу-8 и внешний путь апоптоза.
Апоптоз – это программа клеточной гибели, необходимая для функционирования всех многоклеточных организмов. Апоптотический сигнал может быть вызван множеством факторов, включая активацию рецепторов смерти (DR) (Krammer et al., 2007). Апоптотический сигнальный каскад DR или внешний путь апоптоза запускается активацией соответствующих DR, таких как CD95/Fas или TRAIL-R1/2 (DR4/DR5). Связывание комплиментарного лиганда смерти (DL) приводит к образованию сигнального комплекса, индуцирующего смерть (DISC) (Muzio et al., 1996; Sprick et al., 2000; Lavrik, Krammer, 2012). Комплекс DISC состоит из DR, а также белков FADD, прокаспаз-8, -10 и c-FLIP. Этот комплекс служит центральной платформой для активации прокаспазы-8, которая инициирует последующий апоптотический ответ (Sprick et al., 2002; Hughes et al., 2009). Образование комплекса DISC основано на строго определенных взаимодействиях между доменами смерти (DD) и эффекторными доменами смерти (DED) его основных компонентов (Wilson et al., 2009). Более того, недавно было показано, что прокаспаза-8 образует в комплексе DISC филаменты DED посредством взаимодействий между ее DED доменами. Филаменты DED служат платформой для димеризации и последующей активации прокаспазы-8 (Dickens et al., 2012; Schleich et al., 2012; Fu et al., 2016).
Сообщалось, что в комплексе DISC присутствуют две изоформы прокаспазы-8: прокаспаза-8a и -8b (p55 и p53 соответственно) (Medema et al., 1997). Обе изоформы содержат в их N-концевом продомене два домена DED – DED1 и DED2, за которыми следуют каталитические домены p18 и p10 (рис. 1а). Анализ, выполненный с помощью криоэлектронной микроскопии показал, что DED прокаспазы-8 собираются в упорядоченные структуры, которые были названы филаментами DED (Fu et al., 2016). Филамент DED формируется за счет трех типов взаимодействия между DED, которые классифицируются как тип I, II и III (Fu et al., 2016; Hillert et al., 2020a, 2020b). Структура DED доменов естественным образом приводит к образованию филаментов. В частности, каждый DED включает шесть интерфейсов – Ia/b, IIa/b и IIIa/b, – которые обладают способностью связываться друг с другом (Fu et al., 2016; Seyrek et al., 2020). Взаимодействия типа I опосредованы взаимодействиями интерфейсов Ia и Ib между соседними DED, которые в значительной степени опосредованы высококонсервативными остатками мотива “FL” (Phe/Leu) (Dickens et al., 2012). Взаимодействия типа I необходимы для сборки так называемых линейных цепей DED, которые, в свою очередь, представляют собой субструктуру филамента DED. Примечательно, что линейные цепи прокаспазы-8 сначала были предложены как платформа для димеризации и последующей активации прокаспазы-8 в комплексе DISC, но, как выяснилось позже, цепи DED являются лишь субструктурой филамента DED (Dickens et al., 2012; Schleich et al., 2012; Fu et al., 2016).
Рис. 1.
Потенциальный сайт связывания малых молекул в продомене прокаспазы-8. а – Основные изоформы и доменная организация прокаспазы-8. б – In silico модель положения связывания низкомолекулярного химического соединения (зеленый цвет) с сайтом прокаспазы-8 (PDB: ID 4ZBW), локализованным между DED1 и DED2. Домен DED1 показан темно-синим цветом, DED2 – голубым. Молекулярная поверхность предполагаемого сайта связывания показана коричневым цветом. в – Структура филамента DED прокаспазы-8 (PDB: ID 5L08); одна из субъединиц прокаспазы-8 филамента DED окрашена, а предполагаемый сайт связывания показан в виде молекулярной поверхности светло-коричневого цвета.
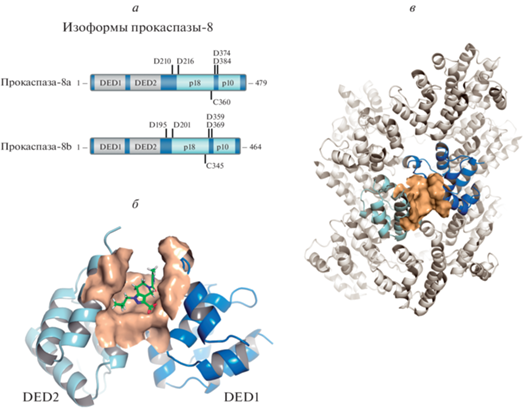
В процессе димеризации, который происходит в составе филамента DED, прокаспаза-8a/b претерпевает конформационные изменения, приводящие к образованию активного центра и активации этого зимогена (Hughes et al., 2009; Dickens et al., 2012). Затем следует расщепление прокаспазы-8a/b по остаткам Asp374/Asp359, что приводит к образованию продуктов расщепления p43/p41 и p12, которые далее подвергаются автокаталитическому процессингу посредством протеолиза по остаткам Asp384 и Asp210/216; это, в свою очередь, приводит к образованию активного гетеротетрамера каспазы-8 р102/р182 (Lavrik et al., 2003; Golks et al., 2006; Hoffmann et al., 2009). Кроме того, было показано, что параллельно с процессингом по остаткам Asp374/Asp359 небольшое количество прокаспазы-8a/b также расщепляется по Asp216, что приводит к образованию продукта расщепления p30, который включает С-концевую часть прокаспазы-8a/b (Hoffmann et al., 2009). Однако роль образования протеолитического фрагмента p30 еще предстоит выяснить.
Фармакологическое адресное воздействие на DED-домены прокаспазы-8 может позволить более детально понять молекулярные механизмы активации внешнего пути апоптоза и разработать новые терапевтические подходы для лечения заболеваний, молекулярный механизм которых затрагивает нарушение данного сигнального пути (Bucur et al., 2015; Hillert et al., 2020). Наличие недавно расшифрованной пространственной структуры филаментов DED (Yu et al., 2009; Wang et al., 2010; Fu et al., 2016) делает возможным осуществление виртуального скрининга низкомолекулярных химических соединений, специфически взаимодействующих с данным молекулярным комплексом.
Настоящая работа посвящена компьютерному дизайну группы низкомолекулярных химических соединений Casp8ins (ингибиторы каспазы-8), предназначенных для ингибирования сборки филаментов DED за счет адресного взаимодействия с DED-доменами прокаспазы-8, и дальнейшей экспериментальной проверки их активности. Экспериментальную проверку способности полученных малых химических соединений ингибировать индукцию внешнего пути апоптоза проводили в культуре клеток при комбинированном действии соединений с DL. Полученные результаты показывают возможность создания с помощью структурно-ориентированного дизайна малых химических соединений, адресно воздействующих на прокаспазу-8 в составе филаментов DED, и представляют первоначальный анализ соединений этого типа.
МАТЕРИАЛ И МЕТОДИКА
Виртуальный скрининг. Молекулярный докинг и виртуальный скрининг проводили с использованием программы Glide пакета Schrödinger Small Molecule Drug Discovery Suite 2015-1 (Schrödinger, Inc) (Friesner et al., 2004, 2006; Halgren et al., 2004). Молекулярный докинг осуществляли в режимах стандартной точности (SP) и экстраточности (XP) с использованием пространственной структуры продомена прокаспазы-8, включающей DED1 и DED2 (Shen et al., 2015; PDB ID: 4ZBW). Перед проведением виртуального скрининга структура белка подверглась подготовительной обработке с использованием модуля “Protein preparation wizard” пакета Schrödinger Suite 2015-1 (Irwin, et al., 2012; Sterling et al., 2015). В расчетах применяли силовое поле OPLS_2005. Виртуальный скрининг выполняли с использованием библиотеки лидер-подобных коммерчески доступных соединений ZINC12, которая содержала структуры более 3.6 млн коммерчески доступных малых молекул (Irwin et al., 2012). Первый этап виртуального скрининга осуществляли в режиме стандартной точности (оценочная функция SP Score). На данном этапе было отобрано около 100 тыс. соединений с лучшими значениями оценочной функции SP Score программы Glide. Второй этап виртуального скрининга проводили в режиме экстраточности с использованием оценочной функции XP Score. В результате этого этапа было отобрано 5000 соединений с лучшими значениями оценочной функции. На третьем этапе полученные соединения подвергали дальнейшему анализу – так называемой визуальной инспекции положения связывания лиганда с рецептором – для выбора соединений с учетом их структурных и физико-химических особенностей. Соединения, отобранные в результате применения всех трех шагов виртуального скрининга приведены на рис. 1а.
Клеточные линии. В работе использовали клеточную линию карциномы шейки матки человека HeLa, стабильно сверхэкспрессирующую CD95 (клетки HeLa-CD95) (Neumann et al., 2010). Клетки культивировали в среде DMEM/HAM F-12 (Merck Millipore, Германия), содержащей 10% термоинактивированной фетальной телячьей сыворотки, 1% смеси пенициллина со стрептомицином (1 : 1) и 0.0001% пуромицина в атмосфере 5% СО2.
Кроме того, использовали клетки линий Jurkat 282 (ACC 282) Т-лейкоза человека и Jurkat, дефицитные по каспазе-8 (Jurkat-C8-KO) (Juo et al., 1998). Клетки культивировали в среде RPMI 1640 (Thermo Fisher Scientific Inc., США), содержащей 10% фетальной сыворотки теленка, инактивированной нагреванием, и 1% смеси пенициллина и стрептомицина (1 : 1) в атмосфере 5% CO2.
Клеточные линии были получены из коллекции клеточных линий г. Брауншвейга (Германия).
Количественная оценка жизнеспособности клеток с помощью анализа количества АТФ в клетках. В 96-луночные планшеты высевали 1.2 × 104 клеток HeLa-CD95 на 1 лунку за 1 сут до стимуляции, или 2 × 104 клеток Jurkat 282 или Jurkat-C8-KO на 1 лунку в день эксперимента. За 2 ч до стимуляции DL добавляли ингибиторы каспазы-8 и панкаспазный ингибитор zVAD-fmk (50 мкМ). В каждую лунку добавляли по 50 мкл раствора CellTiter-Glo. Измерения проводили в соответствии с инструкциями производителя (CellTiter-Glo Luminescent Cell Viability Assay, Promega, Германия). Интенсивность люминесценции анализировали с помощью микропланшетного ридера Infinite M200pro (Tecan, Швейцария). Измеренное количество АТФ необработанных клеток принимали за одну относительную единицу (отн. ед.). Каждое измерение выполняли как минимум дважды.
Статистический анализ. Для выполнения Т-тестов (парных, параметрических, двусторонних) использовали программное обеспечение Graphpad Prism 8, для апостериорных тестов Даннета – ANOVA. Различия считали достоверными при: **p < 0.005 и *р < 0.05; нд – недостоверно.
РЕЗУЛЬТАТЫ
Виртуальный скрининг малых химических соединений, адресно-связывающихся с каспазой-8 (Casp8in). Известно, что N-концевой продомен прокаспазы-8 содержит два DED домена (DED1 и DED2) (рис. 1а). Мы предположили, что связывание низкомолекулярного химического соединения в районе линкерного участка между DED1 и DED2 доменами может нарушать правильную сборку филаментов DED и, как следствие, ингибировать активацию каспазы-8. Для проверки этой гипотезы было проведено комплексное компьютерно-экспериментальное исследование, включающее виртуальный скрининг малых химических соединений (Casp8inB–Casp8inG), способных адресно связываться с предполагаемым сайтом, расположенным в полости между DED1 и DED2 прокаспазы-8 (рис. 1б, в; рис. 2), и экспериментальное тестирование их биологической активности in vitro (рис. 3).
Рис. 2.
Виртуальный скрининг библиотеки ZINC c использованием сайта, расположенного на линкере между доменами DED1 и DED2 прокаспазы-8. а – Схема виртуального скрининга, б – лиганды, выбранные для экспериментальной проверки. Обозначены идентификаторы ZINC и взаимодействующие остатки. Прокаспаза-8 DED1 показана темно-синим цветом, DED2 – светло-синим, а малая молекула – зеленым.
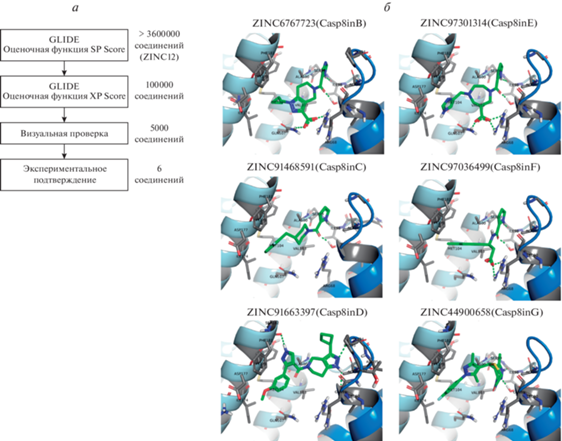
Рис. 3.
Полученные низкомолекулярные химические соединений. Показана структура и указаны используемое название и идентификационный номер (ID) по базе данных ZINC.
Детальный анализ пространственной структуры продомена прокаспазы-8, включающей DED1 и DED2 (Shen et al., 2015; PDB ID: 4ZBW), показал наличие потенциальной полости, подходящей для связывания малых химических соединений в области между DED1 и DED2 (рис. 2). В результате виртуального скрининга с использованием данного потенциального сайта связывания было отобрано шесть лучших соединений, которые мы назвали ингибиторами каспазы-8 (Casp8in).
Проверка активности соединений группы Casp8in с помощью CD95L-/TRAIL-опосредованного воздействия на клетки. Предполагаемый нами механизм биологической активности малых химических соединений Casp8in состоял в блокировании активации каспазы-8 в составе филаментов DED. Как ожидается, данная активность должна приводить к ингибированию DL-индуцированного апоптоза и восстановлению жизнеспособности клеток, обработанных препаратом Casp8in в комбинации с DL. Тестирование малых молекул проводили с учетом зависимости от времени действия и дозы соединения.
На первом этапе экспериментального исследования соединений Casp8in оценивали специфичность их влияния на жизнеспособность клеток, что представляет собой один из необходимых тестов при анализе свойств соединений, полученных с помощью скрининга in silico. Для этого, в частности, оценивали жизнеспособность клеток Т-лейкемии Jurkat 282 при совместной обработке соединениями Casp8in и CD95L, а также Casp8in и TRAIL по сравнению с обработкой только CD95L и TRAIL (рис. 4, 5а, б). Оценка жизнеспособности клеток основывалась на измерении содержания клеточного АТФ с использованием тест-системы CellTiter-Glo (широко применяемый тест для определения жизнеспособности клеток). В качестве положительного контроля для проверки эффектов предполагаемых ингибиторов каспазы-8 мы использовали известный панкаспазный ингибитор zVAD-fmk в концентрации 50 мкМ.
Рис. 4.
Анализ жизнеспособности клеток Jurkat 282 при совместной обработке DL и ингибиторами каспазы-8 (Casp8in/DL). а, б – Клетки предварительно обрабатывали Casp8in B, C, D или F в течение 2 ч. После этого клетки обрабатывали CD95L или TRAIL в течение 6 ч (а) или 22 ч (б). в, г – Клетки предварительно обработаны Casp8inE (в) или Casp8inG (г) в течение 2 ч; по горизонтали – концентрация Casp8in. После этого клетки обрабатывали CD95L или TRAIL в течение 6 ч. Жизнеспособность клеток измеряли с использованием анализа жизнеспособности клеток Cell Titer-Glo-Luminescent (НС – нестимулированные клетки). Показаны средние значения и их стандартные отклонения; n = 3 (а, б, в) или n = 2 (г). Для статистического анализа использовали Т-тесты. Различия достоверны при *р < 0.05; нд – недостоверно. Соединения Casp8in растворяли в ДМСО, который в максимальной концентрации использовали как отрицательный контроль; zVAD-fmk в концентрации 50 мкМ использовали как положительный контроль (то же относится к рис. 5).
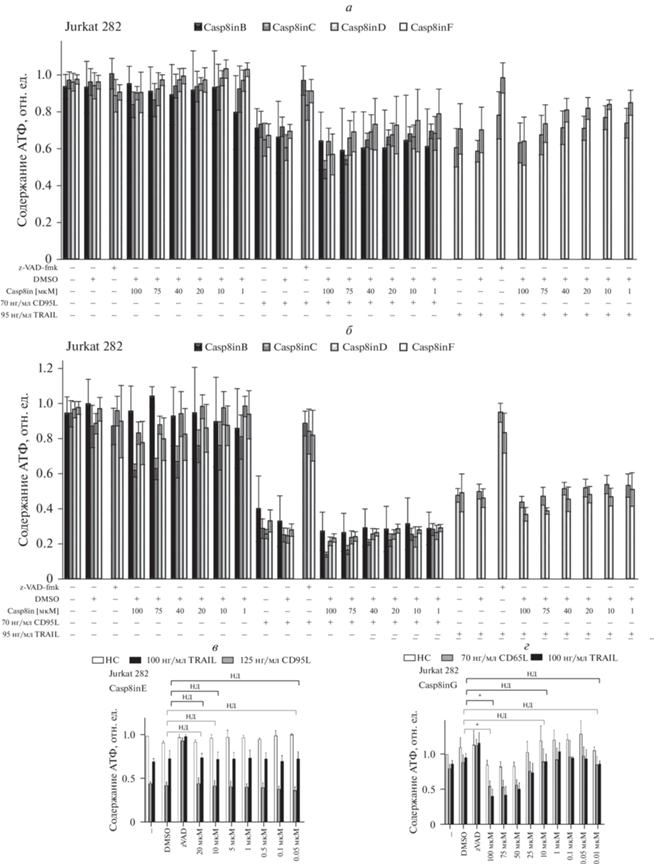
Рис. 5.
Анализ жизнеспособности клеток разных линий при костимуляции Casp8in/DL. По горизонтали – концентрация Casp8in. Клетки Jurkat 282 (а, б), Jurkat-C8-KO (в, г) и HeLa-CD95 (д, е) предварительно обрабатывали Casp8inE (а, в, д) или Casp8inG (б, г, е) в течение 2 ч. После этого клетки обрабатывали CD95L или TRAIL в течение 6 ч. Жизнеспособность клеток анализировали с помощью Cell Titer-Glo-Luminescent (НС – нестимулированные клетки). Обработку zVAD-fmk использовали в качестве положительного контроля. Показаны средние значения и их стандартные отклонения; n = 3 (а, б, в, г) или n = = 2 (д, е). Для статистического анализа использовали Т-тесты. Различи достоверны при *р < 0.05 или **p < 0.005; нд – недостоверно.
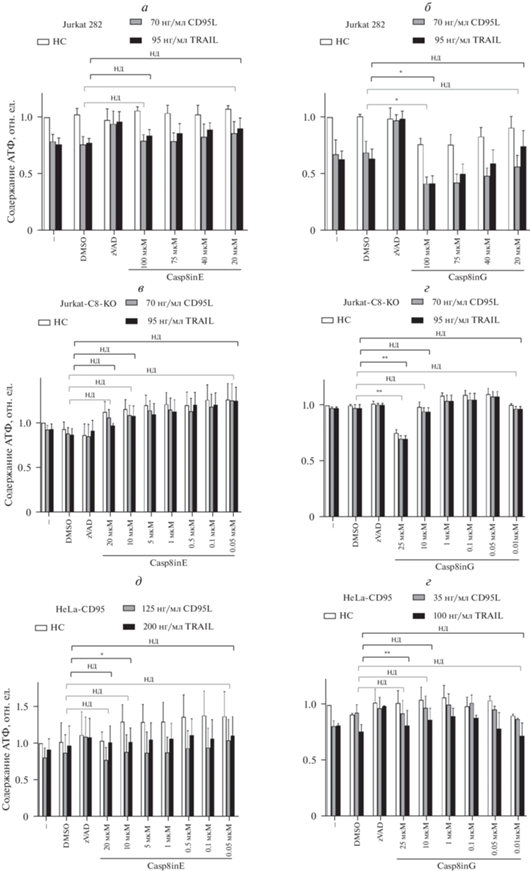
В результате проведенных исследований было обнаружено, что стимуляция CD95L и TRAIL приводила к потере жизнеспособности клеток Jurkat 282. При этом оказалось, что 4 из шести тестируемых соединений (Casp8inB, Casp8inC, Casp8inD и Casp8inF) не оказывали сильного влияния на индуцированную DL потерю жизнеспособности клеток Jurkat 282 (рис. 4). Однако два соединения, Casp8inE и Casp8inG, продемонстрировали небольшую тенденцию к ингибированию TRAIL-индуцированной потери жизнеспособности клеток (рис. 5а, б). Более того, Casp8inE также уменьшал потерю жизнеспособности клеток после обработки CD95L (рис. 5а). На основании этих результатов соединения Casp8inE и Casp8inG были отобраны для проведения дальнейших экспериментальных исследований их свойств.
Для исключения неспецифического действия исследуемого соединения обычно в качестве контроля используется клеточная линия с делецией гена-мишени. Поскольку предполагаемыми мишенями действия изучаемых нами соединений является каспаза-8, то в качестве контроля были выбраны клетки Jurkat-C8-KO, в которых отсутствует каспаза-8. Известно, что в силу данной особенности эти клетки являются нечувствительными к CD95L- и TRAIL-опосредованной индукции апоптоза (Juo et al., 1998; Sprick et al., 2002). Результаты исследований по влиянию Casp8inE и Casp8inG на CD95L- или TRAIL-индуцированную потерю жизнеспособности клеток Jurkat-C8-KO показаны на рис. 5в, г. Как видно из рисунка, обработка клеток Jurkat-C8-KO соединением Casp8inE, как в случае применения только отдельно взятым соединением, так и в комбинации с DL, не оказало заметного влияния на их жизнеспособность. Этот результат свидетельствует об отсутствии неспецифических эффектов при действии Casp8inE.
Несколько иная картина наблюдалась при обработке клеток соединением Casp8inG. Применение данного соединения при высоких концентрациях (25 мкМ и выше) приводила к потере жизнеспособности клеток независимым от DL образом (рис. 5г). Цитотоксические эффекты Casp8inG при его высоких концентрациях также наблюдали на клетках Jurkat 282 (рис. 5в). Из полученных результатов следует, что Casp8inG оказывает цитотоксическое действие при высоких концентрациях в обоих тестируемых типах клеток Jurkat.
Для исключения эффектов, специфичных только к одному анализируемому типу клеток, мы дополнительно провели изучение свойств Casp8inE и Casp8inG с использованием клеток HeLa-CD95 (клетки HeLa, сверхэкспрессирующие CD95). Результаты по измерению эффекта Casp8inE и Casp8inG на CD95L- или TRAIL-индуцированную потерю жизнеспособности клеток HeLa-CD95 показаны на рис. 5д, е. Известно, что эта клеточная линия чувствительна к CD95L- и TRAIL-индуцированному апоптозу, а также есть данные по эффективному формированию в клетках комплекса DISC (Neumann et al., 2010; Hillert et al., 2020a, 2020b). Клетки HeLa-CD95 обрабатывали Casp8inE и Casp8inG дозозависимым образом, как отдельно взятыми соединениями, так и совместно с DL (рис. 5д, е). Подобно клеткам Jurkat 282, стимуляция DL приводила к потере жизнеспособности клеток HeLa-CD95. Однако в отличие от клеток Jurkat 282, не было обнаружено существенных различий в индуцированной DL потере жизнеспособности клеток при ко-стимуляции Casp8inG и Casp8inE. Интересно заметить, что соединение Casp8inG не проявляло цитотоксического действия на клетки HeLa-CD95 в том же диапазоне концентраций, что и на клетках Jurkat, что указывает на специфический цитотоксический эффект этого соединения на клетки Jurkat.
В совокупности наши данные убедительно указывают на то, что два соединения – Casp8inG и Casp8inE – способны модулировать индуцированную DL потерю жизнеспособности клеток и поэтому их можно рассматривать как основу для дальнейшего развития ингибиторов, адресно действующих на каспазу-8, в будущих исследованиях.
ОБСУЖДЕНИЕ
В настоящей работе мы провели компьютерно-экспериментальный поиск малых молекул Casp8in (ингибиторов каспазы-8), способных модулировать индукцию внешнего пути апоптоза. В результате применения компьютерных методов виртуального скрининга было предложено 6 малых химических соединений, потенциально способных связываться с продоменом прокаспазы-8 в области контакта двух доменов DED1 и DED2. В качестве механизма действия соединений Casp8in предполагалось, что их связывание в заданном сайте будет препятствовать сборке филаментов DED, что, в свою очередь, может привести к снижению активности каспазы-8 в комплексе DISC и ингибированию последующей активации эффекторных каспаз и индукции апоптоза.
Экспериментальное исследование активности соединений Casp8in было выполнено с использованием тестов по оценки их влияния на жизнеспособность клеток при одиночной и комбинированной обработке совместно с DL. На данном этапе крайне важно определить, обладают ли выбранные соединения цитотоксическими эффектами, которые могут проявиться при использовании широкого диапазона концентраций этих соединений. Кроме того, для анализа малых молекул необходима проверка с использованием нескольких клеточных линий, в том числе ввиду различной степени экспрессии целевых белков в клетках разных типов (Fricker et al., 2010). Причем ключевым этапом данной проверки является использование генетических нокаутов и фармакологических ингибиторов, позволяющих проверять специфичность эффектов анализируемых соединений. В связи с этим, в настоящей работе мы использовали клетки Jurkat-C8-KO, которые являются устоявшейся моделью для тестирования роли каспазы-8 в передаче сигналов, и панкаспазный ингибитор zVAD-fmk в качестве положительного контроля для оценки результатов ингибирования каспазы-8. Использование нокаутных клеточных линий позволяет выявить возможные нецелевые эффекты и охарактеризовать диапазон цитотоксичности исследуемого соединения.
Проведенные нами экспериментальные исследования соединений Casp8in показали, что два из них (Casp8inG и Casp8inE) обладали заметной способностью увеличивать жизнеспособность клеток при DL-индуцированном апоптозе. Следует отметить, что Casp8inE не обладало цитотоксичностью на культуре клеток Jurkat-C8-KO, что подтверждает специфичность его действия на целевую мишень. В то же время, Casp8inG проявлял цитотоксический эффект при концентрациях выше 25 мкМ, что необходимо учитывать при оценки результатов тестирования его биологической активности.
Полученные результаты по активности соединений, созданных исключительно на основе компьютерного дизайна, внушают большой оптимизм по реализации выбранной стратегии создания ингибиторов индукции внешнего пути апоптоза, механизм действия которых основан на ингибировании формирования DED филаментов. Соединения Casp8inG и Casp8inE могут составить основу для дизайна улучшенных вариантов ингибиторов с использованием итерационного подхода, включающего последовательные шаги по оптимизации их химической структуры на основе компьютерного предсказания модификаций и экспериментальной оценки биологического эффекта.
В отличие от основных регуляторов внутреннего пути апоптоза, для которых специфические низкомолекулярные ингибиторы уже успешно разработаны и в настоящее время проходят клинические испытания, внешний путь только начинает изучаться (Bucur et al., 2015; Roberts et al., 2016; Hillert et al., 2020a). Создание соединений, нацеленных на внешний путь апоптоза, до сих пор требует решения полного комплекса задач, включая поиск валидных мишеней, дизайн малых химических соединений, действующих адресно на выбранную мишень, эффективные схемы экспериментальной проверки их биологической активности. Результаты исследования, представленные в настоящей работе, описывают одну из возможных стратегий по компьютерному дизайну и экспериментальному тестированию активности потенциальных ингибиторов внешнего пути апоптоза.
Список литературы
Bucur O., Gaidos G., Yatawara A., Pennarun B., Rupasinghe C., Roux J., Andrei S., Guo B., Panaitiu A., Pellegrini M., Mierke D.F., Khosravi-Far R. 2015. A novel caspase 8 selective small molecule potentiates TRAIL-induced cell death. Sci. Rep. V. 5. P. 9893.
Dickens L.S., Boyd R.S., Jukes-Jones R., Hughes M.A., Robinson G.L., Fairall L., Schwabe J.W., Cain K., Macfarlane M. 2012. A death effector domain chain DISC model reveals a crucial role for caspase-8 chain assembly in mediating apoptotic cell death. Mol. Cell. V. 47. P. 291.
Fricker N., Beaudouin J., Richter P., Eils R., Krammer P.H., Lavrik I.N. 2010. Model-based dissection of CD95 signaling dynamics reveals both a pro- and antiapoptotic role of C-FLIPL. J. Cell Biol. V. 190. P. 377.
Friesner R.A., Banks J.L., Murphy R.B., Halgren T.A., Klicic J.J., Mainz D.T., Repasky M.P., Knoll E.H., Shelley M., Perry J.K., Shaw D.E., Francis P., Shenkin P.S. 2004. Glide: A new approach for rapid, accurate docking and scoring. 1. Method and assessment of docking accuracy. J. Med. Chem. V. 47. P. 1739.
Friesner R.A., Murphy R.B., Repasky M.P., Frye L.L., Greenwood J.R., Halgren T.A., Sanschagrin P.C., Mainz D.T. 2006. Extra precision glide: Docking and scoring incorporating a model of hydrophobic enclosure for protein-ligand complexes. J. Med. Chem. V. 49. P. 6177.
Fu T.M., Li Y., Lu A., Li Z., Vajjhala P.R., Cruz A.C., Srivastava D.B., DiMaio F., Penczek P.A., Siegel R.M., Stacey K.J., Egelman E.H., Wu H. 2016. Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Mol. Cell. V. 64. P. 236.
Golks A., Brenner D., Schmitz I., Watzl C., Krueger A., Krammer P.H., Lavrik I.N. 2006. The role of CAP3 in CD95 signaling: New insights into the mechanism of procaspase-8 activation. Cell Death Differ. V. 13. P. 489.
Halgren T.A., Murphy R.B., Friesner R.A., Beard H.S., Frye L.L., Pollard W.T., Banks J.L. 2004. Glide: A new approach for rapid, accurate docking and scoring. 2. Enrichment factors in database screening. J. Med. Chem. V. 47. P. 1750.
Hillert L.K., Ivanisenko N.V., Busse D., Espe J., Konig C., Peltek S.E., Kolchanov N.A., Ivanisenko V.A., Lavrik I.N. 2020a. Dissecting DISC regulation via pharmacological targeting of caspase-8/c-FLIPL heterodimer. Cell Death Differ. V. 27. P. 2117.
Hillert L.K., Ivanisenko N.V., Espe J., Konig C., Ivanisenko V.A., Kahne T., Lavrik I.N. 2020b. Long and short isoforms of c-FLIP act as control checkpoints of DED filament assembly. Oncogene. V. 39. P. 1756.
Hoffmann J.C., Pappa A., Krammer P.H., Lavrik I.N. 2009. A new C-terminal cleavage product of procaspase-8, p30, defines an alternative pathway of procaspase-8 activation. Mol. Cell. Biol. V. 29. P. 4431.
Hughes M.A., Harper N., Butterworth M., Cain K., Cohen G.M., MacFarlane M. 2009. Reconstitution of the death-inducing signaling complex reveals a substrate switch that determines CD95-mediated death or survival. Mol. Cell. V. 35 P. 265.
Irwin J.J., Sterling T., Mysinger M.M., Bolstad E.S., Coleman R.G. 2012. ZINC: a free tool to discover chemistry for biology. J. Chem. Inf. Model. V. 52. P. 1757.
Juo P., Kuo C. J., Yuan J., Blenis J. 1998. Essential requirement for caspase-8/FLICE in the initiation of the Fas-induced apoptotic cascade. Curr. Biol. V. 8. P. 1001.
Krammer P.H., Arnold R., Lavrik I.N. 2007. Life and death in peripheral T cells. Nat. Rev. Immunol. V. 7. P. 532.
Lavrik I.N., Krammer P.H. 2012. Regulation of CD95/Fas signaling at the DISC. Cell Death Differ. V. 19. P. 36.
Lavrik I., Krueger A., Schmitz I., Baumann S., Weyd H., Krammer P.H., Kirchhoff S. 2003. The active caspase-8 heterotetramer is formed at the CD95 DISC. Cell Death Differ. V. 10. P. 144.
Medema J.P., Scaffidi C., Kischkel F.C., Shevchenko A., Mann M., Krammer P.H., Peter M.E., 1997. FLICE is activated by association with the CD95 death-inducing signaling complex (DISC). EMBO J. V. 16. P. 2794.
Muzio M., Chinnaiyan A.M., Kischkel F.C., O’Rourke K., Shevchenko A., Ni J., Scaffidi C., Bretz J. D., Zhang M., Gentz R., Mann M., Krammer P.H., Peter M.E., Dixit V.M. 1996. FLICE, a novel FADD-homologous ICE/CED-3-like protease, is recruited to the CD95 (Fas/APO-1) death–inducing signaling complex. Cell. V. 85, P. 817.
Neumann L., Pforr C., Beaudouin J., Pappa A., Fricker N., Krammer P.H., Lavrik I.N., Eils R. 2010. Dynamics within the CD95 death-inducing signaling complex decide life and death of cells. Mol. Syst. Biol. V. 6. P. 352.
Roberts A.W., Davids M.S., Pagel J.M., Kahl B.S., Puvvada S.D., Gerecitano J.F., Kipps T.J., Anderson M.A., Brown J.R., Gressick L., Wong S., Dunbar M., Zhu M., Desai M.B., Cerri et al. 2016. Targeting BCL2 with venetoclax in relapsed chronic lymphocytic leukemia. New Eng. J. Med. V. 374. P. 311.
Schleich K., Warnken U., Fricker N., Ozturk S., Richter P., Kammerer K., Schnolzer M., Krammer P.H., Lavrik I.N. 2012. Stoichiometry of the CD95 death-inducing signaling complex: Experimental and modeling evidence for a death effector domain chain model. Mol. Cell. V. 47. P. 306.
Seyrek K., Ivanisenko N.V., Richter M., Hillert L.K., Konig C., Lavrik I.N. 2020. Controlling cell death through post-translational modifications of DED proteins. Trends Cell Biol. V. 30. P. 354.
Shen C., Yue H., Pei J., Guo X., Wang T., Quan J.M. 2015. Crystal structure of the death effector domains of caspase-8. Biochem. Biophys. Res. Commun. V. 463. P. 297.
Sprick M.R., Rieser E., Stahl H., Grosse-Wilde A., Weigand M.A., Walczak H. 2002. Caspase-10 is recruited to and activated at the native TRAIL and CD95 death-inducing signalling complexes in a FADD-dependent manner but can not functionally substitute caspase-8. EMBO J. V. 21. P. 4520.
Sprick M.R., Weigand M.A., Rieser E., Rauch C.T., Juo P., Blenis J., Krammer P.H., Walczak H. 2000. FADD/MORT1 and caspase-8 are recruited to TRAIL receptors 1 and 2 and are essential for apoptosis mediated by TRAIL receptor 2. Immunity. V. 12. P. 599.
Sterling T., Irwin J.J. 2015. ZINC 15–Ligand Discovery for Everyone. J. Chem. Inf. Model. V. 55. P. 2324.
Wang L., Yang J.K., Kabaleeswaran V., Rice A.J., Cruz A.C., Park A.Y., Yin Q., Damko E., Jang S.B., Raunser S., Robinson C.V., Siegel R.M., Walz T., Wu H. 2010. The Fas-FADD death domain complex structure reveals the basis of DISC assembly and disease mutations. Nat. Struct. Mol. Biol. V. 17. P. 1324.
Wilson N.S., Dixit V., Ashkenazi A. 2009. Death receptor signal transducers: nodes of coordination in immune signaling networks. Nat. Immunol. V. 10. P. 348.
Yu J.W., Jeffrey P.D., Shi Y. 2009. Mechanism of procaspase-8 activation by c-FLIPL. Proc. Natl. Acad. Sci. USA. V. 106. P. 8169.
Дополнительные материалы отсутствуют.


