Цитология, 2022, T. 64, № 3, стр. 226-231
Распределение метастазов в органах мышей после ортотопического введения клеток колоректального рака CT26
Л. С. Кузнецова 1, Б. А. Маргулис 1, И. В. Гужова 1, В. Ф. Лазарев 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: lazarev@incras.ru
Поступила в редакцию 01.03.2022
После доработки 11.03.2022
Принята к публикации 12.03.2022
- EDN: AKYWYI
- DOI: 10.31857/S0041377122030087
Аннотация
Одной из причин высокого уровня смертности от рака кишечника является формирование метастазов, и для анализа механизма их развития необходимы эффективные животные модели рака. С целью формирования подобных моделей метастазирования мы осуществляли ортотопическую прививку мышам клеток колоректального рака мыши CT26, содержащих ген люциферазы, в подслизистую область слепой кишки животных. Через 30 сут после прививки мышей умерщвляли и определяли наличие метастазов в органах на основе анализа количества матричной РНК гена люциферазы с помощью полимеразной цепной реакции в реальном времени. Установлено, что после ортотопического введения клеток колоректального рака CT26 у экспериментальных животных обнаруживаются метастазы не только в печени, но и в легких, и в селезенке. Подобные данные получены впервые и позволяют рассматривать использованный нами протокол для моделирования на мышах процесса метастазирования колоректального рака.
Один из наиболее распространенных типов рака – колоректальный – часто сопровождается формированием множественных очагов опухолевого роста – метастазов (Roth et al., 2021). Процесс метастазирования, будучи не до конца изученным, коррелирует с неблагоприятным прогнозом для пациентов (Nagai et al., 2021).
Известно, что чаще всего при развитии колоректального рака можно наблюдать метастазы в печени (Acciuffi et al., 2022). Однако потенциальные очаги вторичного роста опухоли могут быть локализованы и в других органах, в том числе в селезенке и легких (Vatandoust et al., 2015). Для поиска новых лекарств и подходов к эффективной терапии метастазирующих опухолей нужны качественные и релевантные модели на животных. Критическое значение при этом имеют органы или ткани, в которых могут возникать очаги вторичного опухолевого роста. Клетки карциномы кишечника мыши CT26 являются одной из наиболее удобных и доступных для исследователей моделей формирования опухолей in vivo, однако до сих пор не было известно, в каких органах могут формироваться метастазы в случае ортотопической трансплантации опухоли.
Чаще всего для моделирования метастазирования клетки CT26 вводят животным либо внутривенно, и в этом случае формируются метастазы в легких (Hashemzehi et al., 2020), либо вводят в селезенку для получения метастазов в печени (Sorski et al., 2014). Описанные способы введения опухолевых клеток серьезно ограничивают релевантность и корректность самой модели, поскольку в процессе метастазирования крайне важную роль играет микроокружение опухоли (Chandra et al., 2021). Кроме того, в этом случае невозможно в полной мере учесть процессы деградации ткани, окружающей опухоль, а также лимфатическую или сосудистую инвазию (Hanahan, Weinberg, 2011).
Альтернативой описанным методикам может быть ортотопическое введение клеток колоректального рака. Одним из наиболее эффективных и релевантных способов ортотопической трансплантации карциномы кишечника является введение суспензии клеток в подслизистую область слепой кишки (Hite et al., 2018).
Именно этот способ мы применили в настоящей работе, целью которой был поиск метастазов в тканях печени, селезенки и легких мышей после ортотопического введения раковых клеток непосредственно в область слепой кишки.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Клетки колоректального рака мыши CT26 были любезно предоставлены профессором Г. Мультхофф (Технический университет Мюнхена, Германия). Клетки культивировали в среде DMEM (Gibco, США), содержащей 10% бычьей эмбриональной сыворотки (FBS; Gibco, США), антибиотики пенициллин 100 ед/мл и стрептомицин 0.1 мг/мл (БиолоТ, Россия) при 37°С и 5% CO2. Для экспериментов мы использовали линию клеток CT26-luc, полученную с помощью трансдукции клеток CT26 геном люциферазы (luc) в составе вектора pHIV-iRFP720-E2A-Luc, как было описано ранее (Komarova et al., 2021).
Ортотопическое введение клеток животным. Для экспериментов были использованы самки мышей линии BALB/c. Все животные были получены из питомника Центра генетических коллекций животных Нижегородского государственного университета им. Н.И. Лобачевского (Нижний Новгород). Животных перед операцией наркотизировали с помощью смеси препаратов Золетил-100 (Virbac, Франция) и Рометар (Bioveta, Чехия), смешивая эти препараты с физиологическим раствором (Гематек, Россия) в объемном соотношении 1 : 3 : 40 соответственно. Клетки CT26-luc в количестве от 106 до 2.5 × 106 суспензировали в 50 мкл среды DMEM и 50 мкл реактива Matrigel (Corning Incorporated, США) Затем суспензию клеток в объеме 100 мкл вводили в подслизистую область слепой кишки. Во время операции смачивали внутренние органы мыши физиологическим раствором, не допуская пересыхания. После операции брюшную полость зашивали, мышам для обезболивания вводили диклофенак (Атолл, Россия) в дозировке 1 мкг на 1 кг веса животного. Спустя 30 сут животных умерщвляли, и извлекали органы (кишечник, печень, селезенку, легкие) для последующего анализа.
Полимеразная цепная реакция в реальном времени (ПЦР-РВ). Для анализа органов мышей с ПЦР-РВ их гомогенизировали и растворяли в реактиве ExtractRNA (Евроген, Россия) в соотношении 1 мл на 100 мкг ткани. Выделение матричной РНК осуществляли по описанному ранее протоколу (Mikeladze et al., 2021). Далее для получения комплементарной ДНК проводили реакцию обратной транскрипции с помощью набора MMLV RT (Евроген, Россия) согласно протоколу производителя. Для анализа использовали 2 мкг РНК на пробу.
Все реакции ПЦР-РВ проводили на системе детекции ПЦР-РВ CFX96 (BioRad, США) с использованием qPCRmix-HS SYBR (Евроген, Россия) согласно протоколу производителя. Для подтверждения корректности ампликонов использовали анализ кривой плавления. Данные были проанализированы на кратность изменения количества матричной РНК с использованием программного обеспечения Bio-Rad CFX (версия 3.1). Нуклеотидные последовательности праймеров были следующими: актин: (прямой) 5'-ACCGTGAAAAGATGACCCAGAT-3', (обратный) 5'-GTACGACCAGAGGCATACAGG-3'; люцифераза: (прямой) 5'-AGATCCTCAACGTGCAAAAGAAG-3', (обратный) 5'-ACGAAGGTGTACATGCTTTGGA-3'. Актин использовали в качестве контроля для нормализации.
Все праймеры были заказаны в компании Евроген (Россия). Параметры ПЦР-РВ: 5 мин предварительной денатурации при 95°С; затем 40 циклов: 30 с при 95°С, 30 с при 65°С и 30 с при 70°С.
РЕЗУЛЬТАТЫ
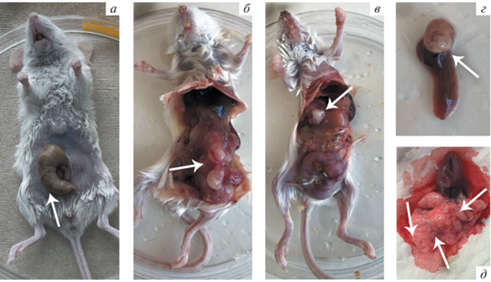
Для изучения распределения вторичных очагов опухолевого роста в органах мышей мы использовали клетки колоректального рака мыши, трансдуцированные геном luc, CT26-luc. Клетки с репортерным геном удобны для диагностики очагов опухолевого роста, поскольку в клетках тканей мыши указанный ген не экспрессируется. Клетки вводили в подслизистую область слепой кишки мыши, как показано на рис. 1а. Спустя 30 сут животных умерщвляли и извлекали органы для анализа. Типичный внешний вид очагов опухолевого роста в исследуемых органах представлен на рис. 1б–д.
Рис. 1.
Внешний вид зоны операции и сформированных спустя 30 сут после введения клеток CT26 очагов опухолевого роста у мышей. а – Общий вид мыши во время проведения операции по инъекции клеток CT26-luc в подслизистую область слепой кишки. Стрелкой обозначено место инъекции. б – Вид брюшной полости мыши с выросшей опухолью. Стрелкой отмечено злокачественное образование на стенке кишечника. в – Вид брюшной полости мыши с выросшей опухолью. Стрелкой показан метастаз на правой доле печени. г – Вид извлеченной из животного селезенки с метастазом (стрелка). д – Вид извлеченных из животного легких и сердца. На легких видны множественные метастазы (стрелки).
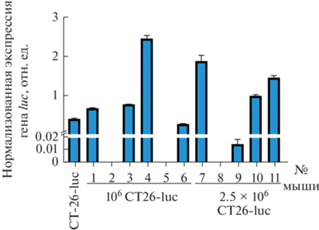
Для подтверждения формирования опухолей у мышей после ортотопического введения клеток колоректального рака помимо визуальной диагностики мы анализировали уровень экспрессии гена luc в тканях кишечника экспериментальных животных. Для анализа мы использовали метод количественной ПЦР и установили, что у 4 из 6 мышей, которым вводили 106 клеток CT26-luc формировались первичные опухоли. В группе мышей, которым вводили 2.5 × 106 CT26-luc опухоли кишечника формировались у 4 животных из 5 (рис. 2). Таким образом ортотопическое введение клеток рака кишечника дало желаемый результат: мы наблюдали первичные очаги опухолевого роста у большинства животных.
Рис. 2.
Экспрессия гена люциферазы luc в слепой кишке мышей через 30 сут после инъекции им клеток CT26-luc в разном количестве. Представлены результаты анализа тканей кишечника мышей методом RT-PCR. Клетки CT26-luc вводили мышам в количестве 106 или 2.5 × 106. В качестве положительного контроля использовали клетки CT26-luc, выращенные in vitro (крайний левый столбик). Значения экспрессии гена luc нормализованы относительно гена актина. Показаны средние значения и среднеквадратичное отклонение по результатам трех независимых экспериментов.
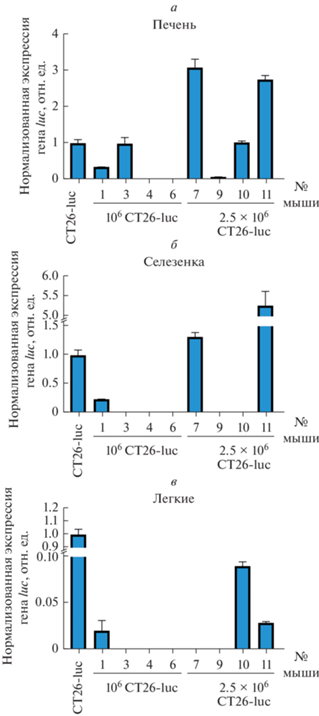
Следующим этапом нашей работы был поиск метастазов в печени, селезенке и легких тех животных, у которых были выявлены очаги первичного опухолевого роста. Для этого мы проанализировали количество мРНК гена luc в соответствующих органах животных. На основе результатов ПЦР-РВ нам удалось установить наличие люциферазы в печени у 2-х животных из группы, которой вводили 106 клеток CT26-luc и у 4-х животных из группы, которой вводили 2.5 × 106 этих же клеток (рис. 3а). Анализ экстрактов селезенки мышей позволил выявить экспрессию luc всего у 3-х животных: у одного из группы, которой вводили 106 клеток CT26-luc и у 2-х из группы, которой вводили 2.5 × 106 клеток (рис. 3б). Аналогичные результаты были получены по данным анализа легких: экспрессию гена luc выявили у 3-х животных: у одного из группы, которой вводили 106 клеток и у 2-х из группы, которой вводили 2.5 × 106 клеток CT26-luc (рис. 3в).
Рис. 3.
Экспрессия гена luc в тканях мышей с развившимся злокачественным новообразованием. Представлены результаты анализа тканей печени (а), селезенки (б) и легких (в) мышей с помощью метода RT-PCR. Клетки CT26-luc были введены мышам в количестве 106 либо 2.5 × 106. Значения экспрессии гена luc нормализованы относительно гена актина. Показаны средние значения и среднеквадратичное отклонение по результатам трех независимых экспериментов.
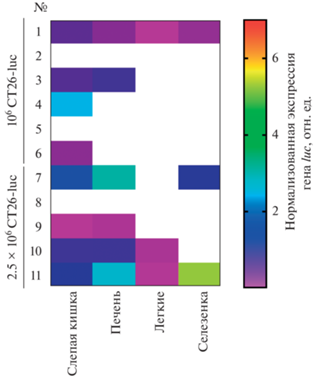
На основе полученных данных была составлена тепловая карта экспрессии гена luc в тканях кишечника, печени, селезенки и легких (рис. 4). Мы установили, что при ортотопическом введении клеток колоректального рака CT26 наблюдаются множественные вторичные очаги опухолевого роста. Важно отметить, что метастазы в печень были обнаружены у всех животных, получивших инъекцию 2.5 × 106 клеток, у которых развилась первичная опухоль. При этом у 2-х животных были обнаружены метастазы во всех исследованных органах (рис. 4).
ОБСУЖДЕНИЕ
Развитие карциномы кишечника в большинстве случаев сопровождается метастазированием в печень (Vatandoust et al., 2015). Реже наблюдаются метастазы в других органах, в том числе в легких (Chen et al., 2021), в селезенке (Vatandoust et al., 2015), в мозге (McKay, 2021) и даже в мышечной ткани (Guo et al., 2021). Мы предположили, что ортотопическая прививка клеток колоректального рака мыши сможет сделать картину процесса метастазирования более соответствующей процессу, происходящему в организме, то есть вызвать метастазирование не только в печень, но и в другие органы, например в селезенку и в легкие. Для проверки этой гипотезы мы использовали линию клеток CT26, содержащую ген luc. Мы считаем, что использование люциферазы в качестве репортера позволяет надежно верифицировать наличие метастаза в органе в случае невозможности обнаружить его визуально. Дополнительно стоит отметить, что подобный подход с применением клеток, трансдуцированных люциферазным репортером, может быть использован для прижизненной диагностики очагов опухолевого роста у мышей с помощью методики биолюминисценции (Banan et al., 2020).
В большинстве случаев при работе с in vivo моделями метастазирования колоректального рака специалисты обращают внимание на метастазы в печени (Oh et al., 2017); другие органы при этом остаются вне зоны интереса. В частности, для клеток CT26 ранее не было известно, что при ортотопическом введении они могут давать метастазы в легкие и селезенку. При необходимости получения легочных метастазов in vivo исследователи традиционно используют методику внутривенного введения опухолевых клеток (Hashemzehi et al., 2020). Еще один распространенный способ прививки колоректального рака при моделировании метастазирования – инъекции в селезенку (Huang et al., 2020; Fleten et al., 2017). Обычно этот способ используют для получения метастазов в печени (Huang et al., 2013). Однако все гетеротопические модели имеют определенные ограничения применения. В первую очередь, эти ограничения связаны с отсутствием адекватного микроокружения, что негативно сказывается на процессах метастазирования (Bürtin et al., 2020). Таким образом, полученные нами данные о появлении дополнительных очагов опухолевого роста при ортотопической трансплантации могут быть полезны для моделирования процессов метастазирования.
Настоящая работа была направлена на изучение возможности использования методики ортотопического введения клеток CT26 для моделирования процессов метастазирования, сопутствующих прогрессии колоректального рака. Нам удалось продемонстрировать, что инъекция клеток колоректального рака мыши в подслизистую область слепой кишки с высокой вероятностью приводит к формированию метастазов не только в печени, но и в легких и селезенке. Таким образом, метод, описанный в данной работе, может быть использован для моделирования вторичного роста колоректальной опухоли в органах грудной и брюшной полости.
Список литературы
Acciuffi S., Meyer F., Bauschke A., Croner R., Settmacher U., Altendorf-Hofmann A. 2022. Solitary colorectal liver metastasis: overview of treatment strategies and role of prognostic factors. J. Cancer Res. Clin. Oncol. V. 148. P. 657. https://doi.org/10.1007/S00432-021-03880-4
Banan B., Beckstead J.A., Dunavant L.E., Sohn Y., Adcock J.M., Nomura S., Abumrad N., Goldenring J.R., Fingleton B. 2020. Development of a novel murine model of lymphatic metastasis. Clin. Exp. Metastasis. V. 37. P. 247. https://doi.org/10.1007/S10585-020-10025-3
Bürtin F., Mullins C.S., Linnebacher M. 2020. Mouse models of colorectal cancer: Past, present and future perspectives. World J. Gastroenterol. V. 26. P. 1394. https://doi.org/10.3748/WJG.V26.I13.1394
Chandra R., Karalis J.D., Liu C., Murimwa G.Z., Park J.V., Heid C.A., Reznik S.I., Huang E., Minna J.D., Brekken R.A. 2021. The colorectal cancer tumor microenvironment and its impact on liver and lung metastasis. Cancers (Basel). V. 3. P. 6202. https://doi.org/10.3390/CANCERS13246206
Chen H., Stoltzfus K.C., Lehrer E.J., Horn S.R., Siva S., Trifiletti D.M., Meng M. Bin, Verma V., Louie A.V., Zaorsky N.G. 2021. The epidemiology of lung metastases. Front. Med. V. 8. https://doi.org/10.3389/FMED.2021.723396
Fleten K.G., Bakke K.M., Mælandsmo G.M., Abildgaard A., Redalen K.R., Flatmark K. 2017. Use of non-invasive imaging to monitor response to aflibercept treatment in murine models of colorectal cancer liver metastases. Clin. Exp. Metastasis. V. 34. P. 51. https://doi.org/10.1007/S10585-016-9829-3
Guo Y., Wang S., Zhao Z.Y., Li J.N., Shang A., Li D.L., Wang M. 2021. Skeletal muscle metastasis with bone metaplasia from colon cancer: A case report and review of the literature. World J. Clin. cases. V. 9. P. 9285. https://doi.org/10.12998/WJCC.V9.I30.9285
Hanahan D., Weinberg R.A. 2011. Hallmarks of cancer: the next generation. Cell. V. 144. P. 646. https://doi.org/10.1016/J.CELL.2011.02.013
Hashemzehi M., Naghibzadeh N., Asgharzadeh F., Mostafapour A., Hassanian S.M., Ferns G.A., Cho W.C., Avan A., Khazaei M. 2020. The therapeutic potential of losartan in lung metastasis of colorectal cancer. EXCLI J. V. 19. P. 927. https://doi.org/10.17179/EXCLI2020-2093
Hite N., Klinger A., Hellmers L., Maresh G.A., Miller P.E., Zhang X., Li L., Margolin D.A. 2018. An optimal orthotopic mouse model for human colorectal cancer primary tumor growth and spontaneous metastasis. Dis. Colon Rectum. V. 61. P. 698. https://doi.org/10.1097/DCR.0000000000001096
Huang X., Chen Z., Zhang N., Zhu C., Lin X., Yu J., Chen Z., Lan P., Wan Y. 2020. Increase in CD4+FOXP3+ regulatory T cell number and upregulation of the HGF/c-Met signaling pathway during the liver metastasis of colorectal cancer. Oncol. Lett. V. 20. P. 2113. https://doi.org/10.3892/OL.2020.11785
Huang X., Zou Y., Lian L., Wu X., He X., He X., Wu X., Huang Y., Lan P. 2013. Changes of T cells and cytokines TGF-β1 and IL-10 in mice during liver metastasis of colon carcinoma: implications for liver anti-tumor immunity. J. Gastrointest. Surg. V. 17. P. 1283. https://doi.org/10.1007/S11605-013-2194-5
Komarova E.Y., Suezov R.V., Nikotina A.D., Aksenov N.D., Garaeva L.A., Shtam T.A., Zhakhov A.V., Martynova M.G., Bystrova O.A., Istomina M.S., Ischenko A.M., Margulis B.A., Guzhova I.V. 2021. Hsp70-containing extracellular vesicles are capable of activating of adaptive immunity in models of mouse melanoma and colon carcinoma. Sci. Rep. V. 11. P. 21 314. https://doi.org/10.1038/S41598-021-00734-4
McKay M.J. 2021. Brain metastases: Increasingly precision medicine-a narrative review. Ann. Transl. Med. V. 9. P. 1629. https://doi.org/10.21037/ATM-21-3665
Mikeladze M.A., Dutysheva E.A., Kartsev V.G., Margulis B.A., Guzhova I.V., Lazarev V.F. 2021. Disruption of the complex between GAPDH and Hsp70 sensitizes C6 glioblastoma cells to hypoxic stress. Int. J. Mol. Sci. V. 22. P. 1520. https://doi.org/10.3390/ijms22041520
Nagai Y., Kiyomatsu T., Gohda Y., Otani K., Deguchi K., Yamada K. 2021. The primary tumor location in colorectal cancer: A focused review on its impact on surgical management. Glob. Heal. Med. V. 3. P. 386. https://doi.org/10.35772/GHM.2020.01096
Oh B.Y., Hong H.K., Lee W.Y., Cho Y.B. 2017. Animal models of colorectal cancer with liver metastasis. Cancer Lett. V. 387. P. 114. https://doi.org/10.1016/J.CANLET.2016.01.048
Roth L., Russo L., Ulugoel S., Santos R.F. Dos, Breuer E., Gupta A., Lehmann K. 2021. Peritoneal metastasis: Current status and treatment options. Cancers (Basel). V. 14. P. 60. https://doi.org/10.3390/CANCERS14010060
Sorski L., Levi B., Shaashua L., Neeman E., Benish M., Matzner P., Hoffman A., Ben-Eliyahu S. 2014. Impact of surgical extent and sex on the hepatic metastasis of colon cancer. Surg. Today. V. 44. P. 1925. https://doi.org/10.1007/S00595-013-0768-1
Vatandoust S., Price T. J., Karapetis C. S. 2015. Colorectal cancer: Metastases to a single organ. World J. Gastroenterol. V. 21. P. 11767. https://doi.org/10.3748/WJG.V21.I41.11767
Дополнительные материалы отсутствуют.