Цитология, 2022, T. 64, № 3, стр. 232-239
Оценка состояния митохондрий CD4+ И CD8+ Т-лимфоцитов здоровых лиц
Л. Б. Королевская 1, *, Е. В. Сайдакова 1, Н. Г. Шмагель 1, К. В. Шмагель 1
1 Институт экологии и генетики микроорганизмов Уральского отделения Российской академии наук – филиал Пермского федерального исследовательского центра Уральского отделения Российской академии наук (ИЭГМ УрО РАН)
614081 Пермь, Россия
* E-mail: bioqueen@mail.ru
Поступила в редакцию 05.03.2022
После доработки 11.03.2022
Принята к публикации 11.03.2022
- EDN: PLUDGW
- DOI: 10.31857/S0041377122030063
Аннотация
Несмотря на активное исследование состояния митохондрий Т-лимфоцитов при патологических состояниях, данных о параметрах органелл у здоровых людей в доступной литературе не представлено. Целью настоящей работы была оценка состояния митохондрий в Т-лимфоцитах CD4+ и CD8+ здоровых субъектов. Методом проточной цитофлюориметрии определены масса и заряд митохондрий, а также содержание регулятора активности митохондрий (PGC-1α) в CD4+- и CD8+-Т-лимфоцитах с учетом их принадлежности к клеткам памяти и покоящимся (делящимся) элементам. Впервые показано, что у здоровых субъектов в Т-лимфоцитах CD4+ и CD8+ имеются значительные различия по состоянию митохондрий. Установлено, что масса и заряд митохондрий в CD4+-Т-лимфоцитах, являющихся и не являющихся клетками памяти, а также в покоящихся и делящихся элементах существенно превышают соответствующие показатели в CD8+-Т-клетках. При этом среди Т-лимфоцитов CD4+ и CD8+ более высокая масса, заряд митохондрий и содержание PGC-1α являются характерной особенностью клеток памяти и делящихся элементов. Кроме того, у здоровых лиц взаимосвязи между уровнем регулятора активности митохондрий и показателями их состояния в CD4+- и CD8-Т-лимфоцитах существенно различаются: содержание PGC-1α в CD4+-Т-клетках прямо связано с массой митохондрий, а в CD8+-Т-лимфоцитах – с трансмембранным потенциалом органелл.
Т-лимфоциты являются основными клеточными элементами адаптивной иммунной системы. Распознавание антигенспецифических сигналов наивными Т-клетками приводит к их активации, пролиферации и запуску программы дифференцировки в эффекторные лимфоциты. Завершение иммунного ответа сопровождается гибелью большей части антигенспецифических эффекторов и формированием немногочисленного клона долгоживущих клеток памяти (Farber et al., 2014). Последние характеризуются более высоким пролиферативным потенциалом при повторном контакте с антигеном (Rogers et al., 2000; van der Windt et al., 2013). Т-лимфоциты, несущие корецепторые молекулы CD4+ или CD8+, выполняют различные функции, действуя как координаторы и эффекторы иммунного ответа соответственно. Цитотоксические CD8+-Т-лимфоциты устраняют инфицированные клетки путем лизиса (Kaech, Wherry, 2007), CD4+ Т-лимфоциты обеспечивают реализацию иммунного ответа в определенном направлении за счет способности к дифференцировке в различные субпопуляции, в том числе Th1, Th2, Th17, фолликулярные хелперы, регуляторные клетки (Zhu et al., 2010). При этом обе субпопуляции Т-лимфоцитов – CD4+ и CD8+ – тесно кооперируют друг с другом при формировании противовирусного и противоопухолевого иммунитета (Novy et al., 2007; Ahrends et al., 2017).
Известно, что дифференцировка Т-лимфоцитов связана с их метаболизмом (van der Windt et al., 2012, 2013; Phan et al., 2016). Митохондрии являются центральным узлом метаболических путей в клетке и участвуют в ее жизненно важных функциях: производстве энергии, клеточном дыхании, продукции метаболических прекурсоров для синтеза макромолекул, активации, пролиферации, дифференцировке и апоптозе (Spinelli, Haigis, 2018). Дисфункция митохондрий нередко приводит к истощению клеток, что подтверждается большинством публикаций (Bengsch et al., 2016; McKinney, Smith, 2018; Yu et al., 2020). Состояние истощения характеризуется постепенной потерей Т-клетками эффекторных функций, снижением пролиферативной способности, повышением экспрессии ингибиторных молекул, изменением метаболизма (McKinney, Smith, 2018; McLane et al., 2019). Истощение Т-лимфоцитов отмечено у лиц пожилого возраста (Ponnappan, Ponnappan, 2011), а также как результат постоянной стимуляции клеток антигеном при хронических инфекциях (Saeidi et al., 2018; McLane et al., 2019) и онкологических заболеваниях (Mumprecht et al., 2009; McLane et al., 2019). Несмотря на то, что активно ведутся исследования при патологических состояниях, изучение параметров митохондрий в Т-лимфоцитах здоровых людей до настоящего времени не проводили.
Целью данной работы была оценка состояния митохондрий Т-лимфоцитов CD4+ и CD8+ у здоровых добровольцев.
МАТЕРИАЛ И МЕТОДИКА
Объект исследования. Проведение исследования было одобрено этическим комитетом Пермского краевого центра по борьбе со СПИД и инфекционными заболеваниями (рег. № IRB00008964). Было обследовано 23 относительно здоровых добровольца. Критерии включения в исследование были следующие: отсутствие в периферической крови антител к вирусам гепатита С и иммунодефицита человека, поверхностного антигена вируса гепатита В; отсутствие признаков респираторной инфекции в течение 14 сут до момента забора крови; для женщин – отсутствие беременности. Каждый участник исследования подписал информированное согласие. Забор венозной крови проводили натощак в вакуумные пробирки, содержащие в качестве антикоагулянта этилендиаминтетрауксусную кислоту (Weihai Hongyu Medical Devices Co Ltd, Китай). Мононуклеарные клетки выделяли центрифугированием двукратно разведенной крови в градиенте плотности Диаколла (1.077 г/мл; Диаэм, Россия). Клетки дважды отмывали в растворе фосфатно-солевого буфера Дульбекко (DPBS; Gibco, США) и помещали в среду, содержащую 90% термоинактивированной эмбриональной телячьей сыворотки (ЭТС; Biowest, Колумбия) и 10% диметилсульфоксида (AppliChem, Германия). Образцы подвергали контролируемому замораживанию в жидком азоте. Перед проведением исследования клетки размораживали.
Проточная цитометрия. Идентификацию Т-лимфоцитов CD4+ и CD8+ проводили методом проточной цитометрии на флюориметре Fortessa (Becton Dickinson, США) с использованием моноклональных антител анти-CD3-AF700, анти-CD8-BUV737 (Becton Dickinson, США), анти-CD4-Qdot605 и витального красителя LIVE/DEAD® Fixable Aqua Dead Cell Stain Kit (Invitrogen, США). Массу и заряд мембраны митохондрий оценивали с применением митохондриально-селективных красителей MitoTracker Green FM и MitoTracker Orange CM-H2TMRos (Invitrogen, США) соответственно. MitoTracker Orange является нефлюоресцентным красителем, который после проникновения в клетку пассивной диффузией, предпочтительно накапливается в митохондриях, где окисляется до флюоресцентной формы. Интенсивность свечения реагента прямо связана с величиной мембранного потенциала активных митохондрий (Cottet-Rousselle et al., 2011). Краситель MitoTracker Green избирательно аккумулируется в матриксе митохондрий, где ковалентно связывается с митохондриальными белками, реагируя со свободными тиоловыми группами остатков цистеина (Presley et al., 2003; Cottet-Rousselle et al., 2011). Накопление этого флюоресцентного маркера в матриксе митохондрий прямо пропорционально их массе и не зависит от мембранного потенциала органелл (Presley et al., 2003). Красители готовили согласно прилагаемым инструкциям производителя. В пробы с мононуклеарными клетками вносили MitoTracker Green и MitoTracker Orange в конечных концентрациях 25 нМ и 500 нМ соответственно. После окрашивания (37°С, 30 мин) клетки отмывали центрифугированием в растворе DPBS. Далее в пробы вносили флюорохром-меченые антитела и витальный краситель для поверхностного окрашивания клеток. Образцы инкубировали при комнатной температуре в течение 30 мин в защищенном от света месте. По окончании времени инкубации клетки отмывали центрифугированием в избыточном объеме раствора DPBS/2% ЭТС. Осадок ресуспендировали в растворе DPBS/2% ЭТС и проводили цитофлюориметрическое исследование.
Основным регулятором активности митохондрий является PGC-1α (Peroxisome proliferator activated receptor Gamma Coactivator-1 alpha). Он действует как коактиватор транскрипционных факторов митохондриальных генов, вовлеченных в увеличение массы митохондрий, синтез ферментов цикла трикарбоновых кислот, β-окисления жирных кислот, протеинов комплексов дыхательной цепи и белков, регулирующих слияние (фрагментацию) митохондрий (Fernandez-Marcos, Auwerx, 2011; Cheng et al., 2018). Внутриклеточное содержание митохондриального регулятора определяли с применением поликлональных антител анти-PGC-1α-DyLight488 (Novus Biologicals, Великобритания). Предварительно клетки окрашивали поверхностными флюорохром-мечеными антителами (см. выше), фиксировали (при комнатной температуре 60 мин в защищенном от света месте) и пермеабилизировали (двукратным центрифугированием) с использованием коммерческих буферных растворов для фиксации и пермеабилизации клеток (Invitrogen, США). После инкубации с анти-PGC-1α-антителами (комнатная температура, защищенное от света местo, 60 мин) клетки дважды отмывали центрифугированием в буфере для пермеабилизации, после чего ресуспендировали в растворе DPBS/2% ЭТС для проведения цитометрического анализа.
Разделение субпопуляций. Исходя из функциональных различий между Т-лимфоцитами CD4+ и CD8+ и наличия среди них разных субпопуляций клеток с уникальной метаболической программой (MacIver et al., 2013; Sun, Li, 2017), состояние митохондрий исследовали в лимфоцитах, относящихся и не относящихся к клеткам памяти, а также в делящихся и покоящихся элементах. Для разделения субпопуляций применяли моноклональные антитела анти-CD45RA-BV650 (BioLegend, США). Т-лимфоциты, не экспрессирующие молекулу CD45RA, относили к клеткам памяти (Sallusto et al., 1999). С использованием моноклональных антител анти-CD71-BV421 (Becton Dickinson, США) определяли делящиеся и покоящиеся элементы, к которым относили CD71-позитивные и CD71-негативные Т-лимфоциты соответственно. Последнее основано на том, что ранее мы показали возможность использования рецептора к трансферрину (CD71) в качестве суррогатного маркера пролиферирующих CD4+-Т-лимфоцитов (Younes et al., 2018): экспрессия маркера пролиферации клеток Ki-67 была тесно связана с появлением на поверхности клеток молекулы CD71 (r = 0.985).
Статистический анализ полученных данных проводили с использованием непараметрических методов. В выборке рассчитывали медиану и межквартильный размах (25–75 персентиль). Достоверность различий определяли на основе критерия Манна−Уитни. Корреляционный анализ проводили по методу Спирмена. Статистические расчеты и построение графиков выполняли с использованием программы Statistica 6.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Средний возраст обследованных здоровых добровольцев составил 32 г. (28–39 лет), среди которых преобладали женщины (65%). Различий по всем исследованным параметрам между мужчинами и женщинами не установлено. Относительное количество CD4+ и CD8+ Т-лимфоцитов в периферической крови составило 43.6% (42.0–47.5%) и 32.7% (27.7–37.5%) соответственно. Данные по субпопуляционному составу Т-лимфоцитов CD4+ и CD8+ представлены в табл. 1 и соответствуют норме (Yang et al., 2017; Toma et al., 2022).
Таблица 1.
Содержание различных субпопуляций Т-лимфоцитов в периферической крови здоровых людей
| Показатель | CD4+ Т-лимфоцитыа, % | CD8+ Т-лимфоцитыа, % |
|---|---|---|
| CD45RA+ | 58.3 (51.8–62.5) | 59.8 (54.1–70.2) |
| CD45RA– | 41.8 (37.6–48.2) | 40.2 (29.8–45.9) |
| CD71+ | 2.7 (2.1–3.7) | 2.9 (2.8–3.5) |
| CD71– | 97.3 (96.3–98.0) | 97.1 (96.5–97.2) |
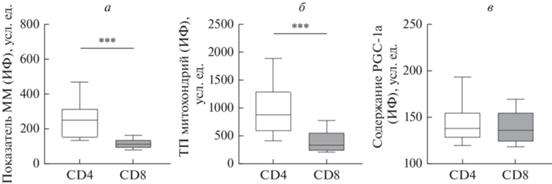
Оценка показателей состояния митохондрий в Т-лимфоцитах CD4+ и CD8+ выявила следующие различия между пулами клеток. Так, масса органелл (рис. 1а) и величина трансмембранного потенциала митохондрий (рис. 1б) были значительно ниже в цитотоксических, чем в хелперных лимфоцитах (P < 0.001). При этом содержание нуклеарного коактиватора PGC-1α – важного регулятора митохондриальной активности – было сопоставимо в обеих субпопуляциях Т-клеток (рис. 1в).
Рис. 1.
Масса митохондрий (ММ), их трансмембранный потенциал (ТП) и содержание PGC-1α в Т-лимфоцитах CD4+ и CD8+ здоровых доноров. Здесь и на рис. 2, 3: по вертикали – интенсивность свечения (ИФ) митохондриально-селективных красителей MitoTracker Green (а), MitoTracker Orange (б) и клеток, экспрессирующих PGC-1α (в), отражающих соответствующие показатели (см. раздел “Материал и методика”). Представлены медианы (горизонтальные линии), интерквартильные размахи (прямоугольники), 10-я и 90-я персентили (вертикальные отрезки); различия достоверны при *P < 0.05, **P < 0.01 или ***P < 0.001 (U-критерий Манна−Уитни).
Известно, что деление Т-лимфоцитов тесно связано с адаптацией митохондрий к меняющимся энергетическим и биосинтетическим потребностям клетки (Spinelli, Haigis, 2018). Исследование массы органелл в покоящихся (CD71–) и делящихся (CD71+) Т-лимфоцитах выявило более высокие показатели в Т-клетках CD4+ по сравнению с популяцией CD8+ (рис. 2а). Так, среди делящихся элементов масса митохондрий в CD4+-Т-лимфоцитах была в 2.4 раза выше, чем в цитотоксических клетках (P < 0.001). В пуле покоящихся клеток различие между показателями Т-лимфоцитов CD4+ и CD8+ было чуть меньше (в 2.2 раза; P < 0.001). CD71+-элементы обладали более высокой массой митохондрий, чем популяция CD71–, что оказалось справедливо как для CD4+-Т-лимфоцитов (P < 0.01), так и для CD8+-Т-клеток (P < 0.001). Примечательно, что даже в делящихся цитотоксических Т-лимфоцитах масса органелл была ниже, чем в покоящихся CD4+-Т-клетках, хотя различия не достигали уровня статистической значимости (P > 0.05). Таким образом, масса митохондрий в делящихся и покоящихся CD4+-Т-лимфоцитах здоровых субъектов существенно превышает таковую в соответствующих субпопуляциях CD8+-Т-клеток. Вместе с тем, делящиеся элементы вне зависимости от принадлежности к пулу хелперных или цитотоксических Т-лимфоцитов обладают большей массой органелл по сравнению с субпопуляцией клеток, находящихся в покое.
Рис. 2.
Масса митохондрий (ММ), их трансмембранный потенциал (ТП) и содержание PGC-1α в делящихся (CD71+) и покоящихся (CD71–) Т-лимфоцитах CD4+ и CD8+ здоровых людей. Объяснения в подписи к рис. 1.
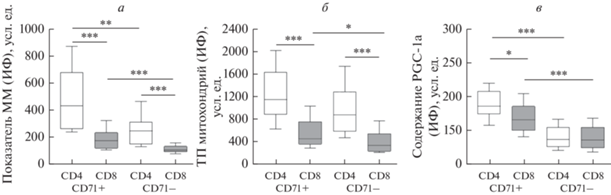
Схожие данные были получены при оценке заряда митохондрий (рис. 2б). Величина трансмембранного потенциала митохондрий в покоящихся и делящихся Т-лимфоцитах CD4+ превышала таковую в Т-клетках CD8+ более чем в 2.5 раза (P < 0.001). Хотя заряд органелл CD71+-элементов каждой из субпопуляций Т-лимфоцитов был выше соответствующих показателей среди клеток CD71–, статистически значимые различия были установлены только при сравнении величин в пуле CD8+-Т-лимфоцитов (P < 0.05). Таким образом, у здоровых людей покоящиеся и делящиеся CD4+-Т-клетки обладают более высоким зарядом мембраны митохондрий по сравнению с соответствующими субпопуляциями цитотоксических Т-лимфоцитов. При этом делящиеся CD8+-Т-клетки характеризуются повышенным трансмембранным потенциалом органелл относительно его величины в покоящихся лимфоцитах.
Ключевым регулятором работы митохондрий является транскрипционный коактиватор PGC-1α (Fernandez-Marcos, Auwerx, 2011). Оценка его содержания в покоящихся и делящихся Т-лимфоцитах CD4+ и CD8+ выявила следующие особенности (рис. 2в). Обе субпопуляции клеток не различались по уровню экспрессии этого белка среди элементов CD71–. При этом делящиеся Т-лимфоциты CD4+ и CD8+ содержали более высокие концентрации регуляторного протеина, чем соответствующие покоящиеся элементы этих субпопуляций (P < 0.001). Вместе с тем, цитотоксические Т-лимфоциты CD71+ несли в себе меньшее количество PGC-1α, чем делящиеся CD4+-Т-клетки (P < 0.05). Полученные данные свидетельствуют о том, что в состоянии покоя уровень экспрессии митохондриального регулятора в CD4+-Т-лимфоцитах сопоставим с таковым в CD8+-Т-клетках. Вместе с тем, содержание PGC-1α в последних оказывается ниже при его оценке среди митотически активных элементов. При этом в делящихся Т-лимфоцитах как CD4+, так и CD8+ концентрация митохондриального регуляторного протеина существенно возрастает относительно его уровня в покоящихся клетках.
Таким образом, полученные нами данные о состоянии митохондрий в покоящихся и делящихся Т-лимфоцитах здоровых субъектов показали, что масса митохондрий, заряд их мембраны и содержание PGC-1α в митотически активных Т-клетках CD4+ значительно выше, чем соответствующие параметры Т-лимфоцитов CD8+. Эта тенденция сохраняется и при оценке массы органелл и их мембранного потенциала в субпопуляциях покоящихся Т-клеток CD4+ и CD8+. Вместе с тем, митотически активные цитотоксические и хелперные Т-лимфоциты, в отличие от покоящихся Т-клеток CD4+ и CD8+, обладают более высокой массой и зарядом митохондрий, а также несут в себе более высокие концентрации митохондриального регулятора PGC-1α. Известно, что метаболизм покоящихся и активированных Т-лимфоцитов существенно отличается: последним требуется больше энергии и биосинтетических компонентов для роста, деления и дифференцировки в различные субпопуляции (MacIver et al., 2013; Sun, Li, 2017). Сходство выявленных нами изменений – более высокие показатели активности митохондрий в делящихся, чем в покоящихся клетках, – может свидетельствовать об идентичности метаболической адаптации Т-лимфоцитов CD4+ и CD8+ в организме. Вместе с тем, различия между хелперными и цитотоксическими Т-лимфоцитами по состоянию митохондрий – более низкая активность митохондрий в клетках CD8+ по сравнению с CD4+, – по-видимому, отражают исключительность метаболических программ, необходимых для поддержания и выполнения функций разных иммуноцитов (MacIver et al., 2013; Jones et al., 2017).
Формирование клеток памяти является уникальным свойством адаптивного иммунитета. Известно, что наивные Т-лимфоциты и клетки памяти имеют ряд метаболических различий (van der Windt et al., 2012, 2013; Callender et al., 2020). Так, повышенная митохондриальная активность клеток памяти способствует более быстрой их пролиферации при повторной стимуляции антигеном (van der Windt et al., 2013). Проведенная нами оценка состояния митохондрий в Т-лимфоцитах, относящихся (CD45RA–) и не относящихся (CD45RA+) к клеткам памяти, показала следующее. В обеих субпопуляциях масса органелл CD4+-Т-лимфоцитов (рис. 3а) почти в 2 раза превышала таковую в CD8+-Т-клетках (P < 0.001). Цитотоксические Т-лимфоциты памяти демонстрировали более высокую массу митохондрий, чем CD45RA-позитивные элементы (P < 0.001). Аналогичные данные были получены при оценке показателей среди CD45RA– и CD45RA+ субпопуляций CD4+-Т-лимфоцитов (P < 0.05). Таким образом, у здоровых субъектов CD4+-Т-лимфоциты обладают большей массой митохондрий, чем CD8+-Т-лимфоциты, что оказалось справедливым, как для клеток относящихся, так и не относящихся к клеткам памяти. Вместе с тем, и CD4+-, и CD8+-Т-лимфоциты памяти характеризуются повышенной массой митохондрий по сравнению с соответствующими лимфоцитами, не принадлежащими к пулу клеток памяти.
Рис. 3.
Масса митохондрий (ММ), их трансмембранный потенциал (ТП) и содержание PGC-1α в Т-лимфоцитах CD4+ и CD8+, относящихся (CD45RA–) и не относящихся (CD45RA+) к клеткам памяти, у здоровых субъектов. Объяснения в подписи к рис. 1.
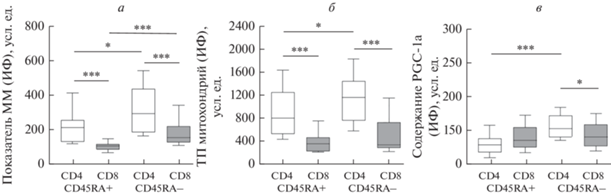
Рядом авторов было показано, что величина мембранного потенциала митохондрий является ключевым фактором формирования CD8+-Т-лимфоцитов памяти (Sukumar et al., 2016). Проведенная нами оценка трансмембранного потенциала митохондрий в CD8+-Т-лимфоцитах, относящихся и не относящихся к клеткам памяти, не выявила статистически значимых отличий между субпопуляциями (рис. 3б). Вместе с тем, заряд органелл цитотоксических лимфоцитов, как в CD45RA+, так и CD45RA– субпопуляциях был существенно ниже соответствующих показателей в CD4+-Т-клетках (P < 0.001). При этом, в отличие от CD8+-Т-лимфоцитов, хелперные клетки демонстрировали более высокую величину мембранного потенциала в субпопуляции клеток памяти относительно CD45RA+ элементов (P < 0.05). Полученные данные свидетельствуют о том, что у здоровых лиц CD4+-Т-лимфоциты, принадлежащие и не принадлежащие к клеткам памяти, наряду с повышенной массой митохондрий, обладают более высоким зарядом органелл по сравнению с соответствующими субпопуляциями CD8+-Т-клеток.
Ранее при оценке у здоровых людей состояния митохондрий в Т-лимфоцитах разной стадии дифференцировки было отмечено, что наивные клетки обладали сниженным мембранным потенциалом и массой митохондрий по сравнению с клетками центральной памяти (Nicoli et al., 2018). Однако эти данные были получены только для CD8+-Т-лимфоцитов. Сравнение состояния митохондрий Т-клеток CD8+ и CD4+ авторы не проводили. Другие исследователи при сопоставлении у здоровых доноров величин мембранного потенциала и массы митохондрий в Т-лимфоцитах CD4+ и CD8+ общего пула (Yu et al., 2017) и терминально-дифференцированных элементов (Callender et al., 2020) выявили более высокие показатели в хелперных клетках. Оценку состояния митохондрий в функционально активных субпопуляциях Т-лимфоцитов CD4+ и CD8+, таких как делящиеся элементы и клетки памяти, ранее никто не проводил.
Как уже упоминалось, PGC-1α является основным регулятором активности митохондрий (Fernandez-Marcos, Auwerx, 2011). Оценка его содержания в клетках памяти (рис. 3в) выявила более высокие показатели в Т-лимфоцитах CD4+, чем в CD8+ (P < 0.05). При этом среди элементов CD45RA+ статистически значимых различий между Т-клетками CD4+ и CD8+ не установлено (P > 0.05). Цитотоксические Т-лимфоциты, относящиеся и не относящиеся к клеткам памяти, несли в себе сопоставимое количество митохондриального регулятора (P > 0.05), тогда как его концентрация в CD4+-Т-лимфоцитах памяти была существенно выше, чем среди элементов CD45RA+ (P < 0.001).
Таким образом, нами впервые установлено, что Т-лимфоциты CD4+, относящиеся и не относящиеся к клеткам памяти, обладают более высокой массой и величиной мембранного потенциала митохондрий по сравнению с соответствующими субпопуляциями CD8+-Т-лимфоцитов. Масса органелл в цитотоксических и хелперных Т-лимфоцитах памяти существенно превышает таковую в элементах, не принадлежащих к клеткам памяти. При этом CD8+-Т-лимфоциты, являющиеся и не являющиеся клетками памяти, обладают сопоставимой величиной заряда мембраны митохондрий и содержанием митохондриального регулятора. Напротив, трансмембранный потенциал митохондрий и уровень PGC-1α в Т-лимфоцитах памяти CD4+ значительно повышены относительно соответствующих величин в клетках, не принадлежащих к элементам памяти. Известно, что в патологических ситуациях истощению подвержены больше Т-лимфоциты CD8+, чем CD4+ (Bengsch et al., 2016; McLane et al., 2019; Yu et al., 2020). Вполне вероятно, что это может быть связано с обнаруженными нами более низкими показателями активности митохондрий в CD8+-Т-лимфоцитах относительно CD4+-Т-клеток.
Еще одним предположением различий состояний митохондрий между Т-лимфоцитами CD4+ и CD8+ может быть разное содержание в клетках регулятора митохондриальной активности. Проведенный корреляционный анализ между концентрацией PGC-1α и параметрами митохондрий в Т-лимфоцитах CD4+ и CD8+ обнаружил следующие взаимосвязи (табл. 2). Оказалось, что уровни митохондриального регулятора в общем пуле CD4+-Т-лимфоцитов, а также в делящихся и покоящихся клетках прямо связаны с массой органелл каждой из популяций. При этом среди цитотоксических Т-лимфоцитов такие взаимосвязи отсутствовали. Более того, во всех исследованных субпопуляциях CD8+-Т-лимфоцитов были установлены самые низкие коэффициенты корреляции. Эти данные могут указывать на участие других, помимо PGC-1α, факторов в регуляции массы митохондрий цитотоксических Т-лимфоцитов.
Таблица 2.
Связь содержания PGC-1α с массой (I) и зарядом (II) митохондрий в Т-лимфоцитах CD4+ и CD8+ здоровых людей
| Параметр | Т-лимфоциты CD4+ | Т-лимфоциты CD8+ | ||
|---|---|---|---|---|
| r | P | r | P | |
| I | ||||
| Общий пул | 0.462 | <0.05 | 0.314 | >0.05 |
| CD45RA+ | 0.410 | >0.05 | 0.266 | >0.05 |
| CD45RA– | 0.401 | >0.05 | 0.237 | >0.05 |
| CD71+ | 0.444 | <0.05 | 0.304 | >0.05 |
| CD71– | 0.486 | <0.05 | 0.318 | >0.05 |
| II | ||||
| Общий пул | 0.411 | >0.05 | 0.484 | <0.05 |
| CD45RA+ | 0.404 | >0.05 | 0.430 | <0.05 |
| CD45RA– | 0.453 | <0.05 | 0.571 | <0.01 |
| CD71+ | 0.548 | <0.01 | 0.490 | <0.05 |
| CD71– | 0.430 | <0.05 | 0.493 | <0.05 |
Однако о том, что PGC-1α влияет на митохондрии Т-лимфоцитов CD8+, свидетельствуют обнаруженные нами во всех исследованных субпопуляциях клеток статистически значимые зависимости между концентрацией регулятора и зарядом мембраны митохондрий (табл. 2). При этом среди Т-лимфоцитов CD4+ такие взаимосвязи были установлены лишь в некоторых субпопуляциях.
Таким образом, нами впервые установлено, что у здоровых субъектов между Т-лимфоцитами CD4+ и CD8+ имеются существенные различия по состоянию митохондрий. Выявлено, что масса и трансмембранный потенциал митохондрий в CD4+-Т-лимфоцитах, являющихся и не являющихся клетками памяти, а также в покоящихся и делящихся элементах, существенно превышают соответствующие показатели в Т-клетках CD8+. При этом как среди хелперных, так и цитотоксических лимфоцитов более высокая масса, заряд митохондрий и содержание PGC-1α являются характерной особенностью клеток памяти и делящихся элементов. Более того, у здоровых лиц взаимосвязи между уровнем регулятора активности митохондрий и показателями их состояния в Т-лимфоцитах CD4+ и CD8+ существенно различаются: если в первом случае содержание PGC-1α прямо связано с массой митохондрий, то во втором – с трансмембранным потенциалом органелл.
Список литературы
Ahrends T., Spanjaard A., Pilzecker B., Babala N., Bovens A., Xiao Y., Jacobs H., Borst J. 2017. CD4(+) T cell help confers a cytotoxic T cell effector program including coinhibitory receptor downregulation and increased tissue invasiveness. Immunity. V. 47. P. 848.
Bengsch B., Johnson A.L., Kurachi M., Odorizzi P.M., Pauken K.E., Attanasio J., Stelekati E., McLane L.M., Paley M.A., Delgoffe G.M., Wherry E.J. 2016. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. V. 45. P. 358.
Callender L.A., Carroll E.C., Bober E.A., Akbar A.N., Solito E., Henson S.M. 2020. Mitochondrial mass governs the extent of human T cell senescence. Aging Cell. V. 19. P. e13067.
Cheng C.F., Ku H.C. Lin H. 2018. PGC-1alpha as a pivotal factor in lipid and metabolic regulation. Int. J Mol. Sci. V. 19. P. 3447.
Cottet-Rousselle C., Ronot X., Leverve X., Mayol J.F. 2011. Cytometric assessment of mitochondria using fluorescent probes. Cytometry A. V. 79. P. 405.
Farber D.L., Yudanin N.A., Restifo N.P. 2014. Human memory T cells: Generation, compartmentalization and homeostasis. Nat. Rev. Immunol. V. 14. P. 24.
Fernandez-Marcos P.J., Auwerx J. 2011. Regulation of PGC-1alpha, a nodal regulator of mitochondrial biogenesis. Am. J. Clin. Nutr. V. 93. P. 884S.
Jones N., Cronin J.G., Dolton G., Panetti S., Schauenburg A.J., Galloway S.A.E., Sewell A.K., Cole D.K., Thornton C.A., Francis N.J. 2017. Metabolic adaptation of human CD4+ and CD8+ T-cells to T-cell receptor-mediated stimulation. Front. Immunol. V. 8. P. 1516.
Kaech S.M., Wherry E.J. 2007. Heterogeneity and cell-fate decisions in effector and memory CD8+ T cell differentiation during viral infection. Immunity. V. 27. P. 393.
MacIver N.J., Michalek R.D. Rathmell J.C. 2013. Metabolic regulation of T lymphocytes. Annu. Rev. Immunol. V. 31. P. 259.
McKinney E.F., Smith K.G.C. 2018. Metabolic exhaustion in infection, cancer and autoimmunity. Nat. Immunol. V. 19. P. 213.
McLane L.M., Abdel-Hakeem M.S., Wherry E.J. 2019. CD8 T cell exhaustion during chronic viral infection and cancer. Annu. Rev. Immunol. V. 37. P. 457.
Mumprecht S., Schurch C., Schwaller J., Solenthaler M., Ochsenbein A.F. 2009. Programmed death 1 signaling on chronic myeloid leukemia-specific T cells results in T-cell exhaustion and disease progression. Blood. V. 114. P. 1528.
Nicoli F., Papagno L., Frere J.J., Cabral-Piccin M.P., Clave E., Gostick E., Toubert A., Price D.A., Caputo A., Appay V. 2018. Naive CD8(+) T-cells engage a versatile metabolic program upon activation in humans and differ energetically from memory CD8(+) T-cells. Front. Immunol. V. 9. P. 2736.
Novy P., Quigley M., Huang X., Yang Y. 2007. CD4 T cells are required for CD8 T cell survival during both primary and memory recall responses. J. Immunol. V. 179. P. 8243.
Phan A.T., Doedens A.L., Palazon A., Tyrakis P.A., Cheung K.P., Johnson R.S., Goldrath A.W. 2016. Constitutive glycolytic metabolism supports CD8(+) T cell effector memory differentiation during viral infection. Immunity. V. 45. P. 1024.
Ponnappan S., Ponnappan U. 2011. Aging and immune function: Molecular mechanisms to interventions. Antioxid. Redox. Signal. V. 14. P. 1551.
Presley A.D., Fuller K.M., Arriaga E.A. 2003. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. V. 793. P. 141.
Rogers P.R., Dubey C., Swain S.L. 2000. Qualitative changes accompany memory T cell generation: Faster, more effective responses at lower doses of antigen. J. Immunol. V. 164. P. 2338.
Saeidi A., Zandi K., Cheok Y.Y., Saeidi H., Wong W.F., Lee C.Y.Q., Cheong H.C., Yong Y.K., Larsson M., Shankar E.M. 2018. T-Cell exhaustion in chronic infections: Reversing the state of exhaustion and reinvigorating optimal protective immune responses. Front. Immunol. V. 9. P. 2569.
Sallusto F., Lenig D., Forster R., Lipp M., Lanzavecchia A. 1999. Two subsets of memory T lymphocytes with distinct homing potentials and effector functions. Nature. V. 401. P. 708.
Spinelli J.B., Haigis M.C. 2018. The multifaceted contributions of mitochondria to cellular metabolism. Nat. Cell Biol. V. 20. P. 745.
Sukumar M., Liu J., Mehta G.U., Patel S.J., Roychoudhuri R., Crompton J.G., Klebanoff C.A., Ji Y., Li P., Yu Z., Whitehill G.D., Clever D., Eil R.L., Palmer D.C., Mitra S., Rao M. et al. P. 2016. Mitochondrial membrane potential identifies cells with enhanced stemness for cellular therapy. Cell Metab. V. 23. P. 63.
Sun H., Li X. 2017. Metabolic reprogramming in resting and activated immune cells. Metabolomics (Los Angel). V. 7. P. 188.
Toma G., Lemnian I.M., Karapetian E., Grosse I., Seliger B. 2022. Transcriptional analysis of total CD8(+) T cells and CD8(+)CD45RA(– memory T cells from young and old healthy blood donors. Front. Immunol. V. 13. P. 806906. https://doi.org/10.3389/fimmu.2022.806906
Van der Windt G.J., Everts B., Chang C.H., Curtis J.D., Freitas T.C., Amiel E., Pearce E.J., Pearce E.L. 2012. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. V. 36. P. 68.
Van der Windt G.J., O’Sullivan D., Everts B., Huang S.C., Buck M.D., Curtis J.D., Chang C.H., Smith A.M., Ai T., Faubert B., Jones R.G., Pearce E.J., Pearce E.L. 2013. CD8 memory T cells have a bioenergetic advantage that underlies their rapid recall ability. Proc. Natl. Acad. Sci. USA. V. 110. P. 14336.
Yang P., Ma J., Yang X., Li W. 2017. Peripheral CD4+ naive/memory ratio is an independent predictor of survival in non-small cell lung cancer. Oncotarget. V. 8. P. 83650.
Younes S.A., Talla A., Pereira Ribeiro S., Saidakova E.V., Korolevskaya L.B., Shmagel K.V., Shive C.L., Freeman M.L., Panigrahi S., Zweig S., Balderas R., Margolis L., Douek D.C., Anthony D.D., Pandiyan P. et al. 2018. Cycling CD4+ T cells in HIV-infected immune nonresponders have mitochondrial dysfunction. J. Clin. Invest. V. 128. P. 5083.
Yu F., Hao Y., Zhao H., Xiao J., Han N., Zhang Y., Dai G., Chong X., Zeng H., Zhang F. 2017. Distinct mitochondrial disturbance in CD4+T and CD8+T cells from HIV-infected patients. J. Acquired Immune Defic. Syndr. V. 74. P. 206.
Yu Y.R., Imrichova H., Wang H., Chao T., Xiao Z., Gao M., Rincon-Restrepo M., Franco F., Genolet R., Cheng W.C., Jandus C., Coukos G., Jiang Y.F., Locasale J.W., Zippelius A., Liu P.S. et al. 2020. Disturbed mitochondrial dynamics in CD8(+) TILs reinforce T cell exhaustion. Nat. Immunol. V. 21. P. 1540.
Zhu J., Yamane H., Paul W.E. 2010. Differentiation of effector CD4 T cell populations (*). Annu. Rev. Immunol. V. 28. P. 445.
Дополнительные материалы отсутствуют.


