Цитология, 2022, T. 64, № 5, стр. 466-477
Клеточная подвижность и структура цитоскелета под влиянием активатора и ингибитора малой ГТФазы RhoA в процессе репликативного старения линии МСК, выделенной из кожи век взрослого донора
Д. Е. Бобков 1, *, А. В. Полянская 1, А. С. Мусорина 1, Е. В. Ломерт 1, Г. Г. Полянская 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: bobkov@incras.ru
Поступила в редакцию 03.06.2022
После доработки 22.06.2022
Принята к публикации 03.07.2022
- EDN: ANGCJO
- DOI: 10.31857/S0041377122050017
Аннотация
Широкое применение МСК человека в биомедицинских технологиях и важная роль клеточной миграции в биомедицинских процессах приводят к необходимости углубления фундаментальных исследований подвижности этих клеток в процессе репликативного старения (РС). В настоящей работе выполнен сравнительный анализ строения актинового цитоскелета и характеристик подвижности клеток линии DF-2 в присутствии активатора (LPA) или ингибитора (Y-27632) малой ГТФазы RhoA на разных стадиях РС. Получены следующие результаты: 1) показано наличие РС в процессе длительного культивирования (8–28 пассажи) контрольных клеток; 2) на поздней стадии РС присутствие 10 нг/мл LPA в течение 24 ч не вызывало изменений в структуре актинового цитоскелета, тогда как ингибитор активности малой ГТФзы RhoA способствовал значительному снижению количества стресс-фибрилл; 3) изменения скорости и извилистости клеточных движений в присутствии LPA или Y-27632 зависят от стадии РС: в частности, LPA снижает, а Y-27632 увеличивает среднюю скорость движения клеток на пассажах 21 и 28 по сравнению с контролем, а на пассаже 8 эти вещества не влияют на скорость клеток. Полученные данные свидетельствуют, по-видимому, об увеличении активности RhoA-ассоциированных сигнальных путей в процессе РС.
Мезенхимные стволовые клетки (МСК) человека являются перспективным объектом как для фундаментальных биологических исследований, так и для использования их в биомедицинских технологиях. В настоящее время значительно расширяется использование МСК человека разного происхождения в биомедицинских исследованиях, связанных с широким спектром заболеваний (Albu et al., 2021; Mannino et al., 2021; Moghadasi et al., 2021; Raposo et al., 2021; Xiao et al., 2021; Saleh et al., 2021; Smojver et al., 2022; Su et al., 2022; Sun et al., 2022; Zhang et al., 2022). Широкое использование МСК человека в биомедицинских технологиях приводит к необходимости расширения и углубления фундаментальных исследований различных свойств, характерных для этих клеток, в разные периоды их жизнедеятельности, включая стадию активного репликативного старения (РС).
РС, происходящее в процессе длительного культивирования клеточных популяций, представляет собой комплексный динамический процесс, индуцированный генетическими и эпигенетическими изменениями, который начинается на ранних пассажах и постепенно усиливается в процессе культивирования. РС характеризуется существенными изменениями многих клеточных свойств (Бобков, Полянская, 2020). Несмотря на то, что МСК человека имеют определенный статус, определяемый рядом характеристик (Dominici et al., 2006; Sensebé et al., 2010), линии МСК различаются по характеристикам, ответственным за важнейшие клеточные процессы, включая клеточную подвижность (миграцию) и РС. Причинами наблюдаемых различий могут быть как эпигенетические факторы, связанные с условиями культивирования или с микроокружением, в котором существовали эти клетки до помещения их в условия in vitro, так и генетические (Stanko et al., 2014; Krylova et al., 2015; Voronkina et al., 2017, 2020; Полянская, 2018; Alessio et al., 2018; Facchin et al., 2018; Li et al., 2018; Полянская и др., 2019; Guan et al., 2019; Jin et al., 2019; Khasawneh et al., 2019; Terunuma et al., 2019; Yang et al., 2019; Koltsova et al., 2021; Semenova et al., 2021; Shin et al., 2021; Tai et al., 2021; Yigitbilek et al., 2021).
Изменение характера клеточной подвижности является одним из признаков РС. Клеточная подвижность связана с внеклеточным матриксом, на котором распластаны клетки, и зависит от организации актинового цитоскелета. Внеклеточный матрикс, состоящий из разных белков, синтезируемых самими клетками, является одним из важнейших регуляторов клеточных процессов, представляя собой микроокружение, в котором живут клетки. Клеточная миграция лежит в основе тканевой репарации, способствующей широкому использованию МСК в биомедицинских технологиях. В связи с этим представляется существенным изучение связи РС с организацией цитоскелета. В настоящее время исследования молекулярных механизмов реорганизации цитоскелета в процессе длительного культивирования, включая активную стадию РС, проводятся в разных клетках человека и животных и находятся на этапе накопления экспериментальных результатов (Larsen et al., 2003; le Clainche, Carlier, 2008; Wang, Jang, 2009; Geissler et al., 2012; Özcan et al., 2016; Turinetto et al., 2016; Moujaber et al., 2019).
В связи с этим нами начаты систематические исследования по реорганизации актинового цитоскелета в процессе РС в клетках линий МСК человека, выделенных из разных источников. Ранее была исследована роль малой ГТФазы RhoA, как одного из ключевых факторов, участвующих в реорганизации актинового цитоскелета, в 3-х линиях МСК человека разного происхождения: MSCWJ-1 (из Вартонова студня пупочного канатика человека); DF-2 (из кожи век взрослого донора) и ADH-MSC (из эпикардиальной жировой ткани взрослого донора). Было показано, что в процессе РС снижается ядерная локализация малой ГТФaзы RhoA в клеточных линиях MSCWJ-1 и DF-2, выделенных из здоровых доноров (Bobkov et al., 2020, 2022), тогда как в клеточной линии ADH-MSC, выделенной из нездорового донора и из нездорового органа (ткань сердца, полученная при проведении аортокоронарного шунтирования) наблюдается обратная картина: увеличение ядерной локализации ГТФaзы RhoA в процессе РС (Goncharova et al., 2021). В клетках MSCWJ-1 показаны колебания средней скорости и направленности клеточного движения; наименьшую скорость и прямолинейность движения наблюдали в активной стадии РС (Bobkov et al., 2020). Надо подчеркнуть, что все перечисленные выше исследования относились исключительно к анализу роли ГТФазы RhoA в реорганизации актинового скелета на ряде клеточных линий, культивирующихся постоянно в нормальных (стандартных) условиях с 10% эмбриональной бычьей сыворотки.
В настоящей работе мы расширили наши исследования, проводимые на линии DF-2, по функциональному анализу RhoA в реорганизации актинового цитоскелета и клеточной подвижности, и изучили влияние активатора (LPA) и ингибитора (Y-27632) малой ГТФазы RhoA на эти процессы. Есть данные о существенном влиянии Y-27632 на изучаемые параметры, но получены эти данные при анализе эндотелиальных клеток (Li et al., 2013; Pipparelli et al., 2013; Diao, Hong, 2015). Ранее на МСК легкого человека было показано влияние LPA на процессы клеточной миграции, однако авторы не учитывали фактор РС (Badri, Lama, 2012).
В настоящей работе клетки линии DF-2 были кратковременно (24 ч) помещены в ростовую среду с концентрацией сыворотки 1% без добавления факторов, стимулирующих жизнеспособность и пролиферацию клеточной культуры. Это было сделано, чтобы избежать нежелательного влияния сыворотки в связи с возможными колебаниями ее свойств. Известно, что сыворотка, с одной стороны, является необходимым компонентом для нормальной жизнедеятельности клеточных популяций in vitro в отсутствие интегральных систем организма, а с другой стороны, являясь нестандартным компонентом ростовой среды, может способствовать изменению клеточных характеристик. Одним из важных ингредиентов сыворотки являются ростовые факторы, способствующие активной пролиферации клеток. Их количество может зависеть от источника получения сыворотки, от концентрации сыворотки в ростовой среде, от условий содержания животных и метода получения конкретной серии сыворотки (Полянская и др., 2019).
Учитывая возможное существенное влияние процентного содержания одной серии сыворотки на исследуемые клеточные характеристики, мы провели предварительное сравнительное исследование характера клеточной подвижности (средней скорости и извилистости клеточных движений) при кратковременном культивировании клеток в ростовой среде, содержащей 10, 5 и 1% сыворотки.
Таким образом, задачи настоящей работы на клетках линии DF-2 были следующими. 1) Проведение количественного анализа активности β-галактозидазы в процессе длительного культивирования; 2) сравнительный анализ клеточной подвижности при 24-часовом культивировании клеток в условиях разного содержания сыворотки (10, 5 и 1%); 3) сравнительный анализ клеточной подвижности и структуры актинового цитоскелета на разных стадиях РС клеток в контроле и при действии активатора или ингибитора малой ГТФзы RhoA.
МАТЕРИАЛ И МЕТОДИКА
Клетки и агенты, действующие на Rho-сигналинг. В работе использовали линию мезенхимных стволовых клеток человека, полученных из кожи век 45-летнего здорового донора (DF-2). Клеточная линия получена и охарактеризована в ЦКП “Коллекция культур клеток позвоночных” ИНЦ РАН (Санкт-Петербург). Клетки исследуемой линий культивировали в ростовой среде, содержащей 90% среды DMEM/F12 (Биолот, Россия) и 10% эмбриональной бычьей сыворотки (FBS) (Hyclone, США). Клеточную линию культивировали в условиях 5% СО2 при 37°С и влажности 90%. Микробиологический анализ подтвердил отсутствие бактериальной, грибковой и микоплазменной контаминации в полученной линии.
В эксперименте по влиянию сыворотки на подвижность на 8-ом пассаже ростовую среду заменяли на такую же, содержащую 1, 5 или 10% FBS. В случаях с низким содержанием сыворотки (1 или 5%) не использовали никакие добавки, влияющие на клетки. В остальных экспериментах по влиянию ингибитора и активатора Rho-сигналинга на клеточные процессы в контрольной группе никакие дополнительные вещества в среду не вводили, а в экспериментальных группах в среду, содержащую 1% сыворотки, вводили модуляторы Rho-сигналинга: LPA (Sigma-Aldrich, США) в концентрации 1 нг/мл для активации LPA-рецепторов или Y-27632 (Sigma-Aldrich, США) в концентрации 10 мкМ для ингибирования ROCK1. Для иммунофлуоресцентного анализа клетки культивировали с веществами-модуляторами в течение 1 ч, после чего фиксировали и окрашивали. Для анализа клеточной подвижности клетки культивировали с веществами-модуляторами и красителем Hoechst 33342 (для прижизненной визуализации ядер) в течение 1 ч, а затем производили съeмку в течение 24 ч. Таким образом, суммарное время культивирования с веществами-модуляторами в процессе анализа клеточной подвижности составляло 25 ч.
Морфологический анализ. Для анализа клеток исследуемой линии использовали изображения, полученные с помощью платформы для конфокальной микроскопии, цитометрии и высокоинформативного скрининга CQ1, оснащeнной объективами с увеличением 20× и 40× (Yokogawa, Япония).
Репликативное старение клеток. Оценивали активность фермента β-галактозидазы. Клетки выращивали в чашках Петри диаметром 3.5 см (Nunc, Дания) до образования субконфлюента. Затем среду удаляли и окрашивали клетки с помощью набора реактивов Senescence β-galactosidase staining kit (Cell Signaling, США) согласно инструкции. У клеток, вступающих в фазу активного РС, цитоплазма окрашивается в ярко синий цвет. Анализ проводили с помощью инвертированного микроскопа (Nicon, Япония) на 8-, 12-, 13-, 17-, 20- и 28-ом пассажах. Долю окрашенных клеток определяли в % при подсчете не менее 700 клеток в разных полях зрения на одну временную точку.
Конфокальная микроскопия для визуализации структуры актинового цитоскелета. Клетки DF-2, выращенные на покровных стeклах, фиксировали 10 мин 3%-ным раствором параформальдегида на PBS при комнатной температуре. Для пермеабилизации клетки обрабатывали 10 мин раствором 0.1%-ного Triton-X100 в PBS. Для окрашивания актинового цитоскелета клетки инкубировали 20 мин в PBS, содержащем 50 мкг/мл родамин-фаллоидина (Thermo Fisher Scientific, США). Ядра клеток окрашивали красителем Hoechst 33342 в концентрации 1.5 мкг/мл (Thermo Fisher Scientific, США). После каждого этапа окрашивания клетки трижды промывали PBS. Полученный препарат монтировали на предметное стекло с помощью заключающей среды ProLong Gold Antifade Mountant (Thermo Fisher Scientific, США). Изображения окрашенных клеток получали с помощью конфокального лазерного сканирующего микроскопа Leica TSC SP8 (Leica, Германия), используя объектив 63× с масляной иммерсией (числовая апертура 1.4). Для возбуждения флуоресценции родамин-фаллоидина использовали HeNe-ый лазер (543 нм), а для возбуждения флуоресценции Hoechst 33342 – диодный лазер (405 нм). Флуоресценцию детектировали с помощью фотоумножителей в диапазонах: 552–792 нм для родамин-фаллоидина и 410–500 нм для Hoechst 33342. Диаметр конфокальной точечной диафрагмы (пинхол) составлял 100 мкм. Производили раздельное сканирование в двух каналах (родамин-фаллоидин, Hoechst 33342). Изображения, полученные в красном канале (родамин-фаллоидин), использовали для оценки локальной связной фрактальной размерности актинового цитоскелета.
Оценка локальной связной фрактальной размерности актинового цитоскелета. Чтобы охарактеризовать структуру актинового цитоскелета, оценивали коэффициент локальной связной фрактальной размерности (local connected fractal dimension – LCFD) клеток, окрашенных на F-актин и распластанных на стeклах, по изображениям (на оптических срезах), полученных с помощью конфокальной микроскопии. В отличие от глобальной фрактальной размерности, которую рассчитывают для всего изображения, набор значений локальной фрактальной размерности рассчитывается для каждого принадлежащего анализируемому объекту пикселя (Waliszewski, 2016). Измерение коэффициента LCFD является косвенной мерой для количественной оценки сложных геометрических объектов, каковым является актиновый цитоскелет распластанной клетки при монослойном культивировании (Qian et al., 2012; Alhussein et al., 2016; Bobkov et al., 2020). Этот коэффициент изменяется в диапазоне от 0 до 2 в зависимости от степени сложности структуры (от количества деталей в структуре): для точки он равен нулю, для линии – единице, а для поверхности – двум. LCFD актинового цитоскелета вычисляли с помощью плагина FracLac в программе ImageJ (Karperien, 2013). Использовали конфокальные изображения с разрешением 1024 × 1024 пикселя, полученные при регистрации сигнала от родамин-фаллоидина, на которых вручную выделяли области интереса с помощью функции ROI (n = 20 для каждой группы наблюдений), содержащие распластанные клетки. В этих же ROI производили измерение площади.
Измерение клеточной подвижности. Исследовали живые подвижные клетки. Сравнительный анализ характеристик движения клеток в процессе РС проводили с использованием покадровой визуализации. Для регистрации движения отдельных клеток использовали платформу для конфокальной микроскопии и автоматической цитометрии CQ1 (Yokogawa, Япония) с технологией вращающегося диска. Изображения в проходящем свете (светлое поле) и флуоресценцию Hoechst 33 342 регистрировали в течение 24 ч каждые 15 мин с использованием лазера с длиной волны 405 нм и сухого объектива 40× (числовая апертура 0.95). Все изображения имели размер 2528 × 2136 пикселей с физическим размером пикселя 0.6667 мкм по осям x и y. В программе ImageJ (Rueden et al., 2017) наборы координат x–y получали из изображений с помощью плагина Manual Tracking. Каждую клетку вручную помечали в середине ядра в каждый момент времени (N = 100 для каждой группы измерений). Анализировали только клетки, удовлетворяющие следующим условиям: клетка находится в поле зрения на всех кадрах одного поля зрения; клетка на протяжении всего периода наблюдений не подвергается делению и не входит в апоптоз. Траектории клеточных движений (треки) объединяли в наборы данных, сохраняли в виде файлов (*.csv) и затем передавали для анализа траекторий в свободную программную среду R. Траектории анализировали с использованием функций пакета trajr (McLean, Skowron Volponi, 2018), который был разработан для численного описания и анализа траекторий движущихся животных, но также подходит и для анализа движущихся клеток (Bobkov et al., 2020). Для описания характера движения клетки вычисляли параметры: средняя скорость, извилистость трека.
Методы статистического анализа. Сбор данных для статистической обработки производили с помощью электронных таблиц Office Excel 2016 (Microsoft, США). Cтатистическую обработку результатов осуществляли в свободной программной среде R версии 4.2.0 (R Core Team, 2022). Полученные в результате измерения активности β-галактозидазы данные обрабатывали статистически с использованием t-критерия Стьюдента для альтернативной изменчивости. Для графического отображения данных, полученных при измерении площадей клеток, рассчитывали средние значения и стандартные ошибки среднего, специальных тестов для выявления отличий не проводили. Данные, полученные при анализе LCFD, прошли тест Шапиро−Уилка (Shapiro, Francia, 1972) на нормальность распределения, поэтому для выявления достоверных отличий между группами измерений использовали параметрический односторонний t-критерий Стьюдента (Sandon, 1943). Данные, полученные при анализе клеточной подвижности, не прошли тест Шапиро−Уилка на нормальность распределения, поэтому для выявления достоверных отличий между группами измерений использовали непараметрический критерий Вилкоксона (Wilcoxon, 1945). Различия считали достоверными при вероятности нулевой гипотезы Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
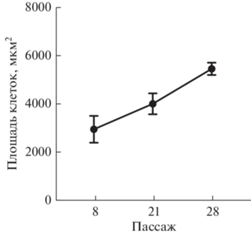
Морфология клеток. Морфологический анализ показал однородность клеточных популяций DF-2, представленных средними по размеру вытянутыми фибробластоподобными клетками (рис. 1). Культивирование с 8-го по 28-ой пассаж сопровождалось почти двукратным увеличением средней площади распластанных клеток (рис. 2). Тенденция МСК к увеличению размеров и распластанности в процессе РС была наглядно продемонстрирована в работах, рассмотренных нами в обзорной статье (Бобков, Полянская, 2020).
Рис. 1.
Однородность клеточных популяций в процессе репликативного старения. Прижизненные конфокальные изображения клеток линии DF-2, выращенных в лунках планшета и культивируемых в течение 24 ч в присутствии 1% сыворотки. Показаны клетки, помещeнные в автоматический конфокальный цитометр на пассажах 8, 21 и 28 в начале эксперимента (0 мин) и в его конце (1440 мин). Ядра клеток окрашены красителем Hoechst 33342. Треки отслеживали по движению центра ядра. Стрелки указывают на двигающиеся клетки, треки движений которых обозначены цветными линиями. Масштабный отрезок: 200 мкм.

Рис. 2.
Увеличение площади клеток линии DF-2 вследствие РС. Показаны средние значения и их стандартные ошибки.
Репликативное старение. Процесс РС клеток линии DF-2 оценивали по активности β-галактозидазы в клеточных популяциях (табл. 1). Уже на 8-ом пассаже обнаружена небольшая доля стареющих клеток, которая существенно увеличивается к 28-му пассажу. Процесс РС в клетках DF-2 протекает быстро, и к 17-му пассажу доля стареющих клеток увеличивается более чем в 5 раз по сравнению с пассажем 8, что свидетельствует о наступлении стадии активного РС.
Таблица 1.
Доля клеток DF-2 (%) с выраженной активностью β-галактозидазы (β-гал) в процессе культивирования
| Пассаж | Число проанализированных клеток | Доля клеток, окрашенных на β-гал, % |
|---|---|---|
| 8 | 803 | 3.70 ± 0.67 |
| 12 | 1066 | 7.20 ± 0.80 |
| 13 | 748 | 12.70 ± 1.22 |
| 17 | 1132 | 23.90 ± 0.26 |
| 20 | 1557 | 26.50 ± 1.25 |
| 28 | 1324 | 43.10 ± 1.36 |
Клеточная подвижность. Увеличение концентрации сыворотки в среде культивирования от 1 до 10% приводило к увеличению средней скорости движения клеток DF-2, но при этом не влияло на извилистость треков (рис. 3). Однако даже при минимальной концентрации сыворотки (1%) как молодые клетки (на пассаже 8), так и клетки в стадии активного РС (на пассажах 21, 28) сохраняли фибробластоподобную форму и оставались подвижными на протяжении 24 ч (рис. 1).
Рис. 3.
Увеличение концентрации сыворотки приводит к ускорению движения клеток DF-2 (а), но при этом не влияет на извилистость треков (б). Клетки выращивали в лунках планшета и культивировали в течение 24 ч в присутствии 1, 5 и 10% сыворотки. В каждой группе измерений анализировали 150 клеток. Показаны средние значения и стандартные отклонения (вертикальные отрезки) значений средней скорости и извилистости. Звездочки показывают достоверность отличий (односторонний тест Уилкоксона): *P < 0.05; ****P < 0.0001; ns – достоверных отличий нет.
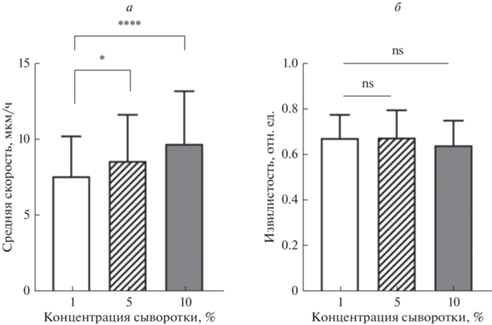
Ряд исследований свидетельствует о влиянии качественного и количественного состава сыворотки на свойства разных клеточных линий при культивировании от нескольких суток до нескольких месяцев (Полянская, 1993; Bieback et al., 2009; Liu et al., 2015; Khasawneh et al., 2019; Toranova et al., 2021). В одной из работ было показано, что снижение содержания сыворотки до 4% при культивировании в течение нескольких суток выборочно влияет на клеточные свойства: не приводит к изменениям клеточной адгезии и скорости заживления раны при воздействии ингибитором Y-27632, но изменяет пролиферативную активность и ряд других параметров (Pipparelli et al., 2013). Таким образом, полученные нами результаты по клеточной подвижности при кратковременном культивировании клеточной культуры (24 ч) в присутствии разных концентраций сыворотки не противоречат ранее полученным данным. Эти результаты свидетельствуют о том, что при всех концентрациях сыворотки, включая 1%, клеточная подвижность присутствует, что является подходящим условием для эксперимента по влиянию модуляторов Rho-сигналинга на клеточную подвижность, результаты которого представлены на рис. 4.
Рис. 4.
Модуляторы Rho-сигналинга не вызывают изменений скорости клеток DF-2 на 8-ом пассаже, но оказывают влияние на поздних пассажах. Представлены результаты измерения средней скорости (а) и извилистости треков (б) клеток, выращенных в лунках планшета и культивируемых в течение 24 ч в присутствии 1% сыворотки (контроль, белые столбцы), а также при добавлении в среду 1 нг/мл LPA (заштрихованные столбцы) или 10 мкМ Y-27632 (темные столбцы). В каждой группе измерений анализировали 150 клеток. Даны средние значения и стандартные отклонения (вертикальные отрезки). Звeздочки показывают достоверность отличий (односторонний тест Уилкоксона): *P < 0.05, **P < 0.01, *** P < 0.001, ****P < 0.0001; ns – достоверных отличий нет.
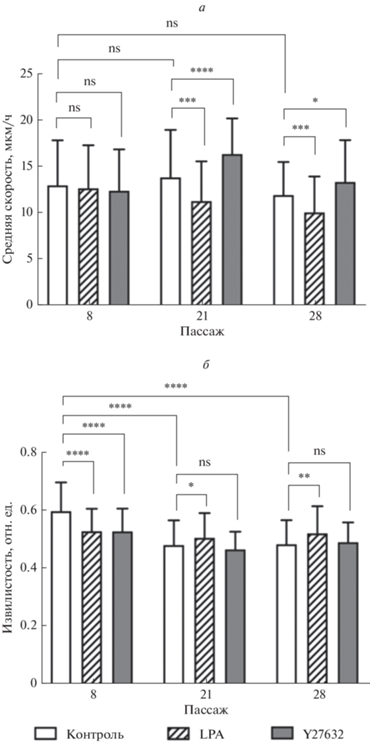
Результаты эксперимента показали, что модуляторы Rho-сигналинга не вызывают значимых изменений скорости клеток DF-2 на 8-ом пассаже, но оказывают влияние на поздних пассажах. Воздействие LPA вызывало снижение средней скорости движения клеток на пассажах 21 и 28 по сравнению с контролем (рис. 4а), воздействие ингибитора Rho-киназы Y-27632 вызывало достоверное увеличение средней скорости движения клеток на пассажах 21 и 28 по сравнению с контролем (рис. 4а). Такие результаты можно объяснить тем, что модификация активности сигнальных путей, ассоциированных с ГТФазой RhoA, приводят к изменениям как количества стресс-фибрилл и клеточных ламелл, так и способности клеток к адгезии.
В то же время были выявлены различия в извилистости клеточных треков между пассажами: на 8-ом пассаже LPA вызывала снижение этого параметра по сравнению с контролем, а на пассажах 21 и 28, наоборот, – увеличение; на 8-ом пассаже Y-27632 увеличивал извилистость относительно контроля, а на пассажах 21 и 28 уже не влиял. При этом следует отметить, что значимых отличий по средней скорости движения между контрольными клетками на пассажах 8, 21 и 28 не было выявлено (рис. 4а), т.е. РС клеток DF-2 не снижает клеточную подвижность. Однако были выявлены отличия по извилистости треков контрольных клеток: на пассажах 21 и 28 этот параметр был достоверно меньше, чем на пассаже 8 (рис. 4б). По-видимому, снижение скорости движения МСК в процессе РС не является обязательной характеристикой РС, тогда как обязательным признаком РС являются изменения характера клеточной подвижности.
Эти результаты согласуются с полученными нами ранее на клеточной линии MSCWJ-1, на которой показано отсутствие различий средней скорости движения клеток между пассажами 9 и 28 (Bobkov et al., 2020). При этом характер изменений внутриклеточной локализации RhoA в процессе РС совпадает в клетках линий MSCWJ-1 и DF-2 при культивировании в среде с 10% сыворотки (Bobkov et al., 2022). По результатам влияния модулирующих Rho-сигналинг агентов на подвижность клеток DF-2 в процессе РС можно заключить, что чувствительность актинового цитоскелета МСК к действию этих агентов зависит от пассажа – более чувствительными оказываются старые клетки.
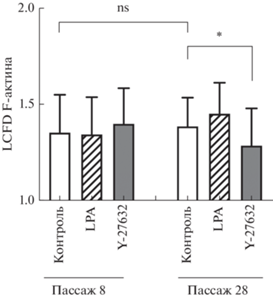
Локальная связная фрактальная размерность (LCFD) актинового цитоскелета. Для того чтобы проверить предположение об изменениях структуры актинового цитоскелета, сопутствующих изменениям характера клеточной подвижности, мы проанализировали коэффициент LCFD актинового цитоскелета при культивировании клеток линии DF-2 на пассажах 8 и 28 (рис. 5, 6). Приведенные на рис. 5 конфокальные изображения клеток демонстрируют, что на 28-ом пассаже под действием Y-27632 в клетках снижается количество стресс-фибрилл и увеличивается количество ламелл. И действительно, измерения коэффициента LCFD для пассажей 8 и 28 свидетельствуют о его достоверном снижении по сравнению с контролем только на пассаже 28. LPA на 28-ом пассаже вызывала увеличение LCFD F-актина на уровне статистической тенденции. На 8-ом пассаже оба вещества не оказали влияния на LCFD F-актина (рис. 6).
Рис. 5.
Изменение организации актинового цитоскелета в клетках DF-2 при действии активатора (10 нг/мл LPA) или ингибитора (10 мкМ Y-27632) RhoA-ассоциированного сигнального пути зависит от пассажа культивирования клеток (стадии репликативного старения). Конфокальные изображения клеток, выращенных на стeклах и зафиксированных на 8-ом, 14-ом и 28-ом пассажах. Клетки окрашены красителем Hoechst 33342 для визуализации ядер и родамин-фаллоидином для окраски F‑актина. Стрелка (пассаж 28) указывает на клетку, в которой снижено количество стресс-фибрилл и увеличено количество ламелл. Масштабный отрезок: 25 мкм.
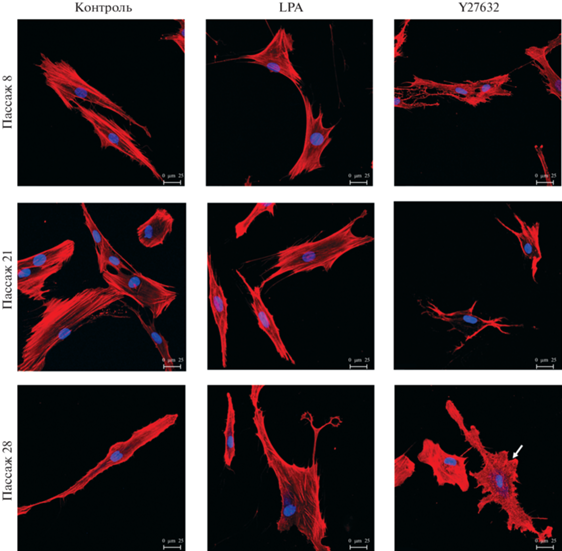
Рис. 6.
Изменение коэффициента локальной связной фрактальной размерности (LCFD) актинового цитоскелета при действии активатора (LPA) и ингибитора (Y‑27632) Rho-киназы на различных пассажах в процессе репликативного старения клеток линии DF-2. Показаны средние значения и стандартные отклонения (вертикальные отрезки) из 20 независимых измерений. Звездочка показывает достоверность отличий (односторонний t‑тест Стьюдента) при P < 0.05; ns – достоверных отличий нет.
В дальнейшем необходимы дополнительные исследования для прояснения механизма взаимодействия внутриклеточных сигнальных путей, опосредуемых малыми ГТФазами Rho-семейства, такими как RhoA, Rac1 и Cdc42, для регуляции подвижности МСК в процессе РС.
БЛАГОДАРНОСТИВ работе было использовано оборудование ЦКП Института цитологии РАН “Коллекция культур клеток позвоночных”, поддержанного грантом Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2021-683).
Список литературы
Бобков Д.Е., Полянская Г.Г. 2020. Клеточные и молекулярные характеристики репликативного старения мезенхимных стволовых клеток человека. Цитология. Т. 62. № 11. С. 782. https://doi.org/10.31857/S0041377120110036 (Bobkov D.E., Poljanskaya G.G. 2020. Cellular and molecular characteristics of replicative aging of human mesenchymal stem cells. (Review). Tsitologiya. V. 62. P. 782. https://doi.)10.31857/S0041377120110036
Полянская Г.Г., Ефремова Т.Н., Кольцова А.М., Мусорина А.С., Шарлаимова Н.С., Яковлева Т.К. 2019. В кн.: Методическое пособие по работе с клеточными культурами человека и животных. С.-Петербург, ПОЛИТЕХ-ПРЕСС. ISBN 978-5-7422-6602-0. С. 114. (Poljanskaya G.G., Efremova T.N., Koltsova A.M., Musorina A.S., Sharlaimova N.S., Yakovleva T.K. 2019. In: Methodological guide for working with human and animal cell cultures. St. Petersburg, POLYTECH PRESS. ISBN 978-5-7422-6602-0. P. 114.)
Полянская Г.Г. 2018. Сравнительный анализ характеристик линий мезенхимных стволовых клеток человека, полученных в коллекции культур клеток позвоночных (обзор). Клеточные культуры, № 34. С. 3. (Poljanskaya G.G. 2018. Comparative analysis of the lines of human mesenchymal stem cells derived in the collection of cell cultures of vertebrates (review). Collection “Cell cultures”, No. 34. P. 3)
Полянская Г.Г., Ефремова Т.Н., Кольцова А.М., Мусорина А.С., Шарлаимова Н.С., Яковлева Т.К. 2019. Методическое пособие по работе с клеточными культурами человека и животных. Спб.: Изд-во Политехнического ун-та, 114 с. (Poljanskaya G.G., Efremova T.N., Koltsova A.M. Musorina A.S., Sharlaimova N.S., Yakovleva T.K. 2019. Methodical handbook for working with cell cultures of humans and animals. SPb.: Polytechnic Univ. Publishing House. 114 pp.)
Полянская Г.Г., Сизова Л.С., Николаенко Н.С. 1993. Кариотипическая характеристика линии фибробластов кожи индийского мунтжака при культивировании с разными сыворотками. Цитология. Т. 35. Р. 86. (Poljanskaya G.G., Sizova L.S., Nikolaenko N.S. 1993. Karyotypic characteristics of the Indian muntjak skin fibroblast line when cultured with different serums. Tsitologiya. V.35. P. 86.)
Albu S., Kumru H., Coll R., Vives J., Vallés M., Denito- Penalva J., Rodriguez L., Codinach M., Hernández J., Navarro X., Vidal J. 2021. Clinical effects of intrathecal administration of expanded Wharton jelly mesenchymal stromal cells in patients with chronic complete spinal cord injury: a randomized controlled study. Cytotherapy. V. 23. P. 146. https://doi.org/10.1016/j.jcyt.2020.08.008
Alessio N., Pipino C., Mandatori D., Di Tomo P., Ferone A., Marchiso M., Melone M.A.B., Peluso G., Pandolfi A., Galderisi U. 2018. Mesenchymal stromal cells from amniotic fluid are less prone to senescence compared to those obtained from bone marrow: an in vitro study. J. Cell Physiol. https://doi.org/10.1002/jcp.26845
Alhussein G., Shanti A., Farhat I.A.H., Timraz S.B.H., Alwahab N.S.A., Pearson Y.E., Martin M.N., Christoforou N., Teo J.C.M. 2016. A spatiotemporal characterization method for the dynamic cytoskeleton. Cytoskeleton. V. 73. P. 221. https://doi.org/10.1002/cm.21297
Badri L., Lama V.N. 2012. Lysophosphatidic acid induces migration of human lung-resident mesenchymal stem cells through the β-catenin pathwayю Stem cells. V. 30. P. 2010. https://doi.org/10.1002/stem.1171
Bieback K., Hecker A., Kocaömer A., Lannert H., Schallmoser K., Strunk D., Klüter H. 2009. Human alternatives to fetal bovine serum for the expansion of mesenchymal stromal cells from bone marrow. Stem Cells. V.27. P.2331. https://doi.org/10.1002/stem.139
Bobkov D., Polyanskaya A., Musorina A., Lomert E., Shabelnikov S., Poljanskaya G. 2020. Replicative senescence in MSCWJ-1 human umbilical cord mesenchymal stem cells is marked by characteristic changes in motility, cytoskeletal organization, and RhoA localization. Mol. Biol. Rep. V. 47. P. 3867. https://doi.org/10.1007/s11033-020-05476-6
Bobkov D., Polyanskaya A., Musorina A., Poljanskaya G. 2022. The RhoA nuclear localization changes in replicative senescence: new evidence from in vitro human mesenchymal stem cells studies. BIOCELL. V. 46. P. 2053. https://doi.org/10.32604/biocell.2022.019469
Diao Y.-M., Hong J. 2015. Rho-associated protein kinase inhibitor, Y-27632, significantly enhances cell adhesion and induces a delay in G1 to S phase transition in rabbit corneal endothelial cells. Mol. Med. Rep. V.12. P. 1951. https://doi.org/10.3892/mmr.2015.3628
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. Int. Soc. Cell. Ther. Pposition statement. Cytother. V. 8. P. 315.
Facchin F., Bianconi E., Romano M., Impellizzeri A., Alviano F., Maioli M., Canaider S., Ventura C. 2018. Comparison of oxidative stress effects on senescence patterning of human adult and perinatal tissue-derived stem cells in short and long-term cultures. Int. J. Med Sci. V. 15. P. 1486.
Geissler S., Textor M., Kühnisch J., Könnig D., Klein O., Ode A., Pfitzner T., Adjaye J., Kasper G., Duda G.N. 2012. Functional comparison of chronological and in vitro aging: differential role of the cytoskeleton and mitochondria in mesenchymal stromal cells. PLoS One. V. 7. P. e52700. https://doi.org/10.1371/journal.pone.0052700
Goncharova D.F., Polyanskaya A.V., Musorina A.S., Poljanskaya G.G., Bobkov D.E. 2021. Analysis of nuclear-cytoplasmic redistribution of actin-binding protein apha-actinin-4 and signaling protein RhoA in the process of replicative senescence of human epicardial adipose tissue-derived ADH-MSC cell line. Cell Tiss. Biol. V. 15. P. 465. https://doi.org/10.1134/S1990519X21050035
Guan Y.T., Xie Y., Li D.S., Zhu Y.Y., Zhang X.L., Feng Y.L., Chen Y.P., Xu L.J., Liao P.F., Wang G. 2019. Comparison of biological characteristics of mesenchymal stem cells derived from the human umbilical cord and decidua parietalis. V. 20. P. 633. https://doi.org/10.3892/mmr.2019.10286
Jin Q., Yuan K., Lin W., Niu C., Ma R., Huang Z. 2019. Comparative characterization of mesenchymal stem cells from human dental pulp and adipose tissue for bone regeneration potential. Artif. Cells Nanomed. Biotechnol. V. 47. P. 1577. https://doi.org/10.1080/21691401.2019.1594861
Karperien A. 2013. FracLac for ImageJ. Charles Sturt University. Colombo. https://doi.org/10.13140/2.1.4775.8402
Khasawneh R.B., Al Sharie A.H., Abu-El-Rub E., Serhan A.O., Obeidat H.N. 2019. Addressing the impact of different fetal bovine serum percentages on mesenchymal stem cells biological performance. Mol. Biol. Rep. V. 46 P. 4437. https://doi.org/10.1007/s11033-019-04898-1
Koltsova A.M. Zenin V.V., Petrosyan M.A., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2021. Isolation and characterization of Mesenchymal Stem Cell Line Derived from different regions of the placenta of the same donor. Cell Tiss. Biol. V. 15. P. 356.
Krylova T.A., Musorina A.S., Zenin V.V., Poljanskaya G.G. 2015. Cellular spheroids obtained from mesenchymal stem cells derived from bone marrow and limb muscle of early human Embryo. Cell Tiss. Biol. V. 9. P. 431.
Larsen M., Tremblay M.L., Yamada K.M. 2003. Phosphatases in cell-matrix adhesion and migration. Nat. Rev. Mol. Cell Biol. V. 4. P 700.
Le Clainche C., Carlier M.F. 2008. Regulation of actin assembly associated with protrusion and adhesion in cell migration. Physiol Rev. V. 88. P. 489.
Li J., Xu S.-Q., Zhao Y.-M., Yu S., Ge L.-H., Xu B.-H. 2018. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Mol. Med. Rep. V. 18. P. 4969. https://doi.org/10.3892/mmr.2018.9501
Li S., Wang C., Dai Y., Yang Y., Pan H., Zhong J., Chen J. 2013. The stimulatory effect of ROCK inhibitor on bovine corneal endothelial cells. Tissue Cell. V. 45. P. 387. https://doi.org/10.1016/j.tice.2013.06.006
Liu Y., Li Y.Q., Wang H.Y., Li Y.J., Liu G.Y. Xu X., Wu X.B., Jing Y.G., Yao Y., Wu C. T., Jin J.D. 2015. Effect of serum choice on replicative senescence in mesenchymal stromal cells. Cytotherapy. V. 17. P. 874. https://doi.org/10.1016/j.jcyt.2015.02.012
Mannino G., Russo C, Longo A., Anfuso C.G., Lupo G., Furno D.L., Giuffrida R., Giurdanella G. 2021. Potential therapeutic applications of mesenchymal stem cells for the treatment of eye diseases. World J. Stem Cells. V. 13. P. 632. https://doi.org/10.4252/wjsc.v13.i6.632
McLean D.J., Skowron Volponi M.A. 2018. trajr: An R package for characterisation of animal trajectories. Ethology. V. 124. P. 440. https://doi.org/10.1111/eth.12739
Moghadasi S., Elveny M., Rahman H.S., Suksatan W., Jalil A. T., Abdelbasset W.K., Yumashev A.V., Shariatzadeh S., Motavalli R., Behzad F., Marofi F., Hassanzadeh A., Pathak Y., Jarahian M. 2021. A paradigm shift in cell-free approach: the emerging role of MSCs-derived exosomes in regenerative medicine. J. Transl. Med. V. 19. P. 302. https://doi.org/10.1186/s12967-021-02980-6
Moujaber O., Fishbein F., Omran N., Liang Y., Colmegna I., Presley J.F, Stochaj U. 2019. Cellular senescence is associated with reorganization of the microtubule cytoskeleton. Cell Mol. Life Sci. V. 76. P. 1169.
Özcan S., Alessio N., Acar M.B., Mert E., Omerli F., Peluso G., Galderisi U. 2016. Unbiased analysis of senescence associated secretory phenotype (SASP) to identify common components following different genotoxic stresses. Aging (Albany NY). V. 8. P. 1316.
Pipparelli A., Arsenijevic Y., Thuret G., Gain P., Nicolas M., Majo F. 2013. ROCK inhibitor enhances adhesion and wound healing of human corneal endothelial cells. PLoS One. V. 8. P. e62095. https://doi.org/10.1371/journal.pone.0062095
Qian A.R., Li D., Han J., Gao X., Di S.M., Zhang W., Shang P. 2012. Fractal dimension as a measure of altered actin cytoskeleton in MC3T3-E1 cells under simulated microgravity using 3-D/2-D clinostats. IEEE Trans. Biomed. Eng. V. 59. P. 1374. https://doi.org/10.1109/TBME.2012.2187785
R Core Team. 2022. R: A language and environment for statistical computing. In: R Foundation for Statistical Computing. Vienna, Austria. https://www.R-project.org
Raposo L., Lourenço A.P., Nascimento D.S., Rui Cerqueira R., Cardim N., Leite-Moreira A. 2021. Human umbilical cord tissue-derived mesenchymal stromal cells as adjuvant therapy for myocardial infarction: a review of current evidence focusing on pre-clinical large animal models and early human trials. Cytotherapy. V. 23. P. 974. https://doi.org/10.1016/j.jcyt.2021.05.002
Rueden C.T., Schindelin J., Hiner M.C., DeZonia B.E., Walter A.E., Arena E.T., Eliceiri K.W. 2017. Image J2: ImageJ for the next gen- eration of scientific image data. BMC Bioinform. V. 18. P. 529. https://doi.org/10.1186/s12859-017-1934-z
Saleh M., Vaezi A.A., Aliannejad R., Sohrabpour A.A., Kiaei S.Z.F., Shadnoush M., Siavashi V., Aghaghazvini L., Khoundabi B., Abdoli S., Chahardouli B., Seyhoun I., Alijani N., Verdi J. 2021. Cell therapy in patients with COVID-19 using Wharton’s jelly mesenchymal stem cells: a phase 1 clinical trial. Stem Cell Res. Ther. V. 12. P. 410. https://doi.org/10.1186/s13287-021-02483-7
Sandon F. 1943. “Student’s” Collected Papers. Edited by ES Pearson and John Wishart, with a foreword by Launce McMullen. Math. Gaz. V. 27. P. 225.
Semenova E., Grudniak M.P., Machaj E.K., Bocian K., Chroscinska-Krawczyk M., Trochonowicz M, Stepaniec I.M., Murzyn M., Zagorska K.E., Boruczkowski D., Kolanowski T.J., Oldak T., Rozwadowska N. 2021. Mesenchymal stromal cells from different parts of umbilical cord: approach to comparison & characteristics. Stem Cell Rev. Rep. V. 17. P. 1780. https://doi.org/10.1007/s12015-021-10157-3
Sensebé L., Krampera M., Schrezenmeier H., Bourin P., Giordano R. 2010. Mesenchymal stem cells for clinical application. Vox Sang. V. 98. P. 93. https://doi.org/10.1111/j.1423-0410.2009.01227.x
Shapiro S.S., Francia R.S. 1972. An approximate analysis of variance test for normality. J. Am. Stat. Assoc. V. 67. P. 215. https://doi.org/ 481232https://doi.org/10.1080/01621459.1972.10
Shin S., Lee J., Kwon Y., Park K-S., Jeong J-H., Choi S-J., Bang S., Chang J., Lee C. 2021. Comparative proteomic analysis of the mesenchymal stem cells secretome from adipose, bone marrow, placenta and Wharton’s Jelly. Int. J. Mol. Sci. V. 22. P. 845. https://doi.org/10.3390/ijms22020845
Smojver I., Katalinić I., Bjelica R., Dragana Gabrić D., Matišić V., Vilim Molnar V., Primorac D. 2022. Mesenchymal stem cells based treatment in dental medicine: a narrative review. Int. J. Mol. Sci. V. 23. P. 1662. https://doi.org/10.3390/ijms23031662
Stanko P., Kaiserova K., Altanerova V., Altaner C. 2014. Comparison of human mesenchymal stem cells derived from dental pulp, bone marrow, adipose tissue, and umbilical cord tissue by gene expression. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub. V. 158. P. 373. https://doi.org/10.5507/bp.2013.078
Su J., Ge X., Jiang N., Zhang Z., Wu X. 2022. Effecacy of mesenchymal stem cells from human exfoliated deciduous teeth and their derivatives in inflammatory diseases therapy. Curr. Stem Cell Res. Ther. Online ahead of print. https://doi.org/10.2174/1574888X17666220417153309
Sun H., Shi C., Ye Z., Yao B., Li C., Wang X., Qian Q. 2022. The role of mesenchymal stem cells in liver injury. (review). Cell Biol. Int. V. 46. P. 501. https://doi.org/10.1002/cbin.11725
Tai C., Wang L., Xie Y., Gao T., Huang F., Wang B. 2021. Analysis of key distinct biological characteristics of human placenta-derived mesenchymal stromal cells and individual heterogeneity attributing to donors. Cells Tiss. Organs. V. 210. P. 45. https://doi.org/10.1159/000513038
Terunuma A., Ashiba K., Takane T., Sakaguchi Y., Terunuma H. 2019. Comparative transcriptomic analysis of human mesenchymal stem cells derived from dental pulp and adipose tissues. J. Stem Cells Regen. Med. V. 15. P. 8. https://doi.org/10.46582/jsrm.1501003
Toranova P., Lochovska K., Pytlik R., Kalbasova M. 2021. The impact of various culture conditions on human mesenchymal stromal cells metabolism. Stem Cells Int. V. 2021. Article ID 6659244. https://doi.org/10.1155/2021/6659244
Turinetto V., Vitale E., Giachino C. 2016. Senescence in human mesenchymal stem cells: functional changes and implications in stem cell-based therapy. Int. J. Mol. Sci. V. 17. P. 1164. https://doi.org/10.3390/ijms17071164
Voronkina I.V., Smagina L.V., Bildyug N.B., A. S. Musorina N.B., Poljanskaya G.G. 2020. Dynamics of matrix metalloproteinase activity and extracellular matrix proteins content in the process of replicative senescence of human mesenchymal stem cells. Cell Tiss. Biol. V. 14. P. 349.
Voronkina I.V., Smagina L.V., Krylova T.A., Musorina A.S., Poljanskaya G.G. 2017. Analysis of matrix metalloproteinase activity during differentiation of mesenchymal stem cells isolated from different tissues of one donor. Cell Tiss. Biol. V. 11. P. 95.
Waliszewski P. 2016. The quantitative criteria based on the fractal dimensions, entropy, and lacunarity for the spatial distribution of cancer cell nuclei enable identification of low or high aggressive prostate carcinomas. Front. Physiol. V. 7. P. 34. https://doi.org/10.3389/fphys.2016.00034
Wang D., Jang D.J. 2009. Protein kinase CK2 regulates cytoskeletal reorganization during ionizing radiation-induced senescence of human mesenchymal stem cells. Cancer Res. V. 69. P. 8200.
Wilcoxon F. 1945. Individual comparisons by ranking methods. Biometrics Bull. V. 1. P. 80. https://doi.org/10.2307/3001968
Xiao Z., Lei T., Liu Y., Yang Y., Bi W., Du H. 2021. The potential therapy with dental tissue-derived mesenchymal stem cells in Parkinson’s disease. Stem Cell Res. Ther. V. 12. P. 5. https://doi.org/10.1186/s13287-020-01957-4
Yang C., ChenY., Zhong L., You M., Ya Z., Luo M., Zhang B., Yang B., Chen Q. 2019. Homogeneity and heterogeneity of biological characteristics in mesenchymal stem cells from human umbilical cords and exfoliated deciduous teeth. Biochemistry and Cell Biology. V. 98. P. 415. https://doi.org/10.1139/bcb-2019-0253
Yigitbilek F., Conley S.M., Tang H., Saadiq I.M., Jordan K.L., Lerman L.O., Taner T. 2021. Comparable in vitro function of human liver-derived and adipose tissue-derived mesenchymal stromal cells: implications for cell-based therapy. Front. Cell Dev. Biol. V. 9. P. 641792. https://doi.org/10.3389/fcell.2021.641792
Zhang X., Li N., Zhu Y., Wen W. 2022. The role of mesenchymal stem cells in the occurrence, development, and therapy of hepatocellular carcinoma. (Review). Cancer Med. V. 11. P. 931. https://doi.org/10.1002/cam4.4521
Дополнительные материалы отсутствуют.


