Цитология, 2022, T. 64, № 5, стр. 478-484
Подавление экспрессии молекулярных шаперонов как фактор повышения эффективности противоопухолевой терапии
М. А. Микеладзе 1, Е. Р. Михайлова 1, Б. А. Маргулис 1, И. В. Гужова 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: irina.guzhova@incras.ru
Поступила в редакцию 27.05.2022
После доработки 21.06.2022
Принята к публикации 22.06.2022
- EDN: LRLMSO
- DOI: 10.31857/S0041377122050066
Аннотация
Современные методы противоопухолевой химиотерапии не способны уничтожить 100% клеточной популяции. Применение современных методов химиотерапии сдерживается повышенной эффективностью систем клеточной защиты раковых клеток, в частности молекулярных шаперонов, экспрессия которых возрастает при применении противоопухолевых препаратов. Комбинационная терапия с ингибиторами отдельных шаперонов, в частности Hsp70, или фактора HSF1, регулирующего синтез белков теплового шока, может стать средством для повышения действенности противоопухолевых препаратов. В настоящем исследовании мы сравнили эффект повышения чувствительности клеток аденокарциномы легкого А549 при подавлении активности Hsp70 или HSF1 в опухолевых клетках. Получив, с помощью метода РНК-интерференции сублинии A549-shHsp70 и A549-shHSF1 мы сравнили их чувствительность к действию противоопухолевых препаратов – этопозиду и оксалиплатину. Подавление функции Hsp70 и снижение активности HSF1 увеличивали количество погибших клеток и повышали активность каспазы-3/7, причем эффект инактивации HSF1 значительно превосходил результаты ингибирования Hsp70. Мы можем сделать вывод, что ингибиторы HSF1 имеют терапевтическую перспективу, будучи в составе противоопухолевых композиций.
Клетки многих опухолей человека демонстрируют высокий уровень молекулярных шаперонов, или белков теплового шока, в частности Hsp70 (Ciocca, Calderwood, 2005), что ведет к тому, что эти клетки более активно пролиферируют, охотнее метастазируют и обладают повышенной устойчивостью к противоопухолевым препаратам (Carpenter, Gökmen-Polar, 2019). В норме молекулярные шапероны обеспечивают правильную конформацию и, соответственно, функцию клеточных белков, транспортировку вновь синтезированных белков к местам клеточной локализации, где им надлежит исполнять их функцию (Вalchin et al., 2016).
Экспрессия всех белков теплового шока регулируется транскрипционным фактором HSF1 (heat shock factor-1), который активируется в ответ на окислительный стресс, нагрев, гипоксию, УФ-излучение и другие воздействия (Li et al., 2017; Gomez-Pastor et al., 2018). В ходе развития опухолевого процесса HSF1 находится в постоянно активном состоянии и играет плейотропную роль, поддерживая злокачественность опухолевых клеток, т.е. увеличение их миграционной способности, повышение инвазивности и пролиферативного потенциала раковых клеток (Mendillo et al., 2012). Высокий уровень HSF1 способствует развитию опухолевых клеток за счет координации ряда фундаментальных клеточных процессов, включая метаболизм глюкозы, контроль клеточного цикла, трансляцию белков и биогенез рибосом (Willmund et al., 2013; Jagadish et al., 2016; Albakova et al., 2020). Во многих исследованиях было показано, что уровень экспрессии HSF1 определял злокачественность новообразования у пациентов с разными типами рака и определял чувствительность опухолей к химиопрепаратам. Именно поэтому были предприняты попытки разработать низкомолекулярные ингибиторы для снижения активности HSF1 и снижения шаперонной активности Hsp70 и Hsp90 для подавления резистентности опухолевых клеток к химиопрепаратам. В настоящее время существует примерно 20 ингибиторов Hsp90, часть из которых проходит клинические испытания (Zuehlke et al., 2018; Zininga, Shonhai, 2019), не менее 10 ингибиторов Hsp70, включая выявленную в нашей лаборатории производную колхицина АЕАС (Lazarev et al., 2018) и 14 ингибиторов HSF1 (Carpenter, Gökmen-Polar, 2019), включая открытый нами карденолид CL-43 (Nikotina et al., 2018).
Мы задались вопросом, что является более эффективным средством для противоопухолевой терапии – выведение из строя отдельных шаперонов, которые являются непосредственными участниками процесса, или регулятора их экспрессии HSF1? Целью настоящего исследования стал ответ на этот вопрос.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Клетки немелкоклеточного рака легкого A549 дикого типа (A549wt) и иммортализованные клетки эмбриональной почки человека HEK-293T культивировали в среде DMEM, содержащей 10% бычьей эмбриональной сыворотки (FBS, Gibco, США), 2 мМ L-глутамина и антибиотики пенициллин (100 ед./мл) и стрептомицин (0.1 мг/мл) (БиолоТ, Россия) при 37°C и 5% CO2.
Все клеточные культуры были получены из Российской коллекции клеточных культур (ИНЦ РАН, Санкт-Петербург).
Трансферная плазмида pGFP-C-shLenti для нокдауна Hsp70 и его мастер-регулятора HSF1 была приобретена у OriGene (США): клоны TRCN0000008513 (shРНК против HSPA1A (Hsp70)); последовательность, кодирующую зрелую смысловую последовательность TTGATGCTCTTTGTTCAGGTCG, TRCN0000280463 или TRCN0000007481 (shРНК против Hsf1); последовательность, кодирующую зрелую смысловую последовательность CAAACGTGGAAGCTGTTCC или ATACTTGGGCATGGAATGTGC соответственно. Пакующая плазмида pMD2.G и плазмида вирусной оболочки psPAX были приобритены у Addgene (США).
Клетки HEK-293T трансфицировали с помощью полиэтиленимина (PEI; Sigma, США) смесью всех трех, для получения линии A549-shHsp70, или четырех, для получения линии A549-shHSF1, плазмид. Супернатанты клеточных культур, содержащие лентивирусные частицы, собирали в течение трех дней, после чего вирус концентрировали и высаживали с помощью центрифугирования при 5600 g в 30%-ном растворе полиэтиленгликоля (PEG; Sigma, США) при 4°C. Осажденные вирусы растворяли в 50 мкл бессывороточной среды OptiMEM (Gibco, США) и далее использовали для трансдукции клеток A549. Положительные клоны отбирали в течение 12-суточной селекции на пуромицине (2.0 мкг/мл; Sigma, США) не менее чем за 2 нед. до начала экспериментов. Для анализа чувствительности А549 к химиотерапии в зависимости от уровня белков Hsp70 и (или) HSF1 клетки культивировали в присутствии препаратов оксалиплатин и этопозид в концентрацях 12.5, 25, 50, 100, 150 или 200 мкМ (Pharmachemie, Израиль).
Иммуноблотинг. Нокдаун Hsp70 или HSF1 в клетках A549 верифицировали с помощью Вестерн-блот-анализа. Клетки, полученные с помощью селекции на пуромицине, лизировали на льду в растворе, содержащем 20 мМ TrisHCl pH 7.5, 20 мМ NaCl, 0.01% Тритона X-100, 1 мМ ЭДТА, 1 мМ PMSF. Равные количества белка лизатов (20 мкг/проба) использовали для электрофореза в 11%-ном SDS-полиакриламидном геле и последующего иммуноблотинга. После переноса на PVDF-мембрану неспецифическое связывание блокировали раствором 5%-ного обезжиренного молока в PBS в течение ночи при 4°C. Далее мембрану последовательно инкубировали с антителами против Hsp70 клон 3С5 (Lasunskaia et al., 2010) и HSF1 (Cell Signaling, США). Для контроля нагрузки использовали антитела к тубулину (Thermo Fisher, США). После инкубации с первичными антителами, мембраны промывали раствором PBS, содержащим 0.05% Tween 20 (Sigma-Aldrich, США) и инкубировали с вторыми антителами против иммуноглобулинов мыши и (или) крысы, меченными пероксидазой хрена (Abcam, Великобритания).
Повышение количества белков Hsp70 и HSF1 в раковых клетках после обработки химиопрепаратами также регистрировали с помощью иммуноблотинга. Клетки А549 дикого типа культивировали в присутствии оксалиплатина в концентрации 25, 50 или 100 мкМ или этопозида в концентрации 12.5, 25, 50 или 100 мкМ в течение 24 ч, затем лизировали. Лизаты использовали для электрофореза и Вестерн-блот-анализа. Блот последовательно инкубировали с антителами против Hsp70, HSF1 и тубулина, указанными выше.
МТТ-тест. Токсичность химиотерапевтических препаратов регистрировали по количеству живых клеток с помощью метода определения активности дегидрогеназ по Мосману (МТТ-тест). Клетки A549 с разным уровнем экспрессии Hsp70 или HSF1 инкубировали в лунках 96-луночного планшета с оксалиплатином в концентрации 25, 50, 100 мкМ или с этопозидом в концентрации 12.5, 25, 50, 100 мкМ в течение 48 ч. Далее культуральную среду заменяли на раствор МТТ (1 мг/мл) в PBS (ПанЭко, Россия) из расчета 100 мкл на лунку. Спустя 2 ч, раствор удаляли, а кристаллы формазана, образовавшиеся в живых клетках, растворяли в DMSO (Sigma, США) в течение 15 мин. Оптическую плотность измеряли с помощью прибора Varioscan (Thermo Scientific, США) при длине волны 570 нм.
Анализ ферментативной активности каспазы 3 и 7. Для определения активности эффекторной каспазы 3 и 7 после проведенной химиотерапии использовали каспазный тест. Клетки A549, A549-shHsp70 и A549-shHSF1 рассеивали в лунки 12-луночного планшета в концентрации 3 × 105 кл./мл. После культивирования в присутствии 25, 50, 100 мкМ оксалиплатина или 12.5, 25, 50, 100 мкМ этопозида, в течение 14 ч, клетки центрифугировали при 2000 об./мин, дважды промывали холодным PBS и лизировали в буфере, содержащем 100 мМ HEPES, pH 7.2, 10% сахарозы, 1 мМ EDTA pH 8.0, 0.1% CHAPS и 10 мМ DTT. Лизаты подвергали двум циклам замораживания–оттаивания и осаждали при 13 000 об./мин в течение 10 мин. Лизат, содержащий 200 мкг белка в 50 мкл буфера для лизиса, вносили в лунки черного 96-луночного планшета (ThermoFisher, США) и в каждую лунку добавляли 40 мкМ флуорогенного субстрата (DMQD-AMC; Sigma, США). Планшет инкубировали при 37°C в течение 2 ч. Флуоресценцию детектировали с помощью ридера FluoStar Omega (BMG, Labtech, Великобритания), используя длину волны возбуждения и эмиссии 355 и 460 нм соответственно.
Статистическая обработка. Данные представлены как среднее значение и его стандартная ошибка (SEM). Количественный анализ выполнен с помощью GraphPad Prism 9.3.1. Сравнение проводили с помощью теста однофакторного дисперсионного анализа ANOVA с последующей коррекцией c помощью теста множественного сравнения Дуннета, который позволяет сравнивать каждое среднее значение со всеми другими средними значениями. Все эксперименты повторяли не менее трех раз. Статистическую значимость определяли значением P < 0.05.
РЕЗУЛЬТАТЫ
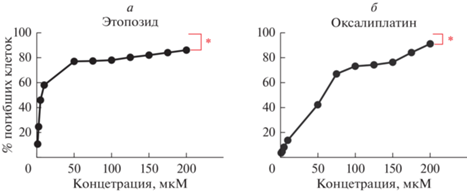
Задачей противоопухолевой терапии является полное уничтожение опухолевых клеток, поскольку в противном случае происходит рецидив опухолевого роста и со временем обнаруживаются опухолевые узлы в отдаленных от первичного очага тканях. Мы проверили, можно ли с помощью противоопухолевых препаратов добиться полного уничтожения опухолевых клеток, и культивировали клетки немелкоклеточного рака легкого А549 в присутствии противоопухолевых препаратов, которые широко применяются в клинике для лечения рака данного гистогенеза – этопозидом и оксалиплатином в увеличивающихся концентрациях. При культивировании в присутствии этопозида в течение 48 ч доля погибших клеток А549 достигала 50% (IC50) при 7.5 мкМ, после чего эффективность препарата снижалась и при дальнейшем повышении концентрации доля мертвых клеток вырастала на 1–3% при каждом повышении концентрации на 25 мкM (рис. 1а). При культивировании в присутствии оксалиплатина величина IC50 составила 66.6 мкM, и тоже, начиная с концентрации 75 мкM, доля погибших клеток увеличивалась на 1–6% при повышении концентрации препарата на 25 мкM (рис. 1б). В результате, в присутствии этопозида в самой высокой концентрации (200 мкМ) оставалось 14.81 ± 0.84% жизнеспособных клеток и 9.08 ± 1.37% при самой высокой (200 мкМ) концентрации оксалиплатина (рис. 1).
Рис. 1.
Концентрации противоопухолевых препаратов, превышающих терапевтическую дозу, не приводит к полной гибели популяции опухолевых клеток. Представлены данные измерения активности лактатдегидрогеназы с помощью набора Cytotox 96 в клетках А549 после обработки в возрастающих концентрациях этопозидом (а) и оксалиплатином (б). Красной звездочкой отмечены выжившие остатки клеточных популяций.
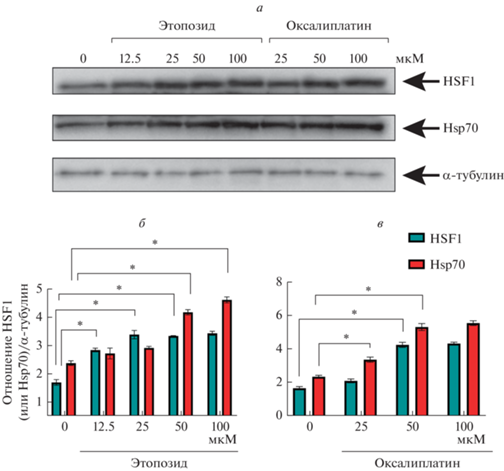
Клетки А549 обладают высоким уровнем экспрессии Hsp70, и мы проверили, как на экспрессию этого шаперона и регулятора его синтеза, HSF1, влияют противоопухолевые препараты этопозид и оксалиплатин. Мы культивировали клетки А549 в присутствии препаратов в повышающейся концентрации (рис. 2) и с помощью иммуноблоттинга определяли в них уровень белков Hsp70 и HSF1. Результаты показали, что уровень обоих белков возрастает дозо-зависимым образом (рис. 2а) и повышается у HSF1в 2 раза в случае действия этопозида и в 3.9 раз в случае оксалиплатина, а у Hsp70 – в 1.94 раза в случае этопозида (рис. 2б) и в 2.3 раза в случае оксалиплатина (рис. 2в).
Рис. 2.
Анализ экспрессии HSF1 и Hsp70 в клетках A549 при применении противоопухолевых препаратов, этопозида и оксалиплатина в возрастающих концентрациях. Представлен иммуноблот клеток A549, инкубированный с антителами против HSF1 и Hsp70 (a) и данные подсчета относительной интенсивности зон HSF1 и Hsp70 к интенсивности α-тубулина для этопозида (б) и оксалиплатина (в). *P < 0.0001.
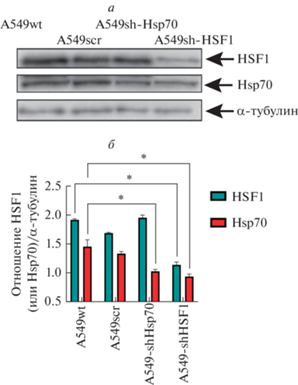
В клинике обычно проводят курсовую терапию, т.е. вводят противоопухолевые препараты внутривенно ежедневно в течение нескольких дней. Очевидно, что каждое последующее введение препарата будет становится менее эффективным, потому что опухолевые клетки приобретают мощную систему защиты в процессе терапии, и целесообразно использовать препараты, которые бы понижали содержание Hsp70 и (или) HSF1. Чтобы понять, подавление какого из этих белков более эффективно, мы получили клетки А549 с нокдауном по Hsp70 и нокдауном по HSF1. Данные иммуноблоттинга показали (рис. 3а), что уровень HSF1 в клетках A549-shHSF1 ниже, чем в клетках A549 в 1.7 раз, уровень Hsp70 в клетках A549-shHsp70 был ниже, чем в клетках A549 в 1.4 раза, а в клетках A549-shHSF1 – в 1.6 раз (рис. 3б).
Рис. 3.
Иммуноблот клеток A549wt, A549scr, A549-shHsp70 и A549-shHSF1 c антителами против HSF1 и Hsp70 (a) и (б) данные подсчета относительной интенсивности зон HSF1 и Hsp70 к интенсивности α-тубулина. *P < 0.0001
Мы проверили, как изменилась чувствительность клеток линий A549-shHSF1 и A549-shHsp70 к этопозиду и оксалиплатину по сравнению с клетками A549wt; для этого клетки культивировали в присутствии противоопухолевых препаратов в возрастающих концентрациях. В анализ также были взяты клетки A549scr, несущие ту же генетическую конструкцию, что и A549-shHSF1 и A549-shHsp70, но без вставки целевого фрагмента. Анализ чувствительности клеток к этопозиду и оксалиплатину был проведен с помощью метода МТТ (рис. 4а, б). Разница в чувствительности к этопозиду у клеток A549-shHsp70 и A549-shHSF1 проявилась уже при наиболее низкой (12.5 мкМ) из используемых концентраций противоопухолевого препарата и была статистически достоверной (P < 0.0001), но начиная с концентрации 25 мкМ доля погибших клеток в клетках A549-shHSF1 была статистически выше (P < 0.0005), чем у клеток A549-shHsp70, и эта тенденция продолжала сохраняться при повышении концентрации препарата (рис. 4а). При действии оксалиплатина мы не выявили повышения чувствительности клеток A549-shHsp70 к противоопухолевому препарату по сравнению с клетками A549wt и A549scr, в то время как клетки A549-shHSF1 приобрели статистически достоверную чувствительность к оксалиплатину (рис. 4б).
Рис. 4.
Подавление HSF1 более эффективно повышает чувствительность клеток А549 к действию противоопухолевых препаратов. Представлены данные теста МТТ клеток A549wt, A549scr, A549-shHsp70 и A549-shHSF1 при применении этопозида (а) и оксалиплатина (б) в возрастающих концентрациях в течение 48 ч, а также активность каспаз 3, 7 для тех же клеток при применении этопозида (в) и оксалиплатина (г). Различия между количеством живых клеток или активностью каспаз 3, 7 в клетках А549wt и А549-shHsp70 или A549-shHSF1 достоверны при *P < 0.0001.
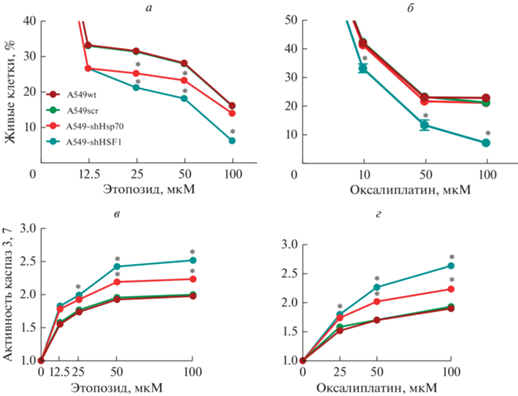
Этопозид и препараты платины вызывают апоптоз опухолевых клеток (Afanasyeva et al., 2007; Hato et al., 2014), и мы измерили уровень ферментативной активности каспаз 3 и 7 (рис. 4в, г) Каспазная активность в клетках A549wt и A549scr после воздействия этопозида или оксалиплатина не отличалась, в то время как уровни каспазной активности у клеток A549-shHsp70 статистически отличались от такового в клетках A549wt и A549scr и в клетках A549-shHSF1 статистически были выше, чем у клеток A549-shHsp70 (рис. 4в, г).
Полученные нами данные убедительно показывают, что подавление одного Hsp70 увеличивает чувствительность опухолевых клеток к действию противоопухолевых препаратов, которые широко используются в клинике, но подавление HSF1 значительно превышает эффект подавления Hsp70, и ингибиторы HSF1 могли бы стать эффективным инструментом в терапевтических схемах при лечении немелкоклеточного рака легкого.
ОБСУЖДЕНИЕ
Два обстоятельства делают многие онкологические заболевания практически неизлечимым – формирование метастазов и способность опухолевых клеток к рецидиву после, казалось бы, успешной терапии (Mitra et al., Li, 2015; Sokolenko et al., 2020). Действительно, после химиотерапии опухоли часто остаются небольшие остатки клеточной популяции. Наш анализ чувствительности панели опухолевых клеток разного гистогенеза к ряду противоопухолевых препаратов, широко применяющихся в клинике, показал, что применение препаратов никогда не приводит к гибели 100% клеток в популяции, т.е., как бы ни была повышена концентрация терапевтического средства, не менее 2–3% клеток остаются живыми. В экспериментах, представленных в данной работе, мы показываем, что даже при увеличении дозы противоопухолевых препаратов этопозида и оксалиплатина выше терапевтической, жизнеспособными остаются 10–15% клеточной популяции.
Для того, чтобы увеличить эффективность противоопухолевой терапии, мы предлагаем использовать ингибиторы функции Hsp70 и активности мастер-регулятора клеточных шаперонов HSF1. В предыдущих исследованиях мы показали, что ингибиторы шаперонной функции АЕАС (производное колхицина) (Lazarev et al., 2018) и ВТ44 (Sverchinsky et al., 2018) повышали чувствительность опухолевых клеток к противоопухолевым препаратам, замедляли рост опухолей меланомы и глиобластомы и увеличивали продолжительность жизни животных-опухоленосителей. Позитивный эффект показал также пептид Hsp70, ICit-2, способный проникать в опухолевые клетки, подавлять шаперонную функцию Hsp70 и усиливать чувствительность опухолевых клеток к действию доксорубицина (Sverchinsky et al., 2017). Мы также использовали ингибитор активности HSF1, выявленный нами в результате высокопроизводительного скриннинга, карденолид CL-43, который не только синергетически увеличивал чувствительность опухолевых клеток к противоопухолевым препаратам (Nikotina et al., 2018), но в режиме монотерапии снижал способность опухолевых клеток к эпителиально-мезенхимному переходу и метастазированию (Nikotina et al., 2021).
Для того чтобы понять, какой подход может быть более значимым в клинике, мы провели данное исследование. Во-первых, мы показали, что препараты, используемые в клинике, повышают уровень и Hsp70, и HSF1, и видимо повышают устойчивость клеток к последующему лечению. Во-вторых, мы получили клетки A549 с подавленной экспрессией как Hsp70, так и HSF1, и выяснили, что именно подавление HSF1 значительно снижает резистентность опухолевых клеток к этопозиду и оксалиплатину, значимо увеличивая активность эффекторных каспаз.
Снижение HSF1 вызывает снижение всех регулируемых им молекулярных шаперонов: Hsp70, Hsp90 и Hsp40 (Nikotina et al., 2018). Нокдаун HSF1 или применение известного ингибитора HSF1 триптолида, который был снят с III фазы клинических испытаний из-за общей токсичности, разрушало цитозольный комплекс между HSF1, p97, Hsp90 и деацетилазой Hsp90, известной как гистондеацетилаза 6 (HDAC6) (Ganguly et al., 2015). Кроме того, HSF1 управляет функцией более 1000 генов, не вовлеченных в ответ клетки на стресс, многие из которых связаны с прогрессией опухоли (Mendillo et al., 2012).
Наши данные свидетельствуют, что для повышения эффективности противоопухолевой терапии лучше использовать ингибиторы HSF1, чем Hsp70.
Список литературы
Afanasyeva E.A., Komarova E.Y., Larsson L.G, Bahram F., Margulis B.A., Guzhova I.V. 2007. Drug-induced Myc-mediated apoptosis of cancer cells is inhibited by stress protein Hsp70. Int. J. Cancer. V. 121. P. 2615. https://doi.org/10.1002/ijc.22974
Albakova Z., Armeev G.A., Kanevskiy L.M., Kovalenko E.I., Sapozhnikov A.M. 2020. HSP70 Multi-functionality in cancer. Cells. V. 9. P. 587. https://doi.org/10.3390/cells9030587
Balchin D., Hayer-Hartl M., Hartl F.U. 2016. In vivo aspects of protein folding and quality control. Science. V. 353. P. 6294. https://doi.org/10.1126/science.aac4354
Carpenter R.L., Gökmen-Polar Y. 2019. HSF1 as a cancer biomarker and therapeutic target. Curr. Cancer Drug Targets. V. 19. P. 515. https://doi.org/10.2174/1568009618666181018162117
Ciocca D.R., Calderwood S.K. 2005. Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatment implications. Cell Stress Chaperones. V. 10 № 2. P. 86–103. https://doi.org/10.1379/csc-99r.1
Ganguly S., Home T., Yacoub A., Kambhampati S., Shi H., Dandawate P., Padhye S., Saluja A.K., McGuirk J., Rao R. 2015. Targeting HSF1 disrupts HSP90 chaperone function in chronic lymphocytic leukemia. Oncotarget. P. 6. P. 31 767. https://doi.org/10.18632/oncotarget.5167
Gomez-Pastor R., Burchfiel E.T., Thiele D.J. 2018. Regulation of heat shock transcription factors and their roles in physiology and disease. Nat. Rev. Mol. Cell Biol. V. 19. P. 4. https://doi.org/10.1038/nrm.2017.73
Hato S.V., Khong A., de Vries I.J., Lesterhuis W.J. 2014. Molecular pathways: the immunogenic effects of platinum-based chemotherapeutics. Clin. Cancer Res. V. 20. P. 2831. https://doi.org/10.1158/1078-0432.CCR-13-3141
Jagadish N., Agarwal S., Gupta N., Fatima R., Devi S., Kumar V., Suri V., Kumar R., Suri V., Sadasukhi T.C., Gupta A., Ansari A.S., Lohiya N.K., Suri A. 2016. Heat shock protein 70-2 (HSP70-2) overexpression in breast cancer. J. Exp. Clin. Cancer Res. V. 35. P. 150. https://doi.org/10.1186/s13046-016-0425-9
Lasunskaia E.B., Fridlianskaia I., Arnholdt A.V., Kanashiro M., Guzhova I., Margulis B. 2010. Sub-lethal heat shock induces plasma membrane translocation of 70-kDa heat shock protein in viable, but not in apoptotic, U-937 leukaemia cells. APMIS. V. 118. P. 179–87. https://doi.org/10.1111/j.1600-0463.2009.02576.x
Lazarev V.F., Sverchinsky D.V., Mikhaylova E.R., Semenyuk P.I., Komarova E.Y., Niskanen S.A., Nikotina A.D., Burakov A.V., Kartsev V.G., Guzhova I.V., Margulis B.A. 2018. Sensitizing tumor cells to conventional drugs: HSP70 chaperone inhibitors, their selection and application in cancer models. Cell Death Dis. V. 9. P. 41. https://doi.org/10.1038/s41419-017-0160-y
Li J., Labbadia J., Morimoto R.I. 2017. Rethinking HSF1 in stress, development, and organismal health. Trends Cell Biol. V. 27. P. 895. https://doi.org/10.1016/j.tcb.2017.08.002
Mendillo M.L., Santagata S., Koeva M., Bell G.W., Hu R., Tamimi R.M., Fraenkel E., Ince T.A., Whitesell L., Lindquist S. 2012. HSF1 drives a transcriptional program distinct from heat shock to support highly malignant human cancers. Cell. V. 150. P. 549. https://doi.org/10.1016/j.cell.2012.06.031
Mitra A., Mishra L., Li S. 2015. EMT, CTCs and CSCs in tumor relapse and drug-resistance. Oncotarget. V. 6. P. 10 697. https://doi.org/10.18632/oncotarget.4037
Nikotina A.D., Koludarova L., Komarova E.Y., Mikhaylova E.R., Aksenov N.D., Suezov R., Kartzev V.G., Margulis B.A., Guzhova I.V. 2018. Discovery and optimization of cardenolides inhibiting HSF1 activation in human colon HCT-116 cancer cells. Oncotarget. V. 9. P. 27268. https://doi.org/10.18632/oncotarget.25545
Nikotina A.D., Vladimirova S.A., Komarova E.Y., Alexeev D., Efremov S., Leonova E., Pavlov R., Kartsev V.G., Polonik S.G., Margulis B.A., Guzhova I.V. 2021. Prevention of High Glucose-Mediated EMT by inhibition of Hsp70 chaperone. Int. J. Mol. Sci. V. 22. P. 6902. https://doi.org/10.3390/ijms22136902
Sokolenko A.P., Bizin I.V., Preobrazhenskaya E.V., Gorodnova T.V., Ivantsov A.O., Iyevleva A.G., Savonevich E.L., Kotiv K.B., Kuligina E.S., Imyanitov E.N. 2020. Molecular profiles of BRCA1-associated ovarian cancer treated by platinum-based therapy: Analysis of primary, residual and relapsed tumors. Int. J. Cancer. V. 146. P. 1879. https://doi.org/10.1002/ijc.32776
Sverchinsky D.V., Lazarev V.F., Semenyuk P.I., Mitkevich V.A., Guzhova I.V., Margulis B.A. 2017. Peptide fragments of Hsp70 modulate its chaperone activity and sensitize tumor cells to anti-cancer drugs. FEBS Lett. V. 591. P. 4074. https://doi.org/10.1002/1873-3468.12913
Sverchinsky D.V., Nikotina A.D., Komarova E.Y., Mikhaylova E.R., Aksenov N.D., Lazarev V.F., Mitkevich V.A., Suezov R., Druzhilovskiy D.S., Poroikov V.V., Margulis B.A., Guzhova I.V. 2018. Etoposide-induced apoptosis in cancer cells can be reinforced by an uncoupled link between Hsp70 and caspase-3. Int. J. Mol. Sci. V. 19. P. 2519. https://doi.org/10.3390/ijms19092519
Willmund F., del Alamo M., Pechmann S., Chen T., Albanèse V., Dammer E.B., Peng J., Frydman J. 2013. The cotranslational function of ribosome-associated Hsp70 in eukaryotic protein homeostasis. Cell. V.152. P. 196. https://doi.org/10.1016/j.cell.2012.12.001
Zininga T., Shonhai A. 2019. Small Molecule inhibitors targeting the heat shock protein system of human obligate protozoan parasites. Int. J. Mol. Sci. V. 20. P. 5930. https://doi.org/10.3390/ijms20235930
Zuehlke A.D., Moses M.A., Neckers L. 2018. Heat shock protein 90: Its inhibition and function. Philos. Trans. R. Soc. Lond. B. Biol. Sci. V. 373. P. 20160527. https://doi.org/10.1098/rstb.2016.0527
Дополнительные материалы отсутствуют.


