Цитология, 2022, T. 64, № 5, стр. 448-456
Локализация теломерсвязывающего белка TRF2 в сперматогенных клетках зимующих лягушек Rana temporaria
А. О. Травина 1, *, П. К. Швец 2, Г. Н. Почукалина 1, О. И. Подгорная 1, 3
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный технологический институт
190013 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный университет, кафедра цитологии и гистологии
199034 Санкт-Петербург, Россия
* E-mail: alotra1@yandex.ru
Поступила в редакцию 18.04.2022
После доработки 23.06.2022
Принята к публикации 23.06.2022
- EDN: RXWZPE
- DOI: 10.31857/S004137712205008X
Аннотация
Теломерная ДНК связана с комплексом белков, который называется шелтерин. Есть данные, свидетельствующие о том, что функции шелтеринового комплекса шире, чем просто защита концов хромосом. Известны примеры необычного распределения компонента шелтерина, теломерсвязывающего белка TRF2, в ооцитах мыши и травяной лягушки Rana temporaria и в сперматозоидах мыши. В настоящей работе исследовали распределение TRF2 в клетках сперматогенного ряда травяной лягушки. Для подтверждения специфичности антител к TRF2 травяной лягушки использовали Вестерн-блот-анализ препаратов семенников. Антитела, отобранные с помощью иммуноблотинга, использовали для определения локализации TRF2 в сперматогониях и сперматозоидах с помощью иммунноэлектронной микроскопии. Показано, что в сперматогониях TRF2 равномерно распределен по ядру. Присутствие TRF2 выявлено в цитоплазме сперматогоний в составе электронноплотных структур. В сперматозоидах часть TRF2 находится в акросоме, что подтверждает универсальность явления для позвоночных.
Теломеры относят к классу тандемных повторов (ТП). С многократно повторяющимися мономерами TTAGGG связан специфический комплекс теломерсвязывающих белков, который называется шелтерин. Шелтерин млекопитающих состоит из белков TRF1, TRF2, TIN2, POT1, TPP1 и RAP1 (de Lange, 2018). Белки TRF1, TRF2 и POT1 непосредственно взаимодействуют с теломерной ДНК (de Lange, 2018). Белок TRF2 обладает высокой степенью гомологии с TRF1. В состав TRF2 входит домен с неизвестными функциями udTRF2, которого нет в составе TRF1. Косвенные данные свидетельствовали о гомологии между доменом udTRF2 и некоторыми участками rod-доменов белков ламинов (Voronin et al., 2003). Работа зарубежных авторов подтвердила взаимодействие между ламином A/C и TRF2 in vivo (Wood et al., 2014).
Мы предполагали, что именно домен udTRF2 отвечает за взаимодействие TRF2 и теломер с ядерной мембраной. С помощью ко-иммунопреципитации рекомбинантного udTRF2 с ядерным экстрактом и последующего масс-спектрометрического анализа мы показали, что TRF2 взаимодействует с ламинами А/С именно через домен udTRF2 (Travina et al., 2021). Масс-спектрометрический анализ также позволил идентифицировать еще 23 белка, связывающих udTRF2 (Travina et al., 2021). Обилие белков свидетельствует либо о неожиданных функциях TRF2, либо о неожиданных функциях всего теломерного комплекса. Определение локализации TRF2 может помочь обосновать предположения об этих функциях.
В последнее время появляются данные, свидетельствующие о несвязанных с теломерами функциях различных компонентов шелтерина, как в соматических, так и в половых клетках. Например, компоненты шелтерина, TRF2 и Rap1 действуют как факторы транскрипции многих генов (Mendez-Bermudez et al., 2018). Известно необычное распределение TRF2 во время гаметогенеза. Почукалина с соавторами показали, что в преовуляторных ооцитах мыши TRF2 демонстрирует динамичное распределение по мере формирования кариосферы (Pochukalina et al., 2016). Авторы выделили 3 стадии формирования кариосферы в соответствии с общепринятой классификацией (Bouniol-Baly et al., 1999). На стадии NSN (non-surrounded nucleolus – не окруженное ядрышко) TRF2 находится в кластерах интерхроматиновых гранул, которые еще называют ядерными спеклами или доменами SC35, и колокализуется с белком SC35 (SRSF2) (Pochukalina et al., 2016). На стадиях pSN (partly surrounded nucleolus – частично окруженное ядрышко) и SN (surrounded nucleolus – окруженное ядрышко) TRF2 перемещается в центральное тело (ЦТ) кариосферы (Pochukalina et al., 2016) или атипичное ядрышко (Fulka, Langerova, 2019).
TRF2 обнаружен в ядерной оболочке и ядерных спеклах ооцита лягушки R. temporaria (Bugaeva, Podgornaya, 1997; Ilicheva et al., 2018a). TRF2 выявлен в акросоме сперматозоидов мыши (Dolnik et al., 2007). Однако работы о роли TRF2 в гаметогенезе остаются единичными. Исследование, посвященное изучению локализации TRF2 в сперматогенезе мыши, оставляет открытым вопрос о том, является ли необычное положение TRF2 в акросоме сперматозоидов характерным для млекопитающих или носит общий характер.
Для определения локализации TRF2 в настоящей работе использовали семенники лягушки. В процессе сперматогенеза можно наблюдать разные стадии развития и созревания половых клеток. Сперматогенез R. temporaria относится к прерывистому типу, в значительной степени не зависит от факторов внешней среды (Witschi, 1924) и регулируется сложной системой, включающей сезонные колебания секреции гонадотропинов и циклическое изменение чувствительности зародышевого эпителия к этим гормонам (van Oordt, 1956; van Oordt et al., 1968). Мы использовали зимних лягушек (конца февраля и начала марта), семенники которых обогащены сперматогониями и сперматозоидами, и определяли локализацию теломерсвязывающего белка TRF2 в этих клетках.
МАТЕРИАЛ И МЕТОДИКА
Объект. Взрослые самцы лягушек R. temporaria отловлены в Ленинградской области. Объектом исследования служили семенники, полученные из зимующих лягушек в конце февраля–начале марта.
Электрофорез и иммуноблотинг. Белки клеток семенников разделяли с помощью SDS-электрофореза по Лэммли (Laemmli, 1970), а затем переносили на нитроцеллюлозную мембрану, используя метод полусухого переноса (Towbin et al., 1979). Мембрану обрабатывали раствором 5%-ного обезжиренного молока, приготовленного на PBS, содержащем 0.5% Tween20 (PBS-Tween), после чего инкубировали в течение 1.5 ч в растворе первичных антител против TRF2 (sc9143 и sc52968, Santa Cruz Biotechnology, США; ab13579, Abcam, Великобритания в разведении 1 : 1000; а также ранее полученные антитела против домена udTRF2 (Ilicheva et al., 2018b) в разведении 1 : 500) и против TRF1 (sc5596, Santa Cruz Biotechnology, США; разведение 1 : 1000). После отмывки мембрану инкубировали со вторичными антителами, конъюгированными с щелочной фосфатазой. Выявление щелочной фосфатазы проводили с помощью систем детекции BCIP/NBT (Sigma, США).
Электронная микроскопия. Для общеморфологических исследований кусочки семенников фиксировали в 2.5%-ном глутаральдегиде на 0.05 M какодилатном буфере, содержащем 53.4 мг/мл сахарозы в течение 1 ч при 4°C. Материал отмывали в растворе какодилатного буфера с добавлением 41 мг/мл сахарозы и постфиксировали в растворе 4%-ного тетраоксида осмия (OsO4) на какодилатном буфере в течение 1 ч при 4°C. Фиксированный материал обезвоживали в растворах этанола возрастающей концентрации, ацетоне и заключали в Epon-Araldite (Polyscience, США).
Клеточный состав семенных канальцев предварительно визуализировали на полутонких срезах 2 мкм толщиной, окрашенных толуидиновым синим (0.2% с добавлением 2.5% Na2CO3). Наблюдение и фотосъемку проводили на микроскопе ZEISS Axio Scope.A1 (Германия). Ультратонкие срезы толщиной 70 нм получали на ультратоме Reichert Ultracut-E (Австрия). Контрастирование срезов проводили 2%-ным уранилацетатом на 70%-ном этаноле в течение 20 мин с последующей отмывкой дистиллированной водой.
Для иммуноэлектронного мечения ультратонких срезов кусочки семенников фиксировали в течение 1 ч при 4°C в 3.7%-ном растворе формальдегида на 1-кратном фосфатно-солевом буферном растворе (PBS), отмывали в 1-кратном PBS в течение ночи при 4°C. Постфиксацию проводили 4%-ным OsO4 на 1-кратном PBS 1 ч при 4°C, после чего материал отмывали в нескольких сменах дистиллированной воды. Затем материал обрабатывали в течение 10 мин в 0.5 М растворе NH4Cl. Фиксированный материал обезвоживали в растворах этанола, контрастировали в насыщенном растворе уранилацетата на этаноле и заключали в смолу LR White (Polyscience, США).
Ультратонкие срезы обрабатывали в течение 30 мин в фильтрованном блокирующем буферном растворе (0.05% Tween-20, 0.5% желатина из кожи рыб, 1-кратный PBS), после чего инкубировали в растворе первичных антител во влажных камерах при 4°С в течение ночи. Первичные антитела разводили 1 : 100 в отмывочном буферном растворе (0.05% Tween-20, 0.1% желатина из кожи рыб, 1-кратный PBS). Для вымывания первичных антител, не связавшихся с целевым антигеном исследования, сетки промывали в четырех сменах отмывочного раствора, после чего инкубировали в растворе вторичных антител в разведении 1 : 20 1.5 ч при комнатной температуре. Ультратонкие срезы исследовали на электронном микроскопе Carl Zeiss Libra 120 (Германия) при 80 кВ. Изображения получены с помощью программы Adobe Photoshop.
Реактивы. В работе использовали: поликлональные антитела против TRF2 sc9143 (Santa Cruz Biotechnology, США); моноклональные антитела против TRF2 ab13579 (Abcam, Великобритания) и sc52968 (Santa Cruz Biotechnology, США); поликлональные антитела против домена udTRF2 (Ilicheva et al., 2018b); поликлональные антитела против TRF1 sc5596 (Santa Cruz Biotechnology, США); антитела козы против иммуноглобулинов кролика, морской свинки или мыши, конъюгированные с щелочной фосфатазой; антитела козы против иммуноглобулинов кролика, конъюгированные с коллоидным золотом 10 нм; смолы LR White, и Epon-Araldite; 5-бром-4-хлор-3-индолилфосфат BCIP, тетразолий голубой NBT (Sigma, США).
РЕЗУЛЬТАТЫ
Специфичность антител к TRF2 для лягушки. Для определения локализации белка в клетках необходимы специфичные для вида антитела. Доступные коммерческие антитела к TRF2 получены к аминокислотной последовательности TRF2 человека, поэтому могут не обладать достаточной специфичностью по отношению к TRF2 травяной лягушки. Для выбора антител к TRF2 травяной лягушки провели имунноблоттинг на препаратах семенников (рис. 1).
Рис. 1.
Электрофорез семенников лягушки (а) и иммуноблоттинг с использованием различных антител к TRF2 семенников (б). М – белковый маркер. а: Дорожка 1 – семенник лягушки. б – Дорожки: 1 – мышиные антитела ab13579 (Abcam, Великобритания); 2 – мышиные антитела sc52968 (Santa Cruz, США); 3 – кроличьи антитела sc9143 (Santa Cruz, США); 4 – кроличьи антитела sc5596 (Santa Cruz, США); 5 – ранее полученные антитела морской свинки к домену udTRF2 (Ilicheva et al., 2018b).

Антитела Anti-TRF2 Rabbit antibody Santa Cruz sc9143 (рис. 1б, дорожка 3) распознают один белок с кажущейся молекулярной массой около 56 кДа, что соответствует расчетной молекулярной массе изоформы Х1 теломерсвязывающего белка TRF2 травяной лягушки R. temporaria (56.27 кДа). Неспецифическое окрашивание в районе 15 кДа, наблюдаемое и на дорожках 1, 3 и 5, вероятно, соответствует остаткам деградировавших белков. Для дальнейшего исследования локализации белка в семенниках лягушки использовали антитела sc9143 к TRF2.
Морфологический анализ. Семенники лягушки обладают морфологическими признаками, характерными для начала марта. Клеточный состав семенных канальцев лягушки в это время года представлен только сперматогониями, расположенными на периферии семенных канальцев, небольшим количеством удлиненных сперматид и большим количеством зрелых сперматозоидов, пучки которых заполняют цисты внутри канальца (рис. 2а). В семенниках лягушки наблюдали два типа сперматогониальных клеток. Они обозначены как первичные и вторичные типы сперматогоний. Сперматогонии первичного, или типа А, являются наименее дифференцированными зародышевыми клетками, в то время как вторичные сперматогонии, или типа В, более дифференцированы; последнее поколение сперматогоний типа В образует первичные сперматоциты (Clermont, Bustos-Obregon, 1968). Термины “первичные” и “вторичные” сперматогонии являются обобщающими и могут включать различные по морфологии типы клеток. У разных видов описаны морфологически и/или функционально разные типы сперматогоний типов А и В. Однако общими чертами всех типов вторичных сперматогоний у амфибий считаются незавершенные цитокинезы и образование клеточных мостиков (Haczkiewicz et al., 2017). В настоящей работе мы обозначали одиночные сперматогонии как первичные, а сгруппированные сперматогонии названы вторичными.
Рис. 2.
Клеточный состав семенных канальцев лягушки. а – Поперечное сечение семенных канальцев, полутонкий срез, окраска толуидиновым синим, Сг1 – первичный сперматогоний, С – клетка Сертоли, Сг2 – вторичные сперматогонии, Спз – сперматозоиды в семенных канальцах; световая микроскопия, об: 40×. б – Первичный сперматогоний: я – ядро, яд –ядрышко, яо – ядерная оболочка, ц – цитоплазма. в – Вторичный сперматогоний, соединенный цитоплазматическим мостом (цм) с соседней клеткой. г – Сперматогоний в метафазе, хр – хромосомы. д – Сперматогоний, плотный материал nuage (звездочка), в толщу которого встроены митохондрии (м), который появляется в околоядерном пространстве.
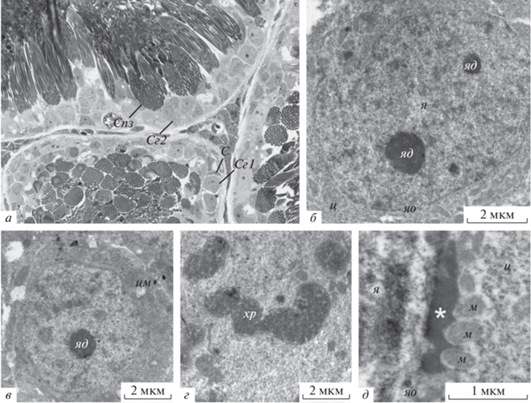
Первичные сперматогонии распределены поодиночке и располагаются на периферии семенных канальцев, каждая клетка окружена одной или несколькими уплощенными клетками Сертоли неправильной формы (рис. 2а). На светооптическом уровне первичные сперматогонии представляют собой клетки овальной формы с крупным центрально расположенным ядром сферической формы, содержащим одно или несколько заметных ядрышек и редкие пятна гетерохроматина. Близко расположенные сгруппированные клетки встречались редко, и были определены как вторичные сперматогонии (рис. 2а).
На ультраструктурном уровне ядро первичных сперматогоний содержит отдельные блоки гетерохроматина, разбросанные по ядру, и одно или несколько ядрышек (рис. 2б). Ядерная оболочка имеет в целом сферические очертания (рис. 2б), но иногда наблюдали неглубокие инвагинации. Ультратонкая структура вторичных сперматогоний сходна (рис. 2в). Между вторичными сперматогониями наблюдали цитоплазматические мостики, удерживающие клетки связанными (рис. 2в). Иногда наблюдали митотически делящиеся сперматогонии (рис. 2г).
В цитоплазме некоторых первичных сперматогоний, в прилежащих к ядерной оболочке участках, наблюдали крупные скопления электронно-плотного материала, ассоциированного с агрегатами митохондрий (рис. 2д). Эти структуры известны как nuage (Eddy, 1975), и считается, что этот плотный материал состоит из рибонуклеопротеинов и РНК-процессирующих белков (Saffman, Lasko, 1999; Houston, King, 2000; Knaut et al., 2000; Houwing et al., 2007).
Локализация TRF2 в сперматогенных клетках лягушки. Для определения локализации TRF2 использовали метод иммуномечения на ультраструктурном уровне. После обработки антителами митотических клеток золотые частицы избирательно локализуются на конденсированном хроматине метафазных хромосом (рис. 3а), что соответствует ожидаемому положению TRF2. В ядре первичного сперматогония наблюдали равномерное распределение белка по ядру, в том числе и в ядрышке (рис. 3б). Хотя TRF2 локализуется в виде чашеобразных структур на наружной поверхности ядерной оболочки ооцита лягушки (Podgornaya et al., 2000), мы не обнаружили селективного мечения ядерной оболочки сперматогоний (рис. 3б).
Рис. 3.
Иммунноэлектронное мечение TRF2 в первичных сперматогониях. а – Первичный сперматогоний в метафазе, хр – хромосомы. б – Первичный сперматогоний в интерфазе, яд – ядрышко, яо – ядерная оболочка. в, г – Локализация TRF2 в nuage (звездочка). Мечение первичными антителами к TRF2 (sc9143, Santa Cruz, США), связанными с вторичными антителами, конъюгированными с частицами золота размером 10 нм (черные точки).

Неожиданно мечение золотом наблюдали в цитоплазме в составе крупных аморфных участков электронно-плотного материала, определенными по морфологии как nuage (рис. 2г, 3в, г).
В сперматозоидах ядро все еще содержит TRF2, в основном на периферии ядра (рис. 4а, б). Метка TRF2 обнаруживается также в акросоме (рис. 4а, с). Таким образом, подтверждается универсальное (акросомное) расположение TRF2 у позвоночных – лягушки (данная работа) и мыши (Dolnik et al., 2007).
Рис. 4.
Иммунноэлектронное мечение TRF2 в сперматозоидах. а – Локализация TRF2 в ядре (я) и акросоме (ак) сперматозоида; б – поперечный срез, локализация TRF2 в ядре (я); в – поперечный срез, локализация TRF2 в акросоме (ак). Мечение первичными антитеами к TRF2 (sc9143, Santa Cruz, США), связанными с вторичными антителами, конъюгированными с частицами золота размером 10 нм (черные точки).

ОБСУЖДЕНИЕ
Локализация TRF2, как компонента шелтерина, ожидается в связи с теломерами. В случае митоза метка TRF2 локализуется на конденсированных хромосомах (рис. 3а). В интерфазе TRF2 равномерно распределен по ядру (рис. 3б). Первоначально TRF2 был выделен из ядерной оболочки ооцита лягушки R. temporaria (Podgornaya et al., 2000). Предполагалось, что этот белок играет ключевую роль во взаимодействии теломер с ядерной мембраной (Ilicheva et al., 2015). Для получения препарата ядерной оболочки использовали ооциты на стадии диплотены. Мы не наблюдали TRF2 в ядерной оболочке сперматогоний. Известно, что в пре-мейотических клетках (сперматогониях) теломеры разбросаны по всему ядру и не имеют физического контакта с ядерной оболочкой (Scherthan et al., 1996). Поэтому отсутствие TRF2 в ядерной оболочке сперматогоний ожидаемо. В настоящей работе мы использовали семенники зимних лягушек и наблюдали только сперматогонии и сперматозоиды. Стадии профазы мейоза I, когда теломеры мигрируют к периферии и прикрепляются к ядерной оболочке (Loidl, 1990; Zickler, Kleckner, 1998), требуют отдельного изучения.
Некоторое количество метки TRF2 наблюдали в ядрышках. В сперматогенезе мыши локализация TRF2 в ядрышке никогда не наблюдали (Dolnik et al., 2007). Известно, что TRF2 может находиться в ядрышке в некоторых клеточных линиях человека на определенных стадиях клеточного цикла (Zhang et al., 2004). TRF2 удерживается в ядрышке за счет взаимодействия с ядрышковым белком NOLC1 (Yuan et al., 2017). Своевременные высвобождение TRF2 из ядрышка и последующее связывание с теломерами имеют решающее значение для целостности хромосом (Zhang et al., 2004). Сперматогонии интенсивно делятся митотически, прежде чем начать мейоз. Поэтому сохранение избытка TRF2 в ядрышке возможно и этом случае.
Связь TRF2 с ядрышком показана и для оогенеза мыши. На поздних этапах оогенеза мыши TRF2 может накапливаться в ЦТ кариосферы (Pochukalina et al., 2016) или в атипичном ядрышке (Fulka et al., 2019). У млекопитающих ЦТ кариосферы образуется в результате последовательных трансформаций ядрышка развивающегося ооцита и содержит несколько ядрышковых белков (Bogolyubov, 2018). TRF2 локализуется в SC35-содержащих ядерных тельцах до конца диплотены и только затем начинает накапливаться в ЦТ кариосферы (Pochukalina et al., 2016). В ооцитах лягушки иммуноокрашивание против TRF2 было намного более интенсивным в SC35-содержащих ядерных тельцах, а не в капсуле кариосферы, предполагая, что домены SC35 являются основными сайтами для накопления TRF2 в ядре поздних ооцитов R. temporaria (Ilicheva et al., 2018a). Таким образом, показано динамичное распределение TRF2 на разных стадиях оогенеза. При сперматогенезе лягушки также наблюдали перемещение TRF2, как в те же (ядрышко), так и в другие компартменты (в акросому).
В зрелых сперматозоидах лягушки значительная часть TRF2 находится в акросоме (рис. 4а, с). В сперматогенезе мыши TRF2 присутствует в акросоме с начальных стадий ее формирования (Dolnik et al., 2007). В ходе спермиогенеза у позвоночных хроматин подвергается конденсации, которая начинается на ранней или средней стадии сперматид и достигает кульминации в сперматозоидах (Ward, Coffey, 1991). Конденсация является универсальным признаком почти всех животных, хотя специфические паттерны упаковки хроматина сильно различаются у разных видов (Ward, Coffey, 1991; Fuentes-Mascorro et al., 2000). Объем ядра значительно уменьшается во время спермиогенеза, количество и вариабельность белков снижаются. Акросома сперматозоида содержит компоненты, необходимые для проникновения в оболочку ооцита (Ramalho-Santos et al., 2002), а также некоторые ДНК-связывающие белки (Herrada, Wolgemuth, 1997; Aul, Oko, 2002).
Сперматозоид представляет собой высокодифференцированную и транскрипционно молчащую клетку, тем не менее, он содержит некоторые факторы транскрипции (Herrada, Wolgemuth, 1997; D’Cruz et al., 2001; Bastián et al., 2007). Среди них Stat1 был обнаружен в сперматозоидах человека, тогда как Stat4 был обнаружен в сперматозоидах как человека, так и мыши; мышиный Stat4 был локализован в перинуклеарной теке (Herrada, Wolgemuth, 1997; D’Cruz et al., 2001). Очевидно, сперматозоиды доставляют в яйцеклетку не только мужской геном, но и важные молекулы, необходимые для оплодотворения и развития эмбриона (Ostermeier et al., 2004; Miller et al., 2005). TRF2 в акросоме, возможно, принципиально важен для выравнивания геномов в зиготе.
Интересным оказалось присутствие TRF2 в nuage. Ранее с помощью масс-спектрометрии среди интерактантов udTRF2-домена мы идентифицировали ряд РНК-связывающих белков, включая представителей семейства DEAD-box АТФ-зависимых РНК-хеликаз, некоторые гетерогенные ядерные нуклеопротеины (hnRNP) и факторы сплайсинга (Travina et al., 2021). Клетки зародышевой линии различных организмов эукариот содержат электронно-плотные структуры, которые известны как nuage (Eddy, 1975). Структуры nuage характеризуются аморфной формой, отсутствием окружающих мембран, обилием РНК и РНК-связывающих белков и могут находится в тесной ассоциации с кластерами митохондрий или (и) непосредственно примыкать к ядерной оболочке. Многочисленные структуры nuage обнаруживаются как в оогенезе, так и в сперматогенезе (Nguyen-Chi, Morello, 2011). Предложено несколько названий для различных электронно-плотных структур конкретных зародышевых линий для описания их морфологических особенностей, внутриклеточной локализации и предполагаемых функций (Russell, Frank, 1978; Hamaguchi, 1993; Yokota, 2012).
Согласно одной из номенклатур, просперматогонии, сперматогонии и сперматоциты обладают формой nuage, временно связанной с митохондриями, называемой межмитохондриальным цементом IMC (IMC – inter-mitochondrial cement) (Chuma et al., 2009). Многообразные типы nuage могут значительно различаться по своей морфологии у различных видов. Тем не менее эти структуры у разных видов имеют много гомологичных компонентов, что указывает на то, что все они участвуют в регуляции РНК и, вероятно, имеют сходные механизмы действия (Chuma et al., 2009). Охарактеризовано около десяти консервативных белков, локализованных в nuage, среди которых РНК-хеликазы (MVH/DDX4, DDX25), Tudor-домен-содержащие белки (TDRD1/MTR, TDRD6, TDRKH/TDRD2) и белки семейства Piwi (Mili, Miwi и Miwi2) (Chuma et al., 2009; Arkov, Ramos, 2010; Yokota, 2012; Wang et al., 2020). Белки, обнаруженные в структурах nuage, участвуют в трансляционном контроле мРНК и в подавлении экспрессии мобильных элементов.
Транскрипты ТП недавно обнаружены в nuage ооцитов человека (Dobrynin et al., 2020; Enukashvily et al., 2021). Транскрипт теломерного ТП TERRA, возможно, имеет принципиальное значение для эмбрионального развития и старения (Libertini et al., 2021). В дальнейшем мы предполагаем получить данные о других белковых компонентах nuage в гаметах травяной лягушки и проверить в них наличие транскриптов TERRA.
Список литературы
Arkov A.L., Ramos A. 2010. Building RNA-protein granules: insight from the germline. Trends Cell Biol. V. 20. P. 482.
Aul R.B., Oko R.J. 2002. The major subacrosomal occupant of bull spermatozoa is a novel histone H2B variant associated with the forming acrosome during spermiogenesis. Dev. Biol. V. 242. P. 376.
Bastián Y., Zepeda-Bastida A., Uribe S., Mújica A. 2007. In spermatozoa, Stat1 is activated during capacitation and the acrosomal reaction. Reproduction. V. 134. P. 425.
Bogolyubov D.S. 2018. Karyosphere (Karyosome). A peculiar structure of the oocyte nucleus. Int. Rev. Cell Mol. Biol. V. 337. P. 1. https://doi.org/10.1016/bs.ircmb.2017.12.001
Bouniol-Baly C., Hamraoui L., Guibert J., Beaujean N., Szöllösi M.S., Debey P. 1999. Differential transcriptional activity associated with chromatin configuration in fully grown mouse germinal vesicle oocytes. Biol. Reprod. V. 60. P. 580.
Bugaeva E.A., Podgornaya O.I. 1997. Telomere-binding protein from the nuclear envelope of oocytes of the frog Rana temporaria. Biochemistry (Mosc). V. 62. P.1311.
Chuma S., Hosokawa M., Tanaka T., Nakatsuji N. 2009. Ultrastructural characterization of spermatogenesis and its evolutionary conservation in the germline: germinal granules in mammals. Mol. Cell Endocrinol. V. 306. P. 17.
Clermont Y., Bustos-Obregon E. 1968. Re-examination of spermatogonial renewal in the rat by means of seminiferous tubules mounted in toto. Am. J. Anat. V. 122. P. 237.
D’Cruz O.J., Vassilev A.O., Uckun F.M. 2001. Members of the Janus kinase/signal transducers and activators of transcription (JAK/STAT) pathway are present and active in human sperm. Fertil. Steril. V. 76. P. 258.
De Lange T. 2018. Shelterin-mediated telomere protection. Ann. Rev. Genet. V. 52. P. 223.
Dobrynin M.A., Korchagina N.M., Prjibelski A.D., Shafranskaya D., Ostromyshenskii D.I., Shunkina K., Stepanova I., Kotova A.V., Podgornaya O.I., Enukashvily N.I. 2020. Human pericentromeric tandemly repeated DNA is transcribed at the end of oocyte maturation and is associated with membraneless mitochondria-associated structures. Sci. Rep. V. 10. P. 19 634.
Dolnik A.V., Pochukalina G.N., Parfenov V. N., Karpushev A.V., Podgornaya O.I., Voronin A.P. 2007. Dynamics of satellite binding protein CENP-B and telomere binding protein TRF2/MTBP in the nuclei of mouse spermatogenic line. Cell Biol. Int. V. 31. P. 316. https://doi.org/10.1016/j.cellbi.2007.01.017
Eddy E.M. 1975. Germ plasm and the differentiation of the germ cell line. Int. Rev. Cytol. V. 43. P. 229.
Enukashvily N.I., Dobrynin M.A, Chubar A.V. 2021. RNA-seeded membraneless bodies: Role of tandemly repeated RNA. Adv. Protein Chem. Struct. Biol. V. 126. P. 151.
Fuentes-Mascorro G., Vergara-Onofre M., Mercado E., Hernández-Pérez O., Rosado A. 2000. Participation of DNA structure on sperm chromatin organization. Arch. Androl. V.45. P. 61.
Fulka H., Langerova A. 2019. Nucleoli in embryos: A central structural platform for embryonic chromatin remodeling? Chromosome Res. V. 27. P. 129.
Haczkiewicz K., Rozenblut-Kościsty B., Ogielska M. 2017. Prespermatogenesis and early spermatogenesis in frogs. Zoology (Jena). V. 122. P. 63.
Hamaguchi S. 1993. Alterations in the morphology of nuages in spermatogonia of the fish, Oryzias latipes, treated with puromycin or actinomycin D. Reprod. Nutr. Dev. V. 33. P. 137.
Herrada G., Wolgemuth D.J. 1997. The mouse transcription factor Stat4 is expressed in haploid male germ cells and is present in the perinuclear theca of spermatozoa. J. Cell Sci. V. 110. P. 1543.
Houston D.W., King M.L. 2000. Germ plasm and molecular determinants of germ cell fate. Curr. Top Dev. Biol. V. 50. P. 155.
Houwing S., Kamminga L.M., Berezikov E., Cronembold D., Girard A., van den Elst H., Filippov D.V., Blaser H., Raz E., Moens C.B., Plasterk R.H., Hannon G.J., Draper B.W., Ketting R.F. 2007. A role for Piwi and piRNAs in germ cell maintenance and transposon silencing in zebrafish. Cell. V. 129. P. 69.
Ilicheva N., Podgornaya O., Bogolyubov D., Pochukalina G. 2018a. The karyosphere capsule in Rana temporaria oocytes contains structural and DNA-binding proteins. Nucleus. V. 9. P. 516.
Ilicheva N.V., Travina A.O., Voronin A.P., Podgornaya O.I. 2018b. Development and characterization of polyclonal antibodies against thelinker region of the telomere-binding protein TRF2. Electronic J. Biotechnol. V. 32. P. 1–5. https://doi.org/10.1016/j.ejbt.2017.12.001
Ilicheva N.V., Podgornaya O.I, Voronin A.P. 2015. Telomere repeat-binding factor 2 is responsible for the telomere attachment to the nuclear membrane. Adv. Protein Chem. Struct. Biol. V. 101. P. 67
Knaut H., Pelegri F., Bohmann K., Schwarz H., Nüsslein-Volhard C. 2000. Zebrafish vasa RNA but not its protein is a component of the germ plasm and segregates asymmetrically before germline specification. J. Cell Biol. V. 149. P. 875.
Laemmli U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. V. 227. P. 680.
Libertini G., Shubernetskaya O., Corbi G., Ferrara N. 2021. Is evidence supporting the subtelomere–telomere theory of aging? Biochemistry (Mosc.). V. 86. P. 1526.
Loidl J. 1990. The initiation of meiotic chromosome pairing: The cytological view. Genome. V. 33. P. 759.
Mendez-Bermudez A., Lototska L., Bauwens S., Giraud-Panis M.J., Croce O., Jamet K., Irizar A., Mowinckel M., Koundrioukoff S., Nottet N., Almouzni G., Teulade-Fichou M. P., Schertzer M., Perderiset M., Londoño-Vallejo A. et al. 2018. Genome-wide control of heterochromatin replication by the telomere capping protein TRF2. Mol. Cell. V. 70. P. 449. e5. https://doi.org/10.1016/j.molcel.2018.03.036
Miller D., Ostermeier G.C., Krawetz S.A. 2005. The controversy, potential and roles of spermatozoal RNA. Trends Mol. Med. V. 11. P. 156.
Nguyen-Chi M., Morello D. 2011. RNA-binding proteins, RNA granules, and gametes: is unity strength? Reproduction. V. 142. P. 803.
Ostermeier G.C., Miller D., Huntriss J.D., Diamond M.P., Krawetz S.A. 2004. Reproductive biology: Delivering spermatozoan RNA to the oocyte. Nature. V. 429. P. 154.
Podgornaya O.I., Bugaeva E.A., Voronin A.P., Gilson E., Mitchell A.R. 2000. Nuclear envelope associated protein that binds telomeric DNAs. Molecular reproduction and development: incorporating gamete research. V. 57. P. 16.
Pochukalina G.N., Ilicheva N.V., Podgornaya O.I., Voronin A.P. 2016. Nucleolus-like body of mouse oocytes contains lamin A and B and TRF2 but not actin and topo II. Mol. Cytogenet. V. 9. P. 50.
Ramalho-Santos J., Schatten G., Moreno R.D. 2002. Control of membrane fusion during spermiogenesis and the acrosome reaction. Biol. Reprod. V. 67. P. 1043.
Russell L., Frank B. 1978. Ultrastructural characterization of nuage in spermatocytes of the rat testis. Anat. Rec. V. 190. P. 79.
Saffman E.E., Lasko P. 1999. Germline development in vertebrates and invertebrates. Cell Mol. Life Sci. V. 55. P. 1141.
Scherthan H., Weich S., Schwegler H., Heyting C., Härle M., Cremer T. 1996. Centromere and telomere movements during early meiotic prophase of mouse and man are associated with the onset of chromosome pairing. J. Cell Biol. V. 134. P. 1109.
Towbin H., Staehelin T., Gordon J. 1979. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc. Natl. Acad. Sci. USA. V. 76. P. 4350.
Travina A.O., Ilichev N.V., Mittenberg A.G., Shabelnikov S.V., Kotova A.V., Podgornaya O.I. 2021. The Long linker region of telomere-binding protein TRF2 is responsible for interactions with lamins. Int. J. Mol. Sci. V. 22. P. 3923.
Van Oordt P.G. 1956. The role of temperature in regulating the spermatogenetic cycle in the common frog (Rana temporaria). Acta Endocrinol. (Copenh). V. 23. P. 251.
Van Oordt P.G., van Dongen W.J., Lofts B. 1968. Seasonal changes in endocrine organs of the male common frog, Rana temporaria. I. The pars distalis of the adenohypophysis. Z. Zellforsch. Mikrosk. Anat. V. 88. P. 549.
Voronin A.P., Lobov I.B., Gilson E., Podgornaya O.I. 2003. A telomere-binding protein (TRF2/MTBP) from mouse nuclear matrix with motives of an intermediate filament-type rod domain. J. Anti Aging Med. V. 6. P. 205.
Wang X., Lv C., Guo Y., Yuan S. 2020. Mitochondria associated germinal structures in spermatogenesis: piRNA pathway regulation and beyond. Cells. V. 9. P. 399.
Ward W.S., Coffey D.S. 1991. DNA packaging and organization in mammalian spermatozoa: Comparison with somatic cells. Biol. Reprod. V. 44. P. 569.
Witschi E. 1924. Die entwicklung der keimzellen der Rana temporaria l. erster teil: urkeimzellen und spermatogenese. Z. Zellforsch. Mikroskop. Anat. V. 1. P. 523.
Wood A.M., Rendtlew Danielsen J.M., Lucas C.A., Rice E.L., Scalzo D., Shimi T., Goldman R.D., Smith E.D., Le Beau M.M., Kosak S.T. 2014. TRF2 and lamin A/C interact to facilitate the functional organization of chromosome ends. Nat. Commun. V. 5. P. 5467.
Yokota S. 2012. Nuage proteins: Their localization in subcellular structures of spermatogenic cells as revealed by immunoelectron microscopy. Histochem. Cell Biol. V. 138. P. 1. https://doi.org/10.1007/s00418-012-0962-z
Yuan F., Li G., Tong T. 2017. Nucleolar and coiled-body phosphoprotein 1 (NOLC1) regulates the nucleolar retention of TRF2. Cell Death Discov. V. 3. P. 17043.
Zhang S., Hemmerich P., Grosse F. 2004. Nucleolar localization of the human telomeric repeat binding factor 2 (TRF2). J. Cell Sci. V. 117. P. 3935.
Zickler D., Kleckner N. 1998. The leptotene-zygotene transition of meiosis. Annu. Rev. Genet. V. 32. P. 619.
Дополнительные материалы отсутствуют.


