Цитология, 2022, T. 64, № 5, стр. 511-520
Особенности действия экстрактов семян грейпфрута, листьев облепихи и чаги на свойства модельных липидных мембран
С. С. Ефимова 1, *, А. А. Захарова 1, Д. Н. Чернышова 1, О. С. Остроумова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: efimova@incras.ru
Поступила в редакцию 15.04.2022
После доработки 02.05.2022
Принята к публикации 02.05.2022
- EDN: WSORXD
- DOI: 10.31857/S0041377122050030
Аннотация
В работе исследовано действие экстрактов семян грейпфрута (ЭСГ), листьев облепихи (ЭЛО) и чаги (ЭЧ) на модельные липидные мембраны. Показано, что пороговые концентрации ЭСГ и ЭЧ, приводящие к дестабилизации фосфатидилглицерин-обогащенных бислоев, в 1.3–1.4 раза меньше, чем в случае фосфатадилхолин-содержащих мембран. Установлено, что ЭСГ и ЭЛО снижают граничный потенциал мембран, сформированных из смеси фосфатадилхолина и холестерина (изменения достигают 45 и 40 мВ при концентрациях 60 и 800 мкг/мл соответственно). ЭЧ выраженным потенциал-модифицирующим эффектом не характеризуется. Показано, что изменения граничного потенциала в присутствии ЭЛО обусловлены наличием в его составе флавонолов, кверцетина и мирицетина. Методом дифференциальной сканирующей микрокалориметрии также обнаружено, что кверцетин и мирицетин способны влиять на термотропное поведение мембранообразующих липидов, а, следовательно, на плотность их упаковки. Показана потенциация порообразующей активности противогрибкового полиенового макролида нистатина и антибактериального липопептида полимиксина Б при введении ЭЛО. Эти данные указывают на возможный синергизм противомикробного действия тестируемых антибиотиков и ЭЛО, что может быть использовано при создании комбинированных противомикробных средств широкого спектра действия.
Одним из глобальных вызовов XXI в. является рост смертности от инфекционных заболеваний на фоне распространения устойчивых к антибиотикам патогенных микроорганизмов. В связи с растущей резистентностью к антибиотикам у возбудителей инфекционных заболеваний человека особую значимость для исследователей и клиницистов приобретает разработка лекарственных препаратов, характеризующихся более медленным развитием устойчивости. Ввиду консервативности мишени таким свойством обладают препараты, действующие на клеточную мембрану, в частности антибиотики, образующие поры в мембранах клеток-мишеней. Как правило, серьезным ограничением применения подобных препаратов является их высокая токсичность.
Макролидные полиеновые антибиотики, в частности амфотерицин Б и нистатин, используются в медицине для лечения различных грибковых инфекций, включая системные микозы. Согласно превалирующей в литературе гипотезе, механизм фунгицидного действия полиенов обусловлен их связыванием с эргостерином в мембране грибковой клетки (Gray et al., 2012) и нарушением ее проницаемости вследствие формирования ион-проводящих пор (Andreoli, 1974; Ermishkin et al., 1976). Вероятность связывания с холестерином в мембранах клеток человека определяет высокую токсичность полиеновых антибиотиков (Wilcock et al., 2013), наиболее часто выражающуюся в нефропатии (Sawaya et al., 1995), что существенно ограничивает их применение в клинической практике (Zotchev 2003; Laniado-Laborín, Cabrales-Vargas, 2009; Bagnis, Deray, 2013).
Полимиксин Б – это полипептидный антибиотик, продуцируемый грамположительной бактерией Bacillus polymyxa и направленно действующий на грамотрицательные микроорганизмы. Его применение показано при полирезистентности целевых штаммов. Однако побочные эффекты полимиксина Б, в частности выраженная нефротоксичность (Zavascki et al., 2007; Abdelraouf et al., 2014; Zavascki, Nation, 2017), существенно ограничивают спектр применения этого антибиотика.
Одним из способов преодоления проблемы высокой токсичности антибиотиков является поиск соединений, способных потенцировать их порообразующую способность и, тем самым, снижать действующую концентрацию. Особый интерес в этой связи представляют вещества природного происхождения. Это обусловлено сразу несколькими причинами: известным профилем безопасности и возможностью перепрофилирования в кратчайшие сроки, а также собственной противомикробной активностью некоторых природных экстрактов.
Семена грейпфрута (Citrus paradisi) характеризуются выраженным антибактериальным действием, которое обусловлено их уникальным фитохимическим составом (Ionescu et al., 1990; Heggers et al., 2002). В составе ЭСГ в большом количестве обнаруживаются биофлавоноиды, относящиеся к классу флаванонов, большинство из которых гликозилированы (Avula et al., 2016). Известно, что семена грейпфрута проявляют активность в отношении Staphylococcus sp. (в частности Staphylococcus aureus), Klebsiella sp., Escherichia coli, Pseudomonas aeruginosa, Legionella pneumophila, а также против некоторых видов спирохет (Ionescu et al., 1990; Heggers et al., 2002; Fukuyama et al., 2003; Oyelami et al., 2005; Brorson, Brorson, 2007).
Разные сорта облепихи (например, Hippophae rhamnoides) являются важным источником антимикробных агентов. Фенольные соединения в составе ЭЛО, в основном, представлены флавонолами и их гликозидами (Yogendra Kumar et al., 2013). Анализ данных из литературы показывает, что экстракт листьев облепихи (ЭЛО) проявляет антибактериальную активность в отношении Staphylococcus aureus, Bacillus cereus, Pseudomonas aeruginosa и некоторых других важных с медицинской точки зрения видов бактерий (Arora et al., 2012; Michel et al., 2012; Yogendra Kumar et al., 2013).
Данные из литературы свидетельствуют и о высокой антибактериальной и противогрибковой активности экстракта берeзового гриба или чаги (Inonotus obliquus) (ЭЧ), в том числе в отношении клинически важных патогенов человека, включая Staphylococcus aureus, Pseudomonas aeruginosa, Bacillus cereus и Aspergillus niger (Glamočlija et al., 2015). Значительную долю экстрактивных веществ чаги представляют липофильные соединения, в частности тритерпеноиды и стерины (Nikitina et al., 2016).
Цель настоящего исследования заключалась в изучении мембранной активности природных экстрактов (семян грейпфрута, листьев облепихи и чаги) и оценка перспектив их совместного применения с порообразующими антибиотиками. Показана липидная специфичность действия ЭСГ и ЭЧ на модельные мембраны, что может обуславливать селективность влияния этих экстрактов на бактериальные мембраны. Впервые продемонстрирована способность ЭЛО снижать граничный потенциал фосфолипидных мембран и определены компоненты, ответственные за его потенциал-модифицирующий эффект. Обнаружена потенциация ЭЛО порообразующей способности макролидного полиенового антимикотика нистатина и липопептидного антибиотика полимиксина Б. Эти данные могут служить научно-техническим заделом для разработки комбинированных противомикробных средств широкого спектра действия.
МАТЕРИАЛ И МЕТОДИКА
Реактивы. В работе использовали следующие реактивы (Sigma, США): хлорид калия (KCl), хлорид натрия (NaCl), HEPES, KOH, NaOH, пентан, этанол, гексадекан, диметилсульфоксид (ДМСО), Тритон Х-100, сефадекс G-50, кальцеин, нистатин, полимиксин Б, кверцетин, мирицетин, рутин; 1-пальмитоил-2-олеил-sn-глицеро-3-фосфохолин (ПОФХ); 1,2-диолеил-sn-глицеро-3-фосфохолин (ДОФХ); 1,2-диолеоил-sn-глицеро-3-фосфо-(1'-rac-глицерин) (ДОФГ); 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (ДПФХ); холестерин (ХОЛ) и сфингомиелин (СМ).
Экстракт семян грейпфрута (ЭСГ), экстракт листьев облепихи (ЭЛО) и экстракт чаги (ЭЧ) предоставлены ЗАО Эвалар (Россия). Тестирование проводили для трех образцов каждого экстракта, представляющих собой независимые серии экстрагирования.
Формирование плоских бислоев и исследование влияния экстрактов на ионную проницаемость мембран. Формирование бислойных липидных мембран проводили по методу Монтала и Мюллера (Montal, Muller, 1972) путем сведения конденсированных липидных монослоев на отверстии в тефлоновой пленке, разделяющей экспериментальную камеру на два (цис- и транс-) отделения. Объем каждого отделения составлял 1.5 мл, толщина тефлоновой пленки – 10 мкм, диаметр отверстия – 30–50 мкм. Перед началом процесса формирования мембраны отверстие в тефлоновой пленке обрабатывали гексадеканом. Мембраны формировали из смесей ДОФХ и ХОЛ в молярном соотношении 80 и 20 мол. %; ДОФХ, ДОФГ и ХОЛ в соотношении 40, 40 и 20 мол. % и ПОФХ, СМ и ХОЛ в соотношении 60, 20 и 20 мол. %. Эксперименты проводили при одинаковом ионном составе разделяемых мембраной водных растворов электролита (0.1 M KCl, рН 7.4). Кислотность растворов (рН 7.4) поддерживали буферной смесью 5 мМ HEPES–KOH. После испарения пентана на поверхности водного раствора оставался конденсированный липидный монослой. Подъем уровней жидкости в обоих отсеках камеры выше отверстия в тефлоновой пленке приводил к образованию бислойной мембраны. Измерения тока, протекающего через бислойную липидную мембрану, осуществляли в режиме фиксации потенциала.
Для подачи напряжения на мембрану и отведения сигнала использовали хлор-серебряные электроды (Ag/AgCl), соединенные с растворами камеры через агарозные мостики (1.5%-ный гель агарозы, 2 М KCl). Положительным считали напряжение, вызывающее поток катионов из цис- в транс-отделение камеры. Электрофизиологические измерения проводили при комнатной температуре. Усиление и аналогово-цифровое преобразование трансмембранных токов проводили при помощи Axopatch 200B и Digidata 1440A (Axon Instruments, США).
Образцы экстрактов из исходных растворов в воде или ДМСО добавляли в оба отсека камеры до предельных концентраций, которые вызывают дестабилизацию и разрушение бислоя (Сthr).
Определение изменений электрического потенциала на границе мембрана/водный раствор при введении тестируемых экстрактов. Ионофор нонактин из стока в спирте добавляли в омывающие растворы с обеих сторон мембраны до конечной концентрации 10–7–10‒6 М. Липидные мембраны формировали из смесей ДОФХ/ХОЛ (80/20 мол. %), ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) и ПОФХ/СМ/ХОЛ (60/20/20 мол. %) по методу Монтала и Мюллера в 0.1 M растворах KCl (5 мМ HEPES−KOH, рН 7.4), как описано выше.
Проводимость бислоя (G) находили как отношение стационарного трансмембранного тока к трансмембранному напряжению, равному 50 мВ. Изменения электрического потенциала на границе мембраны с водным раствором при введении тестируемых экстрактов (Δφb) определяли согласно распределению Больцмана (Andersen et al., 1976):
(1)
$\frac{{{{G}_{m}}}}{{G_{m}^{0}}} = \exp \left( {\frac{{e\Delta {{\varphi }_{b}}}}{{kT}}} \right),$Электрофизиологические измерения активности порообразующих антибиотиков в бислойных липидных мембранах. Для формирования липидных бислоев использовали смеси ДОФХ/ХОЛ (80/20 мол. %) и ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %). Мембраны модифицировали противогрибковым полиеновым антибиотиком нистатином и антибактериальным циклическим липопептидом полимиксином Б. Нистатин или полимиксин Б добавляли с цис-стороны бислоя до конечной концентрации в диапазоне 1–3 и 50–100 мкM соответственно. Тестируемые экстракты вводили в оба отсека камеры до конечной концентрации 100 мкг/мл. Вычисляли среднее отношение стационарного макроскопического нистатин- или полимиксин-индуцированного тока после и до введения экстракта $({{{{I}_{\infty }}} \mathord{\left/ {\vphantom {{{{I}_{\infty }}} {I_{\infty }^{0}}}} \right. \kern-0em} {I_{\infty }^{0}}}).$
Оценка изменения проницаемости мембран под действием тестируемых экстрактов путем флуориметрии утечки кальцеина из липосом. Однослойные везикулы из смесей ДОФХ/ХОЛ (80/20 мол. %), ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) или ПО ФХ/СМ/ХОЛ (60/20/20 мол. %), нагруженные флуоресцентным красителем кальцеином, формировали с помощью мини-экструдера (Avanti Polar Lipids, Inc., США). Исходный раствор липида в хлороформе помещали в виалу, после чего растворитель удаляли потоком азота. Полученную липидную пленку гидратировали буферным раствором (35 мМ кальцеина, 10 мМ HEPES–NaOH, pH 7.4) и после пятикратного замораживания–размораживания 13 раз пропускали через поликарбонатную мембрану (Nucleopore TM, США) с диаметром пор 100 нм для получения гомогенной популяции больших однослойных липосом. Незахваченный липосомами кальцеин удаляли гель-фильтрацией на колонке, заполненной сефадексом G-50. В качестве элюента использовали свободный от кальцеина буферный раствор (150 мМ NaCl, 10 мМ HEPES–NaOH, pH 7.4). Кальцеин, находящийся внутри липосом, в концентрации 35 мМ испытывал самотушение. Флуоресценция кальцеина, вытекающего из липосом в окружающий их раствор под действием тестируемых экстрактов, свидетельствовала об увеличении проницаемости мембран вследствии разобщения образующих их липидов при встраивании компонентов экстрактов. Липосомную суспензию разделяли на аликвоты. Контрольные образцы не модифицировали. Тестируемые экстракты добавляли в липосомальную суспензию до концентрации 5–250 мкг/мл.
Интенсивность флуоресценции высвобожденного из липосом кальцеина (RF, %) измеряли с помощью спектрофлюориметра (Флюорат Панорама-02, Россия; длина волны возбуждения и эмиссии соответственно 490 и 520 нм). В конце эксперимента в суспензию добавляли Тритон X-100. В концентрации 10 мМ этот детергент вызывает разрушение всех липидных везикул и полное высвобождение захваченного маркера.
Величину утечки RF (%) определяли по формуле:
Дифференциальная сканирующая микрокалориметрия модифицированных экстрактами или их компонентами липидных везикул. Большие одноламеллярные липосомы изготавливали из ДПФХ методом электроформации c помощью прибора Nanion vesicle prep pro (Германия). На стeкла подавали переменное напряжение с амплитудой 3 В и частотой 10 Гц в течение 1 ч при температуре 55°C. Концентрация липида составляла 3 мМ. В экспериментальные образцы вводили компоненты ЭЛО (кверцетин, мирицетин или рутин) до достижения соотношения липид : флавонол 10 : 1. Компоненты ЭЧ и ЭСГ пентациклические тритерпеноиды (бетулин и люпеол) и флаванононы (нарингин и нарирутин, которые являются гликозидами нарингенина) соответственно были исследованы ранее (Efimova et al., 2018; Efimova, Ostroumova, 2021). Термограммы липосомальных суспензий получали при помощи дифференциального сканирующего микрокалориметра µDSC7 (Setaram, Франция). Воспроизводимости температурной зависимости теплоемкости достигали путем повторного нагревания образца сразу после охлаждения с постоянной скоростью 0.2°C/мин. Термограммы характеризовали наличием пика, соответствующего предпереходу ДПФХ из гель- в промежуточную риппл-фазу, максимальной температурой основного фазового перехода (Tm), а также шириной пика, соответствующего плавлению, на полувысоте (T1/2). Изменение указанных параметров позволяет судить о термотропном поведении липидов при адсорбции компонентов экстрактов.
Все параметры, характеризующие действие экстрактов или их компонентов на свойства мембран или реконструированных каналов, определены путем вычисления среднего арифметического величин, полученных в 4–9 независимых экспериментах. Величины Сthr и RF представлены в виде средних значений и их стандартных отклонений (SD). Величины Δφb, ${{{{I}_{\infty }}} \mathord{\left/ {\vphantom {{{{I}_{\infty }}} {I_{\infty }^{0}}}} \right. \kern-0em} {I_{\infty }^{0}}},$ ΔTm и ΔT1/2 представлены в виде среднего значений и его стандартной ошибки (SE).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе исследована способность ЭСГ, ЭЛО и ЭЧ увеличивать ионную проницаемость плоских липидных бислоев различного состава. Модельные липидные мембраны формировали из незаряженных и отрицательно заряженных фосфолипидов, сфинголипидов и стеринов. В табл. 1 представлены пороговые концентрации экстрактов, при достижении которых нарушалась электрическая стабильность липидных бислоев различного состава. Добавление ЭСГ, ЭЛО и ЭЧ до концентрации соответственно 950, 300 и 900 мкг/мл к незаряженным мембранам из ДОФХ/ХОЛ (80/20 мол. %) не вызывало увеличения их проницаемости для ионов. При этом максимально достижимая концентрация ЭЛО была ограничена допустимым объемом растворителя в экспериментальной кювете и составляла 300 мкг/мл. Введение ДМСО в большем количестве способствовало росту ионной проницаемости мембран и не позволяло дискриминировать эффекты растворителя и экстракта. Дальнейшее увеличение концентрации ЭСГ и ЭЧ (более 950 и 900 мкг/мл соответственно) приводило к повышению проницаемости липидных бислоев для ионов, нарушению их электрической стабильности (увеличению чувствительности к при-ложению трансмембранной разности потенциалов) и последующему разрушению. В случае незаряженных мембран из смеси ПОФХ/СМ/ХОЛ (60/20/20 мол. %) наблюдали аналогичные ДО-ФХ/ХОЛ-бислоям эффекты, а именно: введение ЭСГ, ЭЛО и ЭЧ до концентрации соответственно 1100, 300 и 1000 мкг/мл не способствовало росту ионной проницаемости мембран, а увеличение концентрации ЭСГ и ЭЧ вызывало дестабилизацию и дезинтеграцию мембран указанного состава.
Таблица 1.
Влияние тестируемых экстрактов на физико-химические свойства модельных липидных мембран различного состава
| экстракт | ДОФХ/ХОЛ (80/20 мол. %) |
ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) |
ПОФХ/СМ/ХОЛ (60/20/20 мол. %) |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Сthr мкг/мл |
Δφbmax мВ |
RF % |
Сthr мкг/мл |
Δφbmax мВ |
RF % |
Сthr мкг/мл |
Δφbmax мВ |
RF % |
|
| ЭСГ | 950 ± 50 | −38 ± 7 | 6 ± 3 | 700 ± 50 | −28 ± 4 | 3 ± 1 | 1100 ± 75 | −20 ± 4 | 2 ± 1 |
| ЭЛО | 300а | −45 ± 11 | 14 ± 7 | 300а | −10 ± 4 | 7 ± 5 | 300а | −35 ± 8 | 8 ± 4 |
| ЭЧ | 900 ± 50 | 11 ± 9 | 1 ± 1 | 650 ± 25 | 10 ± 6 | 2 ± 1 | 1000 ± 50 | −4 ± 3 | 1 ± 1 |
Примечание. Сthr – пороговая концентрация экстракта, вызывающая нарушение диэлектрической функции мембраны и ее разрушение; Δφbmax – изменение электрического потенциала липидных бислоев на границе мембрана/водный раствор; RF – максимальное относительное высвобождение кальцеина из липидных везикул под действием экстракта в концентрации 100 мкг/мл. (а) – максимально достижимая в эксперименте концентрация ЭЛО (дальнейшее увеличение концентрации ЭЛО ограничено введением в экспериментальную кювету максимально допустимого объема ДМСО и нарушением стабильности мембраны под действием самого растворителя).
Замена электрически нейтральных бислоев, сформированных из смесей ДОФХ/ХОЛ или ПО-ФХ/СМ/ХОЛ, на отрицательно заряженные ДО-ФХ/ДОФГ/ХОЛ мембраны вызывала 1.3–1.4-кратное снижение пороговых концентраций ЭСГ и ЭЧ, при которых наблюдали разрыв мембран (табл. 1). Учитывая сходную чувствительность использованных в исследовании холестерин-содержащих мембран к электропробою, снижение пороговых концентраций ЭСГ и ЭЧ в отношении отрицательно заряженных мембран по сравнению с нейтральными бислоями может отражать селективность их мембранного действия и указывать на предпочтительное взаимодействие этих экстрактов с фосфатидилглицерином (ДОФГ) по сравнению с фосфатидилхолинами (ДОФХ или ПОФХ). Учитывая, что отрицательно заряженный фосфатидилглицерин является мажорным компонентом бактериальных мембран, в отличие от фосфатидилхолина, в большом количестве содержащегося в мембранах клеток млекопитающих, полученные данные могут указывать на механизмы антибактериального действия ЭСГ и ЭЧ.
Для установления влияния тестируемых соединений на трансмембранное распределение электрического потенциала проведена оценка изменений граничного потенциала липидных бислоев (Δφb) при введении ЭСГ, ЭЛО и ЭЧ. Зависимости среднего изменения граничного потенциала липидных бислоев, сформированных из смесей ДОФХ/ХОЛ (80/20 мол. %), ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) и ПОФ Х/СМ/ХОЛ (60/20/20 мол. %), от концентрации тестируемых экстрактов в околомембранных растворах представлены на рис. 1. Видно, что все приведенные зависимости характеризуются насыщением – при достижении определенной концентрации экстракта, дальнейшее увеличение его содержания в околомембранном растворе не сопровождается изменением граничного потенциала. Насыщение кривых принято описывать максимальной величиной изменения граничного потенциала, Δφbmax. Величины Δφbmax для ДОФХ/ХОЛ-, ДОФХ/ДОФГ/ХОЛ- и ПОФХ/СМ/ХОЛ-мембран в присутствии тестируемых экстрактов представлены в табл. 1.
Рис. 1.
Зависимость изменения граничного потенциала мембраны от концентрации ЭСГ (квадраты), ЭЛО (кружки) и ЭЧ (треугольники) в мембраноомывающем растворе. Мембраны сформированы из следующих смесей: а – ДОФХ/ХОЛ (80/20 мол. %), б –ДО-ФХ/ДОФГ/ХОЛ (40/40/20 мол. %) или в – ПОФХ/СМ/ХОЛ (60/20/20 мол. %) в растворах 0.1 M KCl, рH 7.4. Трансмембранное напряжение составляет 50 мВ.
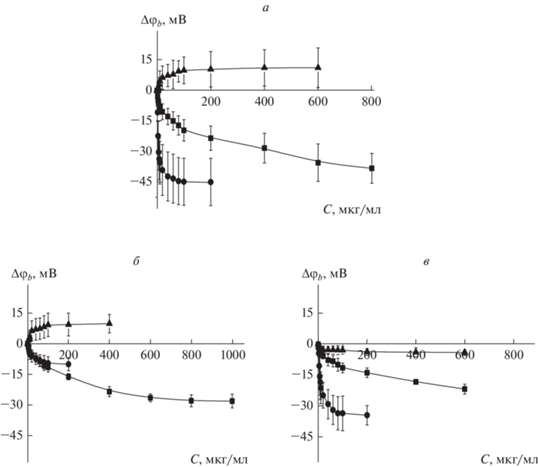
На рис. 1а можно заметить, что наибольшей способностью модифицировать граничный потенциал мембран из ДОФХ/ХОЛ характеризуется ЭЛО: введение экстракта в относительно низких концентрациях (менее 60 мкг/мл) сопровождается уменьшением граничного потенциала до 45 мВ (табл. 1). ЭСГ также способен снижать граничный потенциал, но характеризуется меньшим эффектом при бóльших концентрациях (около 30 мВ при концентрациях более 400 мкг/мл). При этом введение ЭЧ вызывает незначительное (не более 10 мВ) увеличение граничного потенциала ДОФХ/ХОЛ-мембран. Введение в состав мембран отрицательно заряженного ДОФГ сопровождается значительным падением эффективности потенциал-модифицирующего действия ЭЛО (в 4.5 раза) (рис. 1б, табл. 1). Эффективность действия ЭСГ и ЭЧ на нейтральные (ДОФХ/ХОЛ) и отрицательно заряженные мембраны (ДОФХ/ДОФГ/ХОЛ) мало отличается: величины Δφbmax совпадают в пределах погрешности (табл. 1). Граничный потенциал мембран из ПОФХ/СМ/ХОЛ под действием ЭСГ и ЭЛО уменьшается на 20 и 35 мВ соответственно (рис. 1в, табл. 1). Потенциал-модифицирующая активность ЭЧ в отношении бислоев из ПОФХ/СМ/ХОЛ практически не проявляется (рис. 1в, табл. 1).
Согласно данным из литературы, флавонолы (кверцетин и мирицетин), также и гликозид кверцетина рутин являются мажорными компонентами ЭЛО (Yogendra Kumar et al., 2013), а пентациклические тритерпеноиды бетулин и люпеол входят в состав ЭЧ. В составе ЭСГ обнаружены флаванононы, в частности нарингин и нарирутин, которые являются гликозидами нарингенина (Avula et al., 2016). Ранее нами показано, что максимальное уменьшение граничного потенциала фосфатидилхолин-содержащих бислоев при адсорбции кверцетина и мирицетина составляет 104 и 111 мВ соответственно (Efimova, Ostroumova, 2012; табл. 2). Потенциал-моди-фицирующая способность рутина значительно меньше, чем его агликона кверцетина: максимальное уменьшение граничного потенциала мембран не превышает 40 мВ (Ефимова, Остроумова, 2015; табл. 2). Максимальное уменьшение граничного потенциала мембран в присутствии нарингенина составляло 50 мВ (Efimova et al., 2018). Можно предположить, что потенциал-модифицирующий эффект гликозидов нарингенина, нарингина и нарирутина окажется значительно ниже, чем у агликона.
Таблица 2.
Влияние некоторых компонентов тестируемых экстрактов на физико-химические свойства модельных липидных мембран
| Компонент | Δφbmax, мВ | ΔTm, °C | ΔT1/2, °C |
|---|---|---|---|
| ДФФХ | ДПФХ | ДПФХ | |
| Кверцетин | −104 ± 7а | −0.3 ± 0.1 | 0.7 ± 0.3 |
| Мирицетин | −111 ± 1а | −0.3 ± 0.1 | 0.2 ± 0.1 |
| Рутин | −40 ± 6б | 0 | 0 |
| Бетулин | −1 ± 1в | −0.2 ± 0.1в | 0.1 ± 0.1в |
| Люпеол | −1 ± 1в | −0.3 ± 0.1в | 0.1 ± 0.1в |
Примечание. Δφbmax – изменение электрического потенциала липидных бислоев на границе мембрана/водный раствор; ΔTm – изменение температуры главного фазового перехода ДПФХ; ΔT1/2 – изменение полуширины пика, соответствующего плавлению ДПФХ. Соотношение липид : флавонол и липид : тритерпеноид составляет 10 : 1 и 50 : 1 соответственно. Данные взяты из: (а) – Efimova, Ostroumova, 2012; (б) – Ефимова, Остроумова, 2015); (в) – Efimova, Ostroumova, 2021.
Подобная зависимость обнаружена как в случае флавонолов кверцетина и его гликозида рутина (Δφbmax составило 104 и 40 мВ соответственно), так и дигидрохалконов флоретина и его гликозида флорицина (около 150 и 90 мВ соответственно) (Efimova, Ostroumova, 2012; Ефимова, Остроумова, 2015). Ранее нами также установлено, что бетулин и люпеол не влияют на граничный потенциал фосфолипидных мембран (Δφbmax не превышает по абсолютному значению 1 мВ) (Efimova, Ostroumova, 2021; табл. 2). Сопоставление результатов действия на граничный потенциал природных экстрактов и их компонентов позволяет предположить, что изменение граничного потенциала под действием ЭЛО обусловлено присутствием в его составе кверцетина и мирицетина, а слабое потенциал-модифицирующее действие ЭСГ и ЭЧ связано с высоким содержанием в составе этих экстрактов гликозидов нарингенина и пентациклических тритерпеноидов соответственно.
Для оценки способности экстрактов увеличивать проницаемость липидных везикул для маркера путем разобщения мембранных липидов проведена флуориметрия утечки кальцеина из моноламеллярных липосом различного состава при введении в суспензию экстрактов в концентрации до 100 мкг/мл. В табл. 1 представлены средние величины максимальной утечки маркера из ДОФХ/ХОЛ-, ДОФХ/ДОФГ/ХОЛ- и ПОФХ/СМ/ХОЛ-везикул под действием 100 мкг/мл экстракта ЭСГ, ЭЛО или ЭЧ. Вычисления проведены с учетом тушения экстрактами флуоресценции кальцеина (см. раздел “Материал и методика”). В случае ЭСГ, ЭЛО и ЭЧ утечка маркера из везикул ДОФХ/ХОЛ не превышает 6, 14 и 1% соответственно. Величины RF мало зависят от состава липосом. Можно заключить, что ЭСГ и ЭЧ практически не увеличивают проницаемость липосом для кальцеина независимо от их состава. Эти данные указывают на отсутствие способности компонентов ЭСГ и ЭЧ изменять плотность упаковки липидов при встраивании в бислой. Незначительный рост высвобождения маркера из липосом под действием ЭЛО может указывать на способность некоторых компонентов, входящих в состав этого экстракта, разупорядочивать липиды в мембране. Выдвинутое предположение было проверено с помощью дифференциальной сканирующей микрокалориметрии липосом в присутствии компонентов ЭЛО.
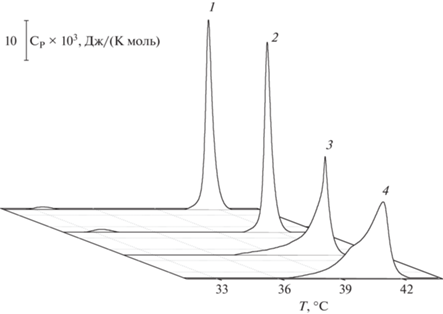
В отсутствие каких-либо модификаторов пред-переход ДПФХ наблюдается при 33.9°C, температура главного фазового перехода липида составляет 41.4°C, а полуширина соответствующего плавлению пика составляет около 0.5°C. Обнаружено, что введение в липосомальную суспензию кверцетина или мирицетина (флавонолов, входящих в состав ЭЛО), приводит к подавлению пред-перехода ДПФХ, снижению его температуры плавления на 0.3 и 0.4°C и увеличению полуширины основного пика на 0.2 и 0.7°C соответственно (рис. 2, табл. 2). Гликозид кверцетина рутин на термограмму плавления ДПФХ практически не влияет (рис. 2, табл. 2). Элиминирование пред-перехода, снижение температуры плавления ДПФХ и увеличение полуширины основного пика на термограмме в присутствии кверцетина и мирицетина указывают на встраивание этих флавонолов в бислой между липидными головками, в результате чего происходит увеличение площади, приходящейся на одну липидную молекулу, разупорядочение ацильных цепей липидов и снижение кооперативности главного фазового перехода ДПФХ. Погружение кверцетина и мирицетина в гидрофильную область мембраны также должно сопровождаться индукцией положительной спонтанной кривизны. Ранее нами показано, что в отличие от флавонолов в составе ЭЛО, кверцетина и мирицетина, компоненты ЭЧ (бетулин и люпеол) практически не влияют на термотропное поведение ДПФХ (Efimova, Ostroumova, 2021; табл. 2).
Рис. 2.
Термограммы плавления ДПФХ (Ср(Т)) в отсутствие (1) и в присутствии рутина (2), мирицетина (3) или кверцетина (4). Соотношение липид : флавонол составляет 10 : 1.
Подробная количественная характеристика влияния природных экстрактов и их компонентов на физико-химические свойства модельных липидных мембран раскрыла перспективы их совместного применения с антибиотиками, порообразующая активность которых зависит от липидного микроокружения. Для оценки синергизма действия экстрактов с антибиотиками в плоские липидные бислои был реконструирован противогрибковый антибиотик, относящийся к классу полиеновых макролидов, нистатин. Известно, что образованные нистатином ионные каналы обладают механочувствительностью, что обусловлено наличием у формируемых пор липидного устья, характеризующегося положительной кривизной (Chulkov et al., 2015).
Рис. 3 (верхняя панель) демонстрирует изменения стационарного трансмембранного тока, индуцированного введением нистатина с цис-стороны ДО-ФХ/ХОЛ-бислоев, после двустороннего добавления тестируемых экстрактов. Как видно на рис. 3а–в, ЭСГ и ЭЧ не влияют на величину тока, а ЭЛО вызывает значительное увеличение порообразующей активности нистатина. Табл. 3 суммирует результаты, полученные в серии независимых экспериментов. Ранее нами показано, что флавонолы, входящие в состав ЭЛО, кверцетин и мирицетин, потенцируют порообразующую способность нистатина (в 19–41 и 4–270 раз соответственно) путем снижения энергии образования липидного устья нистатиновых каналов (Chulkov et al., 2015). Таким образом, потенциация ЭЛО порообразующей активности нистатина, вероятно, связана с наличием в составе экстракта ЭЛО кверцетина и мирицетина и индукцией этими компонентами положительной спонтанной кривизны липидных монослоев. Это хорошо согласуется с результатами изучения влияния компонентов ЭЛО (кверцетина и мирицетина) на термограмму плавления ДПФХ (табл. 2).
Рис. 3.
Влияние различных экстрактов на стационарный макроскопический трансмембранный ток, индуцированный цис-добавкой нистатина (верхняя панель) или полимиксина Б (нижняя панель). Стрелка указывает моменты введения ЭСГ (а, г), ЭЛО (б, д) или ЭЧ (в, е) в омывающий раствор с обеих сторон мембраны до концентрации 100 мкг/мл. Нистатин-модифицированные мембраны сформированы из ДОФХ/ХОЛ (80/20 мол. %) и омываются раствором KCl 2.0 M при pH 7.4 (верхняя панель); полимиксин-модифицированные бислои сформированы из ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) и омываются раствором KCl 0.1 M при pH 7.4 (нижняя панель). Трансмембранное напряжение составляет 50 мВ.
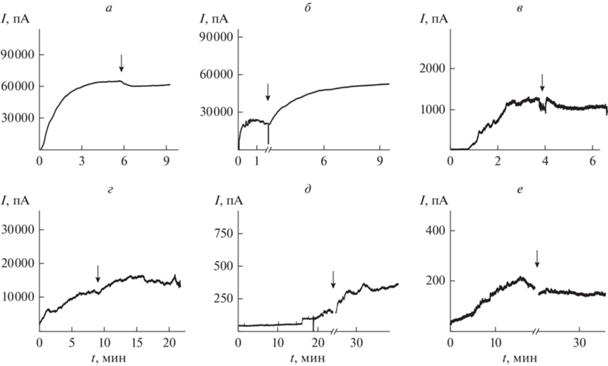
Таблица 3.
Отношение стационарного макроскопического нистатин- или полимиксин Б-индуцированного трансмембранного тока после и до введения экстракта
| Экстракт | ${{{{I}_{\infty }}} \mathord{\left/ {\vphantom {{{{I}_{\infty }}} {I_{\infty }^{0}}}} \right. \kern-0em} {I_{\infty }^{0}}}$ | |
|---|---|---|
| нистатин | полимиксин Б | |
| ЭСГ | 1.0 ± 0.1 | 1.1 ± 0.1 |
| ЭЛО | 11 ± 6 | 3 ± 1 |
| ЭЧ | 1.0 ± 0.1 | 1.0 ± 0.1 |
Примечание. Нистатин-модифицированные мембраны сформированы из ДОФХ/ХОЛ (80/20 мол. %) и омываются раствором KCl 2.0 M при pH 7.4, полимиксин-модифицированные бислои сформированы из ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) и омываются раствором KCl 0.1 M при pH 7.4. Нистатин или полимиксин Б добавляли с цис-стороны бислоя до конечной концентрации в диапазоне 1–3 и 50–100 мкM соответственно. Тестируемые экстракты вводили в оба отсека камеры до конечной концентрации 100 мкг/мл.
Рис. 3 (нижняя панель) демонстрирует действие тестируемых экстрактов на стационарный трансмембранный ток, индуцированный введением с цис-стороны другого антибиотика, антибактериального циклического липопептида полимиксина Б. Известно, что полимиксин Б формирует в модельных липидных мембранах ионные каналы (Корепанова и др., 2000). На рис. 3д показано, что ЭЛО усиливает способность полимиксина Б формировать поры в ДОФХ/ДОФГ/ХОЛ-мембранах. В среднем, липопептид-индуцированный трансмембранный ток после введения ЭЛО увеличивается в 3 раза (табл. 3). ЭСГ и ЭЧ на активность полимиксина Б практически не влияют (рис. 3д, е соответственно), и средние токи до и после добавки экстрактов практически не отличаются (табл. 3). Сходство влияния тестируемых экстрактов на порообразующую активность нистатина и полимиксина Б может свидетельствовать о сходном строении образуемых этими антибиотиками пор. Можно предположить, что полимиксин Б формирует в мембранах тороидальные поры, одно устье которых образовано молекулами липопептида, а второе – мембранными липидами. Важно отметить, что по такому принципу формирует каналы другой липопептидный антибиотик сирингомицин Е (Ostroumova et al., 2007).
Таким образом, полученные данные указывают на синергизм противомикробного действия порообразующих антибиотиков (нистатина и полимиксина Б) и ЭЛО, что может быть использовано при создании комбинированных противомикробных средств широкого спектра действия, назначаемых медицинскими специалистами до выявления природы патогена.
Список литературы
Ефимова С.С., Остроумова О.С. 2015. Модификаторы дипольного потенциала липидных бислоев. Акта Натура. Т. 7. № 4. С. 73. (Efimova S.S., Ostroumova O.S. 2015. Modifiers of the dipole potential of lipid bilayers. Acta Naturae. V. 7. P. 70.)
Корепанова Е.А., Шевченко Е.В., Кожомкулов Е.Т., Вассерман А.Н., Морозова Е.Р., Антонов В.Ф. 2000. Полимиксин Б и Са2+ индуцируют флуктуации проводимости в БЛМ из дипальмитоилфосфатидной кислоты. Биофизика. Т. 45. С. 276. (Korepanova E.A., Shevchenko E.V., Kozhomkulov E.T., Vasserman A.N., Morozova E.R., Antonov V.F. 2000. Polymyxin B and Ca(2+) induce conductance fluctuations in the dipalmitoyl phosphatidic acid bilayer lipid membrane. Biofizika. V. 45. P. 276.)
Abdelraouf K., Chang K.T., Yin T., Hu M., Tam V.H. 2014. Uptake of polymyxin B into renal cells. Antimicrob Agents Chemother. V. 58. P. 4200.
Andersen O.S., Finkelstein A., Katz I., Cass A. 1976. Effect of phloretin on the permeability of thin lipid membranes. J. Gen. Physiol. V. 67. P. 749.
Andreoli T. 1974. The structure and function of amphotericin B cholesterol pores in lipid bilyer membranes. Ann. N.Y. Acad. Sci. V. 235. P. 448.
Arora R., Mundra S., Yadav A., Stobdan T. 2012. Antimicrobial activity of seed, pomace and leaf extracts of sea buckthorn (Hippophae rhamnoides L.) against foodborne and food spoilage pathogens. African. J. Biotechnol. V. 11. P. 10424. https://doi.org/10.5897/AJB11.4150
Avula B., Sagi S., Wang Y.H., Wang M., Gafner S., Manthey J.A., Khan I.A. 2016. Liquid chromatography-electrospray ionization mass spectrometry analysis of limonoids and flavonoids in seeds of grapefruits, other citrus species, and dietary supplements. Planta. Med. V. 82. P. 1058.
Bagnis C.I., Deray G. 2013. Amphotericin B nephrotoxicity. Saudi J. Kidney Dis. Transplant. V. 13. P. 481.
Brorson O., Brorson S.H. 2007. Grapefruit seed extract is a powerful in vitro agent against motile and cystic forms of Borrelia burgdorferi sensu lato. Infection. V. 35. P. 206.
Chulkov E.G., Schagina L.V., Ostroumova O.S. 2015. Membrane dipole modifiers modulate single-length nystatin channels via reducing elastic stress in the vicinity of the lipid mouth of a pore. Biochim. Biophys. Acta. V. 1848. P. 192.
Efimova S.S., Zakharova A.A., Medvedev R.Ya., Ostroumova O.S. 2018. Ion channels induced by antimicrobial agents in model lipid membranes are modulated by plant polyphenols through surrounding lipid media. J. Membr. Biol. V. 251. P. 551.
Efimova S.S., Ostroumova O.S. 2012. Effect of dipole modifiers on the magnitude of the dipole potential of sterol-containing bilayers. Langmuir. V. 28. P. 9908. https://doi.org/10.1021/la301653s
Efimova S.S., Ostroumova O.S. 2021. Is the membrane lipid matrix a key target for action of pharmacologically active plant saponins? Int. J. Mol. Sci. V. 22. P. 3167. https://doi.org/10.3390/ijms22063167
Ermishkin L.N., Kasumov K.M., Potzeluyev V.M. 1976. Single ionic channels induced in lipid bilayers by polyene antibiotics amphotericin B and nystatine. Nature. V. 262. P. 698.
Fukuyama M., Furuhata K., Oonaka K., Yakiwara R., Koizumi T., Hara M., Dogasaki C., Shimada T., Kuribayashi T., Nakazawa M., Watanabe T. 2003. Isolation and serotyping of Vero toxin-producing Escherichia coli (VTEC) from pig. Kansenshogaku Zasshi. V. 77. P. 1032.
Glamočlija J., Ćirić A., Nikolić M., Fernandes Â., Barros L., Calhelha R.C., Ferreira I.C., Soković M., van Griensven L.J. 2015. Chemical characterization and biological activity of Chaga (Inonotus obliquus), a medicinal “mushroom”. J. Ethnopharmacol. V. 162. P. 323.
Gray K.C., Palacios D.S., Dailey I., Endo M.M., Uno B.E., Wilcock B.C., Burke M.D. 2012. Amphotericin primarily kills yeast by simply binding ergosterol. Proc. Natl. Acad. Sci. USA. V. 109. P. 2234.
Heggers J.P., Cottingham J., Gusman J., Reagor L., McCoy L., Carino E., Cox R., Zhao J.G. 2002. The effectiveness of processed grapefruit-seed extract as an antibacterial agent: II. Mechanism of action and in vitro toxicity. J. Altern. Complement. Med. V. 8. P. 333.
Ionescu G., Kiehl R., Wichmann-Kunz F., Williams C.H., Bauml L., Levine S. 1990. Oral Citrus seed extract in atopic eczema: In vitro and in vivo studies on intestinal microflora. J. Orthomolecular. Med. V. 5. P. 155.
Laniado-Laborín R., Cabrales-Vargas M.N. 2009. Amphotericin B: side effects and toxicity. Rev. Iberoam. Micol. V. 26. P. 223.
Michel T., Destandau E., Le Floch G., Lucchesi M.E., Elfakir C. 2012. Antimicrobial, antioxidant and phytochemical investigations of sea buckthorn (Hippophae rhamnoides L.) leaf, stem, root and seed. Food Chem. V. 131. P. 754.
Montal M., Muller P. 1972. Formation of bimolecular membranes from lipid monolayers and study of their electrical properties. Proc. Natl. Acad. Sci. USA. V. 65. P. 3561.
Nikitina S.A., Khabibrakhmanova V.R., Sysoeva M.A. 2016. Composition and biological activity of triterpenes and steroids from Inonotus obliquus (chaga). Biochem. (Moscow). Suppl. Series B. V. 62 P. 369.
Oyelami O.A., Agbakwuru E.A., Adeyemi L.A., Adedeji G.B. 2005. The effectiveness of grapefruit (Citrus paradisi) seeds in treating urinary tract infections. J. Altern. Complement. Med. V. 11. P. 369.
Ostroumova O.S., Gurnev P.A., Schagina L.V., Bezrukov S.M. 2007. Asymmetry of syringomycin E channel studied by polymer partitioning. FEBS Lett. V. 581. P. 804.
Sawaya B.P., Briggs J.P., Schnermann J. 1995. Amphotericin B nephrotoxicity: the adverse consequences of altered membrane properties. J. Am. Soc. Nephrol. V. 6. P. 154.
Wilcock B.C., Endo M.M., Uno B.E., Burke M.D. (2013). C2′-OH of amphotericin B plays an important role in binding the primary sterol of human cells but not yeast cells. J. Am. Chem. Soc. V. 135. P. 8488. https://doi.org/10.1021/ja403255s
Yogendra Kumar M.S., Tirpude R.J., Maheshwari D.T., Bansal A., Misra K. 2013. Antioxidant and antimicrobial properties of phenolic rich fraction of Seabuckthorn (Hippophae rhamnoides L.) leaves in vitro. Food Chem. V. 141. P. 3443.
Zavascki A.P., Goldani L.Z., Li J., Nation R.L. 2007. Polymyxin B for the treatment of multidrug-resistant pathogens: a critical review. J. Antimicrob. Chemother. V. 60. P. 1206. https://doi.org/10.1093/jac/dkm357
Zavascki A.P., Nation R.L. 2017. Nephrotoxicity of polymyxins: is there any difference between colistimethate and polymyxin B? Antimicrob. Agents Chemother. V. 61. P. e02319-16. https://doi.org/10.1128/AAC.02319-16
Zotchev S.B. 2003. Polyene macrolide antibiotics and their applications in human therapy. Curr. Med. Chem. V. 10. P. 211.
Дополнительные материалы отсутствуют.


