Цитология, 2022, T. 64, № 5, стр. 495-510
Ультраструктурный и иммуногистохимический анализ полипозной ткани при хроническом полипозном риносинусите
А. Н. Горшков 1, 2, *, Е. А. Варюшина 3, Е. В. Безрукова 4, М. А. Афлитонов 5, А. С. Симбирцев 6
1 Научно-исследовательский институт гриппа им. А.А. Смородинцева Минздрава России
197376 Санкт-Петербург, Россия
2 НМИЦ им. В.А. Алмазова Минздрава России
197341 Санкт-Петербург, Россия
3 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
4 Кафедра оториноларингологии Северо-западного государственного медицинского университет им. И.И. Мечникова
191015 Санкт-Петербург, Россия
5 Оториноларингологическое отделение клинической больницы Балтийского федерального университета им. Канта
236041 Калининград, Россия
6 Государственный научно-исследовательский институт особо чистых биопрепаратов ФМБА России
197110 Санкт-Петербург, Россия
* E-mail: angorsh@yahoo.com
Поступила в редакцию 27.03.2022
После доработки 27.04.2022
Принята к публикации 05.05.2022
- EDN: VVMBUH
- DOI: 10.31857/S0041377122050042
Аннотация
Хронический риносинусит (ХРС) – сложное воспалительное заболевание, широко распространенное во всем мире и характеризующееся большой длительностью лечения. Лежащее в основе хронического полипозного риносинусита (ХПРС) воспаление слизистой оболочки околоносовых пазух приводит к множественным патоморфологическим изменениям. ХПРС связан с ремоделированием нормальных тканей, включая их деградацию и субэпителиальный фиброз. Гистопатологические исследования дают важнейшую информацию об особенностях протекания воспалительного процесса в слизистых оболочках околоносовых пазух. Ультраструктурные исследования полипозной ткани позволяют глубже понять механизмы развития патологических процессов в данных структурах на клеточном и субклеточном уровнях. Цель данной работы: выявление патогенетических особенностей полипозного воспалительного процесса при контролируемой и неконтролируемой формах течения ХПРС. Основные задачи: исследование процессов воспаления и ремоделирования в полипозной ткани на тканевом, клеточном и субклеточном уровнях при данных формах заболевания. Материалом для исследований послужили биопсии полипозной ткани из решетчатого лабиринта (операционный материал), полученные у пациентов с контролируемой и неконтролируемой формами ХПРС. Гистологический анализ выполняли на срезах, окрашенных гематоксилином Карацци и эозином. Локализацию маркера макрофагов CD68 в полипозной ткани исследовали методом непрямой иммуногистохимии. Ультраструктурные исследования проводили с помощью трансмиссионной электронной микроскопии. Во всех исследованных случаях наблюдали патогистологические изменения, как в эпителиальном слое, так и в соединительно-тканной строме полипа. Было показано, что при полипозе нарушается целостность эпителиального слоя, происходит его гиперплазия и метаплазия. Субэпителиально и в строме полипа выявлены фиброз, отек, отложения коллагена и лейкоцитарная инфильтрация. По результатам иммуногистохимического исследования CD68-позитивные макрофаги детектируются в полипозной ткани как внутри- и субэпителиально, так и в соединительно-тканной строме полипа. Электронно-микроскопическое исследование образцов полипозной ткани выявило множественные патологические изменения, в том числе нарушения целостности плотных контактов в эпителии полипов, деструктивные изменения ресничек эпителиоцитов, инфильтрацию полипозной ткани эозинофилами и плазматическими клетками. Таким образом, анализ патоморфологической картины полипов позволил нам выявить особенности протекания процессов воспаления и ремоделирования в полипозной ткани при контролируемой и неконтролируемой формах заболевания. В результате проведенного комплексного исследования на тканевом, клеточном и субклеточном уровнях были обнаружены изменения в структуре слизистой оболочки полипов.
Хронический риносинусит (ХРС) – сложное воспалительное заболевание, которое затрагивает значительную часть населения во всем мире и связано с большой длительностью лечения. Лежащее в основе хронического полипозного риносинусита (ХПРС) воспаление слизистой оболочки околоносовых пазух приводит к множественным патофизиологическим и патоморфологическим изменениям, включая дисфункцию эпителия, ремоделирование тканей, их разрушение и субэпителиальный фиброз (Meng et al., 2013; Kuhar et al., 2017). Классификация, этиология и патогенез ХПРС до конца не выяснены, поэтому изучение этих аспектов остается актуальным. В 2003 г. была предложена классификация ХПРС, при которой фенотипы полипозного риносинусита определены по наиболее вероятной причине возникновения заболевания (Пискунов, 2003; Пискунов, 2019). В международном Европейском согласительном документе по риносинуситу и назальному полипозу (EPOS, 2012) выделили два фенотипа ХРС – без полипов и с полипами (ХПРС) (Fokkens et al., 2012). В свою очередь, среди ХПРС дифференцируют формы с эозинофильными или нейтрофильными полипами. В 2020 г. в рекомендациях EPOS предложено разделение ХПРС на первичный и вторичный, при этом диффузные первичные ХПРС по характеру доминирующего эндотипа делятся на Th2- и не-Th2-типы (Fokkens et al., 2020). Th-2-тип иммунного ответа при ХПРС связан с эозинофильным воспалением, обильной продукцией иммуноглобулина Е (IgE), гистамина и Th-2-цитокинов (IL-5, IL-13) (Heffler et al., 2018; Ryu, Kim, 2019; Laidlaw et al., 2021). В 2021 г. на Европейском форуме по изучению аллергий и заболеваний дыхательных путей (EUFOREA) для оценки эффективности (контроля) лечения было предложено дифференцировать контролируемую, частично контролируемую и неконтролируемую формы течения ХПРС (Hellings et al., 2013; Toma, Hopkins, 2016; Bachert et al., 2021). При неконтролируемой форме течения ХПРС наблюдается резистентность к интраназальной кортикостероидной терапии. Причина развития неконтролируемой формы течения ХПРС (и неэффективности лечения) остается неизвестной, вот почему поиск патогенетических механизмов, играющих роль при неблагоприятном течении заболевания, является важной задачей.
Гистопатологические исследования являются важнейшим источником информации об особенностях протекания воспалительного процесса в слизистых оболочках носа и околоносовых пазух (Kim et al., 2007; Kuhar et al, 2017; Shay, Tajudeen, 2018). Такие данные дают новые фундаментальные знания о патогенетических механизмах ХПРС. Кроме того, в клинической практике они обладают прогностической ценностью и являются необходимыми при оценке результатов терапии. Морфологические исследования составляют один из общепризнанных методов изучения местного воспалительного процесса при ХРС и полипозе. Чаще всего они включают в себя гистологическое и иммуногистохимическое исследование операционного материала или тканевых биопсий полипов (Kuhar et al, 2017; Pyo, Kim, 2021; Viksne et al., 2021). Имеется также высокий интерес исследователей к анализу ультраструктурной организации всего комплекса слизистой оболочки носа и околоносовых пазух при ХПРС (Ильинская, Захарова, 2001, 2005; Li et al., 2014; Khurana et al., 2020). Электронно-микроскопические исследования полипозной ткани позволяют глубже понять механизмы развития патологических процессов в данных структурах. Цель данной работы: выявление патогенетических особенностей полипозного воспалительного процесса при контролируемой и неконтролируемой формах течения ХПРС. Основные задачи: исследования процессов воспаления и ремоделирования в полипозной ткани на тканевом, клеточном и субклеточном уровнях при данных формах заболевания.
МАТЕРИАЛ И МЕТОДИКА
Биопсийный материал. Материалом для исследований послужили биопсии полипозной ткани из решетчатого лабиринта (операционный материал), полученные у пациентов с ХПРС с контролируемой и неконтролируемой формами течения патологического процесса.
I группа. ХПРС (контролируемая форма) – 10 человек. Критерии включения: длительность заболевания более 5-ти лет, отсутствие оперативного лечения или одно оперативное лечение в течение болезни, уменьшение размеров полипозной ткани при применении интраназальных глюкокортикостероидов (ИНГКС) в течение нескольких месяцев, редкие рецидивы (1 раз в 5 лет) или их отсутствие.
II группа. ХПРС (неконтролируемая форма) – 15 человек (в том числе у 3 человек была сопутствующая БА, у 4 человек – астматическая триада (БА + + непереносимость НПВС + полипоз). Данная форма резистентна к терапии ИНГКС. Критерии включения: длительность заболевания более 5-ти лет, неоднократные оперативные вмешательства (от 2 и более раз), повторные курсы системной кортикостероидной терапии (не менее 1 раза в год) и частые рецидивы (через 1–2 г. после оперативного вмешательства).
Гистологическое и иммуногистохимическое исследование. Биоптаты полипозной ткани разрезали на кусочки 5 × 5 × 5 мм, фиксировали в 4%-ном растворе параформальдегида (ПФ) (Sigma, США) в фосфатно-солевом буфере (ФСБ), рН 7.2–7.4 в течение 40 мин при 4°С. Далее образцы отмывали в ФСБ, пропитывали в 20%-ном растворе сахарозы в ФСБ, помещали в среду для замораживания тканей ОСТ (Sakura, Япония) и замораживали в жидком азоте. Криостатные срезы толщиной 6 мкм были получены на криостате CM 1510-1 (Leica, Германия), срезы монтировали на предметные стекла Super Frost Plus (Mentzel, Германия).
Для гистологического исследования срезы на предметных стеклах окрашивали гематоксилином Карацци и эозином (Биовитрум, Россия), обезвоживали в спиртах восходящей концентрации, просветляли в ксилоле и заключали в бальзам под покровное стекло.
Локализацию CD68 на срезах исследовали методом непрямой иммуногистохимии. В качестве первых антител использовали мышиные моноклональные антитела к человеческому CD68 MA5-13324 (Thermo fisher, США). Первичные антитела разводили в дилюэнте для антител Antibody Diluent with Background Reducing Components Code S3022В (Dako, Дания), рабочие разведения антител были подобраны в предварительных экспериментах. В случае отрицательного контроля на срезы наносили дилюэнт без первичных антител. После инкубации с антителами проводили отмывку в отмывочном буфере, содержащем 50 мМ TBS (50 mM TBS IHC Wash Buffer + Tween®; Cell Marque, США) 2 раза по 10 мин. Для визуализации иммуномечения использовали систему детекции N-Histofine Simple Stain MAX PO (MULTI) Universal Immuno-peroxidase Polymer (Nichirei biosciences inc, Япония), а в качестве окрашиваюшего реагента – DAB (DAB Kit; Cell Marque, США) в соответствии с инструкциями производителей. Срезы докрашивали гематоксилином Каррацци и заключали в среду Clear Mount (GeneTex, США).
Гистологические и иммуногистохимические препараты изучали в оптическом микроскопе DMLB со встроенной камерой DC300 (Leica Microsystems AG) на нескольких увеличениях объектива (×10, ×20, ×40, ×100).
Электронная микроскопия. Немедленно после выделения образцы полипозной ткани были фрагментированы на небольшие кусочки (1–2 мм) и зафиксированы в 2.5%-ном растворе глютарового альдегида на ФСБ в течение 1 ч при комнатной температуре, после чего промыты в 3-х сменах ФСБ. Далее была выполнена постфиксация материала в 1%-ном растворе тетроксида осмия на том же буфере, при той же температуре в течение 1 ч. После фиксации объекты были обезвожены в серии растворов этанола возрастающей концентрации (30, 50, 70, 96, 100%), пропитаны ацетоном и заключены в эпоксидную смолу Эпон. Полимеризация эпоксидной смолы проходила в течение 24 ч в термостате при температуре 56°С.
На ультрамикротоме Leica UC7 были получены ультратонкие срезы исследуемых образцов полипов (толщина срезов 50–70 нм). Срезы были собраны на медные сетки для электронной микроскопии. Сетки со срезами были отконтрастированы в спиртовом растворе уранилацетата и водном растворе цитрата свинца. Электронно-микроскопическое исследование срезов выполнено в микроскопе JEOL JEM 1011. Цифровые электронные микрофотографии были получены с использованием камеры Morada (Digital Imaging Solutions Inc.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
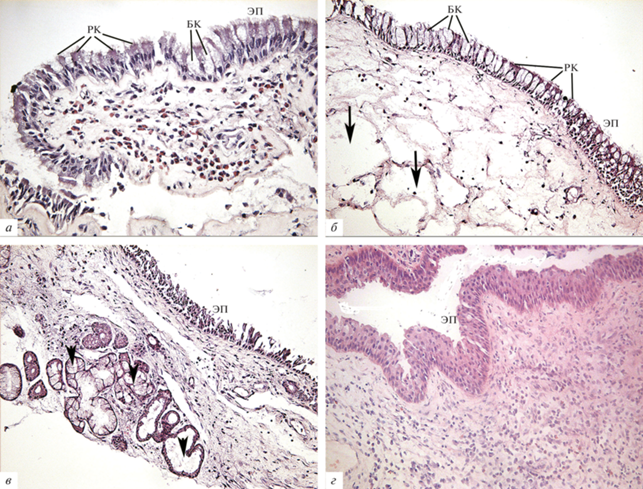
Гистологическая характеристика особенностей воспалительной картины при полипозе носа. На рис. 1 (а–г) представлены микрофотографии срезов полипов слизистой оболочки клеток решетчатого лабиринта. При контролируемой форме течения ХПРС (I группа) хорошо виден многорядный цилиндрический мерцательный эпителий, покрывающий полип (рис. 1а). На апикальной части реснитчатых эпителиальных клеток наблюдается гипертрофия ресничек. Бокаловидные клетки гипертрофированы, визуализируются вакуоли, заполненные слизью. На некоторых участках наблюдается отрыв эпителия до базального слоя, а на некоторых зонах, расположенных в центральной части полипа, эпителий отсутствует. При неконтролируемой форме ХПРС (II группа) на срезах полипа в эпителии наблюдается меньшее количество клеток с ресничками, чем в предыдущем случае (рис. 1б). На некоторых участках эпителия есть гипертрофированные бокаловидные клетки, содержащие вакуоли. Наблюдаются признаки дистрофических изменений эпителия (отрыв апикальной части и разрушение клеток). В строме наблюдаются признаки сильного отека за счет повышенного содержания воды в ткани полипа (рис. 1б). Умеренная инфильтрация воспалительными иммунными клетками представлена эозинофилами, лимфоцитами, плазматическими клетками. При ХПРС, протекающем на фоне БА, на препаратах наблюдаются значительные изменения эпителия (рис. 1в). Респираторный эпителий сохранен на некоторых участках, однако местами видны зоны, на которых происходит отрыв апикальной части клеток. Наблюдаются ранние признаки метаплазии респираторного эпителия. В строме полипа обращает на себя внимание большое количество гипертрофированных слизистых желез, визуализируется умеренная инфильтрация воспалительными клетками (рис. 1в). При ХПРС на фоне астматической триады были выявлены наиболее значительные изменения эпителиальной оболочки полипов (рис. 1г). Эпителий из многорядного становится многослойным, часть клеток не имеют связи с базальной мембраной, клетки эпителия утрачивают реснички, не наблюдаются бокаловидные клетки, продуцирующие слизь. На срезах отчетливо визуализируется диффузная мононуклеарная инфильтрация собственного слоя слизистой оболочки. Таким образом, анализ патоморфологической картины полипов позволяет выявить различия в выраженности изменений покровного эпителия полипозной ткани и качественном составе клеток, инфильтрирующих собственный слой слизистой полипов. Для детализации полученных данных, было выполнено иммуногистохимическое исследование с использованием антител против макрофагального маркера CD68.
Рис. 1.
Гистологическое исследование биоптатов полипозной ткани. а – ХПРС, контролируемая форма; б – ХПРС, неконтролируемая форма, стрелки – отек в строме полипа; в – ХПРС + БА, головки стрелок – слизистые железы; г – ХПРС + астматическая триада. Обозначения: БК – бокаловидные клетки, РК – реснитчатые клетки, ЭП – эпителий, покрывающий полип. Увеличение объектива: 40× (а) и 20× (б–г).
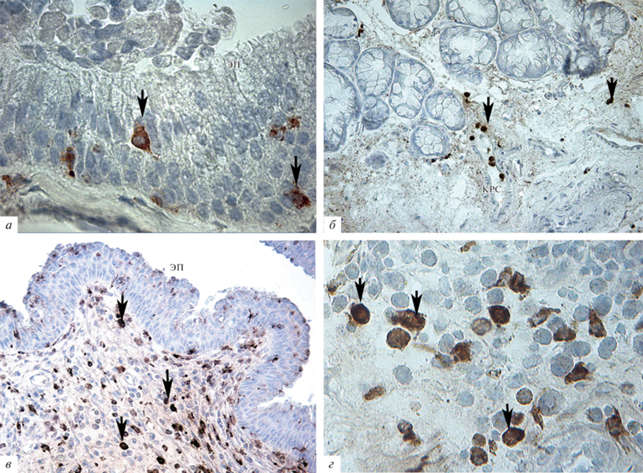
Иммуногистохимическое исследование полипозной ткани. CD68-положительные клетки в полипозной ткани обладали морфологическими признаками макрофагов: размер около 20 мкм, овальная или звездчатая форма, бобовидное или овальное ядро (рис. 1а, г). Инфильтрирующие ткани полипа CD68+-макрофаги наблюдались при всех исследованных формах полипоза (рис. 2а–г). Выраженная макрофагальная инфильтрация была выявлена при ХПРС, протекающем на фоне БА, в особенности сопровождающимся астматической триадой (рис. 2г). Распределение CD68+-макрофагов в полипозной ткани отличалось следующими особенностями: в пределах эпителиального слоя наблюдалось внутриэпителиальное и субэпителиальное расположение CD68+-макрофагов (рис. 2а, в). В соединительно-тканной строме полипа макрофаги обнаруживались в сосудах или около них (рис. 2б), а также иногда располагались в ткани вне связи с сосудами (рис. 2б–г).
Рис. 2.
Иммуногистохимическое выявление CD68+-макрофагов в полипозной ткани. а – Внутриэпителиальная локализация макрофагов при контролируемой форме ХПРС. б – Макрофаги в соединительно-тканой строме полипа (стрелка в центре) в кровеносном сосуде и рядом (стрелка справа) в ткани вне связи с сосудами при ХПРС + БА. в, г – Выраженная инфильтрация макрофагами на срезах полипа при ХПРС + астматическая триада. в – Субэпителиальная область, г – соединительно-тканная строма полипа. Стрелки – CD68+-макрофаги. Обозначения: КРС – кровеносный сосуд, ЭП – эпителий, покрывающий полип. Увеличение объектива: 100× (а, г) и 20× (б, в).
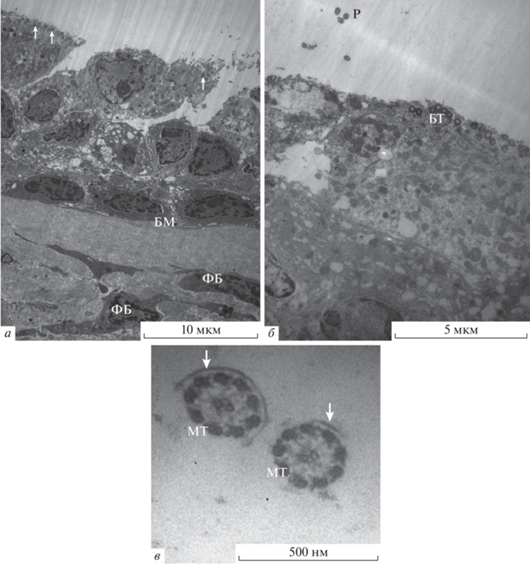
Электронно-микроскопическое исследование полипов. При проведении электронно-микроскопического исследования образцов полипов нами установлено, что в некоторых участках исследованных полипов изолирующие плотные контакты между соседними клетками эпителия не сформированы. Эпителиальные клетки слабо контактируют друг с другом латеральными пальцевидными выростами – интердигитациями, или не контактируют вовсе. В результате, между соседними эпителиальными клетками появляются щели размером около 1 мкм, с обнажением соответствующих участков базальной мембраны. При контролируемой форме ХПРС эпителий полипа в описываемых зонах преимущественно однорядный, форма клеток кубическая, высота эпителия в среднем 6–8 мкм. Реснички на апикальной поверхности эпителиальных клеток, как правило, отсутствуют (рис. 3а). В ряде случаев были отмечены картины некротической гибели эпителиальных клеток; при этом размер щелей между сохранившимися эпителиоцитами возрастает до размера погибшей клетки – 5–8 мкм (рис. 3б). Следует отметить также, что иногда в полипозном эпителии происходит утрата не только клеточного компонента эпителиального слоя, но и части его БМ. Обнажившийся таким образом участок соединительно-тканного внеклеточного матрикса может заселяться гранулоцитами из состава инфильтрата (рис. 3в). При неконтролируемой форме ХПРС в некоторых эпителиальных клетках цитоплазма заполнена многочисленными плотно упакованными нитями тонофиламентов, что, по-видимому, свидетельствует о начале частичной кератинизации данного эпителия (рис. 3г).
Рис. 3.
Эпителий полипа при контролируемой (а–в) и неконтролируемой (г) форме ХПРС. Трансмиссионная электронная микроскопия. а – Однорядный эпителий со щелями (стрелки) между соседними клетками; б – некроз эпителиальной клетки, с появлением щели в эпителии размером 5–7 мкм; в – частичная утрата базальной мембраны эпителия и миграция гранулоцита в данную область, стрелки – нарушение целостности базальной мембраны; г – многочисленные пучки тонофиламентов в цитоплазме эпителиальной клетки. Обозначения: БМ – базальная мембрана, ГЦ – гранулоцит, Э – эпителиальная клетка.

Другим возможным вариантом комплексных ультраструктурных перестроек респираторного эпителия полипов является его метаплазия в многослойный плоский эпителий. При неконтролируемой форме ХПРС (ХПРС+БА) количество клеточных слоев в составе такого многослойного эпителия может варьировать от 3 до 7 и более, что, очевидно, отражает степень прогрессии процесса метаплазии. Базальный слой клеток, контактирующий с базальной мембраной, обычно представлен некрупными электронно-плотными уплощенными клетками высотой около 5 мкм, с правильными овальными ядрами (рис. 4а). Апикальнее в эпителиальном пласте располагаются более крупные (8–10 мкм) клетки неправильной формы, цитоплазма которых часто бывает сильно вакуолизирована (рис. 4а, б). Апикально расположенные клетки в составе многослойного эпителия полипа часто содержат в цитоплазме многочисленные базальные тельца ресничек (рис. 4а, б). При этом сами реснички очень редко обнаруживаются на ультратонких срезах (рис. 4б), что заставляет говорить об их деструкции в рассматриваемом видоизмененном эпителии полипа.
Рис. 4.
Ультраструктура эпителия полипа при неконтролируемой форме ХПРС (ХПРС + БА). Видны ранние этапы метаплазии респираторного эпителия в многослойный плоский эпителий. а, б – В апикально расположенных эпителиальных клетках выявляются многочисленные базальные тельца ресничек, но сами реснички (Р) встречаются редко. в – Частичная утрата плазматической мембраны, обнаруживаемая на поперечных срезах ресничек. Стрелки – сохранившиеся фрагменты мембраны в ресничках. Обозначения: БТ – базальные тельца, БМ – базальная мембрана, МТ – микротрубочки, ФБ – фибробласты.
При детальном ультраструктурном анализе срезов немногочисленных выявленных ресничек обнаруживается, что в них сохраняется характерный набор микротрубочек и ассоциированных с ними моторных белков (аксонемный комплекс), однако одновременно частично или почти полностью утрачивается плазматическая мембрана, окружающая ресничку (рис. 4в).
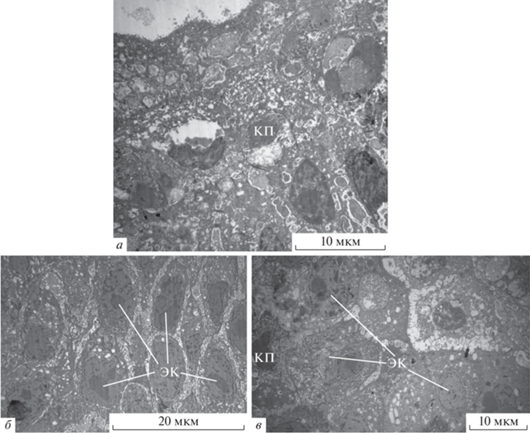
При неконтролируемой форме ХПРС (ХПРС + + астматическая триада) в некоторых случаях на ультратонких срезах полипов наблюдаются и более продвинутые стадии метаплазии эпителия в многослойный плоский эпителий, сопровождающиеся увеличением количества слоев клеток до 7 и более, значительным увеличением электронной плотности клеток, массовым кариопикнозом и практически полной деструкцией органоидов цитоплазмы (рис. 5). В составе такого многослойного полипозного эпителия реснички не обнаруживаются.
Рис. 5.
Эпителий полипа при неконтролируемой форме ХПРС (ХПРС + астматическая триада). Поздние этапы метаплазии респираторного эпителия в многослойный плоский эпителий (а–в). Наблюдается увеличение числа клеточных слоев, кариопикноз, деструкция органоидов цитоплазмы. Обозначения: ЭК – эпителиальные клетки, КП – кариопикноз.
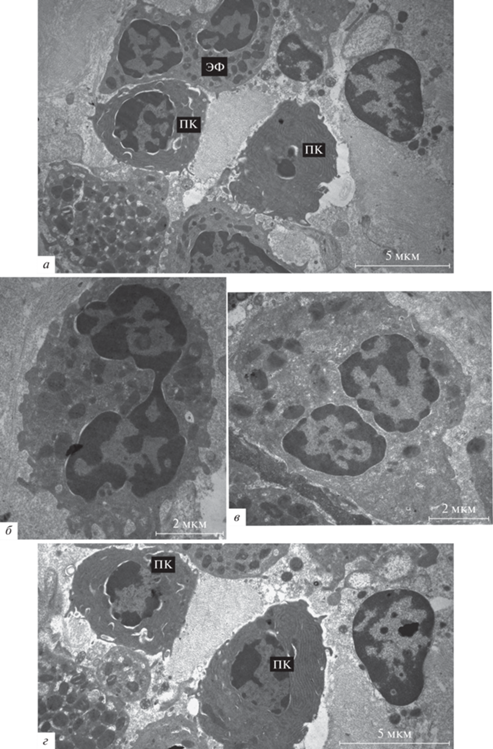
Электронно-микроскопическое исследование стромы полипа выявило ее активную лейкоцитарную инфильтрацию. Как правило, воспалительные иммунные клетки инфильтрата формируют небольшие кластеры (10–20 клеток) в соединительной ткани полипа, без очевидной ассоциации с кровеносными сосудами (рис. 6а). Популяция лейкоцитов в составе инфильтрата гетерогенна. Значительную ее часть во всех исследованных полипах составляют эозинофилы с сегментированным ядром и многочисленными гранулами в цитоплазме, содержащими кристаллоподобные включения (рис. 6б, в), и плазматические клетки. Плазматические клетки (рис. 6г) характеризуются мощным развитием шероховатого эндоплазматического ретикулума (шЭПР).
Рис. 6.
Лейкоцитарная инфильтрация в строме полипов. а – Кластер клеток лейкоцитарного инфильтрата в соединительно-тканной строме полипа при неконтролируемой форме ХПРС. б, в – Эозинофилы в собственной пластинке полипов при контролируемой (б) и неконтролируемой (в) форме ХПРС. Наблюдаются сегментированные ядра и кристаллоподобные включения в составе гранул. г – Зрелые плазматические клетки в собственной пластинке полипа при неконтролируемой форме ХПРС. Обозначения: ПК – плазматические клетки, ЭФ – эозинофил.
В собственной пластинке полипов обнаруживается значительное количество кровеносных капилляров (рис. 7а). На препаратах визуализируются фенестрации между отдельными эндотелиальными клетками (рис. 7а). Также наблюдается истончение эндотелиальной выстилки (рис. 7а). Стенки капилляров в составе полипов тесно ассоциированы с сетью тонких удлиненных отростков (телоподий), принадлежащих специализированным периваскулярным интерстициальным клеткам – телоцитам (рис. 7а).
Рис. 7.
Строма полипа при неконтролируемой форме ХПРС. а – Кровеносный капилляр в собственной пластинке полипа. Стрелки – отростки телоцитов (телоподии), ассоциированные с эндотелием капилляров. б – Гладкомышечные клетки, окруженные базальной мембраной, в строме полипа при ХПРС + БА. Видны многочисленные кавеолы на плазматической мембране гладкомышечных клеток (стрелки). в – Секреторные клетки слизистой железы в составе полипа при ХПРС + БА. Обозначения: БМ – базальная мембрана, СГ – секреторные гранулы. ЭЦ – эритроциты, ЭНД – эндотелий.
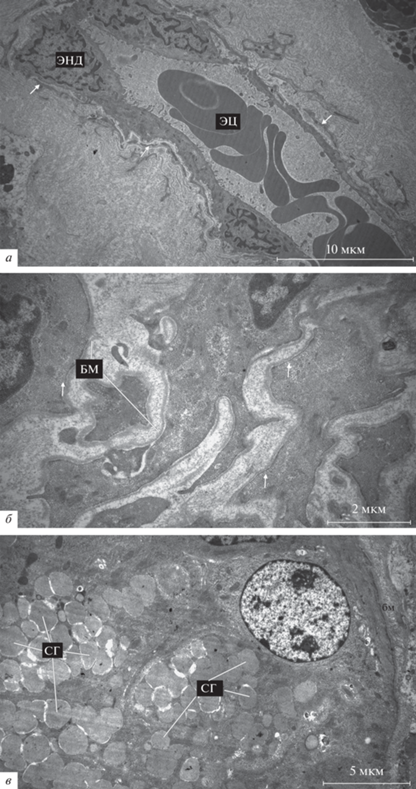
В соединительно-тканной строме полипов обнаруживаются также небольшие группы гладкомышечных клеток, окружeнных собственной базальной мембраной. Особенностью ультраструктуры гладкомышечных клеток является огромное количество мелких (80–100 нм) пиноцитозных везикул колбовидной формы – кавеол, связанных с плазматической мембраной (рис. 7б). В составе полипов присутствуют также слизистые железы, секреторные клетки которых заполнены множеством электронно-прозрачных секреторных гранул (рис. 7в).
ОБСУЖДЕНИЕ
Эпителий полости носа в норме служит не только механическим барьером для защиты от факторов окружающей среды, микроорганизмов и токсинов, но также участвует как во врожденном, так и в адаптивном иммунном ответе (Yan et al., 2013). В нормальном эпителии дыхательных путей баланс обновления и дифференцировки клеток регулируется рядом генов и клеточных сигнальных путей. При воспалении слизистой оболочки эпителий повреждается, после чего происходит быстрое ремоделирование, которое может варьировать от эпителиальной гиперплазии до метаплазии бокаловидных клеток, наблюдается потеря ресничек, фиброз или утолщение базальной мембраны (БМ).
Проведенный нами гистологический анализ показал, что при контролируемой и при неконтролируемой формах течения ХПРС наблюдается гипертрофия ресничек на реснитчатых клетках, а также гипертрофия бокаловидных клеток, продуцирующих слизь. Этот факт был описан и другими авторами, которые отмечали большое количество бокаловидных клеток в эпителии полипов, при этом клетки с нормальной ультраструктурой секреторных гранул и микровилл встречались очень редко (Ильинская, Захарова, 2001). Мы наблюдали на препаратах признаки дистрофических изменений эпителия (отрыв апикальной части и разрушение клеток). При ХПРС, протекающем на фоне БА, изменения эпителия становятся наиболее выраженными. При ХПРС + БА наблюдаются ранние признаки метаплазии респираторного эпителия, а при ХПРС на фоне астматической триады – признаки поздней метаплазии эпителия. Эпителий из многорядного становится многослойным, часть клеток не имеют связи с базальной мембраной, клетки эпителия утрачивают реснички, не наблюдаются бокаловидные клетки, продуцирующие слизь.
Выполненное в нашей работе электронно-микроскопическое исследование образцов полипов выявило ряд ультраструктурных особенностей, отражающих течение патологического процесса в полипозной ткани. Нами установлено, что покрывающий полип респираторный эпителий претерпевает значительные изменения своей морфологической и функциональной организации, причeм эти изменения могут носить разнонаправленный характер. В частности, в некоторых участках исследованных полипов отмечена очевидная утрата эпителием барьерной функции. В этих областях изолирующие плотные контакты между соседними клетками эпителия не сформированы, между соседними эпителиальными клетками появляются щели с обнажением соответствующих участков БМ, отмечены картины некротической гибели эпителиальных клеток. Реснички на апикальной поверхности эпителиальных клеток, как правило, отсутствуют. Происходит утрата не только клеточного компонента эпителиального слоя, но и части БМ, при этом обнажается участок соединительно-тканного внеклеточного матрикса. Обнаружено, что в некоторых эпителиальных клетках цитоплазма заполнена нитями тонофиламентов, что, по-видимому, свидетельствует о начале частичной кератинизации данного эпителия. Другим возможным комплексом ультраструктурных перестроек респираторного эпителия полипов является его метаплазия в многослойный плоский эпителий. Количество клеточных слоев в составе такого многослойного эпителия может варьировать от 3 до 7 и более, что, очевидно, отражает степень прогрессии процесса метаплазии. В составе многослойного эпителия полипа часто обнаруживали клетки, которые содержат в цитоплазме многочисленные базальные тельца ресничек. При этом сами реснички очень редко обнаруживаются на ультратонких срезах, что заставляет говорить об их деструкции в рассматриваемом видоизменeнном эпителии полипа. В ресничках сохраняется характерный набор микротрубочек и ассоциированных с ними моторных белков (аксонемный комплекс), однако одновременно частично или почти полностью утрачивается плазматическая мембрана, окружающая ресничку. При ХПРС, протекающем на фоне БА и, особенно, сопровождающемся астматической триадой, на ультратонких срезах полипов наблюдаются и более продвинутые стадии метаплазии эпителия в многослойный плоский эпителий. Эпителиальная метаплазия при этом сопровождается увеличением количества слоeв клеток до 7 и более, массовым кариопикнозом и практически полной деструкцией органоидов цитоплазмы. В составе такого многослойного полипозного эпителия реснички не обнаруживаются. По нашему мнению, вышеописанные изменения в эпителии (утрата ресничек, гибель эпителиальных клеток, увеличение слоев клеток, массовый кариопикноз) имеют связь с невосприимчивостью полипозной ткани к терапии кортикостероидами при неконтролируемой форме ХПРС.
Полученные в нашей работе данные о том, что при метаплазии эпителия полипа реснитчатые клетки демонстрируют аномальные реснички или потерю ресничек подтверждаются опубликованными в литературе результатами (Ильинская, Захарова, 2001; Yan et al., 2013). Аномальная архитектура ресничек наблюдалась у пациентов с полипами с помощью сканирующей электронной микроскопии. Аномалии в строении ресничек приводят к нарушениям функции мукоцилиарного клиренса. Частота цилиарного ритма ресничек эпителия in vitro значительно снижена у пациентов с полипозом (Yan et al., 2013). Таким образом, морфологические признаки эпителиальной гиперплазии сопровождаются нарушением подвижности ресничек. Движения ресничек клеток эпителия дыхательных путей играют важную роль в освобождении от инородных тел, включая патогены и аллергены с поверхности эпителия, и тем самым защищают ткани от вредных факторов. Нарушение данной функции является вероятной причиной хронического воспаления слизистой оболочки, персистирования инфекции и играет роль при развитии аллергических процессов при ХПРС. По нашим данным, покрывающий поверхность полипа респираторный эпителий может претерпевать глубокие дегенеративные изменения, с полной утратой им как барьерной функции, так и функции мукоцилиарного клиренса. Эти результаты согласуются с имеющимися в литературе характеристиками ультраструктурных изменений эпителия полипов (Ильинская, Захарова, 2001; Kuhar et al., 2017). Ранее при электронно-микроскопическом исследовании было показано статистически значимое увеличение толщины БМ, усиление субэпителиального отека и фиброза в полипах (Kuhar et al., 2017). У пациентов с полипами толщина БМ коррелирует с симптомами и показателями качества жизни. Было показано, что толщина БМ при полипозном процессе значительно превышает таковую у пациентов с риносинуситом без полипов (Kim et al., 2007). Предполагают, что утолщение БМ является компенсаторной реакцией слизистой оболочки на нарушение целостности и проницаемости эпителильного слоя (Ильинская, Захарова, 2001). Также было отмечено, что при полипозе респираторный эпителий околоносовых пазух подвергался более выраженным изменениям, чем эпителий самого полипа. По-видимому, это связано с нарушениями вегетативной иннервации слизистой оболочки пазух. Действительно, нервная система может оказывать влияние на воспалительные/иммунные реакции. В частности, продемонстрирована парасимпатическая гиперактивность у пациентов с аллергическим ринитом (Ozsutcu et al., 2013). Выявлено, что в носовом полипе снижена реактивность биения ресничек в ответ на ацетилхолин (Do et al., 2019).
Важнейшей морфологической особенностью стромы полипа является ее активная лейкоцитарная инфильтрация. Гистологический анализ выявил наличие воспалительной инфильтрации как при контролируемой, так и при неконтролируемой формах ХПРС. По нашим данным, умеренная инфильтрация воспалительными иммунными клетками представлена эозинофилами, лимфоцитами, плазматическими клетками. При ХПРС на фоне астматической триады лейкоцитарная инфильтрация являлась наиболее выраженной. Электронно-микроскопическое исследование подтвердило, что популяция лейкоцитов в составе инфильтрата гетерогенна, во всех исследованных образцах присутствуют эозинофилы и плазматические клетки. Цитоплазма эозинофилов содержит большое количество гранул с кристаллической структурой, что отражает зрелое состояние этих клеток. Плазматические клетки характеризуются мощным развитием шЭПР, что свидетельствует об их полностью зрелом, активированном состоянии в строме полипа.
Лейкоцитарная инфильтрация слизистой оболочки носа и полипов формируется с участием цитокинов и специфических хемокинов, которые продуцируются в очаге под действием повреждения или инфекции (Meng et al., 2013). Продукция в воспалительном микроокружении хемокина IL-8 вызывает приток нейтрофильных гранулоцитов (Henriquez et al., 2015). Привлечение эозинофилов в слизистую оболочку носа требует сложного взаимодействия между клетками эпителия, Th2-лимфоцитами и цитокинами (Vanderhaegen et al., 2021). Значительная эозинофильная инфильтрация полипозной ткани, как показано, обычно связана с более тяжелыми формами заболевания (Kuhar et al., 2017). Инфильтрация эозинофилами, нейтрофилами и плазматическими клетки была ранее обнаружена при ультраструктурном анализе слизистой оболочки при полипозном и полипозно-гнойном ринусинусите и другими авторами (Ильинская, Захарова, 2005). Нейтрофильная инфильтрация была характерна в основном для полипозно-гнойного ринусинусита. Для зрелых плазматических клеток наблюдалось характерное расширение цистерн шЭПР и тесная связь цистерн с митохондриями, что отражает активный синтез иммуноглобулинов, их предшественников на мембранах шЭПР этих клеток и накопление данных белков в цистернах (Ильинская, Захарова, 2005).
При гистологическом исследовании в собственном слое слизистой оболочки полипов выявляли инфильтрацию мононуклеарными клетками. Для дифференцировки макрофагов выполняли иммуногистохимическое исследование с помощью антител к макрофагальному маркеру CD68. Антитела к CD68 распознают гликопротеин массой 110 кДа, который является частью лизосом, и наличие большого количества лизосом в цитоплазме обуславливает положительную реакцию макрофагальных клеток. Инфильтрирующие ткани полипа CD68+-макрофаги наблюдались при всех исследованных формах полипоза, выраженная макрофагальная инфильтрация была выявлена при ХПРС, протекающем на фоне БА, в особенности сопровождающимся астматической триадой. Воспалительная реакция с участием врожденного иммунного ответа при ХПРС – это сложный процесс, в котором участвуют антиген-презентирующие клетки, такие как дендритные клетки, моноциты и макрофаги. Роль CD68+-макрофагов в патогенезе назальных полипов находится под пристальным вниманием исследователей (Banks et al., 2018; Muluk et al., 2020). Макрофаги являются основными продуцентами цитокинов в очаге воспаления, осуществляют презентацию антигена и фагоцитоз. Макрофаги могут как прямо, так и косвенно индуцировать продукцию Th2-цитокинов, хотя их роль при ХПРС остается недостаточно изученной. Полученные в нашей работе результаты согласуются с литературными данными. Многочисленные CD68-положительные клетки с морфологическими признаками макрофагов были обнаружены в эпителии и в собственной пластинке полипов (Muluk et al., 2021). В субэпителиальном и глубоких слоях собственной пластинки CD68-положительные макрофаги, как правило, собираются вокруг эозинофилов и могут фагоцитировать эти клетки (Muluk et al., 2021). Авторы полагают, что повышенное содержание макрофагов в полипозной ткани не вызывает рост носовых полипов, а вместо этого макрофаги уменьшают количество эозинофилов в уже развившихся полипах носа. В другом исследовании было обнаружено наличие локальной макрофагальной инфильтрации в тканях полипов при назальном полипозе, при этом количество макрофагов не зависело от атопического статуса пациента (Banks еt al., 2014). Показано, что продукция хемокинов CCL23, МСР-1, которые участвуют в рекрутировании макрофагов, значительно повышается в полипозной ткани. CCL23, как известно, связывается с CCR1 и привлекает моноциты, макрофаги и дендритные клетки в очаг воспаления. Уровни белка CCL23 были значительно повышены в полипах от пациентов с чувствительностью к аспирину (Poposki et al., 2011). Это позволяет объяснить увеличение количества макрофагов на срезах биопсий у пациентов с астматической триадой в нашем исследовании.
Макрофаги можно разделить на 2 фенотипа – М1 и М2. Макрофаги M1 обладают провоспалительными функциями и нацелены на элиминацию внутриклеточных патогенов. Макрофаги М2 праймируются Th2 цитокинами, усиливают Th2-опосредованный иммунный ответ и играют роль при аллергических заболеваниях. Было показано, что CD68+-макрофаги M1 в полипозной ткани экспрессируют IL-17A (Ryu et al., 2020). Известно, что Th17-ассоциированное воспаление усиливается при хроническом полипозном риносинусите и связано с тяжестью заболевания и резистентностью к стероидам. Обнаружено, что количество макрофагов M2 в слизистых оболочках носовой полости значительно увеличивается при полипозном процессе. Снижение фагоцитоза S. aureus и активация макрофагов с фенотипом M2 способствовали сохранению хронического воспаления. Маркеры Th2-иммунного ответа положительно коррелировали с повышенным количеством макрофагов (Krysko et al., 2010). Макрофаги М2 характеризуются высокой экспрессией интерлейкина-10 (IL-10), что имеет решающее значение для разрешения воспаления. Показано, что при эозинофильной форме ХПРС происходит нарушение продукции IL-10 макрофагами М2, что способствует устойчивому характеру протекания воспаления (Wang et al., 2018).
В соединительно-тканной строме полипов были обнаружены небольшие группы гладкомышечных клеток, окруженных собственной базальной мембраной. В составе полипов присутствуют также слизистые железы, в ряде случаев при неконтролируемом ХПРС наблюдали их гипертрофию.
Известно, что полипозная ткань характеризуется активным ангиогенезом. При ультраструктурном исследовании в собственной пластинке полипов было выявлено значительное количество кровеносных капилляров. При этом происходят изменения морфологии кровеносных сосудов: наблюдаются фенестрации между отдельными эпителиальными клетками и истончение эндотелиальной выстилки. Полученные результаты подтверждаются данными других исследователей, изучавших ультраструктуру кровеносных сосудов при назальном полипозе. По данным трасмиссионной электронной микроскопии, увеличение размера фенестраций между структурами межэндотелиального соединения свидетельствует о сосудистой дисрегуляции, вызванной воспалением при ХПРС (Khurana et al., 2020). При ХПРС наблюдают значительное увеличение васкуляризации, экспрессии проангиогенных генов и белков (Khurana et al., 2020). Стенки капилляров в составе полипов, по нашим наблюдениям, ассоциированы с периваскулярными интерстициальными клетками – телоцитами. По современным представлениям, именно телоциты являются важнейшим клеточным фактором регуляции ангиогенеза в норме и при разнообразных патологических процессах (Zhang, 2016).
Анализ патоморфологической картины полипов позволил нам выявить особенности протекания процессов воспаления и ремоделирования в полипозной ткани при контролируемой и неконтролируемой формах заболевания. В результате проведенного комплексного исследования на тканевом, клеточном и субклеточном уровнях были обнаружены изменения в структуре слизистой оболочки полипов. Гистологический анализ показал различия в выраженности изменений покровного эпителия полипозной ткани и качественном составе клеток, инфильтрирующих собственный слой слизистой полипов. При иммуногистохимическом исследовании в составе воспалительных инфильтратов были дифференцированы активированные макрофаги. Электронно-микроскопическое исследование образцов полипов выявило ряд ультраструктурных особенностей, отражающих течение патологического процесса в полипозной ткани. Эти процессы включают в себя деструкцию и дисфункцию эпителия, эпителиальную метаплазию, обширную лейкоцитарную инфильтрацию стромы полипа, патологический ангиогенез. Выраженность и направленность перечисленных изменений связаны с тяжестью и формой ХПРС. По нашему мнению, выявленные изменения в эпителии имеют связь с невосприимчивостью полипозной ткани к терапии кортикостероидами при неконтролируемой форме ХПРС.
Список литературы
Ильинская Е.В., Захарова Г.П. 2001.Особенности ультраструктуры эпителия слизистой оболочки верхнечелюстных пазух при хроническом полипозном и полипозно-гнойном риносинусите. Российская ринология. № 4. С. 8. (Ilyinskaya E.V., Zakharova G.P. 2001. Features of the ultrastructure of the epithelium of the mucous membrane of the maxillary sinuses in chronic polypous and polypous-purulent rhinosinusitis. Russian rhinology. № 4. P. 8.)
Ильинская Е.В., Захарова Г.П. 2005. Особенности распределения и ультраструктуры иммунокомпетентных клеток в слизистой оболочке больных хроническими полипозными риносинуситами. Российская оториноларингология. № 1. С. 6. (Ilyinskaya E.V., Zakharova G.P. 2005. Features of the distribution and ultrastructure of immunocompetent cells in the mucosa of patients with chronic polypous rhinosinusitis. Russian otorhinolaryngology. № 1. P. 6.)
Пискунов Г.З. 2003. Полипоз носа, околоносовых пазух и его лечение. Российская ринология. № 2. С. 10. (Piskunov G.Z. 2003. Polyposis of the nose, paranasal sinuses and its treatment. Russian Rhinology. № 2. P. 10.)
Пискунов Г.З. 2019. Клинические фенотипы полипозного риносинусита. Российская ринология. Т. 27. № 4. С. 224. (Piskunov G.Z. 2019. Clinical phenotypes of polyposis rhinosinusitis. Russian Rhinology. V. 27. № 4. P. 224). https://doi.org/10.17116/rosrino201927041224
Bachert C., Han J.K., Wagenmann M., Hosemann W., Lee S.E., Backer V., Mullol J., Gevaert P., Klimek L., Prokopakis E., Knill A., Cavaliere C., Hopkins C., Hellings P. 2021. EUFOREA expert board meeting on uncontrolled severe chronic rhinosinusitis with nasal polyps (CRSwNP) and biologics: Definitions and management. J. Allergy Clin. Immunol. V. 147. № 1. P. 29. https://doi.org/10.1016/j.jaci.2020.11.013
Banks C.A., Schlosser R.J., Wang E.W., Casey S.E., Mulligan R.M., Mulligan J.K. 2014. Macrophage infiltrate is elevated in CRSwNP sinonasal tissue regardless of atopic status. otolaryngology head and neck surgery. V. 151. P. 215. https://doi.org/10.1177/0194599814528672
Do H.B., Ohbuchi T., Yokoyama M., Kitamura T., Wakasugi T., Ohkubo J.-I., Suzuki H. 2019. Decreased ciliary beat responsiveness to acetylcholine in the nasal polyp epithelium. Clinical Otolaryngology. V. 44. P. 356. https://doi.org/10.1111/coa.13312
Fokkens W.J., Lund V.J., Hopkins C., Hellings P.W., Kern R., Reitsma S., Toppila-Salmi S., Bernal-Sprekelsen M., Mullol J., Alobid I., Terezinha Anselmo-Lima W., Bachert C., Baroody F., von Buchwald C., Cervin A. et al. 2020. European position paper on rhinosinusitis and nasal polyps. Rhinology. V. 58 (Suppl. S29). P. 1. https://doi.org/10.4193/Rhin20.600
Fokkens W.J., Lund V.J., Mullol J., Bachert C., Alobid I., Baroody F., Cohen N., Cervin A., Douglas R., Gevaert P., Georgalas C., Goossens H., Harvey R., Hellings P., Hopkins C. et al. 2012. European position paper on rhinosinusitis and nasal polyps. Rhinol. Suppl. V. 23: 3 p preceding table of contents. P. 1.
Heffler E., Malvezzi L., Boita M., Brussino L., De Virgilio A., Ferrando M., Puggioni F., Racca F., Stomeo N., Spriano G.M., Canonica G.W. 2018. Immunological mechanisms underlying chronic rhinosinusitis with nasal polyps. Expert Review of Clinical Immunology. https://doi.org/10.1080/1744666x.2018.1512407
Hellings P.W., Fokkens W.J., Akdis C., Bachert C., Cingi C., Dietz de Loos D., Gevaert P., Hox V., Kalogjera L., Lund V., Mullol J., Papadopoulos N.G., Passalacqua G., Rondón C., Scadding G. et al. 2013. Uncontrolled allergic rhinitis and chronic rhinosinusitis: where do we stand today? Allergy. V. 68. № 1. P. 1. https://doi.org/10.1111/all.12040
Henriquez K.M., Hayney M.S., Xie Y., Zhang Z., Barrett B. 2015. Association of interleukin-8 and neutrophils with nasal symptom severity during acute respiratory infection. J. Med. Virol. V. 87. P. 330. https://doi.org/10.1002/jmv.24042
Khurana N., Pulsiphe A., Jedrzkiewicz J., Ashby S., Pollard C.E., Ghandehari H., Alt J.A. 2020. Inflammation-driven vascular dysregulation in chronic rhinosinusitis. International Forum of Allergy & Rhinology. https://doi.org/10.1002/alr.22723
Kim J.-W., Hong S.-L., Kim Y.-K., Lee C.H., Min Y.-G., Rhee C.-S. 2007. Histological and immunological features of non-eosinophilic nasal polyps. Otolaryngology-Head and Neck Surgery. V. 137. P. 925. https://doi.org/10.1016/j.otohns.2007.07.036
Krysko O., Holtappels G., Zhang N., Kubica M., Deswarte K., Derycke L., Claeys S., Hammad H., Brusselle G.G., Vandenabeel P., Krysko D.V., Bachert C. 2010. Alternatively activated macrophages and impaired phagocytosis of S. aureus in chronic rhinosinusitis. Allergy. V. 66. P. 396.https://doi.org/10.1111/j.1398-9995.2010.02498.x
Kuhar H.N., Tajudeen B.A., Mahdavinia M., Gattuso P., Ghai R., Batra P.S. 2017. Inflammatory infiltrate and mucosal remodeling in chronic rhinosinusitis with and without polyps: structured histopathologic analysis. International Forum of Allergy and Rhinology. V. 7. P. 679. https://doi.org/10.1002/alr.21943
Laidlaw T.M., Mullol J., Woessner K.M., Amin N., Mannent L.P. 2021. Chronic Rhinosinusitis with Nasal Polyps and Asthma. J. Allergy Clin. Immunol. Pract. V. 9. P. 1133. https://doi.org/10.1016/j.jaip.2020.09.063
Li Y.Y., Li C.W., Chao S.S., Yu F.G., Yu X.M., Liu J., Yan Y., Shen L., Gordon W., Shi L., Wang D.Y. 2014. Impairment of cilia architecture and ciliogenesis in hyperplastic nasal epithelium from nasal polyps. Journal of Allergy and Clinical Immunology. V. 134. P. 1282. https://doi.org/10.1016/j.jaci.2014.07.038
Meng J., Zhou P., Liu Y., Liu F., Yi X., Liu S., Holtappels G., Claus Bachert C., Zhang N. 2013. The development of nasal polyp disease involves early nasal mucosal inflammation and remodelling. PLoS One. V. 8. e82373. https://doi.org/10.1371/journal.pone.0082373
Muluk N.B., Arikan O.K., Atasoy P., Kiliç R., Yalçinozan E.T. 2020.The role of CD68 (+) histiocytic macrophages in nasal polyp development. J. Neurol. Surg. B. Skull Base. V. 82. P. 700. https://doi.org/10.1055/s-0040-1715593
Ozsutcu M., Ozkaya E., Demir A., Erenberk U., Sogut A., Dundaroz R. 2013. Pupillometric assessment of autonomic nervous system in children with allergic rhinitis. Medical Principles and Practice. V. 22. P. 444. https://doi.org/10.1159/000350292
Poposki J.A., Uzzaman A., Nagarkar D.R., Chustz R.T., Peters A.T., Suh L.A., Carter R., Norton J., Harris K.E., Grammer L.C., Tan B.K., Chandra R.K., Conley D.B., Kern R.C., Schleimer R.P. et al. 2011. Increased expression of the chemokine CCL23 in eosinophilic chronic rhinosinusitis with nasal polyps. Journal of Allergy and Clinical Immunology. V. 128. P. 73. e4. http://doi.org/10.1016/j.jaci.2011.03.017
Pyo J.-S., Kim S.J. 2021. Relationship between histologic changes and inflammatory markers in chronic rhinosinusitis. Int. J. Clin. Exp. Pathol. V. 14. P. 501.
Ryu G., Bae J.-S., Kim J.H., Kim E.H., Lyu L., Chung Y.-J., Mo J.-H. 2020. Role of IL-17A in chronic rhinosinusitis with nasal polyp. Allergy Asthma Immunol. Res. V. 12. P. 507. https://doi.org/10.4168/aair.2020.12.3.507
Ryu G., Kim D.W. 2019. Th2 inflammatory responses in the development of nasal polyps and chronic rhinosinusitis. Current Opinion in Allergy and Clinical Immunology. V. 20. P. 1. https://doi.org/10.1097/aci.0000000000000588
Shay A.D., Tajudeen B.A. 2018. Histopathologic analysis in the diagnosis and management of chronic rhinosinusitis. Current Opinion in Otolaryngology and Head and Neck Surgery. V. 27. P. 20. https://doi.org/10.1097/moo.0000000000000510
Toma S., Hopkins C. 2016. Stratification of SNOT-22 scores into mild, moderate or severe and relationship with other subjective instruments. Rhinology. V. 54. № 2. P. 129. https://doi.org/10.4193/Rhino15.072
Vanderhaegen T., Gengler I., Dendooven A., Chenivesse C., Lefèvre G., Mortuaire G. Eosinophils in the field of nasal polyposis: towards a better understanding of biologic therapies. Clin. Rev. Allergy Immunol. 2021. V. 62. P. 90. https://doi.org/10.1007/s12016-021-08844-7
Viksne R.J., Sumeraga G., Pilmane M. 2021. Characterization of cytokines and proliferation marker Ki67 in chronic rhinosinusitis with nasal polyps: A pilot study. Medicina (Kaunas). V. 57. P. 607.
Wang Z.-C., Yao Y., Wang N., Liu J.-X., Ma J., Chen C.-L., Deng Y.-K., Wang M.-C., Liu Y., Zhang X.-H., Liu Z. 2018. Deficiency in interleukin-10 production by M2 macrophages in eosinophilic chronic rhinosinusitis with nasal polyps. International Forum of Allergy and Rhinology. https://doi.org/10.1002/alr.22218
Yan Y., Gordon W.M., Wang D.-Y. 2013. Nasal epithelial repair and remodeling in physical injury, infection, and inflammatory diseases. Current Opinion in Otolaryngology and Head and Neck Surgery. V. 21. P. 263. https://doi.org/10.1097/moo.0b013e32835f80a0
Zhang H. 2016. Vascular telocytes. Telocytes. P. 377.https://doi.org/10.1007/978-981-10-1061-3_24
Дополнительные материалы отсутствуют.


