Цитология, 2022, T. 64, № 5, стр. 485-494
Строение и динамика количества гемопоэтических клеток костного мозга крыс после введения магнитолипосом
И. В. Мильто 1, 2, *, Н. М. Шевцова 1, В. В. Иванова 1, О. Н. Серебрякова 1, Р. М. Тахауов 1, 2, И. В. Суходоло 1
1 Кафедра морфологии и общей патологии Сибирского государственного медицинского университета Минздрава России
634050 Томск, Россия
2 Северский биофизический научный центр Федерального медико-биологического агентства России
636013 Северск, Россия
* E-mail: milto_bio@mail.ru
Поступила в редакцию 03.06.2022
После доработки 05.07.2022
Принята к публикации 11.07.2022
- EDN: KAPYWU
- DOI: 10.31857/S0041377122050078
Аннотация
Использование наночастиц магнетита в биологии и медицине неуклонно растет, при этом некоторые вопросы относительно их безопасности остаются неясными. Например, магнитолипосомы на основе наномагнетита являются многообещающей основой для создания новых лекарственных препаратов. В настоящей работе с помощью гематологических методов проведена сравнительная оценка изменения количества гемопоэтических клеток костного мозга у половозрелых беспородных крыс в течение 120 сут после внутривенного введения суспензии немодифицированных наночастиц магнетита (НЧМ) и магнитолипосом на их основе. Описаны особенности строения гемопоэтических клеток основных дифферонов костного мозга (эритроцитарного, гранулоцитарного, лимфоцитарного, моноцитарного и тромбоцитарного), а также определена динамика изменения их количества в течение эксперимента. Однократное внутривенное введение суспензии магнитолипосом на основе наночастиц магнетита в дозе 0.14 г (Fe3O4) на 1 кг массы тела (объем инъекции 3 мл) не вызывает изменения структуры и количества гемопоэтических клеток изучаемых дифферонов костного мозга крыс. Отсутствие негативного влияния магнитолипосом на основе наночастиц магнетита на структуру гемопоэтических клеток костного мозга позволяет рассматривать эти наноконструкции как перспективный магнитоуправляемый носитель для создания современных систем целевой доставки диагностических и терапевтических лекарственных средств.
Применение магнитных наноматериалов в биомедицинских исследованиях и медицине открывает новые возможности для изучения живых систем, а также для диагностики и лечения заболеваний (Wu et al., 2010; Kelly et al., 2011; Braham et al., 2018; Maladkar et al., 2020). Одним из самых популярных магнитных наноматериалов являются наночастицы магнетита (НЧМ), которые широко исследуются в связи с возможностью их применения для целевой хемо- и термотерапии, а также в диагностических целях (Wu et al., 2010; Garcia-Pinel et al., 2020). Несмотря на длительное изучение и широкое внедрение в различные сферы деятельности человека НЧМ, в настоящее время отсутствует однозначная позиция относительно их биологической безопасности, которая продолжает быть предметом научных исследований (Couto et al., 2014). В последнее десятилетие в связи с использованием наночастиц для визуализации костного мозга и их применением для его радиопротекции, интенсивно изучается влияние наночастиц на гемопоэтические клетки, а также особенности распределение наночастиц в костном мозге (Dadachova, 2013).
НЧМ широко используются для визуализации костного мозга при диагностике заболеваний кроветворной системы, а также для целевой доставки лекарственных препаратов в этот орган. Помимо этого, НЧМ применяют для радиопротекции костного мозга при лучевой терапии злокачественных новообразований в связи с высокой радиочувствительностью гемопоэтических клеток (Dadachova, 2013).
В связи с высокой склонностью НЧМ к агрегации, для биомедицинских целей их всегда подвергают поверхностной модификации, одним из вариантов которой является заключение НЧМ в оболочку из двойного слоя липидов (Couto et al., 2015). Липосомы с заключенными в них НЧМ называют магнитолипосомами (Soenen et al., 2011). Магнитолипосомы являются перспективной наноконструкцией для целевой доставки лекарственных средств и обладают рядом уникальных свойств, среди которых высокая биосовместимость, возможность проведения поверхностной модификации, способность переносить как гидрофильные (в полости), так и гидрофобные (в липидном бислое) соединения, сочетание визуализирующих и терапевтических агентов. Кроме того, имеется возможность создания магнитолипосом различных размеров в широком диапазоне (от 20 нм до более 1 мкм) (Soenen et al., 2011).
Вариабельность липидного состава оболочки магнитолипосом обеспечивает их эффективную функционализацию и делает их идеальной наноконструкцией для целевой доставки. Кроме того, магнитолипосомы можно визуализацировать с помощью разных методов (например, МРТ и флуоресценции), что обеспечивает надежный контроль их распределения и позволяет использовать их в биомедицинских целях (Kelly et al., 2011; Soenen et al., 2011).
Биосовместимость магнитолипосом для медицинского применения требует тщательного и всестороннего исследования. При этом особое внимание следует уделить взаимодействию НЧМ с кроветворной системой в связи с тем, что применение магнитолипосом может быть сопряжено с их внутрисосудистым введением (Ruiz et al., 2015). Изучение влияния магнитолипосом на основе НЧМ на кроветворные клетки костного мозга in vivo является важнейшим этапом изучения их биологических свойств.
Несмотря на то, что использование систем целевой доставки лекарственных препаратов на основе НЧМ будет способствовать снижению их повреждающего действия и улучшению эффективности терапии, необходимо оценить влияние данных наноконструкций на качественные и количественные показатели костного мозга.
Целью исследования являлась оценка влияния магнитолипосом на основе НЧМ после однократного внутривенного введения их суспензии на структуру и количество клеток эритроцитарного, гранулоциатрного, моноцитарного, лимфоцитарного и тромбоцитарного дифферонов костного мозга крыс.
МАТЕРИАЛ И МЕТОДИКА
Характеристика НЧМ. Изучаемые НЧМ являются сферическими частицами (средний диаметр 7 нм), которые образованы смесью оксидов железа(II) и (III). НЧМ синтезированы механохимическим способом в Отделе структурной макрокинетики ТНЦ СО РАН (Томск).
Приготовление суспензии немодифицированных НЧМ. Навеску немодифицированных НЧМ растворяли в стабилизирующем растворе (pH 7.4), в состав которого входили цитрат и хлорид натрия (РЕА-ХИМ, Россия), а также динатриевая соль HEPES (AppliChem, Германия).
Приготовление суспензии магнитолипосом. Получение магнитолипосом проводили путем совместной экструзии суспензии немодифицированных НЧМ и липидов (8 мг/мл) в виде эмульсии через поликарбонатные фильтры (Sartorius, Германия) с размером пор 100 нм. Водородный показатель суспензии составлял 7.4.
Эмульсию липидов готовили из 1,2-дипальмитоил-глицеро-3-фосфохолина (Lipoid GmbH, Германия), 1,2-дистеароил-глицеро-3-фосфохолина (Lipoid GmbH, Германия), холестерола, 1,2-дистеароил-глицеро-3-фосфоэтаноламина и ацетата α-токоферола (Avanti Polar Lipids, Inc., США). Молярное соотношение липидов сосьавляло 9 : 1 : 0.2 : 0.02 : 0.2 соответственно.
Стандартизация суспензий немодифицированных НЧМ и магнитолипосом. Рентгено-флуоресцентным методом (Quant’X, Thermo Scientific, Швейцария) устанавливали концентрацию НЧМ в суспензиях. Методом динамического светорассеяния (Zetasizer Nano ZS, Malvern Instruments, Великобритания) определяли размер структурных элементов суспензий. Структуру и форму частиц в суспензиях изучали с помощью трансмиссионного электронного микроскопа JEM-100 CX II (JEOL, Япония).
Дизайн эксперимента. Работа выполнена на 128 беспородных половозрелых (4-месячного возраста) крысах-самцах (150 ± 30 г), разделенных на 4 группы: интактные животные (24 крысы); животные с однократным введением 2 мл эмульсии полых липосом (8 мг/мл липидов; 24 крысы); животные с однократным введением 2 мл суспензии немодифицированных НЧМ (0.14 г (Fe3O4) на 1 кг массы тела; 40 крыс); животные с однократным введением 3 мл суспензии магнитолипосом (0.14 г (Fe3O4) на 1 кг массы тела; 40 крыс). Суспензию вводили крысам, находящимся в фиксаторе Когана, через хвостовые вены. Выведение животных из эксперимента осуществляли на 1, 7, 14, 21, 40, 60, 90 и 120 сут после введения суспензии путем асфиксии СО2.
Приготовление гематологических препаратов костного мозга. В течение 2–3 мин после выведения животного из эксперимента из костного мозга грудины крыс готовили мазки, которые высушивали, фиксировали в абсолютном метаноле и окрашивали по методу Романовского–Гимзы. Из костного мозга каждого животного готовили по 3 мазка. Окрашивание мазков костного мозга проводили согласно инструкции производителя раствора азур-эозина по Романовскому (МиниМед-Р, Россия) (Bolliger, 2004).
Исследование гематологических препаратов костного мозга. Окрашенные мазки костного мозга изучали с помощью светового микроскопа Axioscope 40 (Zeiss, Германия) с использованием объектива с масляной иммерсии и увеличением 100× и окуляра с увеличением 10×). На препаратах костного мозга крыс оценивали структуру гемопоэтических клеток и подсчитывали миелограмму. Для определения миелограммы считали не менее 1000 клеток в мазке костного мозга по правилу меандров. Для фотосъемки гемопоэтических клеток костного мозга использовали цифровую камеру Canon G5 (Canon, Япония). Определение размеров гемопоэтических клеток костного мозга проводили по фотографиям с помощью программы ImageJ 1.48 (NIH Image, США).
Статистическая обработка результатов. Количественные результаты обрабатывали с помощью программы “SPSS 11.5” и представляли в виде медианы (Ме), а также нижнего (Q25) и верхнего (Q75) квартилей. Вследствие того, что распределение не соответствовало нормальному (критерий Шапиро–Уилкса), для выяснения достоверности различий морфометрических показателей между экспериментальными группами использовали критерий Манна–Уитни для независимых выборок (p < 0.05). Сравнение параметров внутри групп проводили с применением критерия Вилкоксона для зависимых выборок (p < 0.05).
Реактивы. В работе использовали: азур-эозин по Романовскому (МиниМед-Р, Россия); динатриевую соль HEPES (AppliChem GmbH, Германия); хлорид натрия и цитрат натрия (РЕАХИМ, Россия); 1,2-дипальмитоил-глицеро-3-фосфохолин (Lipoid GmbH, Германия), 1,2-дистеароил-глицеро-3-фосфохолин (Lipoid GmbH, Германия); 1,2-дистеароил-глицеро-3-фосфоэтаноламин, холестерол и ацетат α-токоферола (Avanti Polar Lipids, Inc., США).
РЕЗУЛЬТАТЫ
Характеристика НЧМ. Немодифицированные НЧМ находятся в суспензии в виде отдельных сферических частиц и их агломератов. Физико-химические параметры суспензии немодифицированных НЧМ приведены в табл. 1
Таблица 1.
Физико-химические параметры эмульсии полых липосом, суспензии немодифицированных НЧМ и суспензии магнитолипосoм
| Объект | Физико-химические параметры суспензии/эмульсии | ||
|---|---|---|---|
| концентрация магнетита, мг/мл | средний размер структурного элемента, нм | диапазон изменения размера структурного элемента, нм | |
| Полые липосомы | – | 146 | 65–500 |
| Немодифицированные НЧМ | 7 | 90.4 | 45–300 |
| Магнитолипосомы | 4.8 | 75 | 60–80 |
Характеристика полых липосом. Липосомы представлены сферическими и эллиптическими полыми везикулами, стенка которых образована одним (моноламеллярные липосомы) или несколькими (полиламеллярные липосомы) липидными бислоями. Физико-химические параметры эмульсии полых липосом приведены в табл. 1.
Характеристика магнитолипосом. Магнитолипосомы представлены везикулами, в полости которых находятся НЧМ и агломераты НЧМ. Оболочка магнитолипосом образована одним или несколькими липидными бислоями, которые полностью окружают НЧМ и агломераты НЧМ. Физико-химические параметры суспензии магнитолипосом даны в табл. 1.
В виду идентичности клеточного состава изученных гемопоэтических дифферонов, а также отсутствия различий строения и размеров аналогичных гемопоэтических клеток у животныхвсех 4-х экспериментальных групп в течение 120 сут, описание структуры и среднего диаметра этих клеток далее приводится для животных после введения суспензии магнитолипосом.
Эритроцитарный дифферон. В течение эксперимента в мазках костного мозга крыс выявляли следующие клетки эритроцитарного дифферона (в порядке дифференцировки): эритробласты, пронормобласты, базофильные нормобласты, полихроматофильные нормобласты и оксифильные нормобласты. Эритробласты – круглые клетки (с диаметром 13.7 (12.9; 15.2) мкм) с ультрабазофильной цитоплазмой и крупным круглым ядром, которое содержит 1–2 ядрышка и эухроматин, имеющий сетчатую структуру. Пронормобласты – круглые клетки (с диаметром 10.8 (10.3; 11.9) мкм) с базофильной цитоплазмой и крупным круглым ядром, в котором преобладает эухроматин (структура хроматина сетчатая, ядрышки отсутствуют). Базофильные нормобласты – круглые мелкие клетки (с диаметром 9.1 (7.9; 10.0) мкм) с умеренно базофильной цитоплазмой и круглым ядром, в котором преобладает гетерохроматин (структура хроматина зернистая, ядрышки отсутствуют). Полихроматофильные нормобласты – круглые мелкие клетки (с диаметром 6.2 (5.6; 6.5) мкм) с полихромной (слабо базофильной или серо-розовой) цитоплазмой и круглым ядром, в котором преобладает гетерохроматин (структура хроматина плотная, ядрышки отсутствуют) (рис. 1). Оксифильные нормобласты – круглые мелкие клетки (диаметр 5.7 (5.1; 6.3) мкм) с оксифильной цитоплазмой и круглым пикнотичным ядром.
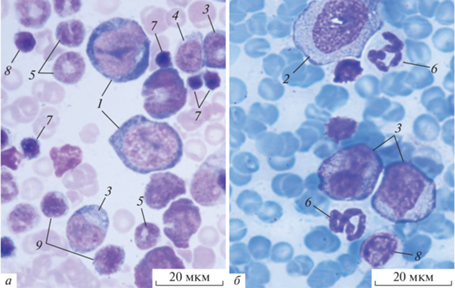
Рис. 1.
Гемопоэтические клетки костного мозга крысы после внутривенного введения магнитолипосом через 7 (а) и 40 сут (б). Показаны: 1 – миелобласт, 2 – нейтрофильный промиелоцит, 3 – нейтрофильный миелоцит, 4 – нейтрофильный метамиелоцит, 5 – палочкоядерный нейтрофил, 6 – сегментоядерный нейтрофил, 7 – полихроматофильный нормобласт, 8 – лимфоцит, 9 – моноцит. Окраска азур II-эозином.
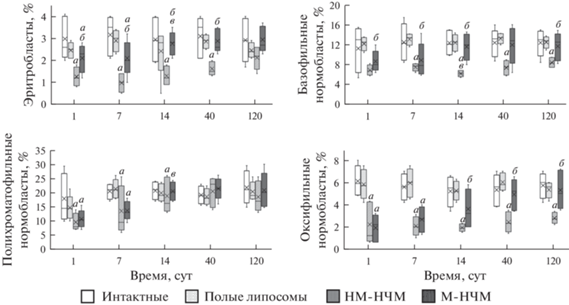
Введение суспензии немодифицированных НЧМ сопровождается снижением относительного количества эритробластов с 1 по 40 сут, базофильных и оксифильных нормобластов – с 1 по 120 сут, а полихроматофильных нормобластов – до 14 сут включительно по сравнению с аналогичными показателями интактных крыс. Введение суспензии магнитолипосом вызывает аналогичные, но менее продолжительные изменения эритроцитарного дифферона с полной нормализацией показателей к 14 сут эксперимента.
Динамика относительного количества клеток эритроцитарного дифферона в костном мозге крыс экспериментальных групп представлена на рис. 2.
Рис. 2.
Динамика относительного количества клеток (%) эритроцитарного дифферона в костном мозге крыс экспериментальных групп в течение 120 сут. Здесь и на рис. 3 и 4: показаны значения медиан (Ме), а также нижнего (Q25) и верхнего (Q75) квартилей; а – отличие (P < 0.05, критерий Манна−Уитни) от соответствующего показателя крыс интактной группы, б – отличие от соответствующего показателя крыс после введения немодифицированных НЧМ (P < 0.05, критерий Манна−Уитни), в – отличие от показателя предыдущего срока этой же группы (P < 0.05, критерий Вилкоксона).
Дифферон гранулоцитов на мазках костного мозга крыс представлен (в порядке дифференцировки): миелобластами, промиелоцитами, миелоцитами, метамиелоцитами, палочкоядерными гранулоцитами и сегментоядерными гранулоцитами (нейтрофилами, эозинофилами и базофилами). Миелобласты – округлые клетки (диаметр 18.7 (17.4; 19.4) мкм) с крупным круглым ядром, в котором преобладает эухроматин (структура хроматина сетчатая, содержится 1–2 ядрышка) и базофильной цитоплазмой, в которой могут присутствовать единичные азурофильные гранулы (рис. 1). Промиелоциты – крупные округлые клетки (диаметр 19.1 (18.5; 20.7) мкм) с крупным круглым, центрально расположенным ядром, содержащим 1–2 ядрышка. Хроматин имеет более грубую структуру, чем у миелобласта. В выраженной слабо базофильной цитоплазме присутствует азурофильная зернистость и появляются специфические гранулы, которые у нейтрофильных промиелоцитов представлены мелкими (пылевидными) фиолетовыми (базофильными) гранулами (нейтрофильной зернистостью) (рис. 1), у эозинофильных промиелоцитов – крупными красными (оксифильными, эозинофильными) гранулами (эозинофильной зернистостью), а у базофильных промиелоцитов – крупными фиолетовыми гранулами (базофильной зернистостью).
Предшественники нейтрофилов и эозинофилов со стадии промиелоцита представлены двумя формами клеток: со сферическими и кольцевидными ядрами. Нейтрофильные миелоциты – округлые клетки (диаметр 13.4 (12.4; 15.0) мкм) с бобовидным или торовидным, эксцентрично расположенным ядром (структура хроматина грубая, ядрышки отсутствуют) и голубовато-розовой цитоплазмой с хорошо выраженной нейтрофильной зернистостью. Азурофильная зернистость отсутствует (рис. 1). Нейтрофильные метамиелоциты – округлые клетки (диаметр 11.8 (10.7; 12.6) мкм) с бобовидным или кольцевидным, эксцентрично расположенным ядром (структура хроматина глыбчатая, ядрышки отсутствуют) в розовой цитоплазме выражена нейтрофильная зернистость (рис. 1). Палочкоядерные нейтрофилы – округлые клетки (диаметр 9.2 (8.6; 10.7) мкм) с незамкнутым или кольцевидным несегментированным ядром (рис. 1). Сегментоядерные нейтрофилы крыс всех 4-х групп представляют собой округлые клетки (диаметр 10.5 (9.2; 11.1) мкм) с сегментированным незамкнутым гиперхромным ядром, имеющим 4–5 перетяжек. Цитоплазма нейтрофилов слабо оксифильна и имеет нейтрофильную зернистость (рис. 1).
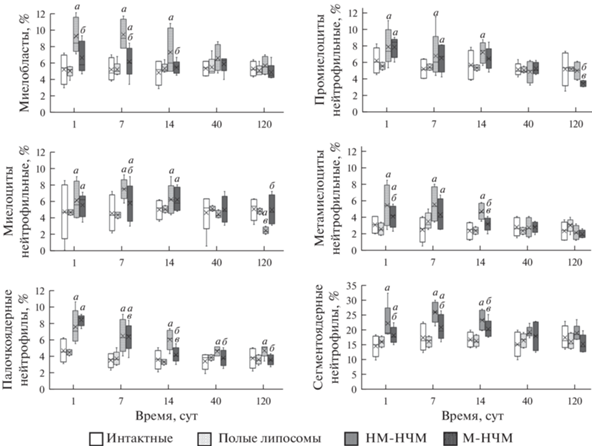
Дифферон нейтрофила. Введение суспензии немодифицированных НЧМ вызывает увеличение относительного количества клеток дифферона нейтрофила (миелобластов, промиелоцитов, миелоцитов, метамиелоцитов и сегментоядерных нейтрофилов) с 1 по 14 сут, а также сопровождается увеличением относительного количества палочкоядерных нейтрофилов в течение всего эксперимента. При этом введение суспензии магнитолипосом сопровождается увеличением относительного количества всех клеток этого дифферона с 1 по 7 сут, за исключением нейтрофильных миелоцитов, повышение количества которых сохраняется до 14 сут.
Динамика относительного количества клеток дифферона нейтрофила в костном мозге крыс в течение 120 сут у животных экспериментальных групп представлена на рис. 3.
Рис. 3.
Динамика относительного количества клеток (%) дифферона нейтрофила в костном мозге крыс экспериментальных групп в течение 120 сут.
Дифферон эозинофила. В мазках костного мозга крыс всех экспериментальных групп определяли эозинофильные миелоциты, эозинофильные метамиелоциты, палочкоядерные эозинофилы и сегментоядерные эозинофилы. Палочкоядерные эозинофилы (диаметр10.1 (9.2; 11.8) мкм) представлены клетками с незамкнутым или кольцевидным несегментированным ядром. Сегментоядерные эозинофилы (диаметр 11.0 (9.8; 12.2) мкм) имеют незамкнутое сегментированное гиперхромное ядро. Оба типа клеток имеют множество крупных оксифильных гранул в цитоплазме. Увеличение относительного количества клеток дифферона эозинофила, сохраняющееся с 1 по 14 сут эксперимента, отмечали только после введения суспензии немодифицированных НЧМ (рис. 4).
Рис. 4.
Динамика относительного количества клеток (%) моноцитарного и лимфоцитарного дифферонов, а также дифферонов эозинофила и базофила в костном мозге крыс экспериментальных групп в течение 120 сут.
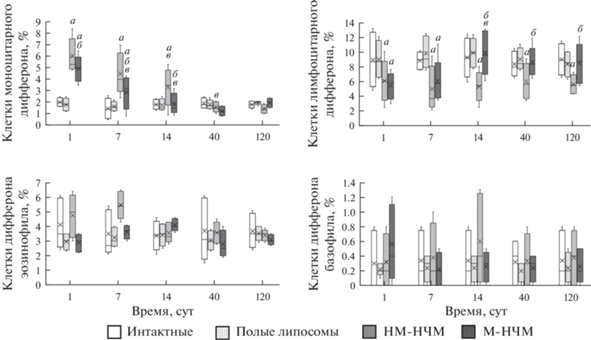
Дифферон базофила. Клетки дифферона базофила в мазках костного мозга крыс в течение эксперимента выявляли в небольшом количестве. Они представлены исключительно сегментоядерными базофилами. Введение суспензии немодифицированных НЧМ и магнитолипосом не сопровождается изменением относительного содержания клеток дифферона базофила.
Динамика относительного количества клеток дифферонов эозинофила и базофила в костном мозге крыс в течение эксперимента у животных исследованных групп показана на рис. 4.
Дифферон моноцита. Моноциты костного мозга крыс всех экспериментальных групп представлены крупными округлыми клетками (D 11.0 (10.2; 14.19) мкм) с бобовидным или овальным ядром, в котором доминирует эухроматин. Цитоплазма моноцитов слабо базофильна и содержит единичные крупные азурофильные гранулы (рис. 1). В мазках костного мозга присутствуют макрофаги (диаметр 15.7 (15.2; 16.5) мкм), количество которых не отличается у крыс экспериментальных групп. Введение суспензии немодифицированных НЧМ вызывает увеличение относительного количества клеток дифферона моноцита с 1 по 14 сут, при этом введение суспензии магнитолипосом сопровождается увеличением этого показателя с 1 по 7 сут (рис. 4).
Дифферон лимфоцита. Лимфоциты костного мозга крыс являются мелкими круглыми клетками (диаметр 6.9 (6.2; 7.6) мкм) с крупным гиперхромным округлым ядром, которое окружено узкой полоской базофильной цитоплазмы (рис. 1).
Введение суспензии немодифицированных НЧМ сопровождается снижением относительного количества клеток дифферона лимфоцита с 1 по 120 сут, тогда как введение суспензии магнитолипосом вызывает снижение относительного количества клеток этого дифферона лишь с 1 по 7 сут (рис. 4).
Плазматические клетки также определяли в костном мозге крыс всех экспериментальных групп. Они представляют собой округлые клетки (диаметр 11.0 (10.6; 12.8) мкм) с базофильной цитоплазмой и мелким эксцентрично лежащим ядром, гетерохроматин которого формирует радиальные тяжи. Мы не наблюдали изменения их относительного количества у крыс в течение эксперимента ни в одной из экспериментальных групп.
Динамика относительного количества клеток дифферонов моноцита и лимфоцита в костном мозге крыс 1–4 экспериментальных групп в течение 120 сут представлена на рис. 4.
Мегакариоциты крыс всех 4-х групп в течение эксперимента представлены крупными клетками (с диаметром 51.5 (39.3; 61.4) мкм), имеющими неправильную форму, крупное дольчатое ядро и выраженную базофильную цитоплазму, которая заполнена мелкими оксифильными гранулами. Относительное количество мегакариоцитов у крыс не меняется в течение эксперимента, не отличается между экспериментальными группами и составляет 0.55%.
ОБСУЖДЕНИЕ
Костный мозг является основным органом кроветворения в постнатальном периоде развития, обеспечивающим формирование эритроцитов, лейкоцитов, тромбоцитов, а также тучных клеток, миелоидных и лимфоидных дендритных клеток (Paik et al., 2015; Mu et al., 2017).
Ввиду использования НЧМ в биомедицинских исследованиях, представляется важной оценка их биосовместимости, обязательным этапом изучения которой являются исследования на организменном уровне. Изучение распределения НЧМ в организме экспериментальных животных показали, что значительная доля НЧМ накапливается в органах с развитой системой мононуклеарных фагоцитов (МНФ), включая костный мозг. Влияние НЧМ на гемопоэтические клетки костного мозга активно изучается в связи с перспективой применения этого вида наноматериала для диагностики и лечения опухолевых и инфекционных (например, кандидоза, аспергиллеза, криптококкоза) заболеваний костного мозга (Dadachova, 2013; Mu et al., 2017).
Изучение гемосовместимости НЧМ и магнитолипосом на их основе, предназначенных для внутривенного введения, является обязательным и необходимым этапом исследования их биосовместимости (Wu et al., 2010). Показано, что моноциты и макрофаги способны к цитоплазматическому метаболизированию НЧМ и депонированию образовавшихся ионов железа в комплексе с ферритином (Wu et al., 2010, 2014; Kelly et al., 2011; Chen et al., 2018).
В водных растворах немодифицированные НЧМ часто подвергаются агрегации. Нанесение на поверхность НЧМ покрытия увеличивает их седиментационную устойчивость, время циркуляции в крови и биосовместимость (Chen et al., 2018). Покрытие и размер частиц влияют на их биораспределение, период полувыведения и клеточное поглощение: крупные НЧМ (более 60 нм) быстро фагоцитируются клетками системы МНФ печени и селезенки (до 75% от дозы), тогда как мелкие НЧМ (менее 60 нм) дольше циркулируют в крови и имеют больше возможностей для проникновения в иные клетки (Wu et al., 2010; Couto et al., 2015).
При введении НЧМ в кровь они взаимодействуют с белками плазмы, что может сопровождаться гемолизом, активацией системы комплемента или свертывающей системы. Взаимодействие НЧМ с клетками влияет на пролиферацию, секрецию, клеточную гибель, метаболическую активность и т.д. Действуя на гемопоэтические клетки костного мозга, НЧМ опосредованно влияют на иммунную систему (Gaharwar et al., 2020).
Выраженные побочные эффекты, связанные с применением препаратов для лечения неопухолевых и опухолевых заболеваний костного мозга, существенно ограничивают их применение. Разработка систем адресной доставки лекарственных средств в костный мозг способствует повышению их эффективности и снижению терапевтической дозы препаратов, предназначенных для лечения заболеваний костного мозга (острой и хронической лейкемии, множественной миеломы, миелодиспластического синдрома и др.) (Braham et al., 2018; Maladkar et al., 2020). Эффективность лекарств при лечении злокачественных новообразований костного мозга довольно низкая вследствие их быстрого метаболизма и клиренса. Большая часть системно введенных лекарственных препаратов метаболизируется, выводится почками или накапливается в других органах. Эффективность целевой доставки лекарственного препарата зависит от размера, заряда, формы и других характеристик поверхности носителя (Kelly et al., 2011; Mu et al., 2017; Garcia-Pinel et al., 2020). Липосомы, как носители лекарств способны инкапсулировать макромолекулярные терапевтические агенты и позволяют легко модифицировать свою поверхность для обеспечения оптимальных фармакокинетических свойств (Mu et al., 2017).
В этой связи значительные усилия исследователей сосредоточены на оценке токсичности НЧМ in vitro. Так, оценка токсичности НЧМ на первичных культурах гемопоэтических клеток условно здоровых доноров показала, что в диапазоне концентраций 5–100 мг/мл они не являются токсичными (Dadachova, 2013).
В то время как биоразлагаемые наночастицы практически лишены токсичности в отношении костного мозга, наночастицы металлов и оксидов металлов различаются по своему воздействию на костный мозг в зависимости от дозы и пути введения. Следовательно, исследования биологических эффектов должны проводиться отдельно для каждого вида наноматериала, планируемого к биомедицинскому применению (Dadachova, 2013).
Показано, что внутривенное введение наночастиц Fe2O3 в дозах 15 или 30 мг на 1 кг массы тела индуцирует апоптоз в гемопоэтических клетках костного мозга и вызывает снижение количества миелокариоцитов у крыс линии Вистар, а также сопровождается дозозависимым ингибированием активности антиоксидантных ферментов и ростом концентрации малонового диальдегида (Gaharwar et al., 2020).
Многократное внутрижелудочное введение крысам линии Вистар с экспериментальной железодефицитной анемией НЧМ и магнитолипосом в дозе 12 мг (Fe)/кг сопровождается увеличением количества эритроцитов и концентрации гемоглобина, а также снижением количества лейкоцитов крови. При этом авторы отмечают отсутствие изменения структуры форменных элементов крови (Fathy et al., 2019).
В ряде работ in vitro показано отсутствие влияния наночастиц Fe2O3 на экспрессию клеточных маркеров гемопоэтических клеток костного мозга и отсутствие цитотоксичности (Paik et al., 2015).
Противоречивость сведений о биологических эффектах НЧМ объясняется широкой вариативностью их физико-химических параметров: размера, заряда, площади удельной поверхности, варианта поверхностной модификации, типа покрытия и др. Свойства поверхности (типа модификации или покрытия) сильно влияют на уровень цитотоксичности НЧМ (Paik et al., 2015; Chen et al., 2018).
Культивирование эритроцитов с НЧМ приводит к повреждению плазмолеммы эритроцитов, изменению их морфометрических параметров, сдвигу эритрограммы в сторону предгемолитических форм. Имеет место прямое взаимодействие НЧМ с плазмолеммой эритроцитов и изменение поверхностного заряда мембраны эритроцитов, что способствует их агрегации (Плескова и др., 2017).
НЧМ проникают в мононуклеарные клетки по механизму эндоцитоза. При сокультивировании мононуклеарных клеток с НЧМ показано проникновение последних в цитоплазму и накопление их внутри везикул (с диаметром 0.5–3.5 мкм). Проникновение НЧМ сопровождается появлением глубоких инвагинаций кариолеммы, увеличением размеров ядрышек и количества везикул. НЧМ подвергаются фагоцитозу при сокультивировании с клетками костного мозга: например, содержание железа внутри моноцита за 24 ч возрастет от 0.07 до 5 пг (Paik et al., 2015; Chen et al., 2018).
Доза НЧМ, которую мы использовали в настоящей работе, выше предполагаемой терапевтической дозы, что способствует выявлению их потенциального токсического влияния. Так, рекомендованная доза препаратов Feridex IV (Berlex Laboratories, Великобритания) и Endorem (Guerbert, США) 0.56 мг/кг массы тела (Ruiz et al., 2015).
Благодаря липидному покрытию, поверхность магнитолипосом можно легко функционализировать для увеличения времени их циркуляции в крови, а также для обеспечения активного нацеливания за счет конъюгации с пептидами или антителами (Soenen et al., 2011). Изготовление магнитолипосом из природных липидов делает эти конструкции биосовместимыми и биодеградируемыми. Наличие липидной оболочки является основной защитой транспортируемых ими лекарственных препаратов от ферментативной деградации и уменьшает их токсичность. Кроме того, магнитолипосомы повышают седиментационную стабильность НЧМ, позволяя им дольше оставаться в циркуляции, что увеличивает их биораспределение. Магнитолипосомы являются наиболее оптимальной системой целевой доставки, которая позволяет увеличить эффективность лекарственного препарата, а также обеспечить его активное или пассивное нацеливание и контролируемое высвобождение с заранее определенной скоростью (Fathy et al., 2019).
Некоторые авторы показали отсутствие прямого негативного воздействия НЧМ на жизнеспособность клеток, однако при повышении внутриклеточного содержания НЧМ возникают функциональные нарушения. Биогенные магнитолипосомы (магнетосомы) бактерий рода Magnetospirillum на основе магнетита, LD50 которых составляет 62.7 мг/кг массы тела, при внутривенном введении крысам в дозе 40 мг/кг массы тела не оказывают повреждающего эффекта на клетки костного мозга, печени и почек (Soenen et al., 2011).
НЧМ могут вызывать окислительный стресс, клеточную гибель и воспаление, т.к. участвуют в образовании активных форм кислорода при растворении наночастиц в лизосомах. Повышение концентрации активных форм кислорода может вызвать повреждение ДНК, которое может сопровождаться остановкой пролиферации и клеточной гибелью (Gaharwar et al., 2020).
По результатам цитотоксического теста с трипановым синим совместное культивирование НЧМ (в концентрации 0.3–3 мг/л) с гемопоэтическими клетками костного мозга мышей линии CBA/CaLac в течение 24 ч не вызывает увеличения гибели клеток по сравнению с контролем (Хлусов и др., 2008).
НЧМ индуцируют иммуносупрессию, которая проявляется снижением количества естественных киллерных (NK) лимфоцитов и отношения CD4+/CD8+-лимфоцитов, а также сопровождается увеличением количества В-лимфоцитов (Gaharwar et al., 2020).
Наша работа продемонстрировала, что магнитолипосомы на основе НЧМ не вызывают повреждения гемопоэтических клеток костного мозга крыс, а их применение сопровождается обратимыми количественными изменениями миелограмм. Несмотря на длительное изучение биологических свойств НЧМ, многие стороны их влияния на организм (гемосовместимость, цитотоксичность) неоднозначны и требуют индивидуального исследования в зависимости от размера, формы и типа покрытия НЧМ.
Проведенное исследование позволяет рекомендовать использование магнитолипосом на основе НЧМ в качестве магниточувствительной системы для доставки лекарственных препаратов, которая не обладает повреждающим действием в отношении гемопоэтических клеток костного мозга.
Список литературы
Плескова С.Н., Горностаева Е.Е., Крюков Р.Н., Боряков А.В., Зубков С.Ю. 2017. Изменения архитектоники и морфометрических характеристик эритроцитов под воздействием наночастиц магнетита. Цитология. Т. 59. № 12. С. 874. (Pleskova S.N., Gornostaeva E.E., Kryukov R.N., Boryakov A.V., Zubkov S.Yu. 2018. Changes in the architectonics and the morphometric characteristics of erythrocytes under the influence of magnetite nanoparticles. Cell Tiss. Biol. (Tsitologiya). V. 12. P. 127).
Хлусов И.А., Седой В.С., Найден Е.П. 2008 Влияние магниточувствительных наноразмерных частиц на пул стволовых кроветворных клеток in vitro. Наносистемы, наноматериалы, нанотехнологии. Т. 6. № 4. С. 1247. (Khlusov I.A., Sedoy V.S., Nayden E.P. 2008. The effect of magnetically sensitive nanoscale particles on the pool of hematopoietic stem cells in vitro. Nanosystems, nanomaterials, nanotechnologies. V. 6. № 4. P. 1247.)
Bolliger A.P. 2004. Cytologic evaluation of bone marrow in rats: indications, methods, and normal morphology. Veterinary Clinical Pathol. V. 33. P. 58.
Braham M.V., Deshantri A.K., Minnema M.C., Öner F.C., Schiffelers R.M., Fens M.H., Alblas J. 2018. Liposomal drug delivery in an in vitro 3D bone marrow model for multiple myeloma. Int. J. Nanomed. V. 13. P. 8105.
Chen S., Chen S., Zeng Y., Lin L., Wu C., Ke Y., Liu G. 2018. Size-dependent superparamagnetic iron oxide nanoparticles dictate interleukin-1β release from mouse bone marrow derived macrophages. J. Appl. Toxicol. V. 38. P. 978.
Couto D., Freitas M., Vilas-Boas V., Dias I., Porto G., Arturo Lopez-Quintela M., Rivas J., Freitas P., Carvalho F., Fernandes E. 2014. Interaction of polyacrylic acid coated and non-coated iron oxide nanoparticles with human neutrophils. Toxicol. Letters. V. 225. P. 57.
Couto D., Sousa R., Andrade L., Leander M., Lopez-Quintela M.A., Rivas J., Freitas P., Lima M., Porto G., Porto B., Carvalho F., Fernandes E. 2015. Polyacrylic acid coated and non-coated iron oxide nanoparticles are not genotoxic to human T‑limphocytes. Toxicol. Letters. V. 234. P. 67.
Dadachova E. 2013. The Effects of nanoparticles on bone marrow cells In: Handbook of immunological properties of engineered nanomaterials. World scientific Publishing. Singapore. P. 433.
Fathy M.M., Fahmy H.M., Balah A.M.M., Mohamed F.F., Elshemey W.M. 2019. Magnetic nanoparticles-loaded liposomes as a novel treatment agent for iron deficiency anemia: in vivo study. Life Science. V. 234. P. 1167.
Gaharwar U.S., Kumar S., Rajamani P. 2020. Iron oxide nanoparticle-induced hematopoietic and immunological response in rats. Royal Soc. Chem. V. 10. P. 35753.
Garcia-Pinel B., Jabalera Y., Ortiz R., Cabeza L., Jimenez-Lopez C., Melguizo C., Prados J. 2020. Biomimetic magnetoliposomes as oxaliplatin nanocarriers: in vitro study for potential application in colon cancer. Pharmaceutics. V. 12. P. 589.
Kelly C., Jefferies C., Cryan S.-A. 2011. Targeted liposomal drug delivery to monocytes and macrophages. J. Drug Delivery. V. 2011. P. 727241. https://doi.org/10.1155/2011/727241
Maladkar M., Sankar S., Yadav A. 2020. A novel approach for iron deficiency anemia with liposomal iron: concept to clinic. Journal of Biosciences and Medicines. V. 8. P. 27.
Mu C.-F., Shen J., Liang J., Zheng H.-S., Xiong Y., Wei Y.-H., Li F. 2017. Targeted drug delivery for tumor therapy inside the bone marrow. Biomaterials. https://doi.org/10.1016/j.biomaterials.2017.11.029
Paik S.-Y.-R., Kim J.-S., Shin S.J., Ko S. 2015. Characterization, quatification, and determination of the toxicity of iron oxide nanoparticles to the bone marrow cells. Int. J. Mol. Sci. V. 16. P. 22243. https://doi.org/10.3390/ijms160922243
Ruiz A., Ali L.M.A., Caceres-Velez P.R., Cornudella R., Gutierrez M., Moreno J.A., Pinol R., Palacio F., Fascineli M.L., de Azevedo R.B., Morales M.P., Millan A. 2015. Hematotoxicity of magnetite nanoparticles coated with polyethylene glycol: in vitro and in vivo study. Toxicol. Res. V. 4. P. 1555.
Soenen S.J., Velde G.V., Ketkar-Atre A., Himmelreich U., De Cuyper M. 2011. Magnetoliposomes as magnetic resonance imaging contrast agent. WIREs Nanomed. Nanobiotechnol. V. 3. P. 197.
Wu Q.H., Jin R.R., Feng T., Liu L., Yang L., Tao Y.H., Anderson J.M., Ai H., Li H. 2014. Iron oxide nanoparticles and induced autophagy in human monocytes. Toxicol. Letters. V. 225. P. 57.
Wu W., Chen B., Cheng J., Wang J., Xu W., Liu L., Xia G., Wei H., Wang X., Yang M., Yang L., Zhang Y., Xu C., Li J. 2010. Biocompatibility of Fe3O4/DNR magnetic nanoparticles in the treatment of hematologic malignancies. Int. J. Nanomed. V. 5. P. 1079.
Дополнительные материалы отсутствуют.


