Цитология, 2023, T. 65, № 1, стр. 39-53
Цитотоксическая активность атмосферной холодной плазменной струи в отношении 3D-клеточной модели рака молочной железы человека
Е. А. Патракова 1, 2, М. М. Бирюков 1, 2, 5, *, О. С. Троицкая 1, 5, Д. Д. Новак 1, 2, 5, Е. В. Милахина 3, 5, П. П. Гугин 4, 5, Д. Э. Закревский 3, 4, 5, И. В. Швейгерт 5, О. А. Коваль 1, 2 , 5
1 Институт химической биологии и фундаментальной медицины СО РАН
630090 Новосибирск, Россия
2 Новосибирский государственный университет
630090 Новосибирск, Россия
3 Новосибирский государственный технический университет
630073 Новосибирск, Россия
4 Институт физики полупроводников им. А.В. Ржанова СО РАН
630090 Новосибирск, Россия
5 Институт теоретической и прикладной механики им. С.А. Христиановича СО РАН
630090 Новосибирск, Россия
* E-mail: biryukov.mm@ya.ru
Поступила в редакцию 03.08.2022
После доработки 28.09.2022
Принята к публикации 28.09.2022
- EDN: GLBBFZ
- DOI: 10.31857/S004137712301008X
Аннотация
Воздействие на солидные опухоли струей холодной плазмы (ХПС) является инновационным подходом, который активно начали разрабатывать лишь в последнее десятилетие. Вследствие этого актуальны исследования, направленные на выявление условий селективности такого воздействия на опухолевые клетки, в том числе в составе 3D-моделей, имитирующих злокачественные новообразования. Известно, что основные цитотоксические эффекты ХПС обуславливают активные формы кислорода и азота, которые образуются в потоке плазмы, и доступность которых может отличаться для клеток в классических 2D- и 3D-моделях культивирования. В настоящей работе использовали многоклеточные сфероиды из клеток MCF7-EGFR с гиперэкспрессией рецептора эпидермального фактора роста (EGFR), клетки родительской линии аденокарциномы молочной железы MCF7, а также клетки нетрансформированной молочной железы человека MCF10A. Облучение сфероидов MCF7-EGFR вело к деструкции многоклеточных 3D-структур на отдельные клетки с активацией в них процессов гибели. Показано, что клетки облученных сфероидов подвергаются фагоцитозу активированными макрофагами. При сравнении прямого воздействия ХПС и культивирования сфероидов MCF7-EGFR в среде, облученной ХПС (СО-ХПС), обнаружено большее содержание активных форм кислорода и азота в клетках сфероидов при культивировании в облученной среде, что далее ведет к большему цитотоксическому эффекту, чем при прямом облучении. Показано, что цитотоксические свойства СО-ХПС лучше сохраняются при хранении такой среды при 4, чем при −20°С. Таким образом, для индукции гибели опухолевых клеток в составе сфероидов добавление культуральной среды, облученной ХПС, было эффективнее, чем прямое облучение клеток.
Проблема недостаточной эффективности существующих методов терапии онкобольных обусловлена тем, что многообразие генетических дефектов опухолевых клеток и их сочетаний делает опухоли высокогетерогенными, что, в свою очередь, диктует необходимость дифференцированных подходов к лечению. Рак молочной железы (РМЖ) – наиболее частое злокачественное новообразование у женщин, которое занимает второе место в структуре смертности населения от злокачественных новообразований во всем мире, уступая только раку легкого (Sung et al., 2021). Поэтому, разработка новых подходов к терапии солидных опухолей не теряет своей актуальности.
В настоящее время активно развивается плазменная медицина, исследующая электромагнитное и химическое воздействие плазменных образований на биологические объекты, изменяющих гомеостаз клетки. Стимулированные плазмой химические реакции в жидкости и в клетке ведут к повышению концентраций кислород- и азотсодержащих активных радикалов и ионов, которые взаимодействуют с клеточными структурами и молекулами, повреждая их и вызывая клеточную гибель. Газоразрядная неравновесная плазма, применяемая в плазменной медицине, состоит из низкоэнергетичных ионов и высокоэнергетичных электронов, ионизующих газ и генерирующих радикалы, вступающие в реакции со всеми основными типами биополимеров клетки – липидами, углеводами, белками и нуклеиновыми кислотами (Attri et al., 2015; Klinkhammer et al., 2017). Температура газа в плазменной струе остается близкой к температуре тела человека, что делает возможным ее использование в медицинских целях. Применение именно инертных газов в плазменных струях обусловлено низким напряжением пробоя таких газов (порядка нескольких кВ). В основном, в качестве рабочего газа используются аргон и гелий, что связано с их доступностью.
Успешное применение холодной плазмы для заживления поверхностных ран, атопических дерматитов и диабетической стопы у человека указывало на то, что применение ХПС также будет безопасно при облучении зоны опухоли (Domonkos et al., 2021). В 2015 г. пациенты с немелкоклеточной карциномой головы и шеи с изъязвлeнными опухолями были подвергнуты облучению холодной плазмой, в результате чего был достигнут ряд терапевтических эффектов: уменьшение бактериальной нагрузки, частичное заживление язв и, в некоторых случаях, торможение роста опухоли в зоне прямого воздействия плазмы (Metelmann et al., 2015).
Поскольку в экспериментах in vitro показана чувствительность опухолевых клеток различного гистологического происхождения к действию холодной плазмы и культуральной среды, облученной плазмой (СО-ХПС), потенциал этого метода для противоопухолевой терапии оценивают как многообещающий, и уже определены категории больных, для которых облучение холодной плазмой может иметь значительные терапевтические эффекты (Dai et al., 2018). В то же время, число исследований биологических и химических эффектов холодной плазмы в отношении 3D-клеточных моделей опухолей, позволяющих выявить параметры облучения, при которых эффективно подавляется пролиферация большинства опухолевых клеток в составе сфероида, пока невелико (Judée et al., 2016; Wiegand et al., 2016; Xu et al., 2016; Wanigasekara et al., 2022).
Применение 3D-клеточных моделей для доклинических исследований по сравнению с классическими 2D-моделями имеет ряд преимуществ: они более точно отражают межклеточные взаимодействия, пространственную организацию рецепторов клеточной поверхности, распределение метаболитов и кислорода в межклеточном пространстве (Ferreira et al., 2018; Colombo, Cattaneo 2021; Salinas-Vera et al., 2022). Поэтому использование 3D-сфероидов в качестве модели для облучения ХПС имеет существенное значение для последующей трансляции метода в клиническую практику.
В настоящей работе для облучения применяли газоразрядное устройство, генерирующее последовательность стримеров при синусоидальном рабочем напряжении с диапазоном частоты 13–40 кГц. Стримеры распространялись от плазменного устройства по струе гелия или аргона в окружающем воздухе при атмосферном давлении и касались облучаемых объектов (клеток или культуральной среды). Способ воздействия плазмой, когда стримеры касались непосредственно клеток, называется прямым облучением, в отличие от опосредованного воздействия, когда плазмой облучается питательная среда (СО-ХПС), которая затем добавляется к клеткам.
Оптимизация условий облучения для преимущественной гибели опухолевых клеток входила в задачи нашего исследования. Нам удалось определить длительность облучения, обеспечивающую преимущественную гибель раковых клеток человека для условий с заземленным электродом под планшетом с клетками и без него. Мы показали, что как прямое облучение, так и культивирование клеток в присутствии СО-ХПС, снижает жизнеспособность клеток MCF7 в дозозависимом режиме. Далее были изучены эффекты прямого облучения плазмой и СО-ХПС в отношении сфероидов РМЖ.
В качестве 3D-клеточной модели для исследования эффектов ХПС в работе использовали полученную нами ранее линию MCF7-EGFR, растущую преимущественно в виде сфероидов без использования гидрогелей и факторов роста (Troitskaya et al., 2021).
МАТЕРИАЛ И МЕТОДИКА
Реактивы и материалы. Использовали: культуральные среды IMDM, RPMI-1640, DMEМ, термически инактивированную эмбриональную сыворотку телят (FBS) и раствор антибиотиков-антимикотиков (пенициллин, стрептомицин, амфотерицин) (GIBCO, Life Technologies, США), GlutaMAXTM (GIBCO, Invitrogen, Франция), раствор йодистый пропидий (BD Pharmingen Apoptosis Detection Kit; BD Biosciences, США), натрий-фосфатный буфер (PBS), 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид (МТТ), форбол-12-миристат 13-ацетат (PMA; Sigma-Aldrich, США), H2DCFDA и StemPro™ Accutase (Thermo Fisher Scientific, США), красители цитоплазмы Cell Tracker Green и Cell Tracker Red (Life Technologies, США), ДМСО (Реахим, Москва, Россия), флаконы для культивирования с площадью поверхности 25 см2 (TPP, Швейцария), 96-луночные планшеты и 6-луночные планшеты (Thermo Scientific, Япония), электронные планшеты E-планшеты RTCA (ASEA Biosciences, США), набор реагентов Griess Reagent System (Promega, США).
Оборудование. Использовали: центрифугу Minispin (Eppendorf, Германия), СО2-инкубатор (Heraeus, Германия), инвертированный флуоресцентный микроскоп Eclipse Ti2 (Nikon Corporation, Япония), систему iCELLigence Real Time Cell Analyzer (RTCA; ACEA Biosciences, США), проточный цитометр BD FACSCantoII (BD Biosciences, США), многоканальный спектрофотометр (Berthold Technologies, Германия).
Клеточные линии и их культивирование. Клеточная линия MCF7-EGFR была получена в лаборатории биотехнологии ИХБФМ СО РАН (Новосибирск, Россия) методом ретровирусной трансдукции как описано (Troitskaya et al., 2021).
Клетки аденокарциномы молочной железы человека MCF7 (ACC 115, DSMZ, Германия) и эпителиальные клетки молочной железы MCF10A (ATCC CRL-10317; Манасас, США) выращивали в среде IMDM, клетки острой моноцитарной лейкемии THP-1 (из коллекции культур клеток позвоночных ИНЦ РАН, Санкт-Петербург, Россия) культивировали в среде RPMI-1640, клетки MCF7-EGFR выращивали в среде DMEM в присутствии 10% FBS, 2 мМ L-глутамина и 1%-ного раствора антибиотиков-антимикотиков (100 ед./мл пенициллина, 100 мг/мл стрептомицина сульфата, 0.25 мкг/мл амфотерицина) при температуре 37 ± 1°С в атмосфере CO2 (5.0 ± 0.5%).
Для пассирования сфероиды MCF7-EGFR размером более 500 мкм диссоциировали до единичных клеток добавлением реактива StemPro™ Accutase как рекомендовано производителем, после чего клетки высаживали в 96-луночные или 24-луночные планшеты по 1 × 104 или 4 × 104 клеток на лунку соответственно и культивировали в стандартных условиях в течение 5–7 сут до образования открепленных сфероидов.
Холодная плазменная струя (ХПС). В работе для генерации плазменной струи использовали источник синусоидального напряжения с диапазоном частоты f ≈ 13–40 кГц и напряжением U = 3.5–5 кВ. Газоразрядная ячейка выполнена в виде коаксиального диэлектрического канала длиной 100 мм с внутренним диаметром 8 мм, на выходе из которого размещен диэлектрический капилляр с диаметром 2.3 мм, формирующий сопло. Внутри канала соосно размещен стержневой электрод длиной 50 мм и диаметром 2 мм. У сопла диэлектрического канала расположен кольцевой заземленный электрод, который вместе с внутренним потенциальным электродом формирует разрядную зону. Инертный газ поступает в диэлектрический канал плазменного источника со скоростью 3–9 л/мин и распространяется до облучаемой мишени. Дополнительный заземленный металлический электрод располагался на расстоянии 2.5 см от сопла устройства перпендикулярно направлению распространения струи.
При прямой обработке клеток, культивируемых в 100 мкл среды, после облучения добавляли 100 мкл свежей среды в лунки и продолжали культивирование в стандартных условиях. В экспериментах с добавлением облученной культуральной среды (СО-ХПС), ее объем составлял 1/2 финального объема среды в лунке.
Анализ пролиферации клеток в режиме реального времени на приборе iCELLigence. Определение жизнеспособности клеток в режиме реального времени в системе iCELLigence проводили как описано ранее (Нуштаева и др., 2022). Клеточный индекс рассчитывали для каждой лунки E-планшета с помощью программного обеспечение RTCA 1.2 (Roche Diagnosis, Франция), генерирующего кривые роста клеток. В каждом эксперименте использовали не менее 3-х экспериментальных образцов, эксперимент повторяли не менее 2-х раз.
Анализ жизнеспособности клеток сфероидов методом проточной цитометрии. Сфероиды MCF7-EGFR культивировали в лунках 96-луночного планшета в объеме 100 мкл культуральной среды, облучали ХПС, после чего добавляли 100 мкл свежей среды и продолжали культивирование. В случае обработки СО-ХПС, к сфероидам добавляли 100 мкл облученной среды и продолжали культивирование в стандартных условиях. По окончании культивирования сфероиды разрушали добавлением раствора StemPro™ Accutase, открепленные клетки окрашивали раствором йодидистого пропидия в соответствии с протоколом производителя и анализировали на проточном цитометре не менее 1 × 105 событий в образце.
Анализ уровня внутриклеточных активных форм азота и кислорода. Молекула АФК-зависимого флуоресцентного зонда H2DCFDA способна проникать через клеточную мембрану, где в неизменном состоянии не флуоресцирует при облучении светом с длиной волны λ = 485 нм. Под действием внутриклеточных эстераз происходит деацетилирование H2DC-FDA до H2DCF, который накапливается в клетке, а его дальнейшее окисление под действием внутриклеточных АФК и АФА способствует превращению его в 2',7'-дихлорофлуоресцеин (DCF–), обладающий флуоресценцией (λem = 530 нм) при возбуждении светом с характеристической длиной волны λex = 485 нм (Yazdani, 2015). Концентрация DCF– в клетке пропорциональна концентрации АФК и АФА, которые, таким образом, могут быть определены методами флуоресцентного анализа.
К сфероидам MCF7-EGFR, культивируемым в стандартных условиях в лунках 96-луночного планшета, добавляли раствор красителя H2DCFDA (10 мкМ), культивировали в стандартных условиях 30 мин, после чего облучали ХПС или добавляли СО-ХПС. Через 6 ч после облучения, изменения флуоресценции H2DCFDA визуализировали в клетках сфероидов с помощью инвертированного микроскопа в канале FITC. Полуколичественную оценку изменения активных форм азота (АФА) и кислорода (АФК) в клетках проводили, используя проточный цитометр (λ = 535 нм) после разрушения сфероидов добавлением StemPro™ Accutase.
Определение концентрации ионов нитрита в культуральной среде. Для определения концентрации ионов нитрита $\left( {{\text{NO}}_{2}^{ - }} \right)$ в культуральной среде отбирали аликвоты среды по 25 мкл и определяли концентрацию ${\text{NO}}_{2}^{ - }$ методом Грисса с использованием коммерчески доступного набора реагентов Griess Reagent System. Оптическое поглощение измеряли на спектрофотометре при длине волны λ = 540 нм. Используя стандарты с известной концентрацией ${\text{NO}}_{2}^{ - },$ строили калибровочную кривую. По трем независимым повторам рассчитывали средние значения концентрации нитрит-ионов в образцах и стандартные отклонения.
МТТ-тест. Анализ жизнеспособности клеток методом МТТ-теста проводили, как уже описано (Bagamanshina et al., 2019) через 24 ч после облучения или добавления облученной среды. Среду в лунках 96-луночного планшета с культивируемыми клетками заменяли на среду RPMI-1640 без сыворотки, содержащую 0.25 мг/мл МТТ-реагента и выдерживали 4 ч при 37°С. Далее среду удаляли, а образовавшиеся кристаллы формазана растворяли добавлением 100 мкл ДМСО. Оптическую плотность раствора в лунках измеряли на многоканальном спектрофотометре при λ = 570 нм.
Анализ фагоцитоза сфероидов активированными клетками THP-1. К клеткам THP-1, растущим в среде RPMI-1640 в 6-луночном планшете (5 × 105 кл./лунку), добавляли 50 нМ PMA для индукции дифференцировки в M1-макрофагальный фенотип и продолжали культивирование в течение 48 ч. По окончании культивирования клетки THP-1 окрашивали добавлением флуоресцентного реагента Cell Tracker Green (1 мкМ) при 37°С течение 30 мин, после чего культуральную среду удаляли, клетки дважды промывали добавлением 1 мл PBS. Аналогичным образом предварительно окрашивали сфероиды MCF7-EGFR раствором Cell Tracker Red (10 мкМ). К окрашенным культивируемым THP-1 добавляли образцы окрашенных сфероидов MCF7-EGFR в примерном соотношении клеток и сфероидов 30 : 1 и продолжали совместное культивирование в течение 2 ч в стандартных условиях. Сфероиды и клетки в лунках анализировали с использованием инвертированного флуоресцентного микроскопа. Для количественной оценки активности макрофагов проводили подсчет общего количества сфероидов размером более 40 нм (в месте с наибольшем диаметром) в поле зрения микроскопа площадью 0.4 мм2 и рассчитывали долю сфероидов, атакованных макрофагами, как отношение числа сфероидов с зеленым сигналом к общему числу сфероидов. Данные представляли, как среднее значение и его стандартное отклонение для трех независимых полей зрения.
РЕЗУЛЬТАТЫ
Определение параметров ХПС, индуцирующих преимущественную гибель опухолевых клеток. Индукция гибели раковых клеток зависит от интенсивности взаимодействия ХПС с биологическим объектом, которая, в свою очередь, определяется частотой и амплитудой приложенного напряжения, расстоянием до объекта, скоростью и типом рабочего газа, а также влажностью воздуха (Schweigert et al., 2021). При неизменности указанных параметров интенсивность воздействия может изменяться в зависимости от продолжительности облучения или при введении дополнительных компонентов в систему.
Условия облучения ХПС, при котором гибели подвергаются преимущественно опухолевые клетки, оптимизировали по продолжительности воздействия на примере пары культур единого гистологического происхождения: аденокарциномы молочной железы человека MCF7 и клеток нетрансформированной молочной железы MCF10A (Qu et al., 2015). Жизнеспособность клеток анализировали в режиме реального времени с использованием прибора iCelligence и методом МТТ (рис. 1). Облучение проводили с использованием дополнительного заземленного электрода (так называемой заземленной подложки, или без нее). При сравнении кривых роста опухолевых и нормальных клеток после облучения ХПС можно видеть, что цитотоксический эффект существенно зависел от длительности облучения клеток MCF7 (рис. 1а): облучение в течение 2 мин снижало долю живых клеток (индекс пролиферации, см. рис. 1) на 75% относительно необработанного контроля; в то же время, облучение эпителиальных клеток молочной железы MCF10A в течение 1 и 2 мин приводило к незначительному торможению роста клеток относительно необлученного контроля (рис. 1б) – на 8 и 30% соответственно. Полученные результаты позволяют считать облучение в течение 1 мин специфичным для индукции гибели опухолевых клеток данного типа и при выбранных параметрах генерации ХПС.
Рис. 1.
Влияние продолжительности прямой обработки холодной плазменной струей (ХПС) на пролиферацию клеток MCF7 и MCF10A. а, б – Характерные кривые пролиферации клеток в режиме реального времени на приборе iCELLigence; стрелка показывает момент обработки ХПС. в – Данные МТТ-теста о жизнеспособности клеток через 24 ч после облучения ХПС с использованием заземленной металлической подложки (ЗМП); представлен характерный пример анализа, в котором приведены средние значения и их статистические отклонения (SD) из 3-х экспериментов. Здесь и на рис. 2, 3, 4 параметры генератора ХПС: амплитуда напряжения 4.9 кВ и частота 40 кГц, газ – аргон, 4 л/мин.
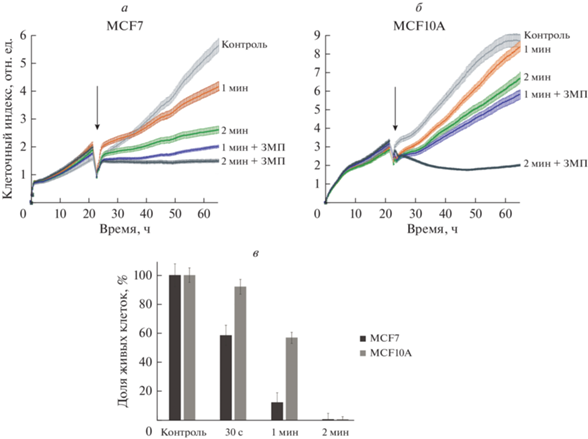
Ранее нами было показано, что введение в систему заземленной металлической подложки (ЗМП), помещенной под культуральным планшетом с растущими клетками, усиливало гибель облученных опухолевых клеток (Schweigert et al., 2019). На моделях MCF7 и MCF10A использование ЗМП также усиливало цитотоксический эффект ХПС (рис. 1). При длительности облучения 2 мин с использованием ЗМП наблюдали полное подавление жизнеспособности как опухолевых, так и здоровых клеток, поэтому для достижения относительной специфичности ХПС в отношении опухолевых клеток, необходимо снижать продолжительность воздействия. Снижение времени облучения с ЗМП до 30 с позволила добиться преимущественной гибели опухолевых клеток (рис. 1в).
Таким образом, определено характерное время преимущественного цитотоксического действия ХПС в отношении клеток аденокарциномы молочной железы человека MCF7 с использованием ЗМП и без нее.
Помимо прямого воздействия, когда облучению подвергают непосредственно растущие клетки, в ряде работ показано цитотоксическое действие на клетки культуральной среды, предварительно облученной ХПС, которую называют “активированной средой”, а мы обозначаем ее СО-ХПС (Tanaka et al., 2021). Высокоэнергетичные электроны в плазменной струе за счет неупругих столкновений с молекулами кислорода, азота и воды генерируют химически активные радикалы и включают цепочки химических реакций в смеси гелия с воздухом в газовой фазе и на поверхности жидкости с образованием основных молекулярных триггеров гибели клеток – АФК и АФА, которые сохраняются при переносе такой СО-ХПС к растущим клеткам (Boehm et al., 2016).
Определение цитотоксического воздействия СО-ХПС в отношении клеток MCF7 и MCF10A проводили с помощью МТТ через 24 ч после добавления облученной среды (ее объем составлял 1/2 финального объема среды в лунке) (рис. 2). Можно видеть, что снижение жизнеспособности при культивировании клеток в присутствие СО-ХПС было сравнимо с таковым значением для клеток, подвергнутых прямому облучению ХПС (рис. 1). Онкотрансформированные клетки MCF7 также оказались более чувствительны к цитотоксическому воздействию СО-ХПС, чем MCF10A. Таким образом, при одинаковых условиях воздействия, опухолевые клетки MCF7 были чувствительны не только к прямому к воздействию ХПС, но и к СО-ХПС.
Рис. 2.
Влияние опосредованной обработки ХПС на жизнеспособность клеток MCF7 и MCF10A. Данные МТТ-теста, проведенного через 24 ч после добавления к клеткам облученной культуральной среды (СО-ХПС). Конечный объем облученной среды составлял 1/2 объема среды в лунке Результаты представлены как средние значения (±SD) из 3-х экспериментов.

Анализ изменения содержания АФА в культуральной среде при культивировании клеток в присутствии СО-ХПС. Использовали реактив Гриса, позволяющий оценить концентрацию ионов нитрита. Культуральную среду обрабатывали ХПС в течение 2 или 5 мин в лунках 96-луночного планшета и непосредственно после облучения добавляли ее (СО-ХПС) к культивируемым клеткам MCF7, после чего продолжали культивирование в стандартных условиях. Через 30 мин, 1 и 6 ч после добавления СО-ХПС отбирали аликвоты среды и определяли концентрацию ${\text{NO}}_{2}^{ - }.$ В качестве отрицательного контроля использовали культуральную среду от клеток, культивируемых в стандартных условиях. В качестве положительного контроля использовали образцы облученной среды, разбавленной аналогично добавляемой к клеткам и инкубированной в аналогичных условиях. Можно видеть (рис. 3), что ХПС-обработка среды приводит к увеличению концентраций ионов нитрита до 10 раз при 2-минутном облучении и до 30 раз при 5-минутном. Таким образом, наблюдаемое увеличение ионов нитрита в культуральной среде при увеличении длительности облучения наиболее вероятно вносит вклад в цитотоксическую активности СО-ХПС.
Рис. 3.
Концентрация ионов нитрита NO2− в культуральной среде. Культуральную среду без клеток облучали 2 или 5 мин (среда), после чего добавляли к культивируемым клеткам А549 (среда с клетками) и продолжали культивирование в стандартных условиях, отбирая аликвоты сред для анализа. Контроль (К): к клеткам добавляли необлученную среду. Концентрацию ${\text{NO}}_{2}^{ - }$ в среде определяли методом Грисса, представлены средние значения (± SD) из 3-х независимых экспериментов

Влияние температуры хранения облученной среды (СО-ХПС) на ее цитотоксическую активность. Отметим, что короткоживущие активные кислородные и азотные радикалы распадаются, либо вступают в реакцию с молекулярными мишенями в клетке и образуют вторичные долгоживущие радикалы. Такие долгоживущие способны сохранятся в течение времени при оптимальных условиях хранения, что должно отражаться на цитотоксической активности СО-ХПС. Для анализа изменения свойств облученной культуральной среды при хранении, образцы СО-ХПС разделяли на аликвоты и помещали на хранение при температуре 4 и −20°С.
Для анализа цитотоксических свойств СО-ХПС культивирование клеток MCF7 проводили в присутствии СО-ХПС, хранившейся при указанных температурах от 1 до 168 ч. В образцах “контроль” использовали необлученную среду после хранения при тех же температурах в течение 48 ч. Точка 0 ч на рис. 4 отражает образец среды, добавленный к клеткам после облучения без хранения. Жизнеспособность клеток оценивали MTT-тестом через 24 ч после замены обычной культуральной среды на облученную. Можно видеть (рис. 4), что СО-ХПС, хранившаяся при 4°С сохраняет свою цитотоксическую активность в течение 48 ч, а хранившаяся при −20°С – только 24 ч. Таким образом, для среды, обработанной ХПС, предпочтительно хранение при 4°С.
Рис. 4.
Влияние температуры хранения облученной культуральной среды (СО-ХПС) и длительности хранения на ее цитотоксическую активность. Время облучения 8 мин. Аликвоты облученной среды помещали для хранения при 4 и −20°С на 0–168 ч, культивировали в ней клетки MCF7 в стандартных условиях и через 24 ч анализировали их жизнеспособность с помощью МТТ-теста. Результаты представлены средними значениями (± SD) из 3-х независимых экспериментов.

Изменение морфологии сфероидов и жизнеспособности клеток в составе сфероидов при прямом облучении ХПС и в присутствии СО-ХПС. Полученные данные о чувствительности клеток MCF7 к прямому и опосредованному воздействию ХПС были важны для перехода исследования к модели многоклеточных сфероидов MCF7-EGFR, в которой также оценивали воздействие прямого и опосредованного влияния ХПС. В отличие от клеток, культивируемых в монослое, сфероиды приближены к многоклеточной структуре организма. В экспериментах с модельными сфероидами использовали плазменную струю в гелии, как более применимую для экспериментов на животных. Аргон и гелий имеют разные физические свойства, что сказывается на свойствах самой плазменной струи и на плазмохимии у поверхности биомишени. При сопоставимых напряжениях струи (4–5 кВ), токи ХПС в аргоне, в отличие от токов в гелии, достигают десятков мА, что некомфортно и опасно для живых организмов с точки зрения электробезопасности. Ранее мы определили, что увеличение напряжения струи в гелии с 4.5 до 4.9 кВ ведет к увеличению температуры струи с 35 до 40°С при частоте 13 кГц, а при частоте 22 кГц температура струи становится горячей (65°С) уже при 4.5 кВ (данные готовятся к публикации). Поскольку разрабатываемый подход имеет целью исследование метода для внедрения его в клиническую практику, температура струи является критическим параметром. Поэтому, в экспериментах со струей в гелии использовали напряжение 4.5 кВ и частоту 13 кГц.
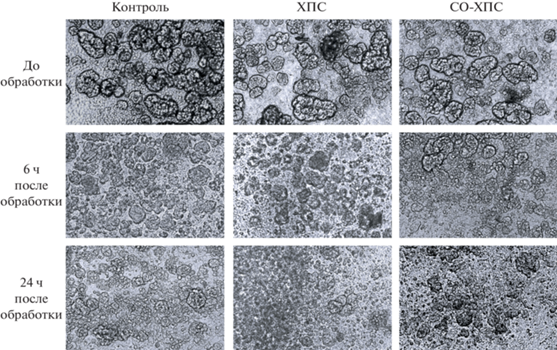
На рис. 5 представлен характерный вид сфероидов до облучения и через 6 и 24 ч после облучения. Можно видеть, что через 24 ч после облучения происходит разрушение крупных сфероидов до сфероидов более мелких и до отдельных клеток, как при прямом облучении, так и при культивировании с СО-ХПС.
Рис. 5.
Изменение морфологии клеток MCF7-EGFR в 3D-культуре после прямого облучения их ХПС и СО-ХПС в течение 1 мин. Микроскопия в проходящем свете; показаны характерные изображения препаратов до облучения и через 6 и 24 ч после облучения. Здесь и на рис. 6, 7, 8 параметры генерации ХПС: 4.5 кВ, 13 кГц, газ – гелий, 9 л/мин.
Изменение жизнеспособности клеток сфероидов в ответ на облучение ХПС оценивали по изменению доли клеток в состоянии позднего апоптоза (некроза). Для этого применяли метод проточной цитометрии с окрашиванием йодистым пропидием (PI). PI проникает в ядра гибнущих клеток с поврежденной плазматической мембраной, и такие клетки можно визуализировать флуоресцентными методами анализа. Сравнение доли PI-положительных клеток (%), подвергнутых прямому облучению и СО-ХПС при выбранных условиях показало, что культивирование сфероидов с СО-ХПС вызывало несколько больший цитотоксический эффект: 78% клеток были PI-положительными против 70% при прямой обработке ХПС (рис. 6). В контрольных необлученных образцах доля PI-положительных клеток была высокой и составляла до 50%. Такую высокую гибель клеток можно объяснить как особенностями подготовки образцов из сфероидов, так и особенностями роста самих сфероидов.
Рис. 6.
Изменение жизнеспособности клеток сфероидов MCF7-EGFR в контроле и после прямой обработки их с помощью ХПС и СО-ХПС. Через 24 ч после воздействия сфероиды диссоциировали на отдельные клетки, образцы клеток инкубировали с йодидистым пропидием (PI) и анализировали методом проточной цитометрии. а – Распределения клеток по параметрам прямого и бокового светорассеяния; P1 – популяция, анализируемая по интенсивности сигнала PI. б – гистограммы распределения клеток по интенсивности флуоресценции PI в канале PE-A (Р2 – диапазон позитивности по PI); в правом верхнем углу гистограмм указаны доли погибших клеток.

Содержание АФК в клетках сфероидов, подвергнутых прямому или опосредованному воздействию ХПС. Поскольку основными индукторами гибели клеток при воздействии холодной плазмы являются АФК и АФА (Vandamme et al., 2012), было важно оценить изменение содержания АФК в клетках сфероидов MCF7-EGFR, подвергнутых прямому или опосредованному воздействию ХПС. Для этого к облученным сфероидам или сфероидам, культивируемым с облученной средой, добавляли реагент H2DCFDA и анализировали сфероиды методом флуоресцентной микроскопии.
Мы обнаружили, что как при прямом облучении ХПС, так и при воздействии СО-ХПС, в образцах сфероидов значительно усиливался зеленый сигнал, указывающий на присутствие АФК в клетках. В качестве положительного контроля использовали сфероиды, к которым добавляли 5%-ный раствор H2O2, который стимулирует конвертацию H2DCFDA в DCF–. Анализ показал, что при опосредованном способе воздействия ХПС доля клеток сфероидов с увеличенным содержанием АФК была незначительно больше, чем при прямом воздействии (рис. 7) при используемых условиях облучения.
Рис. 7.
Изменение АФК и АФА в клетках 3D сфероидов MCF7-EGFR после воздействия ХПС. а – Интенсивность флуоресценции АФК-зависимого зонда H2DCF в клетках сфероидов, окрашенных H2DCFDA. б – Данные проточной цитометрии для клеток сфероидов через 6 ч после облучения; представлены характерные образцы анализа; в правом верхнем углу гистограмм указаны доли (%) H2DCF-позитивных клеток.

Таким образом, сфероиды MCF7-EGFR чувствительны как к прямому облучению ХПС, так и к воздействию СО-ХПС, и эти воздействия сопровождаются увеличением уровня активных форм кислорода внутри клеток.
Захват фагоцитирующими клетками сфероидов, облученных ХПС. Для того, чтобы оценить возможность захвата облученных сфероидов клетками с фагоцитарной активностью, сфероиды предварительно окрашивали флуоресцентным красителем цитоплазмы, подвергали прямому облучению ХПС, после чего через 24 ч добавляли к культивируемым активированным моноцитам ТНР-1. Активированные моноциты характеризуются фагоцитарной активностью, а их окрашивание флуоресцентным красителем позволяет визуализировать захват флуоресцентного субстрата методом флуоресцентной микроскопии (рис. 8а). В контрольных образцах заметны крупные сфероиды без атаки фагоцитами (рис. 8б). Сопоставление наложения изображений в флуоресцентных каналах и в проходящем свете показало, что в стадии активного фагоцитоза происходит потеря красного сигнала от сфероидов в результате полного экранирования зелеными макрофагами, покрывающими сфероиды (рис. 8в, г). Подсчет на основании данных рис. 8 показывает, что облучение ХПС увеличивает долю сфероидов, которые активно захватываются макрофагами, с 59. 6 ± 12.0 до 86.2 ± 4.9% (рис. 8).
Рис. 8.
Фагоцитарная активность макрофагов в отношении сфероидов MCF7-EGFR, облученных ХПС. а – Схема эксперимента; РМА – форбол-12-миристат 13-ацетат. б, в – Фагоцитоз через 2 ч после добавления сфероидов к макрофагам; красным флуоресцентным красителем окрашены сфероиды, зеленым – макрофаги; флуоресцентная микроскопия (в левом верхнем углу указана доля (%) сфероидов, атакованных макрофагами), г – сфероиды в проходящем свете после облучения ХПС, атакованные макрофагами. б–г – Характерные примеры анализа; красным флуоресцентным красителем окрашены сфероиды, зеленым флуоресцентным красителем – макрофаги.

ОБСУЖДЕНИЕ
В настоящее время исследование применения ХПС в отношении солидных опухолей человека проводят не только in vitro и на животных, но и в рамках ранних стадий клинических испытаний на пациентах. В базе данных клинических исследований (www.clinicaltrials.gov) официально зарегистрированы два исследования, в которых тестируют противоопухолевое действие ХПС в отношении солидных опухолей.
Первое из них (NCT04267575) было начато в 2019 г. и предполагает исследование безопасности применения ХПС для облучения операционного поля после удаления крупных солидных новообразований при IV-ой стадии рака молочной железы, предстательной железы, поджелудочной железы, немелкоклеточного рака легкого, рака яичников и других с окончанием исследований в 2023 г. Во втором исследовании (NCT03218436) холодная аргоновая плазма была использована для облучения цервикальной интраэпителиальной неоплазии, которая классифицируется как предраковое состояние (Basu et al., 2018). Облучение проводили в процессе кольпоскопического исследования без анестезии и оценивали ремиссию через 3 и 6 мес после облучения, но итоговые результаты исследования пока не представлены. Таким образом, в настоящее время нет доступных данных клинических исследований о противоопухолевой активности ХПС на людях. Поэтому исследование эффективных режимов облучения, механизмов действия, селективности облучения на клеточных моделях, приближенных к опухолям, не теряет своей актуальности.
Тем не менее, доклинические исследования ХПС позволили сформировать представления о том, какие опухоли могут быть чувствительны к облучению. Основными потенциальными мишенями струи холодной плазмы будут опухоли, для которых не предложено эффективной таргетной терапии, опухоли, залегающие неглубоко в тканях, изолированные, устойчивые к радиотерапии, рецидивирующие и метастазирующие. Эти опухоли должны быть удалены хирургически, а обработке ХПС должно подвергаться операционное поле, что позволяет преодолеть лимит распространения генерируемых активных частиц вглубь тканей (Dai et al., 2018). Позитивный ответ реализуется за счет селективности по отношению к опухолевым клеткам, стимулированию иммунной системы, элиминации стволовых опухолевых клеток. Селективное воздействие достижимо как при применении таргетных препаратов, так и при оптимизации условий воздействия – концентрации препарата, времени воздействия и т.д. Поэтому оптимизация условий формирования ХПС и условия облучения ею клеток-мишеней направлены на определение диапазона цитотоксического воздействия на опухолевые клетки без повреждения клеток здоровых. Для этого мы использовали пару клеточных культур – здоровых и опухолевых – одного гистологического происхождения: клетки аденокарциномы молочной железы MCF7 и MCF10A.
В качестве 3D-клеточной модели в работе использовали линию MCF7-EGFR, растущую преимущественно в виде сфероидов без использования матриксов и ростовых факторов. Культура клеток MCF7-EGFR была получена на основе клеток MCF7, в геном которых методом ретровирусной трансдукции была встроена последовательность, кодирующая полноразмерный белок EGFR (Troitskaya et al., 2021). Использование сфероидов MCF7-EGFR, растущих без гидрогелей и ростовых факторов позволило упростить систему оценки реакции клеток сфероидов на стимулы и не учитывать дополнительно эффекты от воздействия ХПС на гидрогели и факторы роста.
Обработку 2D- и 3D-клеточных моделей осуществляли двумя способами: прямым облучением, когда поток плазмы взаимодействовал со средой и растущими клетками, и непрямым, при котором к клеткам добавляли предварительно облученную среду (СО-ХПС). Следует отметить, что при воздействии на клетки и сфероиды СО-ХПС исключаются физические эффекты воздействия ХПС, такие как электрическое поле и УФО.
В настоящее время описано сравнительно немного исследований по воздействию холодной плазмой на 3D-клеточные модели (Wiegand et al., 2016; Wanigasekara et al., 2022). Поскольку 3D-модели более полно имитируют рост опухоли и ее архитектуру по сравнению с клеточными моделями 2D, не вызывает сомнения важность исследования эффектов ХПС в клеточных 3D-моделях. Мы наблюдали, что как при прямом облучении, так и при воздействии СО-ХПС на сфероиды происходит деструкция сфер до единичных клеток. Такое наше наблюдение хорошо согласуется с результатами других авторов о том, что одним из эффектов обработки клеток холодной плазмой является снижение их адгезионной, миграционной и инвазивной способностей (Semmler et al., 2020). Предполагают, что ХПС стимулирует негативную регуляцию интегринов – белков, располагающихся на поверхности клеток и формирующих межклеточные контакты (Shashurin et al., 2010). Наиболее вероятно, что наблюдаемая нами деструкция сфероидов также обусловлена уменьшением интегринов на поверхности облученных клеток и ослаблением межклеточных контактов в сфероиде.
АФК и АФА являются продуктами жизнедеятельности клетки, которые постоянно образуются в ходе метаболизма и участвуют в регуляции сигнальных каскадов. При этом известно, что в опухолевых клетках концентрации АФК и АФА повышены в результате более интенсивного метаболизма (Arfin et al., 2021). Как уже отмечалось ранее, основной вклад в цитотоксическое действие ХПС вносят АФК и АФА (Graves, 2012; Yousfi et al., 2014). Идентификация и количественное определение конкретных активных частиц в биологических образцах затруднительно из-за большого их разнообразия и локализации. Поэтому применяют косвенные методы, основанные на окислительно-восстановительных превращениях молекул-индикаторов окислительного стресса, таких как H2DCFDA.
Используя H2DCFDA, мы показали, что воздействие СО-ХПС на сфероиды MCF7-EGFR вело к большему накоплению АФК в обработанных клетках, чем при прямом воздействии. Показано (Yousfi et al., 2014), что однократное добавление среды, облученной ХПС к сфероидам, образованным клетками карциномы головы и шеи FaDu, не вело к торможению роста сфероидов, но стимулировало открепление отдельных клеток от многоклеточной 3D-структуры, что хорошо согласуется с полученными нами данными. Цитотоксического воздействия в отношении сфероидов FaDu удалось добиться при многократном добавлении среды, облученной ХПС (Yousfi et al., 2014). Авторы предполагают, что низкая чувствительность к активированной среде при однократном добавлении объясняется резистентностью клеток FaDu к H2O2. Поскольку мы показали изменение относительного количества АФК после воздействия ХПС на сфероиды MCF7-EGFR, можно говорить о том, что это изменение опосредует цитотоксический ответ сфероидов MCF7-EGFR на ХПС-активированную среду и прямое облучение.
Для продвижения применения среды или биосовместимых жидкостей, облученных ХПС, в клинической практике, необходимо иметь представление об оптимальных условия хранения ХПС-обработанных жидкостей, при которых сохраняется их цитотоксическая активность. Было показано, что ХПС-обработанная среда сохраняла цитотоксическую и генотоксическую активность в течение 7 сут при хранении при 4 или −80°C (Chauvin et al., 2018). В качестве клеточной модели авторы использовали сфероиды HCT116 карциномы кишечника и диэлектрический барьерный разряд для генерации плазмы. Наиболее интересно, что хранение облученной среды при −20°С снижало ее цитотоксическую и генотоксическую активность, что хорошо согласуется с данными, полученными в нашей работе. Авторы показали, что при хранении облученной среды при 37 и при ‒20°C происходит разложение H2O2 (Chauvin et al., 2018). Тем не менее авторы не дают ответа, почему при промежуточной температуре 4°C такого разложения не происходит.
В качестве нашего собственного предположения, мы можем выдвинуть гипотезу о том, что при хранении в жидкости наиболее вероятно протекают несколько параллельных процессов. Можно предположить, что и при 4, и при –20°C происходит разложение как H2O2, так и других активных частиц, образуемых при воздействии ХПС на культуральную среду. В то же время, параллельно этому, при 4°C происходят реакции взаимодействия первичных активных частиц с компонентами среды с накоплением вторичных перекисных соединений, чего не происходит при –20°C. Накопление вторичных активных частиц обеспечивает цитотоксическое воздействие на клетки при добавлении такой среды. В свою очередь, можно предположить, что при −80°C замедляются химические реакции и лучше сохраняются первичные активные частицы. Точное выявление определенных АФК и АФА в облученной культуральной среде при хранении при разных температурах является отдельной научной задачей. Тем не менее, наши результаты и результаты других исследователей (Judée et al., 2016) показывают низкую эффективность хранения облученной среды при –20°C. Суммируя, можно сказать, что СО-ХПС может применяться как эффективный индуктор гибели опухолевых клеток, если ее хранить при 4 или −80°C.
Неэффективное удаление гибнущих опухолевых клеток фагоцитирующими клетками ведет к развитию воспалительных реакций. Мы показали, что при облучении сфероидов происходит активное поглощение облученных клеток макрофагами. Макрофаги реагируют на комбинацию молекулярных сигналов, испускаемых погибающими клетками, после чего происходит фагоцитоз. Ранее мы уже показали, что облучение опухолевых клеток ведет к активации в них сигналов, распознавемых фагоцитирующими клетками как сигналы “найди меня” и “съешь меня” (Troitskaya et al., 2020). Можно предположить, что в случае облучения ХПС солидных опухолей in vivo, также возможна деструкция опухоли на отдельные опухолевые клетки, в которых активируются процессы гибели, и они будут эффективно удаляться клетками иммунной системы с фагоцитарной активностью. Такое развитие событий на клеточном уровне препятствует процессам воспаления, что улушает ответ на терапию.
Таким образом, возможно достижение относительной селективной цитотоксической активности ХПС в отношении опухолевых клеток, в том числе в составе сфероидов.
Список литературы
Нуштаева А.А., Савинкова М.М., Ермаков М.С., Варламов М.Е., Новак Д.Д., Рихтер В.А., Коваль О.А. 2022. Клетки рака молочной железы изменяют чувствительность к гормональным и ростовым стимулам при 3D культивировании. Цитология Т. 64. С. 353. (Nushtaeva A.A., Savinkova M.M., Ermakov M.S., Varlamov M.E., Novak D.D., Richter V. A., Koval O.A. 2022. Breast cancer cells in 3D model alters their sensitivity to hormonal and growth factors. Сell Tiss. Biol. V. 16. P. 555. )https://doi.org/10.1134/S1990519X22060050
Arfin S., Jha N.K., Jha S.K., Kesari K.K., Ruokolainen J., Roychoudhury S., Rathi B., Kumar D. 2021. Oxidative stress in cancer cell metabolism. Antioxidants. V. 10. P. 642. https://doi.org/10.3390/antiox10050642
Attri P., Kumar N., Park J.H., Yadav D.K., Choi S., Uhm H.S., Kim I.T., Choi E.H., Lee W. 2015. Influence of reactive species on the modification of biomolecules generated from the soft plasma. Sci. Rep. V. 5. P. 8221. https://doi.org/10.1038/srep08221
Bagamanshina A.V., Troitskaya O.S., Nushtaeva A.A., Yunusova A.Y., Starykovych M.O., Kuligina E.V., Kit Y.Y., Richter M., Wohlfromm F., Kähne T., Lavrik I.N., Richter V.A., Koval O.A. 2019. Cytotoxic and antitumor activity of lactaptin in combination with autophagy inducers and inhibitors. BioMed. Res. Int. V. 2019. https://doi.org/10.1155/2019/4087160
Basu P., Taghavi K., Hu, S.-Y., Mogri S., Joshi S. 2018. Management of cervical premalignant lesions. Curr. Probl. Cancer. V. 42. P. 129. https://doi.org/10.1016/j.currproblcancer.2018.01.010
Boehm D., Heslin C., Cullen P.J., Bourke P. 2016. Cytotoxic and mutagenic potential of solutions exposed to cold atmospheric plasma. Sci. Rep. V. 6. P. 21464. https://doi.org/10.1038/srep21464
Chauvin J., Judee F., Merbahi N., Vicendo P. 2018. Effects of plasma activated medium on head and neck FaDu cancerous cells: comparison of 3D and 2D response. ACAMC. V. 18. P. 776. https://doi.org/10.2174/1871520617666170801111055
Colombo E., Cattaneo M.G. 2021. Multicellular 3D models to study tumour-stroma interactions. IJMS. V. 22. P. 1633. https://doi.org/10.3390/ijms22041633
Dai X., Bazaka K., Richard D.J., Thompson E.W., Ostrikov K. 2018. The emerging role of gas plasma in oncotherapy. Trends in Biotechnol. V. 36. P. 1183. https://doi.org/10.1016/j.tibtech.2018.06.010
Domonkos M., Tichá P., Trejbal J., Demo P. 2021. Applications of cold atmospheric pressure plasma technology in medicine, Agriculture Food Industry. Applied Sci. V. 11. P. 4809. https://doi.org/10.3390/app11114809
Ferreira L.P., Gaspar V.M., Mano J.F. 2018. Design of spherically structured 3D in vitro tumor models – advances and prospects. Acta Biomat. V. 75. P. 11. https://doi.org/10.1016/j.actbio.2018.05.034
Graves D.B. 2012. The emerging role of reactive oxygen and nitrogen species in redox biology and some implications for plasma applications to medicine and biology. J. Phys. D: Appl. Phys. V. 45. P. 263001. https://doi.org/10.1088/0022-3727/45/26/263001
Judée F., Fongia C., Ducommun B., Yousfi M., Lobjois V., Merbahi N. 2016. Short and long time effects of low temperature plasma activated media on 3D multicellular tumor spheroids. Sci. Rep. V. 6. P. 21421. https://doi.org/10.1038/srep21421
Klinkhammer C., Verlackt C., Smiłowicz D., Kogelheide F., Bogaerts A., Metzler-Nolte N., Stapelmann K., Havenith M., Lackmann J.-W. 2017. Elucidation of plasma-induced chemical modifications on glutathione and glutathione disulphide. Sci. Rep. V. 7. P. 13828. https://doi.org/10.1038/s41598-017-13041-8
Laschke M.W., Menger M.D. 2017. Spheroids as vascularization units: from angiogenesis research to tissue engineering applications. Biotechnol. Advances. V. 35. P. 782. https://doi.org/10.1016/j.biotechadv.2017.07.002
Metelmann H.-R., Nedrelow, D.S., Seebauer, C., Schuster, M., von Woedtke, T., Weltmann, K.D., Kindler S., Metelmann P.H., Finkelstein S.E., Von Hoff D.D., Podmelle F. 2015. Head and neck cancer treatment and physical plasma. Clinical Plasma Med. V. 3. P. 17. https://doi.org/10.1016/j.cpme.2015.02.001
Qu Y., Han B., Yu Y., Yao W., Bose S., Karlan B.Y., Giuliano A.E., Cui X. 2015. Evaluation of MCF10A as a reliable model for normal human mammary epithelial cells. PLoS One. V. 10. P. e0131285. https://doi.org/10.1371/journal.pone.0131285
Salinas-Vera Y.M., Valdés J., Hidalgo-Miranda A., Cisneros-Villanueva M., Marchat L.A., Nuñez-Olvera S.I., Ramos-Payán R., Pérez-Plasencia C., Arriaga-Pizano L.A., Prieto-Chávez J.L., López-Camarillo C. 2022. Three-dimensional organotypic cultures reshape the microRNAs transcriptional program in breast cancer cells. Cancers. V. 14. P. 2490. https://doi.org/10.3390/cancers14102490
Schweigert I., Alexandrov A., Zakrevsky D., Milakhina E., Patrakova E., Troitskaya O., Birykov M., Koval O. 2021. Mismatch of frequencies of ac voltage and streamers propagation in cold atmospheric plasma jet for typical regimes of cancer cell treatment. J. Phys.: Conf. Ser. V. 2100. P. 012020. https://doi.org/10.1088/1742-6596/2100/1/012020
Schweigert I., Zakrevsky D., Gugin P., Yelak E., Golubitskaya E., Troitskaya O., Koval O.: 2019. Interaction of cold atmospheric argon and helium plasma jets with bio-target with grounded substrate beneath. Applied Sci. V. 9. P. 4528. https://doi.org/10.3390/app9214528
Semmler M.L., Bekeschus S., Schäfer M., Bernhardt T., Fischer T., Witzke K., Seebauer C., Rebl H., Grambow E., Vollmar B., Nebe J.B., Metelmann H.-R., Woedtke T. von, Emmert S., Boeckmann L. 2020. Molecular mechanisms of the efficacy of cold atmospheric pressure plasma (CAP) in cancer treatment. Cancers. V. 12. P. 269. https://doi.org/10.3390/cancers12020269
Shashurin A., Stepp M.A., Hawley T.S., Pal-Ghosh S., Brieda L., Bronnikov S., Jurjus R.A., Keidar, M. 2010. Influence of Cold plasma atmospheric jet on surface integrin expression of living cells: influence of cold plasma atmospheric jet on surface integrin expression of living cells. Plasma Processes Polym. V. 7. P. 294. https://doi.org/10.1002/ppap.200900086
Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomatara, I., Jemal A., Bray F. 2021. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA A Cancer J. Clin. V. 71. P. 209. https://doi.org/10.3322/caac.21660
Tanaka H., Bekeschus S., Yan D., Hori M., Keidar M., Laroussi M. 2021. Plasma-treated solutions (PTS) in cancer therapy. Cancers. V. 13. P. 1737. https://doi.org/10.3390/cancers13071737
Troitskaya O., Golubitskaya E., Biryukov M., Varlamov M., Gugin P., Milakhina E., Richter V., Schweigert I., Zakrevsky D., Koval O. 2020. Non-thermal plasma application in tumor-bearing mice induces increase of serum HMGB1. Int. J. Mol. Sci. V. 21. P. E5128. https://doi.org/10.3390/ijms21145128
Troitskaya O., Novak D., Nushtaeva A., Savinkova M., Varlamov M., Ermakov M., Richter V., Koval O. 2021. EGFR Transgene stimulates spontaneous formation of MCF7 breast cancer cells spheroids with partly loss of HER3 receptor. IJMS. V. 22. P. 12 937. https://doi.org/10.3390/ijms222312937
Vandamme M., Robert E., Lerondel S., Sarron V., Ries D., Dozias S., Sobilo J., Gosset D., Kieda C., Legrain B., Pouvesle J.-M., Pape A.L. 2012. ROS implication in a new antitumor strategy based on non-thermal plasma. Int. J. Cancer. V. 130. P. 2185. https://doi.org/10.1002/ijc.26252
Verjans E.-T., Doijen J., Luyten W., Landuyt B., Schoofs L. 2018. Three-dimensional cell culture models for anticancer drug screening: Worth the effort? J. Cell Physiol. V. 233. P. 2993. https://doi.org/10.1002/jcp.26052
Wanigasekara J., Barcia C., Cullen P.J., Tiwari B., Curtin J.F. 2022. Plasma induced reactive oxygen species-dependent cytotoxicity in glioblastoma 3D tumourspheres. Plasma Processes Polymers. V. 19. P. 2100157. https://doi.org/10.1002/ppap.202100157
Wiegand C., Fink S., Beier O., Horn K., Pfuch A., Schimanski A., Grünler B., Hipler U.-C., Elsner P. 2016. Dose- and time-dependent cellular effects of cold atmospheric pressure plasma evaluated in 3D skin models. Skin Pharmacol. Physiol. V. 29. P. 257. https://doi.org/10.1159/000450889
Xu D., Wang B., Xu Y., Chen Z., Cui Q., Yang Y., Chen H., Kong M.G. 2016. Intracellular ROS mediates gas plasma-facilitated cellular transfection in 2D and 3D cultures. Sci. Rep. V. 6. P. 27872. https://doi.org/10.1038/srep27872
Yazdani M. 2015. Concerns in the application of fluorescent probes DCDHF-DA, DHR 123 and DHE to measure reactive oxygen species in vitro. Toxicol. in Vitro. V. 30. P. 578. https://doi.org/10.1016/j.tiv.2015.08.010
Yousfi M., Merbahi N., Pathak A., Eichwald O. 2014. Low-temperature plasmas at atmospheric pressure: toward new pharmaceutical treatments in medicine. Fundam. Clin. Pharmacol. V. 28. P. 123. https://doi.org/10.1111/fcp.12018
Дополнительные материалы отсутствуют.


