Экология, 2022, № 2, стр. 129-139
Анализ связи филогенетического разнообразия донных сообществ с минерализацией равнинных рек бассейна Нижней Волги
Л. В. Головатюк a, *, В. К. Шитиков a, Т. Д. Зинченко a
a Самарский федеральный исследовательский центр РАН, Институт экологии Волжского бассейна РАН
445003 Тольятти, ул. Комзина, 10, Россия
* E-mail: gollarisa@mail.ru
Поступила в редакцию 03.06.2021
После доработки 02.07.2021
Принята к публикации 09.07.2021
- EDN: PKMGQJ
- DOI: 10.31857/S0367059722010048
Аннотация
На примере донных сообществ малых и средних рек в бассейне Нижней Волги рассмотрены статистические аспекты связи таксономического разнообразия макрозообентоса с минерализацией водной среды. На основе комплекса из 35 видовых и филогенетических индексов α- и β-разнообразия показаны значимые различия макрозообентоса между притоками Саратовского и Волгоградского водохранилищ и солеными реками, притоками оз. Эльтон. Подтверждена гипотеза Дж. Лососа о филогенетическом консерватизме ниш: при низкой и средней минерализации водотоков наблюдается значимый эффект филогенетического рассредоточения, а при высокой минерализации – филогенетической кластеризации. Для каждого из 356 видов выполнена оценка показателя средней соленостной толерантности ССT, который трактуется как математическое ожидание минерализации, при которой наиболее вероятна встречаемость вида. С использованием тестов λ Пагеля и K Блумберга выявлен статистически значимый уровень филогенетического сигнала по отношению к этому свойству (trait) видов. Информация о величине ССT для таксонов на различных систематических уровнях представлена в виде кладистического дерева.
Экологические сообщества представляют собой организованные совокупности взаимодействующих видов, которые обитают в конкретный период времени и в пределах локального географического региона, характеризующегося определенным комплексом условий окружающей среды [1]. Таксономический состав сообществ зависит от способности видов к расселению, экологической толерантности к внешним факторам и их роли в межвидовых отношениях, т.е. в конечном итоге от набора тех свойств, которые приобрел каждый вид в ходе общей эволюционной истории и текущих биогеографических процессов [2]. Наблюдаемая тенденция к передаче многих признаков от предков к потомкам, в результате чего филогенетически близкие виды оказываются также функционально и экологически сходными [3, 4], стала предпосылкой гипотезы о филогенетическом консерватизме ниш (phylogenetic niche conservatism [5, 6]).
При филогенетическом анализе используются данные об иерархически упорядоченной структуре родственных отношений между таксонами (видами, родами, семействами и т.д.), представленной в форме филогенетического дерева [7–9]. В общем случае дерево состоит из корня, узлов и вершин (листьев), которые соответствуют реальным объектам эксперимента. Узлы соединяются ветвями, длина которых может измеряться, например, в миллионах лет с момента дивергенции, и благодаря развитию молекулярных методов эта информация становится все более доступной для разных систематических групп. Основная задача филогенетического анализа – оценка выраженности родственных отношений в пределах древовидной структуры, т.е. является ли статистически значимой тенденция близких таксонов походить друг на друга больше, чем таксоны, случайно извлеченные из общего дерева [10].
Важной проблемой современной биологии является анализ различных аспектов разнообразия на разных уровнях экосистемной организации – от молекулярного до биосферного [3]. Видовое разнообразие обычно оценивается с помощью большой совокупности индексов гетерогенности, сочетающих в себе богатство видов и соотношение вероятностей их присутствия, а также индексов выравненности, которые были разработаны при попытке выделить компонент эквитабельности сообществ в отдельное измерение [11, 12]. Объективная необходимость учета филогенетических различий между видами обусловила расширение понятия разнообразия и появление целой коллекции таксономических и филогенетических индексов [13–18].
Функциональное разнообразие рассматривается как степень изменчивости видов в пространстве их характерных свойств (trait values), связанных с морфометрическими признаками, широтой спектра реакций отдельных видов на воздействие факторов среды, значениями продуктивности, стабильности, скорости усвоения питательных веществ и т.д. [19, 20]. Для анализа взаимосвязи между родством таксонов и свойствами видов используется концепция филогенетического сигнала [21, 22]. Если спроецировать филогенетическое дерево на пространство изменения экологических характеристик, то при наличии сильного филогенетического сигнала близкородственные виды будут располагаться рядом, т.е. изменчивость их свойств вдоль ветвей дерева будет относительно небольшой.
Актуальной проблемой экологии и биогеографии является моделирование пространственного распределения видов и биоразнообразия сообществ под влиянием лимитирующих факторов среды. На основе изучения донных сообществ малых и средних рек на территории Среднего и Нижнего Поволжья нами ранее [23] были сформированы списки индикаторных видов, показывающие закономерную смену ведущих таксонов для различных природно-климатических поясов в последовательности водохранилищ Волжского каскада. Выполнена оценка влияния локального географического градиента на изменение показателей видового разнообразия и показана роль пространственной автокорреляции, основанной на близости местообитаний [24]. Осуществлен анализ общих тенденций формирования видовой структуры с использованием концепции мета-сообществ, в том числе проверка гипотез о согласованной встречаемости видов, образовании компактных ассоциаций видов и т.д. [25]. Построена совокупность моделей совместного распределения видов хирономид (Diptera, Chironomidae) на основе комплекса показателей, определяющих условия окружающей среды, филогенетические отношения, пространственную автоковариацию и вклад межвидовых отношений, рассчитанный по матрице ассоциаций [26].
Цель настоящей работы ‒ детальный анализ структуры донных сообществ на основе филогенетических представлений и выявление закономерностей влияния такого ведущего фактора, как минерализация водной среды, на тесноту родственных связей между видами. Оценивается статистическое распределение по градиенту солености показателя чувствительности отдельных видов и таксономических кластеров высшего уровня; выделены группы гидробионтов с разной степенью галотолерантности.
МАТЕРИАЛ И МЕТОДИКА
Анализ зависимости филогенетической структуры донных сообществ от уровня минерализации рассматривали на примере гидробиологических исследований равнинных рек в бассейне Средней и Нижней Волги, выполненных в разные месяцы вегетационных периодов 1990–2019 гг. [27]. С учетом однородности природно-климатических условий из всего массива наблюдений было отобрано 267 точек отбора гидробиологических образцов на 48 малых и средних реках в степной и опустыненной зонах (см. рис. 1). В точках отбора проб бентоса параллельно проводился мониторинг факторов среды, включающий определение минерализации воды (в г/л). Для сравнительного анализа совокупность наблюдений делили на две группы: “В” – притоки степной зоны Саратовского и Волгоградского водохранилищ и “Э” – соленые реки аридного региона бассейна оз. Эльтон. Обе группы характеризовались примерно эквивалентными объемами выборок учетных единиц, под которыми понимались пробы макрозообентоса, взятые по стандартным методикам и представленные списком видов и их удельными численностями (экз/м2; подробно см. в табл. 1).
Рис. 1.
Территория проведения исследований; диаметр кружков в районах гидробиологической съемки пропорционален квадратичной энтропии Рао донных сообществ.
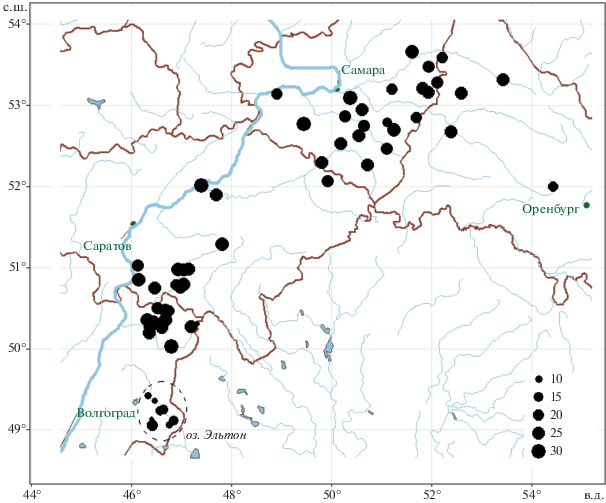
Таблица 1.
Средние значения индексов биоразнообразия макрозообентоса в притоках Саратовского и Волгоградского водохранилищ (“В”) и оз. Эльтон (“Э”)
| Показатели | Общее среднее значение | Групповые средние | t-стати-стика | 95%-ный доверительный интервал разности | |
|---|---|---|---|---|---|
| “В” | “Э” | ||||
| Изучено рек/участков | 48/60 | 41/50 | 7/10 | ||
| Минерализация, г/л (медиана) | 2.7 | 0.59 | 15 | ||
| Выполнено проб | 519 | 281 | 238 | ||
| Обнаружено видов | 356 | 320 | 85 | ||
| Индексы видовой гетерогенности | |||||
| Видов в пробе | 8.383 | 11.171 | 5.092 | 14.96 | 5.27–6.87 |
| Шеннона, бит, Shannon (1948) | 1.852 | 2.470 | 1.123 | 22.25 | 1.22–1.46 |
| Симпсона, Simpson (1949) | 0.577 | 0.726 | 0.400 | 18.44 | 0.291–0.361 |
| Бриллюэ́на, Brillouin (1956) | 1.269 | 1.690 | 0.772 | 22.11 | 0.836–0.999 |
| Маргалефа, Margalef (1958) | 0.955 | 1.341 | 0.499 | 17.17 | 0.745–0.938 |
| Реньи, Renyi (1961), a = 1.5 | 1.135 | 1.536 | 0.662 | 21.06 | 0.792–0.956 |
| Менхиника, Menhinick (1964) | 0.195 | 0.276 | 0.098 | 15.15 | 0.154–0.200 |
| Макинтоша, McIntosh (1967) | 0.388 | 0.508 | 0.247 | 19.78 | 0.234–0.286 |
| Бергера-Паркера, Berger, Parker (1970) | 2.291 | 2.892 | 1.581 | 15.97 | 1.149–1.472 |
| Хилла-Реньи, Hill (1973), a = 1.5 | 3.818 | 5.228 | 2.155 | 18.17 | 2.74–3.40 |
| Тсаллиса, Tsallis (1988), q = 2.5 | 3.211 | 4.305 | 1.919 | 17.08 | 2.11–2.66 |
| Индексы выравненности обилия | |||||
| Пиелу, Pielou (1966) | 0.642 | 0.757 | 0.507 | 12.99 | 0.212–0.287 |
| Макинтоша, McIntosh (1967) | 0.609 | 0.738 | 0.458 | 13.33 | 0.238–0.321 |
| Хейпа, Heip (1974) | 0.472 | 0.561 | 0.367 | 9.33 | 0.153–0.234 |
| Камарго, Camargo (1992) | 0.094 | 0.120 | 0.064 | 12.28 | 0.047–0.065 |
| Смита-Уилсона, Smith, Wilson (1996) | 0.134 | 0.199 | 0.058 | 2.51 | 0.03–0.252 |
| Таксономические индексы | |||||
| Разнообразия D | 35.34 | 47.28 | 21.25 | 18.57 | 23.2–28.7 |
| Отчетливости (distinctness) Dstar | 58.63 | 65.28 | 50.77 | 8.40 | 11.1–17.9 |
| Филогенетические индексы | |||||
| Разнообразие, Faith (1992) | 208.63 | 268.34 | 138.13 | 15.35 | 113–146 |
| Энтропия Q Рао, Rao (1982) | 17.75 | 24.10 | 10.25 | 20.08 | 12.4–15.2 |
| Средняя парная дистанция MPD | 35.49 | 48.20 | 20.49 | 20.08 | 24.9–30.4 |
| Среднее расстояние между близкими таксонами MNTD | 35.67 | 34.75 | 36.76 | –1.34 | –4.96–0.945 |
| Вариация видов PSV | 0.583 | 0.641 | 0.515 | 9.46 | 0.099–0.152 |
| Богатство видов PSR | 5.177 | 7.233 | 2.749 | 15.58 | 3.91–5.04 |
| Выравненность видов PSE | 0.416 | 0.545 | 0.264 | 17.09 | 0.248–0.312 |
| Кластеризация видов PSC | 0.373 | 0.359 | 0.389 | –2.75 | –0.051…–0.0086 |
Примечание. Расчетные формулы индексов и полные ссылки на публикации приведены в [5]; курсивом выделены статистически незначимые связи.
Для каждого из 356 видов с использованием ITIS (Integrated Taxonomic Information System, https://www.itis.gov) было выполнено систематическое описание по 11 таксономическим уровням: Species → Genus → Tribe → SubFamily → → Family → SubOrder → Order → SubClass → → Class → SubPhylum → Phylum. Выделение трибы в качестве самостоятельного уровня определялось тем, что для многочисленного семейства Chironomidae такая градация имеет важное практическое значение. На этой основе последовательно формировали матрицу таксономических дистанций между каждой парой видов и строили кладистическое дерево в формате Newick.
Все этапы подготовки и анализа данных выполняли с использованием пакетов и языка статистической среды R версии 3.6.1. Для расчета показателей α-разнообразия по каждой из 519 проб использовали функцию DER (Diversity, Evenness, Rarity), включенную в пакет EcoIndR [28]. Всего рассчитали 31 индекс, оценивающих разнообразие по различным категориям: богатство видов, их редкость, выравненность, таксономическую сложность и филогенетическую дивергенцию.
Индексы филогенетического α-разнообразия рассчитывали на основе кофенетического расстояния dij, равного сумме длин ветвей дерева, соединяющих два произвольных вида i–j, в том числе:
MPD – среднюю для всех видов величину dij и MNTD – среднее расстояние до ближайшего таксона [3, 7], а также квадратичную энтропию Q Рао [29], учитывающую относительные численности видов pi и pj;
PSV – филогенетическую изменчивость видов, которая количественно определяет, как родство между видами связано с гипотетическим нейтральным свойством (trait), характерным для всех видов в сообществе;
PSC – филогенетическую кластеризацию видов, которая увеличивается по мере уменьшения связи между вершинами дерева, а также филогенетические богатство видов PSR и выравненность PSE [30].
Нулевые модели для оценки ожидаемого распределения значений MPD или MNTD строили в процессе многократных случайных перестановок вершин дерева, после чего для каждой псевдовыборки находили значение тестируемого показателя разнообразия. Стандартизированный размер эффекта SES (Standardized Effect Size) вычисляли путем нормирования разности эмпирической и нуль-модельной метрик на стандартное отклонение нулевого распределения [10].
Для анализа филогенетического β-разнообразия строили матрицы дистанций между всеми комбинациями пар проб макрозообентоса с использованием различных метрик: а) средневзвешенных значений MPD и MNTD; б) меры филогенетического различия сообществ PCD, основанной на оценке PSV [31]; в) UniFrac или относительной доли уникального филогенетического разнообразия, содержащегося в двух сравниваемых сообществах [32, 33]. Эти меры рассматривали в двух вариантах – с учетом относительного обилия видов и без использования весов.
Полученные матрицы филогенетических дистанций сравнивали с соответствующими матрицами расстояний Брея-Кертиса и Сёренсена с использованием матричного коэффициента линейной корреляции Мантеля R [34]. Построение линейных моделей зависимости матриц расстояний от уровня минерализации и последующее разложение суммы квадратов отклонений от центроидов сравниваемых групп выполняли с использованием непараметрического дисперсионного анализа npMANOVA [35].
Расчет мер филогенетического разнообразия осуществляли с использованием R-пакетов picante, phyr и GUniFrac, а проверку значимости статистических критериев – на основе рандомизационного теста и функций mantel() и adonis() из пакета vegan.
Для каждого вида оценивали показатель средней соленостной толерантности (ССТ), равный средневзвешенному значению минерализации Xi (г/л) для n проб, в которых встретился вид:
Количественную меру филогенетического сигнала оценивали по двум статистикам, которые равны нулю при отсутствии зависимости и возрастают по мере увеличения корреляционной связи между степенью таксономического родства и показателем ССТ:
– λ Пагеля [21], приближающаяся к 1 при наличии явного филогенетического сигнала и основанная на сжатии внутренних ветвей по отношению к верхушке (при λ = 0 дерево имеет форму полной политомии);
– K Блумберга [22], основанная на броуновской модели случайного дрейфа эволюции, имеющей место при K = 1, но при K > 1 считается, что виды более сходны между собой, чем для модели броуновского движения.
Статистическую значимость филогенетического сигнала проверяли путем сравнения дисперсии наблюдаемых паттернов независимых контрастов (PIC) признака с нулевой моделью перемешивания меток таксонов по вершинам дерева филогении.
С подробным описанием техники расчетов, скриптами на языке R и примерами вычислений можно ознакомиться на Интернет-ресурсе авторов https://stok1946.blogspot.com/2021/06/blog-post.html.
РЕЗУЛЬТАТЫ
Расположение точек отбора проб и пространственное распределение квадратичной энтропии Q Рао по исследованной территории показано на рис. 1. Для приведенных в табл. 1 индексов разнообразия различных категорий вычислены средние значения для всего мета-сообщества и групповые средние по всем пробам, взятым в реках Приэльтонья (группа “Э”) и притоках Саратовского и Волгоградского водохранилищ (группа “В”). Сравнение средних по t-критерию показало с высоким уровнем статистической значимости более низкий уровень разнообразия донных сообществ в бассейне оз. Эльтон по всем метрикам, кроме MNTD и PSC. Графики изменения основных индексов видового и филогенетического разнообразия от степени минерализации водотоков (г/л) в логарифмической шкале представлены на рис. 2а, б. В табл. 2 приведены значения коэффициента корреляции Мантеля между матрицами дистанций видового и филогенетического разнообразия, а также результаты перестановочного теста при многомерном дисперсионном анализе npMANOVA матриц дистанций с разбиением по группам проб “В” и “Э”.
Рис. 2.
Зависимость основных показателей биоразнообразия от минерализации водотоков Х (серым показаны 95%-ные доверительные интервалы): а – линейные модели для средней парной дистанции MPD × 10–2 (показаны точки наблюдений) и филогенетической вариации видов PSV (штриховая линия); кривые непараметрического сглаживания для индекса Симпсона и индекса Пиелу (штриховая линия); б – линейные модели для среднего расстояния ближайших таксонов MNTD × 10–2 (показаны точки наблюдений) и филогенетической кластеризации видов PSC (штриховая линия).
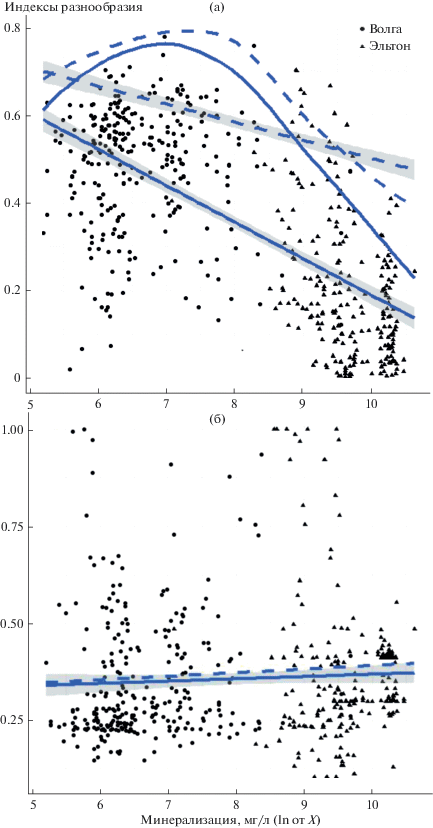
Таблица 2.
Результаты теста Мантеля и многомерного дисперсионного анализа permMANOVA по группам проб макрозообентоса в притоках Саратовского и Волгоградского водохранилищ (“В”) и оз. Эльтон (“Э”) для различных матриц филогенетических расстояний
| Метрика для расчета матрицы дистанций | Тест Мантеля | Тест permMANOVA | ||
|---|---|---|---|---|
| r-статистика | p-значение | псевдо-F | p-значение | |
| MPD с учетом обилия видов | 0.256 | 0.001 | 41.153 | 0.001 |
| MPD невзвешенная | 0.315 | 0.001 | 17.2 | 0.001 |
| MNTD с учетом обилия видов | 0.49 | 0.001 | 16.9 | 0.001 |
| PCD различия сообществ | 0.736 | 0.001 | 99.4 | 0.001 |
| Unifrac взвешенная | 0.452 | 0.001 | 98.563 | 0.001 |
| Unifrac невзвешенная | 0.798 | 0.001 | 94.244 | 0.001 |
Для сравнительной оценки γ-разнообразия объединили строки матрицы численностей видов по группам “В” и “Э” и рассчитали унитарные метрики разнообразия – меру различий (Unifrac = = 0.814) и филогенетический аналог индекса сходства Сёренсена (PhyloSor = 0.312). Меру филогенетического различия PCD рассматривали как мультипликативную комбинацию композиционного компонента PCDc, который является модификацией метрики Сёренсена для общих видов двух сообществ, и филогенетического компонента PCDp, отражающего родственные отношения между несовпадающими видами: PCD = = PCDc × PCDp = 1.22 × 1.33 = 1.62.
Выявлены статистически значимые различия в группах проб “В” и “Э” по величине стандартизированного размера эффекта SES, оцененного при помощи нулевой модели richness с фиксированным числом видов. В частности, для взвешенного варианта MPD средняя величина SES составила –0.466 для притоков р. Волги и 1.17 – для рек Приэльтонья (t = 7.69, p ≈ 0). Заметим, что для объединенных по группам строк матрицы численностей видов эти значения будут –0.045 и –1.98 соответственно.
Для всех 356 видов вычислены значения средней соленостной толерантности ССТ, которые варьировали от 0.27 до 30.5 г/л при среднем 3.35 и медиане 0.89 г/л. Это дало возможность выделить три группы гидробионтов: при ССТ до 1 г/л виды считались олигогалинными (пресноводными), при ССТ свыше 10 г/л – полигалинными (галофильными), а имеющие промежуточные значения – мезогалинными или эвригалинными. Ниже приведен список некоторых видов из разных экологических групп с указанием рассчитанного для них индекса соленостной толерантности ССТ и встречаемости в пробах. Так, к видам с высокой галотолерантностью, галофильным таксонам, относятся Diptera, Chironomidae: Cricotopus salinophilus (средняя соленостная толерантность ССТ = = 20.18/встретился в 168 пробах из общего числа 519), Chironomus salinarius (20.94/117); Diptera, Ceratopogonidae – Palpomyia schmidti (25.92/104); Hemiptera – Sigara assimilis (26.08/9), Oligochaeta – Paranais simplex (10.11/32). Эвригалинными являются Diptera, Chironomidae – Procladius ferrugineus (1.14/129), Dicrotendipes notatus (1.18/54), Ceratopogonidae – Sphaeromias pictus (5.71/67), Amphipoda – Gammarus lacustris (8.29/33), Oligochaeta – Nais elinguis (9.17/21). Среди олигогалинных отмечены Diptera, Chironomidae – Tanytarsus pallidicornis (0.89/62), Stictochironomus crassiforceps (0.94/45), Ephemeroptera – Cloeon simile (0.42/22), Trichoptera – Hydropsyche pellucidula (0.62/9), Oligochaeta – Nais pardalis (0.32/10) и др.
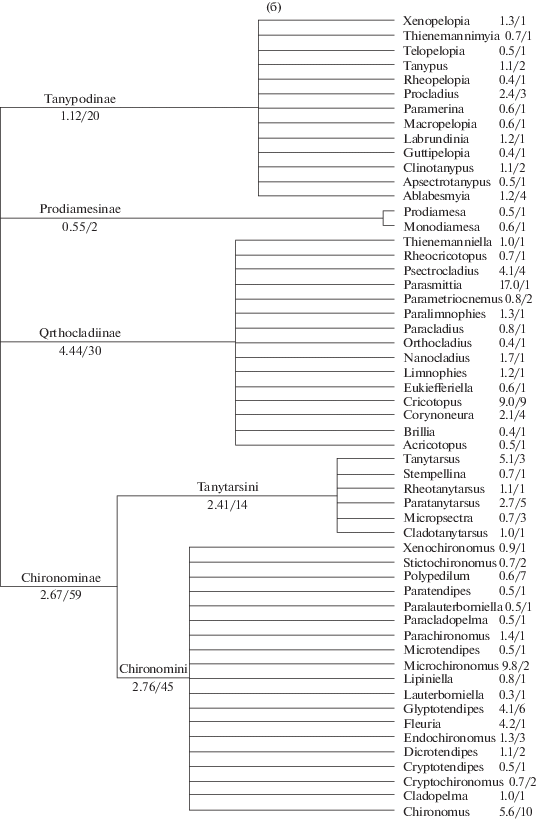
Фрагменты дерева таксономии с указанием групповых величин соленостной толерантности представлены на рис. 3а (полное дерево от Phylum до Order) и 3б (для наиболее представительного семейства Chironomidae – от SubFamily до Genus).
Рис. 3.
Кладограммы таксономического состава макрозообентоса по результатам исследования (средняя соленостная толерантность/число видов в кладе): а – общее дерево от Phylum до Order; б – фрагмент дерева для Diptera, Chironomidae от SubFamily до Genus.
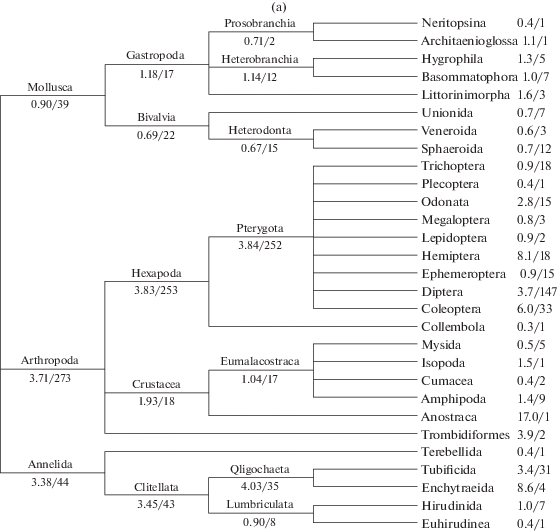
Рис. 3.
Окончание.
Оценка уровня филогенетического сигнала показала высокую статистическую значимость (р ≈ 0) связи таксономической структуры мета-сообщества с минерализацией водной среды: λ Пагеля = 0.789, K Блумберга = 0.318.
ОБСУЖДЕНИЕ
Выполненный нами анализ разнообразия сообществ неизбежно связан с определенными допущениями. Выборки гидробиологических проб, обобщенные в две группы, строго говоря, не являлись независимыми и равновероятными, поскольку притоки волжских водохранилищ занимают гораздо большую территорию, чем бассейн оз. Эльтон, что неизбежно сказывается на величине γ-разнообразия. Однако статистические тесты мы проводили исключительно на основе оценок точечного α-разнообразия (т.е. по отдельным пробам), величина которых уже не зависит от площади исследования.
Формально при анализе мы использовали не филогенетическое, а таксономическое дерево (кладограмму). Хотя биологическое разнообразие и возникло в результате филогенеза, многие задачи экологии опираются не на эволюционный контекст, а на традиционную биологическую систематику [36]. Более того, многие гипотезы, основанные на современных филогенетических моделях, рассматривают закономерности формирования структур из уже существующих видов и непосредственно не связаны с эволюционной историей [37]. Поскольку в классических задачах экологии сообществ необходимость использования эволюционного времени T не всегда очевидна, то допустимо применение деревьев, узлами которых служат конкретные таксоны разного ранга, а длина каждой ветви становится единичной [14]. Показано [18], что процедуры анализа топологии филогенетических деревьев остаются корректными, если время T заменить на число таксономических категорий L.
Большинство видовых и филогенетических метрик синхронно показали более низкий уровень разнообразия донных сообществ в бассейне оз. Эльтон (см. табл. 1, 2) и выявили его обратно пропорциональную зависимость от степени минерализации (см. рис. 2а). Похожие результаты побудили В.C. Микрюкова с соавт. [38] отрицательно ответить на вопрос: является ли информативным дополнительный учет таксономических, генетических и функциональных аспектов при оценке разнообразия? Если речь идет о констатации распространенного факта обеднения структуры сообществ в условиях воздействия экстремальных факторов среды, то с этим мнением нельзя не согласиться. Но когда ставится задача исследования тонких динамических механизмов – какие группы видов исчезают из сообщества в первую очередь или за счет каких функциональных свойств происходит снижение продуктивности, то эти аспекты неизбежно выдвигаются на первый план.
При формировании структуры сообщества определяющую роль играют как биотические, так и абиотические факторы. При отсутствии лимитирующих ограничений среды ключевую роль играют процессы конкурентного исключения (competitive exclusion), ведущие к тому, что степень родства видов в сообществе будет ниже по сравнению со случайным набором видов, поскольку в соответствии с принципом филогенетического консерватизма ниш близкородственные виды будут сильнее конкурировать между собой. Этот эффект определен [5] как филогенетическое рассредоточение (phylogenetic overdispersion), и высокие значения индексов разнообразия при низкой и средней минерализации водотоков на рис. 2а его подтверждают.
Если ограничения среды преобладают над межвидовой конкуренцией, то внешние факторы определяют условия формирования видового состава каждого конкретного сообщества и отфильтровывают те виды, которые не соответствуют требованиям среды (environmental filtering). Тогда филогенетический консерватизм ниш приведет к тому, что степень родства видов в сообществе будет выше по сравнению со случайным набором видов (а разнообразие ниже): этот эффект определен [5] как филогенетическая кластеризация (phylogenetic clustering). На рис. 2б наблюдается весьма умеренный рост кластеризации, уровень которой оценивается индексами MNTD и PSC. Этот эффект на самом деле более выражен, поскольку величина индексов зависит также от числа видов в сообществе.
Оценка стандартизированного размера эффекта SES с использованием индекса MPD показала, что кластеризация сообществ в бассейне оз. Эльтон приводит к существенно более низкому филогенетическому разнообразию по сравнению со случайным набором видов. Отрицательный размер эффекта, полученный и для притоков р. Волги, позволяет считать, что макрозообентос в целом характеризуется относительно слабыми отношениями конкурентного исключения по сравнению с другими систематическими группами.
Все филогенетические индексы в той или иной мере включают в себя два компонента: композиционный (список видов) и собственно филогенетический (выраженность сходства двух деревьев). Сравнение различных матриц β-разнообразия с матрицами расстояний по Брею-Кёртису или Сёренсену (см. табл. 2) позволяет оценить их относительную долю: филогенетическая составляющая MPD/MNTD в большей степени выражена по сравнению с Unifrac/PCD. Выбор конкретной метрики зависит от характера поставленной задачи, например при анализе влияния фактора среды предпочтительнее использовать PCD, позволяющую выполнить декомпозицию на отдельные составляющие PCDc и PCDp.
В реальных условиях каждый вид имеет неопределенное и часто мультимодальное распределение своих экологических свойств по градиенту большинства факторов среды. Отсутствие практической возможности его точного моделирования привело к ситуации, когда виды характеризуются одним значением функционального признака, например средним или медианным [39]. Ранее нами был выполнен многомерный анализ структуры донных сообществ в зависимости от уровня минерализации воды и по результатам ординации сформированы списки видов с различной степенью галотолерантности [40].
При большом числе редких видов такие расчеты становятся неустойчивыми, и поэтому в настоящей работе предложен показатель средней соленостной толерантности ССT, который трактуется как математическое ожидание минерализации, при которой наиболее вероятна встречаемость вида. Анализ филогенетического сигнала по критериям λ Пагеля и К Блумберга показал наличие статистически значимой, хотя и достаточно умеренной связи соленостной чувствительности видов ССТ с таксономической структурой.
Средняя величина ССТ, полученная для отдельных систематических клад (см. рис. 3), позволяет ранжировать группы гидробионтов по преимущественным зонам обитания, связанным с соленостью водотоков, например по подсемействам хирономид: Orthocladiinae, 4.44 г/л > Chironominae, 2.67 > Tanypodinae, 1.12 > Prodiamesinae, 0.55 г/л. Отметим, однако, что из первых двух подсемейств в полной мере галофильными и эвригалинными таксонами являются только отдельные виды родов Cricotopus, Tanytarsus и Chironomus. Статус чувствительных таксонов по отношению к минерализации подтвердили группы Ephemeroptera, Plecoptera и Trichoptera, составляющие индекс качества вод EPT.
Нами установлена закономерность роста внутригрупповой дисперсии ССТ в зависимости от числа видов в кладе, которая, подобно известным моделям SAR, хорошо аппроксимируется степенной функцией. С практической точки зрения это означает, что чем более высокий уровень систематики используется для биотической оценки качества вод, тем больше неопределенность полученного прогноза. Поскольку даже на родовом уровне проявляется значительный разброс реакций таксонов по отношению к условиям среды, то с использованием подсемейств такой прогноз может оказаться ошибочным.
Список литературы
Southwood T.R. The concept and nature of the community // Organisation of Communities: 27th Symp. of the British Ecological Society. Oxford: Blackwell Sci. Publ., 1986. P. 3–27.
Whittaker R.H. Evolution and measurement of species diversity // Taxon. 1972. V. 21. P. 213–251. [Пер. с англ.: Уиттекер Р. Эволюция и измерение видового разнообразия // Антология экологии / Сост. и коммент. Г.С. Розенберга. Тольятти: ИЭВБ РАН, 2004. С. 331–378.]
Якимов В.Н., Гелашвили Д.Б., Розенберг Г.С., Кривоногов Д.М. Современные методы количественного анализа филогенетического разнообразия экологических сообществ // Аспекты биоразнообразия. Сб. трудов Зоологического музея МГУ. 2016. Т. 54. № 1. С. 72–98.
Yakimov V.N., Gerasimova A.S., Zhang S. et al. Phylogenetic α- and β-diversity elevational gradients reveal consistent patterns of temperate forest community structure // Acta Oecologica. 2020. V. 109. P. 103657.
Losos J.B. Phylogenetic niche conservatism, phylogenetic signal and the relationship between phylogenetic relatedness and ecological similarity among species // Ecology Letters. 2008. V. 11. № 10. P. 995–1003.
Wiens J.J., Ackerly D.D., Allen A.P. et al. Niche conservatism as an emerging principle in ecology and conservation biology // Ecology Letters. 2010. V. 13. № 10. P. 1310–1324.
Webb C.O. Exploring the phylogenetic structure of ecological communities: An example for rain forest trees // The American Naturalist. 2000. V. 156. № 2. P. 145–155.
Webb C.O., Ackerly D.D., McPeek M.A., Donoghue M.J. Phylogenies and community ecology // Annual Rev. of Ecology and Systematics. 2002. V. 33. № 1. P. 475–505.
Лукашов В.В. Молекулярная эволюция и филогенетический анализ. М.: БИНОМ. Лаборатория знаний, 2009. 256 с.
Swenson N.G. Functional and phylogenetic ecology in R. N.Y.: Springer, 2014. 212 p.
Pielou E.C. Ecological Diversity. N.Y.: Wiley, 1975. 165 p.
Magurran A.E. Measuring biological diversity. Oxford: Blackwell, 2004. 256 р. [Мэгарран Э. Экологическое разнообразие и его измерение. М.: Мир, 1992. 181 с.]
Faith D.P. Conservation evaluation and phylogenetic diversity // Biological Conservation. 1992. V. 61. № 1. P. 1–10.
Clarke K.R., Warwick R.M. A further biodiversity index applicable to species lists: variation in taxonomic distinctness // Mar. Ecol. Prog. 2001. Ser. 216. P. 265–278.
Ricotta C. Through the jungle of biological diversity // Acta Biotheor. 2005. V. 53. P. 29–38.
Шитиков В.К., Зинченко Т.Д. Изменение таксономического и функционального разнообразия сообществ макрозообентоса по продольному градиенту рек // Успехи современной биологии. 2013. Т. 133. № 6. С. 575–587.
Шитиков В.К., Зинченко Т.Д. Использование чисел Хилла для оценки видового и таксономического разнообразия в группах местообитаний // Принципы экологии. 2013. № 3. С. 23–36.
Chao A., Chiu C.-H., Jost L. Unifying species diversity, phylogenetic diversity, functional diversity, and related similarity and differentiation measures through Hill numbers // Annual Rev. of Ecology, Evolution, and Systematics. 2014. V. 45. № 1. P. 297–324.
Tilman D. Functional diversity / Encyclopedia of Biodiversity Levin S.A. San Diego: Acad. Press, 2001. P. 109–120.
Petchey O.L., Gaston K.J. Functional diversity (FD), species richness and community composition // Ecology Letters. 2002. V. 5. № 3. P. 402–411.
Pagel M. Inferring the historical patterns of biological evolution // Nature. 1999. V. 401. P. 877–884.
Blomberg S.P., Garland T., Ives A.R. Testing for phylogenetic signal in comparative data: behavioral traits are more labile // Evolution. 2003. V. 57. P. 717–745.
Головатюк Л.В., Шитиков В.К., Зинченко Т.Д. Оценка зонального распределения видов донных сообществ равнинных рек бассейна Средней и Нижней Волги // Поволжский экологич. журн. 2017. № 4. С. 335–345. [Golovatyuk L.V., Shitikov V.K., Zinchenko T.D. Estimation of the zonal distribution of species of bottom communities in lowland rivers of the Middle and Lower Volga Basin // Biology Bull. 2018. V. 45. № 10. Р. 1262–1268.]
Головатюк Л.В., Зинченко Т.Д., Шитиков В.К. Географические аспекты пространственного распределения биоразнообразия донных сообществ Среднего и Нижнего Поволжья // Принципы экологии. 2021. № 2. С. 38–53.
Зинченко Т.Д., Шитиков В.К., Головатюк Л.В., Абросимова Э.В. Анализ структуры мета-сообществ планктонных и донных организмов в реках бассейна оз. Эльтон // Аридные экосистемы. 2020. Т. 26. № 4(85). С. 149–155. [Zinchenko T.D., Shitikov V.K., Golovatyuk L.V., Abrosimova E.V. Analysis of the meta-community structure of plankton and bottom organisms in rivers of the Lake Elton basin // Arid. Ecosystems. 2020. V. 10. № 4. 390–395.]
Шитиков В.К., Зинченко Т.Д., Головатюк Л.В. Модели совместного распределения видов на примере донных сообществ малых рек Волжского бассейна // Журнал общ. биол. 2021. Т. 82. № 2. С. 143–154.
Зинченко Т.Д. Эколого-фаунистическая характеристика хирономид (Diptera, Chhironomidae) малых рек бассейна Cредней и Нижней Волги (Атлас). Тольятти: Кассандра, 2011. 258 с.
Guisande C., Heine J., García-Roselló E. et al. DER: An algorithm for comparing species diversity between assemblages // Ecological Indicators. 2017. V. 81. P. 41–46.
Rao C.R. Diversity and dissimilarity coeffcients: a unifed approach // Theor. Popul. Biol. 1982. V. 21. P. 24–43.
Helmus M.R., Bland T.J., Williams C.K., Ives A.R. Phylogenetic measures of biodiversity // Amer. Naturalist. 2007. V. 169. № 3. E68–E83.
Ives A.R., Helmus M.R. Phylogenetic metrics of community similarity // The American Naturalist. 2010. V. 176. № 5. E128–E142.
Lozupone C., Knight R. UniFrac: A new phylogenetic method for comparing microbial communities // Applied Environmental Microbiology. 2005. V. 71. № 12. P. 8228–8235.
Kembel S.W., Cowan P.D., Helmus M.R. et al. Picante: R tools for integrating phylogenies and ecology // Bioinformatics. 2010. V. 26. № 11. P. 1463–1464.
Mantel N. The detection of disease clustering and a generalized regression approach // Cancer Res. 1967. V. 27. P. 209–220.
Anderson M.J. A new method for non-parametric multivariate analysis of variance // Austral Ecology. 2001. V. 26. P. 32–46.
Емельянов А.Ф., Расницын А.П. Систематика, филогения, кладистика // Природа. 1991. № 7. С. 26–37.
Ives A.R. Mixed and Phylogenetic Models: A Conceptual Introduction to Correlated Data. Leanpub book. 2018. URL: https://leanpub.com/correlateddata. (дата обращения 16.05.2021).
Микрюков В.C., Воробейчик Е.Л., Михайлова И.Н. Изменение разнообразия эпифитных лишайников в градиенте атмосферного загрязнения: что добавляет учет таксономических, генетических и функциональных дистанций между видами? // Докл. РАН. 2014. Т. 454. № 1. С. 115–118 .
Mason N.W.H., Mouillot D., Lee W.G., Wilson J.B. Functional richness, functional evenness and functional divergence: the primary components of functional diversity // Oikos. 2005. V. 111. P. 112–118.
Зинченко Т.Д., Головатюк Л.В., Шитиков В.К. Соленостная толерантность сообществ макрозообентоса малых рек бассейна Средней и Нижней Волги // Изв. Самарского НЦ РАН. 2016. Т. 18. № 5. С. 60–66.
Дополнительные материалы отсутствуют.


