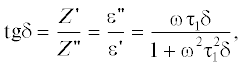Электрохимия, 2021, T. 57, № 11, стр. 679-688
Электрофизические свойства системы ПЭГ 1500–LiTFSI
М. М. Гафуров a, *, М. А. Ахмедов a, **, С. И. Сулейманов a, ***, А. М. Амиров a, К. Ш. Рабаданов a, М. Б. Атаев a, З. Ю. Кубатаев a
a Аналитический центр коллективного пользования ДФИЦ РАН
Махачкала, Россия
* E-mail: malik52@mail.ru
** E-mail: muhamadahmedov@mail.ru
*** E-mail: s.sagim.i@yandex.ru
Поступила в редакцию 07.03.2021
После доработки 26.05.2021
Принята к публикации 04.06.2021
Аннотация
В настоящей работе методами спектроскопии электрохимического импеданса и дифференциально-термического анализа изучены тепловые эффекты, диэлектрические свойства литий-ионного полимерного электролита – полиэтиленгликоль (ПЭГ 1500)–бис(трифторметансульфонил)имид лития (LiTFSI) при различных мольных соотношениях соли в полимере. Показано, что сложная форма “конечного” диффузионного импеданса электролитной системы ПЭГ 1500–LiTFSI при 293 и 343 K может быть обусловлена наложением двух процессов, протекающих одновременно в приэлектродном слое (SEI) и на границе двойного электрического слоя (ДЭС). Обнаружено, что полученные значения коэффициентов диффузии не вписываются в существующую модель Аррениуса для описания механизма переноса ионов лития в полимерной матрице ПЭГ. Установлено, что с увеличением концентрации LiTFSI в ПЭГ 1500 происходит уменьшение времени диэлектрической релаксации. Предположено, что в системе ПЭГ 1500–LiTFSI увеличение ионной проводимости с увеличением температуры до 343 K происходит за счет волновых флуктуаций иона лития и движения полимерной матрицы ПЭГ 1500.
ВВЕДЕНИЕ
На сегодняшний день весьма актуальны исследования свойств полимерных электролитов, обладающих хорошей проводимостью, электрохимической стабильностью, низкой воспламеняемостью и позволяющих создавать безопасные твердотельные устройства с любой удобной формой, геометрией, размерами и др. [1–4]. Данные исследования необходимы как для установления фундаментальных закономерностей формирования транспортных свойств полимерных систем, так и для их практического использования в различных электрохимических устройствах [5–10].
Исследуемый объект данной работы относится к классу литий-ионпроводящих полимерных электролитов (ПЭ) на основе полимерной матрицы – полиэтиленгликоля (ПЭГ) или полиэтиленоксида (ПЭО) и литиевой соли – бис(трифторметансульфонил)имида лития (LiTFSI). Преимуществом использования литиевой соли LiTFSI является сочетание таких свойств, как хорошая растворимость (без растворителя) в полимерной матрице, высокая ионная проводимость, термическая и электрохимическая стабильность [11‒15]. Использование в качестве полимерной матрицы ПЭГ или ПЭО обусловлено способностью кислородных групп (O) полимерной матрицы образовывать с ионом лития (Li+) комплексы типа электрон-дырочных пар, характеризующиеся низкой температурой стеклования, аморфностью и гибкостью полимерной цепи [16]; в то же время известными недостатками данной системы является ее хрупкость и невысокая термическая стабильность [6, 17].
Однако, несмотря на приведенные выше недостатки, во многих странах продолжаются научные исследования Li+ полимерных электролитов [18–28] и катодных материалов [29–32], в которых в качестве полимерной матрицы используется ПЭГ/ПЭО.
Авторами [33] при сравнении свойств низкомолекулярного ПЭГ (M ≈ 550), полиэтиленгликоля монометилового эфира (ПЭГМЭ) и полиэтиленгликоля диметилового эфира (ПЭГДМЭ) было обнаружено, что в присутствии LiTFSI увеличиваются коэффициенты самодиффузии как для катионов Li+, так и для имид-анионов TFSI–. При исследовании реологических и ионно-транспортных свойств в фторсульфонимид-ионных полиэфирных расплавленных электролитах [34] было установлено, что сегментальные движения концевых групп в ПЭО в случае прыжкового механизма для иона Li+ менее выражены, чем в низкомолекулярном ПЭГ. По мнению авторов [34], это может быть связано с малыми размерами доступного свободного объема при сегментальном движении концевых групп ПЭО. В работе [35] на основании данных электрометрии и термического анализа было выявлено, что механизм переноса ионов Li+ с увеличением концентрации соли в электролитной системе ПЭГ 1500–LiTFSI имеет сложный характер. Одновременно исследования методами спектроскопии комбинационного рассеяния света и квантово-химического моделирования показали, что в системе ПЭГ 1500–LiTFSI с увеличением концентрации соли в полимере сольватация анионов TFSI– ионами Li+ в LiTFSILi+ является энергетически менее выгодной и маловероятной. Важно отметить, что перенос ионов в Li+-полимерных электролитах изучается около полувека, однако особенности миграции ионов лития в полимерной матрице ПЭГ/ПЭО и сам механизм ионной проводимости в ней до сих пор не нашли однозначного описания [36].
Из вышеизложенного следует, что для оценки более точного механизма ионного переноса в полимерной матрице ПЭГ/ПЭО необходимо проведение дополнительных экспериментальных исследований по изучению электрофизических свойств электролитной системы ПЭГ/ПЭО-литиевая соль. В данной работе методами дифференциально-термического анализа и спектроскопии электрохимического импеданса были исследованы некоторые электро-теплофизические свойства системы полиэтиленгликоль (ПЭГ 1500)–бис(трифторметансульфонил)имид лития (LiTFSI) при температурах 293 и 343 K и концентрациях соли 0.005–1.0 М.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления полимерных электролитов был использован полиэтиленгликоль с молекулярной массой 1500 (Acros Organic) и бис-(трифторметансульфонил)имид лития (LiTFSI) (Sigma Aldriсh).
Методика приготовления образцов. Все работы при подготовке исследуемых систем проводились в сухом перчаточном боксе, в инертной атмосфере аргона особой чистоты (99.9999 мас. %). Исходная полимерная матрица ПЭГ 1500 содержала в своем составе 1 мас. % примесь воды. Поэтому полимер предварительно в течение суток высушивали в вакууме при температуре 353 K и остаточном давлении 10–3 Па. Соль LiTFSI обезвоживали в течение суток путем нагрева и откачки в вакууме при температуре 423 K. Далее высушенные вещества переносили в перчаточный вакуумный бокс (Plas-Labs, США), где на аналитических весах (Ohaus, Швейцария) взвешивали точную навеску соли LiTFSI и смешивали с точно отмеренным объемом расплавленного полимера ПЭГ 1500 (при Т = 343–348 K) до образования гомогенного раствора. Полученный раствор вновь помещался в вакуумный сушильный шкаф при температуре 353 K и остаточном давлении 10–3 Па на не менее 6 ч. Полноту удаления воды из исследуемых образцов контролировали методом термогравиметрии. Далее были приготовлены 7 образцов, соответствующие мольному соотношению [EO] и [Li]: 200 : 1 (1); 100 : 1 (2); 40 : 1 (3); 20 : 1 (4); 10 : 1 (5); 4 : 1 (6); 2 : 1 (7).
Методы исследования. Термогравиметрический анализ (ТГА) и дифференциально-термический анализ (ДТА) проводился на приборе STA 449 F3 Jupiter (“NETZSCH”, Германия) от комнатной температуры (293 К) при скорости нагрева 10 K/мин в атмосфере аргона в алундовых тиглях. Обработка данных и интегрирование пиков проводились с помощью встроенных прикладных программ фирмы “NETZSCH”. Температура плавления исследуемой системы определялась по точкам минимума на кривых ДТА (по температуре пика фазового перехода).
Исследование электрохимического импеданса проводили с помощью RLC-измерителя Е7-20 (“МНИПИ”, Беларусь) в интервале температур 298–373 K с использованием двухзондовой ячейки с обратимыми литиевыми электродами, площадью 0.25 см2, расположенными на расстоянии 0.4 см друг от друга. Значения сопротивления были получены в частотном диапазоне от 25 Гц до 1 МГц с амплитудой прикладываемого сигнала от 0.04 до 1 В. Расчет полученных годографов проводили графоаналитическим методом, подбирая соответствующую эквивалентную схему при помощи программы ZSim 3.20 (Echem Software, США).
Расчетные формулы. Значения активного Z ' и мнимой части Z '' импеданса как по сопротивлению (R), так и по диэлектрической проницаемости (ε) связаны между собой через тангенс угла наклона tg δ соотношением:
где δ – угол потерь, определяется как отношение квадратов круговых частот ${{\omega _{1}^{2}} \mathord{\left/ {\vphantom {{\omega _{1}^{2}} {\omega _{2}^{2}}}} \right. \kern-0em} {\omega _{2}^{2}}};$ ω1 – частота при Z ''(макс), ω2 – частота при Z ''(мин). Значения времен релаксации, соответствующие максимуму по Z '' (τ1, с) и минимуму по Z '' (τ2, с) оценивали графическим способом [37]. Длину волны Дебая (λD) и величину коэффициента диффузии (D, cм2/с) определяли, используя соотношения (2)–(4) где d – половина толщины слоя электролита, см; lD – протяженность длины диффузии, см [37, 38]. Далее из значения D по уравнениям (5)–(8) были определены время релаксации диффузии (τD, с), время жизни исследуемой системы (τs, с), коэффициенты подвижности (μ, м2/(В с)) и концентрации подвижных носителей заряда (n, м–3).(8)
$n = \frac{{2d}}{{S{{R}_{{\text{e}}}}\mu e}} = \frac{{{{\sigma }_{{\text{e}}}}kT}}{{D{{e}^{2}}}},$Значения длины волны де Бройля для иона лития (${{\lambda }_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}},$ м) и энергия активации (${{E}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}},$ эВ) оценивались, используя уравнения (9) и (10):
(9)
${{\lambda }_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}} = \frac{h}{{{{m}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}{{\mu }_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}}}\sqrt {1 - \frac{{{{\mu }_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}}}{{{{c}^{2}}}}} ;$(10)
${{E}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}} = \frac{{{{h}^{2}}}}{{{{m}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}\lambda _{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}^{2}}} = \frac{{0.153}}{{\lambda _{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}^{2} \times {{{10}}^{{ - 10}}}}};$РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
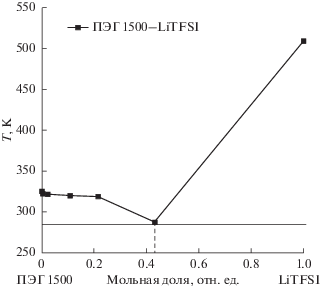
Из данных рис. 1 видно, что в системе ПЭГ 1500–LiTFSI температура фазового перехода (плавления) и энтальпия плавления (площадь под пиком фазового перехода на кривой ДТА) уменьшаются по сравнению с чистым полимером. С ростом концентрации соли до величин мольных соотношений [EO] : [Li] = 40 : 1 и более проявление плавления системы ПЭГ 1500–LiTFSI на кривых ДТА носит сильно “размытый” характер и при достижении максимальных значений концентрации соли в полимере (рис. 1, кривая 8) определить температуру плавления системы из результатов термического анализа не представляется возможным. Поэтому точка минимума плавления системы ПЭГ 1500–LiTFSI, представленная на фазовой диаграмме (рис. 2), была установлена визуальным методом в соответствии с ГОСТ 21553–76.
Рис. 1.
ДТА-кривые ПЭГ 1500 (1) и ПЭГ 1500–LiTFSI (2–8) при мольном соотношении [EO] :[Li]: 200 : 1 (2); 100 : 1 (3); 40 : 1 (4); 20 : 1 (5); 10 : 1 (6); 4 : 1 (7); 2 : 1 (8).
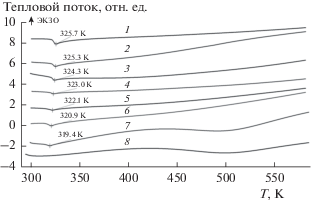
В ходе проведения ДТА-измерений было также обнаружено, что время восстановления исходного твердофазного состояния системы ПЭГ 1500–LiTFSI при ее охлаждении из расплавленного состояния имеет тенденцию к уменьшению с ростом концентрации соли в полимерной матрице в диапазоне от 80 до 15 мин.
Представленная на рис. 2 фазовая диаграмма плавкости указывает на то, что минимальные значения температуры плавления системы ПЭГ 1500–LiTFSI наблюдаются при содержании 0.43 мол. доли соли в полимере.
Параметры зависимости удельной ионной проводимости (σ, См/см) от температуры (1000/T, K–1) для системы ПЭГ 1500–LiTFSI (рис. 3) были построены при частоте 0.5 МГц. Наличие твердой и жидкой фазы в диапазоне температур (293–323 и 343–373 K) на рис. 3 отражается в виде двух температурных соответствующих участков. Важно отметить, что область излома кривых на рис. 3 совпадает с температурой плавления по данным термического анализа (рис. 1). На основе данных прямолинейных участков (рис. 3), подчиняющихся уравнению Аррениуса, было предположено, что перенос ионов Li+ в твердой кристаллической матрице ПЭГ 1500 в диапазоне температур (293–323 K) может протекать через простой прыжковый механизм, тогда как при переходе системы ПЭГ 1500–LiTFSI в жидкое (аморфное) состояние (333–373 K) необходимо учитывать движение полимерной цепи. Следует отметить, что угол наклона кривых зависимости lg(σ)–1000/T в зависимости от концентрации соли в ПЭГ 1500 имеет разный характер, что может указывать на различие в подвижностях ионов в исследуемой системе.
Рис. 3.
Зависимость удельной ионной проводимости от температуры в системах ПЭГ 1500–LiTFSI при мольном соотношении [EO] : [Li]: 200 : 1 (1); 100 : 1 (2); 40 : 1 (3); 20 : 1 (4); 10 : 1 (5); 4 : 1 (6); 2 : 1 (7).
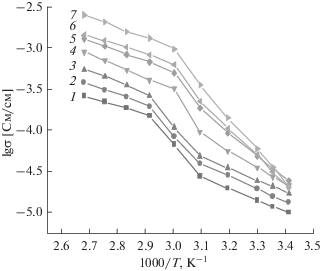
Полученные экспериментальные значения энергий активации (табл. 1) демонстрируют нелинейный характер, что также указывает на различие механизмов переноса ионов Li+ в двух температурных участках (293–323 и 343–373 K). С ростом концентрации соли LiTFSI в полимере в интервале температур 293–323 K происходит увеличение энергии активации. Это, возможно, связано с тем, что усиливается межионное взаимодействие.
Таблица 1.
Параметры энергии активации и удельной ионной проводимости, определенные в электролитной системе ПЭГ 1500–LiTFSI
| Мольное отношение [EO] : [Li] | ΔT, K | Ea, эВ | σac, 10–5 См/см | ΔT, K | Ea, эВ | σac, 10–4 См/см |
|---|---|---|---|---|---|---|
| 200 : 1 | 293–323 | 0.27 ± 0.01 | 1.85 | 343–373 | 0.20 ± 0.04 | 2.13 |
| 100 : 1 | 0.28 ± 0.02 | 2.01 | 0.24 ± 0.05 | 3.79 | ||
| 40 : 1 | 0.30 ± 0.03 | 2.53 | 0.27 ± 0.06 | 4.13 | ||
| 20 : 1 | 0.40 ± 0.06 | 4.27 | 333–373 | 0.28 ± 0.04 | 6.16 | |
| 10 : 1 | 0.55 ± 0.05 | 5.21 | 0.24 ± 0.03 | 8.89 | ||
| 4 : 1 | 293–333 | 0.65 ± 0.07 | 13.70 | 343–373 | 0.22 ± 0.04 | 12.39 |
| 2 : 1 | 0.77 ± 0.08 | 23.72 | 0.25 ± 0.04 | 18.91 |
Следует отметить, что полученные невысокие значения энергии активации и высокие значения удельной ионной проводимости хорошо согласуются с приведенными ранее в литературе данными [33, 34, 40].
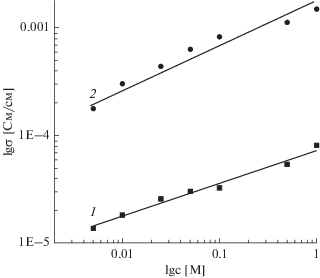
Зависимость удельной ионной проводимости от молярной концентрации LiTFSI (рис. 4) в полимерной матрице ПЭГ 1500 при двух значениях температуры (303 и 343 K) имеет линейный характер, а по абсолютным величинам различаются примерно на порядок.
Рис. 4.
Зависимость удельной ионной проводимости от молярной концентрации в электролитной системе ПЭГ 1500–LiTFSI при 303 (1) и 343 K (2).
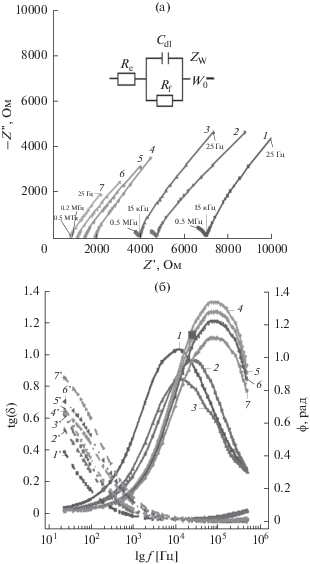
Представленные спектры (годографы) электрохимического импеданса системы ПЭГ 1500–LiTFSI для двух температурных участков – 303 K (рис. 5) и 343 K (рис. 6) имеют сложную форму. Предположено, что сложная форма годографа “конечного” диффузионного импеданса (рис. 5a) может быть обусловлена определенными диффузионными ограничениями миграции ионов лития в твердой кристаллической матрице ПЭГ 1500 на границе двойного электрического слоя (ДЭС) и приэлектродном слое (SEI). Важно отметить, что наличие приэлектродного слоя (SEI) обнаруживается также и в случае плавления системы ПЭГ 1500–LiTFSI (рис. 6а). Из данных рис. 5а видно, что наблюдаемый рост ионной проводимости на спектрах импеданса с увеличением концентрации соли в полимерной матрице ПЭГ 1500 выражается в виде уменьшения форм полуокружностей “конечного” диффузионного импеданса. После достижении температуры плавления при 343 K годографы электрохимического импеданса (рис. 6а) существенно изменяются, приобретая вид годографов полубесконечной диффузии с элементом Варбурга. Значительные изменения спектров импеданса и увеличение ионной проводимости обусловлены фазовым переходом системы ПЭГ 1500–LiTFSI из кристаллического (твердого) в аморфное (жидкое) состояние. Заметные структурные преобразования в виде увеличения угла потерь и значительного смещения сдвига фаз в диапазоне 25 Гц до 500 кГц также отражаются при сравнении рис. 5б и 6б, что может говорить о более высоких значениях времен релаксаций системы.
Рис. 5.
Годографы электролитной системы ПЭГ 1500–LiTFSI: (а) в координатах Найквиста, (б) зависимость тангенса угла потерь от частоты (1–7) и сдвига фаз от частоты (1 '–7 ') в координатах Боде при мольном соотношении [EO] : [Li]: 200 : 1 (1); 100 : 1 (2); 40 : 1 (3); 20 : 1 (4); 10 : 1 (5); 4 : 1 (6); 2 : 1 (7) при температуре 303 K.
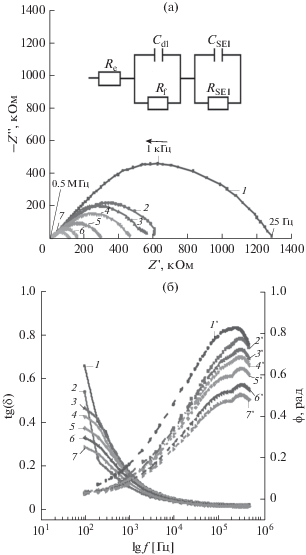
Рис. 6.
Годографы электролитной системы ПЭГ 1500–LiTFSI: (а) в координатах Найквиста, (б) зависимость тангенса угла потерь от частоты (1–7) и сдвига фаз от частоты (1 '–7 ') в координатах Боде при мольном соотношении [EO] : [Li]: 200 : 1 (1); 100 : 1 (2); 40 : 1 (3); 20 : 1 (4); 10 : 1 (5); 4 : 1 (6); 2 : 1 (7) при температуре 343 K.
В табл. 2 и 4 приведены удельные значения Re, RSEI, Roб, Rf, Cdl, CSEI, εSEI, ε, полученные в результате анализа эквивалентных спектров импеданса для системы ПЭГ 1500–LiTFSI при 293 и 343 K с использованием программы ZSim 3.20.
Таблица 2.
Данные анализа эквивалентных спектров импеданса для системы ПЭГ 1500–LiTFSI при 293 K
| Мольное отношение [EO] : [Li] | f при Z '' мин, кГц |
Re × 103, Ом | RSEI × 103, Ом | Roб × 103, Ом | Rf × 103, Ом | Ce × 10–11, Ф | ε, Ф/м | CSEI × 10–11, Ф | εSEI, Ф/м | Cdl, 10–9, Ф |
|---|---|---|---|---|---|---|---|---|---|---|
| 200 : 1 | 490 | 73.2 | 305.36 | 1287.01 | 1213.8 | 1.08 | 1.22 | 2.04 | 2.31 | 0.54 |
| 100 : 1 | 490 | 68.58 | 140.21 | 611.03 | 542.42 | 1.13 | 1.27 | 2.13 | 2.41 | 1.19 |
| 40 : 1 | 490 | 39.01 | 103.56 | 564.14 | 525.14 | 0.94 | 1.06 | 2.44 | 2.75 | 1.24 |
| 20 : 1 | 490 | 47.61 | 68.95 | 467.05 | 419.44 | 2.23 | 2.52 | 3.61 | 4.08 | 4.86 |
| 10 : 1 | 490 | 30.85 | 59.09 | 295.78 | 264.93 | 2.07 | 2.34 | 3.42 | 3.87 | 3.49 |
| 4 : 1 | 490 | 18.61 | 38.06 | 205.02 | 186.41 | 1.52 | 1.72 | 2.67 | 3.01 | 2.45 |
| 2 : 1 | 490 | 12.34 | 16.79 | 145.34 | 133.01 | 1.23 | 1.39 | 2.49 | 2.82 | 1.55 |
Таблица 3.
Электрофизические свойства системы ПЭГ 1500–LiTFSI при 293 K
| Мольное отношение [EO] : [Li] |
τ1 × 10–4, с | τ2 × 10–5, с | τD × 10–3, с | τs, с | λD × 10–5, см |
DSEI × 10–5, cм2/с |
D × 10–6, cм2/с |
i0 × 10–6, А/см2 | μ × 10–6, м2/(В с) |
n × 1014, м–3 |
|---|---|---|---|---|---|---|---|---|---|---|
| 200 : 1 | 6.55 | 8.99 | 6.27 | 0.14 | 1.31 | 0.79 | 32.55 | 3.81 | 11.41 | 0.75 |
| 100 : 1 | 6.45 | 9.30 | 8.07 | 0.29 | 4.05 | 1.17 | 24.48 | 8.52 | 8.58 | 1.87 |
| 40 : 1 | 6.51 | 9.55 | 7.41 | 0.21 | 4.65 | 1.78 | 13.47 | 8.80 | 3.80 | 3.18 |
| 20 : 1 | 20.38 | 30.40 | 4.87 | 0.68 | 10.57 | 2.40 | 8.16 | 34.75 | 2.86 | 3.45 |
| 10 : 1 | 9.25 | 15.77 | 6.25 | 0.38 | 8.04 | 2.13 | 10.84 | 24.8 | 4.72 | 4.29 |
| 4 : 1 | 4.57 | 7.71 | 5.65 | 0.16 | 1.94 | 0.49 | 17.95 | 17.45 | 6.29 | 5.33 |
| 2 : 1 | 2.06 | 3.35 | 5.08 | 0.07 | 1.63 | 0.11 | 19.33 | 11.02 | 6.78 | 7.47 |
Таблица 4.
Данные анализа эквивалентных спектров импеданса для системы ПЭГ 1500–LiTFSI при 343 K
| Мольное отношение [EO] : [Li] | ω при Z '' мин, кГц | Re × 103, Ом | RSEI × 103, Ом | Roб × 103, Ом | Rf × 103, Ом | Ce × 10–11, Ф | ε, Ф/м | CSEI × 10–11, Ф | εSEI, Ф/м | Cdl × 10–6, Ф |
|---|---|---|---|---|---|---|---|---|---|---|
| 200 : 1 | 15 | 5.24 | 5.65 | 7.45 | 1.80 | 1.12 | 1.26 | 4.25 | 4.80 | 6.20 |
| 100 : 1 | 15 | 3.15 | 3.29 | 5.59 | 2.30 | 1.06 | 1.20 | 9.03 | 1.02 | 9.23 |
| 40 : 1 | 15 | 2.87 | 3.19 | 5.01 | 1.82 | 0.56 | 6.31 | 10.70 | 1.21 | 11.67 |
| 20 : 1 | 40 | 1.15 | 1.58 | 2.86 | 1.28 | 0.76 | 8.67 | 12.60 | 1.41 | 11.79 |
| 10 : 1 | 90 | 1.04 | 1.19 | 2.57 | 1.38 | 0.71 | 8.03 | 2.57 | 2.90 | 2.56 |
| 4 : 1 | 130 | 0.76 | 0.89 | 2.22 | 1.33 | 0.69 | 7.86 | 1.39 | 1.59 | 1.84 |
| 2 : 1 | 130 | 0.54 | 0.665 | 1.87 | 1.21 | 0.61 | 6.88 | 1.23 | 1.39 | 1.06 |
Как видно из данных электрофизических свойств при 343 K (табл. 4 и 5) в сравнении с данными, полученными при 293 K (табл. 2 и 3), в зависимости от концентрации соли в полимере наблюдаются значительные изменения: происходит увеличение ионной проводимости, времени релаксации, константы скорости (тока обмена) и концентрации подвижных носителей заряда, что можно объяснить плавлением матрицы ПЭГ 1500 и переходом от твердого к жидкому агрегатному состоянию. Необходимо также отметить, что уменьшение времени релаксации полимерной матрицы существенно влияет на уменьшение сопротивления электролитной системы ПЭГ 1500–LiTFSI при различных температурах (293 и 343 K). При этом следует иметь в виду, что и значения подвижности и скорости диффузии ионов Li+ и TFSI– в системе ПЭГ 1500–LiTFSI уменьшаются.
Таблица 5.
Электрофизические свойства системы ПЭГ 1500–LiTFSI при 343 K
| Мольное отношение [EO] : [Li] | τ1, с | τ2, с | τD, с | τs, с | λD × 10–4, см | DSEI × 10–8, cм2/с |
D × 10–9, cм2/с |
i0 × 10–4, А/см2 | μ × 10–7, см2/(В с) | n × 1021, см–3 |
|---|---|---|---|---|---|---|---|---|---|---|
| 200 : 1 | 40.18 | 4.14 | 29.04 | 126.11 | 3.34 | 2.69 | 8.96 | 2.59 | 3.49 | 3.17 |
| 100 : 1 | 76.42 | 8.86 | 26.68 | 134.02 | 4.26 | 2.05 | 6.84 | 2.01 | 2.67 | 7.13 |
| 40 : 1 | 76.46 | 9.53 | 22.59 | 109.32 | 4.84 | 2.45 | 8.17 | 2.54 | 3.18 | 6.14 |
| 20 : 1 | 54.33 | 3.93 | 22.51 | 67.06 | 1.49 | 0.57 | 1.90 | 3.61 | 10.46 | 11.47 |
| 10 : 1 | 12.72 | 0.92 | 20.36 | 10.97 | 1.79 | 3.50 | 18.38 | 3.35 | 7.15 | 9.80 |
| 4 : 1 | 8.81 | 0.66 | 18.31 | 5.89 | 1.91 | 5.51 | 11.68 | 3.48 | 4.55 | 8.98 |
| 2 : 1 | 4.60 | 0.37 | 17.52 | 2.54 | 1.74 | 8.06 | 2.68 | 3.84 | 0.74 | 5.34 |
Таким образом, невысокие значения коэффициента диффузии (табл. 3 и 5) не совсем вписываются в существующую модель уравнения Аррениуса для объяснения причин механизма переноса ионов лития и роста ионной проводимости при плавлении полимерной матрицы ПЭГ 1500.
В работах [41, 42] было предположено, что основными контролирующими параметрами скорости диффузии могут служить коэффициент трения мономера в расплаве, время релаксации полимера и длина волны де Бройля для иона лития $\left( {{{\lambda }_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}} \right).$
В табл. 6 представлены расчетные данные ${{\lambda }_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ и ${{E}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}},$ полученные при двух температурных участках 293–323 и 343–373 K для различных концентраций соли LiTFSI в ПЭГ 1500.
Таблица 6.
Параметры энергии активации и длины волны де Бройля электролитной системы ПЭГ 1500–LiTFSI
| Мольное отношение [EO] : [Li] | ΔT, K | Ea, эВ | λLi, 10–11 м | ΔT, K | Ea, эВ | λLi, 10–11 м |
|---|---|---|---|---|---|---|
| 200 : 1 | 293–323 | 0.27 | 2.89 | 343–373 | 0.20 | 3.41 |
| 100 : 1 | 0.30 | 2.79 | 0.24 | 3.09 | ||
| 40 : 1 | 0.28 | 2.89 | 0.27 | 2.94 | ||
| 20 : 1 | 0.40 | 2.41 | 333–373 | 0.28 | 2.92 | |
| 10 : 1 | 0.55 | 2.06 | 0.24 | 3.14 | ||
| 4 : 1 | 293–333 | 0.65 | 1.89 | 343–373 | 0.22 | 3.26 |
| 2 : 1 | 0.76 | 1.75 | 0.25 | 3.06 |
Как видно из табл. 6, значение ${{\lambda }_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ почти на порядок ниже теоретической суммы ван-дер-ваальсовых радиусов атомов O и Li (1.9 Å) и намного меньше среднего расстояния между занятым узлом иона Li+.
Таким образом, полученные результаты вновь демонстрируют, что перенос иона Li+ в полиэтиленгликоле является сложным процессом, который можно условно разделить на несколько механизмов: а) подчиняющийся уравнению Аррениуса и связанный с прыжковым переносом иона Li+ в твердой (кристаллической) матрице ПЭГ 1500; б) в виде квазимасштабных волновых флуктуаций иона Li+ между соседними участками функциональных групп ПЭГ 1500 [40], сопровождающихся нарушением динамических взаимодействий между кислородными лигандами и катионами лития в процессе увеличения амплитуд колебаний полимерной матрицы ПЭГ 1500.
ЗАКЛЮЧЕНИЕ
Установлено, что минимальные значения температуры плавления системы ПЭГ 1500–LiTFSI наблюдаются при содержании 0.43 мол. доли соли в полимере. Полученные результаты ДТА-анализа хорошо согласуются с данными по электропроводности и спектрами электрохимического импеданса, где для системы ПЭГ 1500–LiTFSI с увеличением температуры наблюдается фазовый переход I рода и уменьшение времени релаксации.
Показано, что сложная форма “конечного” диффузионного импеданса в электролитной системе ПЭГ 1500–LiTFSI при 293 и 343 K может быть обусловлена наложением одновременно двух процессов, протекающих в приэлектродном слое и на границе двойного электрического слоя. Обнаружено, что значения коэффициентов диффузии в приэлектродном слое и на границе ДЭС с увеличением температуры уменьшаются. Обнаружено, что уменьшение значений коэффициентов диффузии и времени релаксации в системе ПЭГ 1500–LiTFSI не вписывается в существующую модель уравнения Аррениуса для объяснения причин механизма переноса ионов лития и роста ионной проводимости при плавлении полимерной матрицы ПЭГ 1500. Предположено, что в системе ПЭГ 1500–LiTFSI увеличение ионной проводимости с ростом температуры 343–373 K может происходить за счет волновых флуктуаций иона Li+ и колебаний полимерной матрицы ПЭГ 1500, сопровождающихся нарушением динамических взаимодействий между кислородными лигандами и катионами лития в процессе увеличения амплитуд колебаний полимерной матрицы ПЭГ 1500.
Полученные новые данные дополняют современные представления о механизме ионного транспорта и реологических свойствах полимерных электролитов на основе полиэтиленгликоля.
Список литературы
Wu, F., Maier, J., and Yu, Y., Guidelines and trends for next-generation rechargeable lithium and lithium-ion batteries, Chem. Soc. Rev., 2020, vol. 49, p. 1569. https://doi.org/10.1039/C7CS00863E
Zhou, D., Shanmukaraj, D., Tkacheva, A., Armand, M., and Wang, G., Polymer Electrolytes for Lithium-Based Batteries: Advances and Prospects, Chem. 2019, vol. 5, p. 2326. https://doi.org/10.1016/j.chempr.2019.05.009
Гафуров, М.М. Рабаданов, К.Ш., Шабанов, Н.С., Ахмедов, М.А., Амиров, А.М., Кубатаев, З.Ю. Колебательные спектры и ион-молекулярные взаимодействия в системе поливиниловый спирт + соль лития (LiNO3, LiClO4, LiBF4). ЖПС. 2019. № 5(86). С. 691. [Gafurov, M.M., Rabadanov, K.S., Shabanov, N.S., Akhmedov, M.A., Amirov, A.M., and Kubataev, Z.Yu., Vibrational Spectra and Ion–Molecule Interactions in Poly(Vinyl Alcohol) + Lithium Salt (LiNO3, LiClO4, LiBF4), J. Appl. Spectrosc., 2019, vol. 86, no. 5, p. 782.] https://doi.org/10.1007/s10812-019-00893-3
Рабаданов, К.Ш., Гафуров, М.М., Ахмедов, М.А., Шабанов, Н.С., Сулейманов, С.И., Исаев, А.Б. Электропроводность полимерного электролита ПВС–ПТК–LiClO4. Вестник ДГУ. 2019. 3 (34). С. 242. [Rabadanov, K.Sh., Gafurov, M.M., Akhmedov, M.A., Shabanov, N.S., Suleimanov, S.I., and Isaev, A.B., Electrical conductivity of PVA-PTK-LiClO4 polymer electrolyte, Herald of DSU (in Russian), 2019, no. 3(34), p. 242.] https://doi.org/10.21779/2542-0321-2019-34-2-98-104
Arya, A. and Lal Sharma, A., Polymer electrolytes for lithium ion batteries: a critical study, Ionics, 2017, vol. 23, p. 497. https://doi.org/10.1007/s11581-016-1908-6
Long, L., Wang, S., Xiao, M., and Meng, Y., Polymer electrolytes for lithium polymer batteries, J. Mater. Chem. A, 2016, vol. 4, p. 10038. https://doi.org/10.1039/C6TA02621D
Ярмоленко, О.В., Юдина, А.В., Хатмуллина, К.Г. Нанокомпозитные полимерные электролиты для литиевых источников тока (обзор). Электрохимия. 2018. Т. 54. С.377. [Yarmolenko, O.V., Yudina, A.V., and Khatmullina, K.G., Nanocomposite Polymer Electrolytes for the Lithium Power Sources (a Review), Russ. J. Electrochem., 2018, vol. 54, p. 325.] https://doi.org/10.7868/S0424857018040011
Баймуратова, Г.Р., Слесаренко, А.А., Юдина, А.В., Ярмоленко, О.В. Проводящие свойства нанокомпозитных полимерных электролитов на основе диакрилата полиэтиленгликоля и наночастиц диоксида кремния на границе с литиевым электродом. Изв. АН. Сер. хим. 2018. Т. 67. С. 1648. [Baymuratova, G.R., Slesarenko, A.A., Yudina, A.V., and Yarmolenko, O.V., Conducting properties of nanocomposite polymer electrolytes based on polyethylene glycol diacrylate and SiO2 nanoparticles at the interface with a lithium electrode, Russ. Chem. Bull., 2018, vol. 67, p. 1648.] https://doi.org/10.1007/s11172-018-2272-7
Баскакова, Ю.В., Ярмоленко, О.В., Ефимов, О.Н. Полимерные гель-электролиты для литиевых источников тока. Успехи химии. 2012. Т. 81. С. 367. [Baskakova, Yu.V., Yarmolenko, O.V., and Efimov, O.N., Polymer gel electrolytes for lithium batteries, Russ. Chem. Rev., 2012, vol. 81(4), p. 367] https://doi.org/10.1070/RC2012v081n04ABEH004210
Jeon, J, Lee, H, Choi, J. H., and Cho, M., Modeling and Simulation of Concentrated Aqueous Solutions of LiTFSI for Battery Applications, J. Phys. Chem. C., 2020, vol. 124, no. 22, p. 11790. https://doi.org/10.1021/acs.jpcc.0c02187
Бушкова, О.В., Ярославцева, Т.В., Добровольский, Ю.А. Новые соли лития в электролитах для литий-ионных аккумулятор. Электрохимия. 2017. Т. 53. С. 763. [Bushkova, O.V., Yaroslavtseva, T.V., and Dobrovolsky, Y.A., New lithium salts in electrolytes for lithium-ion batteries (Review), Russ. J. Electrochem., 2017, vol. 53, p. 677.] https://doi.org/10.1134/S1023193517070035
Kalhoff, J., Bresser, D., Bolloli, M., Alloin, F., Sanchez, J.-Y., and Passerini, S., Enabling LiTFSI-based Electrolytes for Safer Lithium-Ion Batteries by Using Linear Fluorinated Carbonates as (Co)Solvent, Chem. Sus. Chem., 2014, no. 7(10), p. 2939. https://doi.org/10.1002/cssc.201402502
Ulihin, A.S., Uvarov, N.F., and Gerasimov, K.B., Conductivity of lithium bis(trifluoromethane)sulfonamide (LiTFSI), Materials Today: Proceedings, 2020, vol. 31, p. 532–534. https://doi.org/10.1016/j.matpr.2020.06.142
Nilsson, V., Bernin, D., Brandell, D., Edstrom, K., and Johansson, P., Interactions and Transport in Highly Concentrated LiTFSI-based Electrolytes, Chemphyschem., 2020, no. 21(11), p. 1166. https://doi.org/10.1002/cphc.202000153
Sharova, V., Moretti, A., Diemant, T., Varzi, A., Behm, R.J., and Passerini, S., Comparative study of imide-based Li salts as electrolyte additives for Li-ion batteries, Power Sources, 2018, vol. 375, p. 43. https://doi.org/10.1016/j.jpowsour.2017.11.045
Bekturov, E.A., Ismagulova, S.S., and Dzumadilov, T.K., Complexation of poly(ethylene glycol) with lithium salts in solution, Die Makromolek. Chem., 1990, no. 6(191), p. 1329. https://doi.org/10.1002/macp.1990.021910612
Xue, Z., He, D., and Xie, X., Poly(ethylene oxide)-based electrolytes for lithium-ion batteries, J. Mater. Chem. A, 2015, no. 3(38), p. 19218. https://doi.org/10.1039/C5TA03471J
Banitaba, S.N., Semnani D., Fakhrali, A., Ebadi, S.V., Heydari-Soureshjani, E., Rezaei, B., and Ensafi, A.A., Electrospun PEO nanofibrous membrane enable by LiCl, LiClO4, and LiTFSI salts: a versatile solvent-free electrolyte for lithium-ion battery application, Ionics, 2020, no. 7(26), p. 3249. https://doi.org/10.1007/s11581-019-03414-6
Cai, D., Wang, D.H., Chen, Y.J., Zhang, S.Z., Wang, X.L., Xia, X.H., and Tu, J.P., A highly ion-conductive three-dimensional LLZAO-PEO/LiTFSI solid electrolyte for high-performance solid-state batteries, Chem. Engineering J., 2020, vol. 394, p. 124993. https://doi.org/10.1016/j.cej.2020.124993
Sekhar, B.C., Hachicha, R., Maffre, M., Bodin. C., le Vot, S., Favier, F., and Fontaine, O., Evaluation of the Properties of an Electrolyte Based on Formamide and LiTFSI for Electrochemical Capacitors, J. Electrochem. Soc., 2020, no. 167(11), p. 110508. https://doi.org/10.1149/1945-7111/aba076
Zhou, H., Zhao, R., Xiao, Y., Feng, L., Yang, Y., Bao, L., and Wang, J., Quantum mechanical insight into the Li-ion conduction mechanism for solid polymer electrolytes, J. Polymer Sci., 2020, no. 24(58), p. 3480. https://doi.org/10.1002/pol.20200686
Steinruck, H.G., Takacs, C.J., Kim, H.K., Macka-nic, D.G., Holladay, B., Cao, C.T., Narayanan, S., Dufresne, E.M., Chushkin, Y, Ruta, B., Zontone, F., Will, J., Borodin, O., Sinha, S.K., Srinivasan V., and Toney, M.F., Concentration and velocity profiles in a polymeric lithium-ion battery electrolyte, Energy & Environmental Sci., 2020, no. 11(13), p. 4312. https://doi.org/10.1039/D0EE02193H
Tran, K.T.T., Le, L.T.M., Phan, A.L.B., Tran, P.H., Vo, T.D., Truong, T.T.T., Nguyen, N.T.B., Garg, A., Le, P.M.L., and Tran, M.V., New deep eutectic solvents based on ethylene glycol - LiTFSI and their application as an electrolyte in electrochemical double layer capacitor (EDLC), Molecular Liquids, 2020, vol. 320, p. 114495. https://doi.org/10.1016/j.molliq.2020.114495
Vélez, J. F., Aparicio, M., and Mosa, J., Effect of Lithium Salt in Nanostructured Silica–Polyethylene Glycol Solid Electrolytes for Li-Ion Battery Applications, Phys. Chem. C, 2016, no. 40(120), p. 22852. https://doi.org/10.1021/acs.jpcc.6b07181
Costa, L.T., Sun, B., Jeschull, F., and Brandell, D., Polymer-ionic liquid ternary systems for Li-battery electrolytes: Molecular dynamics studies of LiTFSI in a EMIm-TFSI and PEO blend, Chem. Phys., 2015, no. 2(143), p. 024904. https://doi.org/10.1063/1.4926470
Wetjen, M., Kim, G.T., Joost, M., Appetecchi, G.B., Winter, M., and Passerini, S., Thermal and electrochemical properties of PEO-LiTFSI-Pyr 14TFSI-based composite cathodes, incorporating 4V-class cathode active materials, J. Power Sources, 2014, vol. 246, p. 846. https://doi.org/10.1016/j.jpowsour.2013.08.037
Zhu, C., Cheng, H., and Yang, Y., Electrochemical characterization of two with room-temperature ionic liquids, J. Electrochem. Soc., 2008, vol. 155, p. A569. https://doi.org/10.1149/1.2931523
Gupta, H. and Singh, R.K., Chapter: Ionic Liquid-Based Gel Polymer Electrolytes for Application in Rechargeable Lithium Batteries, in book: Energy Storage Battery Systems—Fundamentals and Applications, Published: IntechOpen, 2020. 19 p. https://doi.org/10.5772/intechopen.93397
Takeichi, N., Kojima, T., Senoh, H., and Ando, H., Local structure and electrochemical performances of sulfurized polyethylene glycol after heat treatment, Sci. Rep., 2020, no. 10, p. 16918. https://doi.org/10.1038/s41598-020-74118-5
Li, S., Lorandi, F., Whitacre, J.F., and Matyjaszewski, K., Polymer Chemistry for Improving Lithium Metal Anodes, Macromolec. Chem. and Phys., 2019, p. 1900379. https://doi.org/10.1002/macp.201900379
Zhu, J., Zhu, P., Yan, C., Dong, X., and Zhang, X., Recent progress in polymer materials for advanced lithium-sulfur batteries, Progress in Polymer Science, 2019, vol. 90, p.118. https://doi.org/10.1016/j.progpolymsci.2018.12.002
Yuan, Z., Zheng, H., Wang, S., and Feng, C., Influences of polyethylene glycol (PEG) on the performance of LiMn2O4 cathode material for lithium ion battery, J. Mater. Sci.: Mater. in Electronics, 2016, vol. 27(5), p. 5408. https://doi.org/10.1007/s10854-016-4442-4
Geiculescu, O.E., Hallac, B.B., Rajagopal, R.V., Creager, S.E., DesMarteau, D.D., Borodin, O., and Smith, G.D., The effect of low-molecular-weight poly(ethylene glycol) (PEG) plasticizers on the transport properties of lithium fluorosulfonimide ionic melt electrolyte, Phys. Chem. B, 2014, vol. 118, p. 5135. https://doi.org/10.1021/jp500826c
Devaux, D., Bouchet, R., Glé, D., and Denoyel, R., Mechanism of ion transport in PEO/LiTFSI complexes: Effect of temperature, molecular weight and end groups, Solid State Ionics, 2012, vol. 227, p. 119. https://doi.org/10.1016/j.ssi.2012.09.020
Гафуров, М.М., Ахмедов, М.А., Рабаданов, К.Ш., Шабанов, Н.С., Амиров, А.М., Сулейманов, С.И., Атаев, М.Б. Исследование строения и электропроводности литий-полимерных электролитов на основе ПЭГ 1500 – LiX (X = SCN, TFSI). Изв. АН. Сер. хим. 2020. № 8(69). С. 1463. [Gafurov, M.M., Akhmedov, M.A., Rabadanov, K.S., Shabanov, N.S., Amirov, A.M., Suleimanov, S.I., and Ataev, M.B., Study of the structure and electrical conductivity of lithium-conducting polymer electrolytes based on PEG-1500–LiX (X = SCN, N(CF3SO2)2), Russ. Chem. Bull., 2020, no. 8(69), p. 1463.] https://doi.org/10.1007/s11172-020-2924-2
Zhou, H., Zhao, R., Xiao, Y., Feng, L., Yang, Y., Bao, L., and Wang, J., Quantum mechanical insight into the Li-ion conduction mechanism for solid polymer electrolytes, Polymer Sci., 2020, p. 2. https://doi.org/10.1002/pol.20200686
Уваров, Н.Ф. Композиционные твердые электролиты. СО РАН, Новосибирск, 2008. 258 с. [Uvarov, N.F., Composite Solid Electrolytes, SB RAS (in Russian), Novosibirsk, 2008. 258 p.]
Nguyen, T.Q. and Breitkopf, C., Determination of Diffusion Coefficients Using Impedance Spectroscopy Data, Electrochem. Soc., 2018, no. 14(165), E826–E831. https://doi.org/10.1149/2.1151814jes
Шольц, Ф. Электроаналитические методы. Теория и практика. М: “Бином. Лаборатория знаний"", 2014. С. 150–162. [Scholz, F. Electroanalytic methods. Theory and practice. M.: "Binom. Knowledge Laboratory”, 2014. p. 150–162.]
Емельянова, Ю.В., Морозова, М.В., Михайловская, З.А., Буянова, Е.С. Импедансная спектроскопия: теория и применение. Екатеринбург: Изд-во “УРФУ”, 2017. 156 с. [Emelyanova, Yu.V., Morozova, M.V., Mikhailovskaya, Z.A., and Buyanova, E.S. Impedance spectroscopy: theory and application, Ekaterinburg: Publishing house “URFU”, 2017. 156 p.]
Choi, W., Shin, H.-Ch., Kim, J.M., Choi, J.-Y., and Yoon, W.-S., Modeling and Applications of Electrochemical Impedance Spectroscopy (EIS) for Lithium-ion Batteries, J. Electrochem. Sci. Technol., 2020, no. 1(11), p. 1. https://doi.org/10.33961/jecst.2019.00528
Волгин, И.В., Ларин, С.В., Люлин, С.В. Особенности диффузии наночастиц в полимерных системах. Высокомолекуляр. соед. Серия С. 2018. № 2(60). С. 221. [Volgin, I.V., Larin, S.V., and Lyulin, S.V., Diffusion of nanoparticles in polymer systems, Polymer Science. Series C, 2018, no. 1(60), p. 122–134.] https://doi.org/10.1134/S1811238218020212
Дополнительные материалы отсутствуют.