Электрохимия, 2021, T. 57, № 9, стр. 564-572
Влияние донорного допирования на ионный (О2–, Н+) транспорт в новых сложных оксидах BaLaIn1 – xNbxO4 + x со структурой Раддлесдена–Поппера
Н. А. Тарасова a, b, А. О. Галишева a, *, И. Е. Анимица a, b, **, А. А. Дмитриева a
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
b Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: a.o.galisheva@urfu.ru
** E-mail: Irina.Animitsa@urfu.ru
Поступила в редакцию 29.11.2020
После доработки 04.03.2021
Принята к публикации 12.03.2021
Аннотация
В работе проведен анализ влияния донорного допирования Nb5+ → In3+ на транспортные свойства сложного оксида BaLaInO4, характеризующегося структурой Раддлесдена–Поппера. Установлено, что полученные фазы способны к диссоциативному поглощению воды из газовой фазы и проявлению протонного переноса. Показано, что донорное допирование BaLaInO4 приводит к росту кислород-ионной и протонной проводимости.
ВВЕДЕНИЕ
Новый структурный тип, производный от структуры перовскита, был впервые описан С.Н. Раддлесденом и П. Поппером в 1957 г. [1]. Эта слоистая структура может быть выражена общей формулой AX(A'BX3)n, где А, А' и B – катионы, Х – анион, а n – количество слоев октаэдров в перовскитном блоке [A/A′BX3], разделенных слоями [A/A'X]. В однослойных фазах Раддлесдена–Поппера AA′BX4 (n = 1) катионы А и А′ занимают одну кристаллографическую позицию в блочном слое и имеют координационное число к. ч. = 9. В случае, когда А и А′ один и тот же катион, общая формула может быть записана как A2BX4, и такие соединения относятся к структуре типа K2NiF4 [2]. Катионы B расположены в анионных октаэдрах [BX6] (к. ч. = 6).
Соединения, обладающие структурой Раддлесдена–Поппера, характеризуются различными физическими свойствами в зависимости от природы входящих в их состав элементов. Такие соединения могут быть использованы в качестве сверхпроводников [3, 4], магнитных [5, 6] и электродных материалов [7–11]. В последние десятилетия значительно увеличилось количество исследований, посвященных изучению материалов, пригодных для использования в качестве компонентов твердооксидных топливных элементов (ТОТЭ), в связи с необходимостью создания эффективных и экологически чистых источников энергии [12–18]. В качестве электролитических материалов могут использоваться кислород-ионные и протонные проводники [19]. Использование протонных проводников в ТОТЭ по сравнению с кислород-ионными проводниками имеет ряд преимуществ, таких как снижение рабочих температуры и повышение эффективности ТОТЭ [16, 17, 19–21]. Поэтому поиск и исследование новых высокопроводящих протонных проводников является одной из важных задач химического материаловедения.
Одним из перспективных представителей семейства однослойных блочно-слоевых структур AA'BX4 является состав BaLaInO4. Уникальная возможность катионов In3+ адаптировать разные координационные числа позволяет реализовать In-содержащим сложным оксидам различные кристаллические структуры. Например, известны ионные проводники со структурой перовскита и браунмиллерита на основе Ba-допированного LaInO3 [22–24] и Ba2In2O5 [25–31] соответственно.
Возможность протонного транспорта в BaLaInO4 и соединениях на его основе была описана нами ранее [32–35]. Доказано, что допирование катионных подрешеток в BaLaInO4 приводит к значительному (до ~1.5 порядка) увеличению значений протонной проводимости. Однако фундаментальные закономерности переноса протона, в том числе влияние природы допанта на величину протонной проводимости, в блочно-слоевых структурах еще не установлены.
В настоящей работе изучено влияние допирования ионами Nb5+ подрешетки индия на транспортные свойства сложного оксида BaLaInO4, характеризующегося структурой Раддлесдена–Поппера. Исследованы температурные и концентрационные зависимости общей проводимости в различных условиях влажности атмосферы и парциального давления кислорода. Проведена дифференциация общей проводимости на вклады – кислород-ионный и протонный, рассчитана подвижность протонов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Составы BaLaIn1 –xNbxO4 +x (0 ≤ x ≤ 0.10) были получены методом твердофазного синтеза из предварительно осушенных BaCO3, La2O3, In2O3, Nb2O5. Синтез проводили на воздухе при ступенчатом повышении температуры (800–1300°С) и многократных перетираниях в агатовой ступке в среде этилового спирта. Для предотвращения возможного испарения компонентов в ходе высокотемпературного отжига синтез проводили в закрытых тиглях, в засыпках из порошков синтезируемых веществ. Температура первого отжига составляла 800°C, что обеспечивало начало синтеза до разложения карбоната бария и связывание бария в промежуточные фазы. Время отжига на каждой стадии составляло 24 ч.
Рентгенографический анализ был выполнен на дифрактометре Bruker Advance D8 в СuKα-излучении при напряжении на трубке 40 кВ и токе 40 мА. Съемка производилась в интервале 2θ = = 20°–80° с шагом 0.05°θ и экспозицией 1 с на точку. Расчеты параметров решетки проводили с помощью программы FullProf Suite.
Термический анализ проводили на приборе NETZSCH STA 409 PC в комплекте с квадрупольным масс-спектрометром QMS 403C Aëolos (NETZSCH), позволяющем одновременно выполнять термогравиметрические измерения (ТГ), и анализ отходящих газов (масс-спектрометрия МС), в интервале температур 25–1000°С и скоростью нагрева 10°/мин. Перед измерениями образцы подвергали термической обработке во влажной атмосфере (рН2О = 2 × 10–2 атм) путем медленного охлаждения от 1000 до 200°C со скоростью 1°/мин с целью получения гидратированных форм образцов.
Электропроводность исследуемых фаз изучалась в атмосферах различной влажности. Влажную атмосферу получали барботированием воздуха при комнатной температуре последовательно через дистиллированную воду и насыщенный раствор бромида калия KBr (pH2O = 2 × 10–2 атм). Сухую атмосферу задавали циркуляцией газа через порошкообразный оксид фосфора P2O5 (pH2O = 3.5 × 10–5 атм). Кроме того, для предотвращения возможной карбонизации керамики проводилось предварительное удаление углекислого газа СО2 из воздуха, для влажной атмосферы – с помощью 20%-ного раствора NaOH, для сухой – с использованием реактива “Аскарит”. Влажность газов контролировали измерителем влажности газов ИВГ-1 МК-С.
Для измерений электрических свойств образцы готовили в виде таблеток, спекание проводили при температуре 1350°С в течение 24 ч. Плотность образцов составляла ~90–93%. Припекание платиновых электродов проводили при температуре 900°С в течение 3 ч.
Изучение электропроводности проводили методом электрохимического импеданса в частотном диапазоне 1 Гц–1 МГц с амплитудой сигнала 15 мВ с использованием измерителя параметров импеданса Elins Z-1000P. Также проводились измерения электропроводности при варьировании парциального давления кислорода pO2 в газовой фазе. Контроль pO2 осуществлялся электрохимическим методом. Использовались кислородные насос и датчик из керамики Y-стабилизированного ZrO2. Все электрохимические измерения были выполнены в условиях равновесия с T, pH2O, pO2. Расчет объемного сопротивления проводили с использованием программного обеспечения Zview software fitting.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты рентгенофазового анализа для соединения BaLaInO4 и допированных составов на его основе BaLaIn1 –xNbxO4 +x (x = 0.05, 0.10) показали, что образцы являются однофазными и характеризуются орторомбической симметрией (пространственная группа Pbca). В качестве примера обработки рентгенограмм методом полнопрофильного анализа на рис. 1 представлены результаты для (а) безводного BaLaIn0.95Nb0.05O4.05 и (б) гидратированного BaLaIn0.95Nb0.05O4.05∙nH2O образцов.
Рис. 1.
Рентгенограммы безводного образца BaLaIn0.95Nb0.05O4.05 (а) и гидратированного образца BaLaIn0.95Nb0.05O4.05∙nH2O (б), показаны экспериментальные (точки), расчетные (линия), разностные (внизу) данные и угловые положения рефлексов (штрихи).

Полученные для BaLaInO4 значения параметров решетки хорошо согласуются с описанными ранее в литературе [36]. Введение ионов Nb5+ в In3+-подрешетку приводит к изменению объема элементарной ячейки по сравнению с недопированным BaLaInO4 (табл. 1). Несмотря на введение в In-подрешетку (${{r}_{{{\text{I}}{{{\text{n}}}^{{{\text{3}} + }}}}}}$ = 0.80 Å) иона с меньшим ионным радиусом (${{r}_{{{\text{N}}{{{\text{b}}}^{{{\text{5}} + }}}}}}$ = 0.64 Å), объем элементарной ячейки увеличивается [37]. Такое изменение обусловлено увеличением параметров a и b; параметр с уменьшается при введении допанта. Данное увеличение параметров может быть объяснено образованием междоузельного кислорода в блоке [La−O], которое сопровождается расширением межслоевого пространства в плоскости (aOb). Это вызывает увеличение параметров a и b [33, 38, 39] и, в итоге, увеличение объема элементарной ячейки.
Таблица 1.
Параметры ячейки и объем ячейки безводных образцов
| Образец | а, Å | b, Å | c, Å | Объем ячейки, Å3 |
|---|---|---|---|---|
| BaLaInO4 | 12.932(3) | 5.906(1) | 5.894(2) | 450.19(5) |
| BaLaIn0.9Nb0.05O4.05 | 12.956(6) | 5.918(0) | 5.886(3) | 451.34(5) |
| BaLaIn0.9Nb0.1O4.10 | 12.961(8) | 5.938(5) | 5.878(5) | 452.70(9) |
Гидратация образцов приводила к изменению их симметрии с орторомбической (Pbca) на моноклинную (P2/m). Как и в случае безводных образцов, введение допанта приводило к увеличению объема элементарной ячейки (табл. 2).
Таблица 2.
Параметры ячейки и объем ячейки гидратированных образцов
| Образец | а, Å | b, Å | c, Å | β, град | Объем ячейки, Å3 |
|---|---|---|---|---|---|
| BaLaInO4∙nH2O | 12.683(6) | 14.708(1) | 7.169(9) | 92.81(9) | 1 335(9) |
| BaLaIn0.9Nb0.05O4.05∙nH2O | 12.684(2) | 14.716(0) | 7.176(0) | 92.85(2) | 1 337(8) |
| BaLaIn0.9Nb0.1O4.10∙nH2O | 12.685(1) | 14.722(3) | 7.181(6) | 92.89(8) | 1 339(4) |
Для определения возможности диссоциативного поглощения воды из газовой фазы для предварительно гидратированных образцов BaLaInO4∙nH2O, BaLaIn0.9Nb0.05O4.05∙nH2O и BaLaIn0.9Nb0.1O4.1∙nH2O были проведены термические и масс-спектрометрические исследования. По убыли массы гидратированных составов была определена степень гидратации. Для удобства сравнения данные приведены в пересчете на число молей воды на формульную единицу сложного оксида (рис. 2). Совместно с ТГ-кривыми представлены результаты масс-спектрометрии для состава BaLaIn0.9Nb0.05O4.05∙nH2O. Основная потеря массы наблюдается в температурном интервале 200–700°С, что, согласно результатам масс-спектрометрического анализа, обусловлено выходом H2O. Выделения других возможных летучих веществ (СО2, О2) не было обнаружено. Наличие нескольких сигналов на кривой ионного тока (H2O) было обусловлено наличием в структуре гидратированных образцов энергетически неэквивалентных гидроксо-групп, характеризующихся различным кристаллографическим положением и различной степенью участия в водородных связях. Подробный анализ был выполнен ранее [40] на примере образца BaLaIn0.9Nb0.1O4.10. Введение допанта приводит к росту степени гидратации, что может быть обусловлено увеличением параметров a и b при введении допанта и увеличением межслоевого пространства (т.е., увеличением размеров солевого блока).
Рис. 2.
Данные термогравиметрии для образцов BaLaInO4∙nH2O (1), BaLaIn0.9Nb0.05O4.05·nH2O (2) и BaLaIn0.9Nb0.1O4.1·nH2O (3), а также данные масс-спектрометрии для образца BaLaIn0.9Nb0.05O4.05·nH2O.

Таким образом, исследуемые в работе допированные образцы, как и недопированный BaLaInO4, способны к поглощению воды из газовой фазы, несмотря на отсутствие в их структуре вакансий кислорода.
Поскольку было установлено, что исследуемые составы способны к диссоциативному поглощению воды, и, как следствие, для них может быть реализована протонная проводимость, то изучение электрических свойств проводилось в атмосферах с контролируемой влажностью.
На рис. 3 приведены типичные годографы импеданса для состава BaLaIn0.9Nb0.05O4.05 в атмосферах сухого воздуха и сухого аргона при температуре 520°С. Годографы состояли из нескольких компонент, отвечающих объемному (Соб ~ 10–11 Ф/см) и зернограничному (Сгз ~ 10–9 Ф/см) сопротивлению образца. Для расчетов удельной проводимости использовали значение сопротивления образца, полученное путем экстраполяции высокочастотной полуокружности (Соб ~ 10–11 Ф/см) на ось абсцисс (обработка Zview).
Рис. 3.
Годограф импеданса для образца BaLaIn0.9Nb0.05O4.05 в атмосфере сухого воздуха (1) и сухого аргона (2) при 520°С.

Температурные зависимости общей электропроводности для твердых растворов BaLaIn1 –xNbxO4 +x, полученные в сухой атмосфере, представлены на рис. 4а. Как видно, значения проводимости для допированных образцов выше на ~1.5 порядка величины по сравнению со значениями для недопированного BaLaInO4.
Рис. 4.
Температурные зависимости общей электропроводности для твердого раствора BaLaIn1 –xNbxO4 +x в атмосфере сухого воздуха (закрытые знаки) и сухого аргона (открытые знаки) (а), а также зависимости электропроводности от парциального давления кислорода в сухой атмосфере при температуре 620°С для образцов x = 0 (1), x = 0.05 (2), x = 0.1 (3) (б).
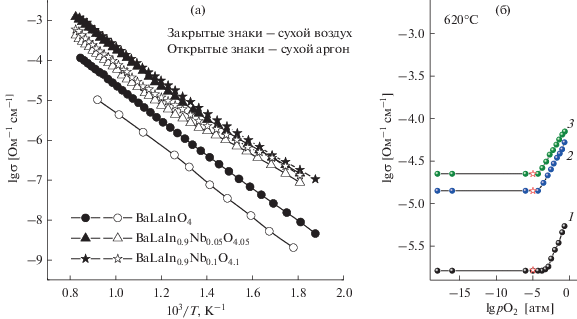
На рис. 4б представлены зависимости электропроводности от парциального давления кислорода в сухой атмосфере при температуре 620°С. Как видно, при значениях pO2 выше 10–4 атм, кривые проводимости имеют положительный наклон, что подтверждает вклад дырочной проводимости. Хорошее соответствие значений проводимости из области плато (10–18–10–5 атм), где доминирует ионная проводимость, со значениями, полученными в атмосфере сухого аргона (красные символы на рис. 4б), позволяет говорить о том, что значения, полученные в сухом азоте, соответствуют значениям кислородно-ионной проводимости.
При высоких температурах, значение электропроводности, полученные в атмосфере сухого аргона, были ниже значений, полученных в атмосфере сухого воздуха для всех образцов (рис. 4а), что подтверждает смешанный ионно-электронный характер проводимости:
Концентрационные зависимости кислород-ионной проводимости для твердого раствора BaLaIn1 –xNbxO4 +x представлены на рис. 5. Как видно, введение Nb5+ приводит к значительному росту кислород-ионной проводимости.
Рис. 5.
Концентрационные зависимости кислородно-ионной проводимости, полученные в атмосфере сухого азота, для твердого раствора BaLaIn1 –xNbxO4 +x.

Сравнение температурных зависимостей общей электропроводности для твердого раствора BaLaIn1 – xNbxO4 + x, полученных в атмосфере влажного воздуха (закрытые знаки) и влажного аргона (открытые знаки) представлено на рис. 6.
Рис. 6.
Температурные зависимости общей электропроводности для твердого раствора BaLaIn1 –xNbxO4 +x в атмосфере влажного воздуха (закрытые знаки) и влажного аргона (открытые знаки).

В температурной области появления протонных носителей заряда (ниже 500°С), значения проводимости, полученные в атмосфере влажного аргона, сравнимы со значениями, полученными в атмосфере влажного воздуха (рис. 6), т.е., не зависят от рО2, что подтверждает ионный характер проводимости. Увеличение электропроводности в атмосфере влажного аргона, по сравнению с сухим аргоном (рис. 7) подтверждает наличие протонного вклада во влажных атмосферах.
Рис. 7.
Температурные зависимости общей электропроводности для твердого раствора BaLaIn1 –xNbxO4 +x в атмосфере сухого аргона (закрытые знаки) и влажного аргона (открытые знаки).

Протонная проводимость была рассчитана как разность между значениями электропроводности, полученными в атмосферах влажного и сухого аргона:
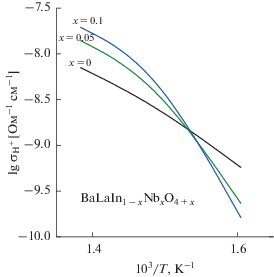
а ее температурные зависимости показаны на рис. 8.Анализируя концентрационные зависимости протонной проводимости (рис. 9) для твердого раствора BaLaIn1 –xNbxO4 +x, видно, что при температурах выше 400°С допирование приводит к росту протонной проводимости, а при температурах ниже 400°С протонная проводимость увеличивается с увеличением концентрации допанта до х = 0.05, а затем уменьшается. Этот максимум хорошо коррелирует с минимумом на кривой концентрационной зависимости энергии активации Ea, рассчитанной для температурного интервала 350–500°С. Значения Ea для наиболее проводящего образца (x = 0.05) составляет ~0.55 эВ, что характерно для протонного транспорта. Для объяснения изменения протонной проводимости при допировании была рассчитана подвижность протонов µH как:
(3)
${{\mu }_{H}} = {{{{\sigma }_{H}}} \mathord{\left/ {\vphantom {{{{\sigma }_{H}}} {Ze{{c}_{H}}}}} \right. \kern-0em} {Ze{{c}_{H}}}},$Рис. 9.
Концентрационные зависимости протонной проводимости (⚫) и энергии активации (◼) для твердого раствора BaLaIn1 –xNbxO4 +x.

Как видно, температурные и концентрационные зависимости подвижности протонов (рис. 10 и 11) характеризуются теми же тенденциями, что и температурные и концентрационные зависимости протонной проводимости (рис. 8 и 9). Очевидно, что, как и кислородно-ионный транспорт, протонный транспорт зависит от двух факторов: изменения концентрации носителей заряда и изменения их подвижности при допировании. Согласно термогравиметрическим исследованиям, увеличение концентрации допанта для BaLaIn1 –xNbxO4 +x приводит к увеличению степени гидратации, т.е., к увеличению концентрации протонов. В то же время взаимодействие дефектов может приводить к образованию ассоциатов:
(5)
${\text{Nb}}_{{{\text{In}}}}^{{ \bullet \bullet }} + 2({\text{OH}})_{i}^{'} \to {{\left( {{\text{Nb}}_{{{\text{In}}}}^{{ \bullet \bullet }} \cdot 2({\text{OH}})_{i}^{'}} \right)}^{ \times }},$Рис. 11.
Концентрационные зависимости подвижности протонов (⚫) и степени гидратации (◼) для твердого раствора BaLaIn1 –xNbxO4 +x.
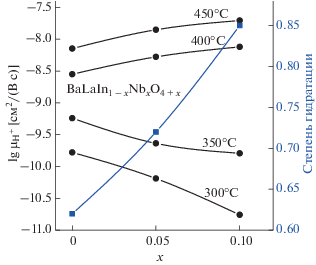
Рис. 12.
Температурные зависимости чисел переноса протонов для твердого раствора BaLaIn1 –xNbxO4 +x.

Таким образом, было установлено, что донорное допирование BaLaInO4 по подрешетке индия приводит к росту кислород-ионной и протонной проводимости. В атмосфере влажного воздуха при температурах ниже 500°С как недопированный, так и допированные образцы являются протонными проводниками с долей протонного переноса ~90%, при этом наибольшими значениями протонной проводимости характеризуется образец BaLaIn0.9Nb0.05O4.05.
ЗАКЛЮЧЕНИЕ
В работе методом твердофазного синтеза получены составы BaLaIn1 –xNbxO4 +x (0 ≤ x ≤ 0.10), рентгенографически подтверждена их однофазность. Установлено, что данные образцы способны к диссоциативному поглощению воды из газовой фазы и проявлению протонного переноса. Установлено, что донорное допирование подрешетки индия приводит к росту кислород-ионной и протонной проводимости. В атмосфере влажного воздуха при температурах ниже 500°С как недопированный, так и допированные образцы являются протонными проводниками с долей протонного переноса ~90%.
Список литературы
Ruddlesden, S.N. and Popper, P., New compounds of the K2NiF4 type, Acta Crystallogr., 1957, vol. 10, p. 538.
Beznosikov, B.V. and Aleksandrov, K.S., Perovskite-Like Crystals of the Ruddlesden–Popper Series, Crystallogr. Report., 2000, vol. 45, p. 792.
Le Page, Y., Structural properties of Ba2RCu3O7 high-Tc superconductors, Phys. Rev. B., 1987, vol. 36, p. 3517.
Cheong, S-W., Thompson, J.D., and Fisk, Z., Properties of La2CuO4 and related compounds, Physica C., 1989, vol. 158, p. 109.
Moritomo, Y., Tomioka, Y., Asamitsu, A., and Tokura, Y., Magnetic and electronic properties in hole-doped manganese oxides with layered structures: La1 –xSr1 +xMnO4, Phys. Rev. B., 1995, vol. 51, p. 3297.
Hector, A.L., Knee, C.S., MacDonald, A.I., Price, D.J., and Weller, M.T., An unusual magnetic structure in Sr2FeO3F and magnetic structures of K2NiF4-type iron(III) oxides and oxide halides, including the cobalt substituted series Sr2Fe1 –xCoxO3Cl, J. Mater. Chem., 2005, vol. 15, p. 3093.
Sayers, R., Liu, J., Rustumji, B., and Skinner, S.J., Novel K2NiF4-Type Materials for Solid Oxide Fuel Cells: Compatibility with Electrolytes in the Intermediate Temperature Range, Fuel Cell, 2008, vol. 8, p. 338.
Montenegro-Hernandez, A., Vega-Castillo, J., Mogni, L., and Caneiro, A., Thermal stability of Ln2NiO4 + δ (Ln: La, Pr, Nd) and their chemical compatibility with YSZ and CGO solid electrolytes, Internat. J. Hydrogen Energy, 2011, vol. 36, p. 15704.
Grimaud, A., Mauvy, F., Bassat, J.M., Fourcade, S., Marrony, M., and Grenier, J.C., Hydration and transport properties of the Pr2 –xSrxNiO4 + δ compounds as H+-SOFC cathodes, J. Mater. Chem., 2012, vol. 22, p. 16017.
Vibhu, V., Rougier, A., Nicollet, C., Flura, A., Fourcade, S., Penin, N., Grenier, J.C., and Bassat, J.M., Pr4Ni3O10 + δ: A new promising oxygen electrode material for solid oxide fuel cells, J. Power Sources, 2016, vol. 317, p. 184.
Yatoo, M.A., Du, Z., Zhao, H., Aguadero, A., and Skinner, S.J., La2Pr2Ni3O10 ± δ Ruddlesden–Popper phase as potential intermediate temperature-solid oxide fuel cell cathodes, Solid State Ionics, 2018, vol. 320, p. 148.
Mahato, N., Banerjee, A., Gupta, A., Omar, S., and Balani, K., Progress in material selection for solid oxide fuel cell technology: A review, Progress in Mater. Sci., 2015, vol. 72, p. 141.
Kan, W.H., Samson, A.J., and Thangadurai, V., Trends in electrode development for next generation solid oxide fuel cells, J. Mater. Chem. A., 2016, vol. 4, p. 17913.
Yesid Gómez, S. and Hotza, D., Current developments in reversible solid oxide fuel cells, Renewable and Sustainable Energy Rev., 2016, vol. 61, p. 155.
da Silva, F.S. and de Souza, T.M., Novel materials for solid oxide fuel cell technologies: A literature review, Internat. J. Hydrogen Energy, 2017, vol. 42, p. 26020.
Zhang, Y., Knibbe, R., Sunarso, J., Zhong, Y., Zhou, W., Shao, Z., and Zhu, Z., Recent Progress on Advanced Materials for Solid-Oxide Fuel Cells Operating Below 500°C, Advanced Materials, 2017, vol. 29, p. 1700132.
Medvedev, D.A., Lyagaeva, J.G., Gorbova, E.V., Demin, A.K., and Tsiakaras, P., Advanced materials for SOFC application: Strategies for the development of highly conductive and stable solid oxide proton electrolytes, Progress in Mater. Sci., 2016, vol. 75, p. 38.
Danilov, N., Lyagaeva, J., Vdovin, G., and Medvedev, D., Multifactor performance analysis of reversible solid oxide cells based on proton-conducting electrolytes, Appl. Energy, 2019, vol. 237, p. 924.
Tarancon, A., Strategies for Lowering Solid Oxide Fuel Cells Operating Temperature, Energies, 2009, vol. 2, p. 1130.
Kochetova, N., Animitsa, I., and Medvedev, D., Recent activity in the development of proton-conducting oxides for high-temperature applications, RSC Adv., 2016, vol. 6, p. 73222.
Wachsman, E.D. and Lee, K.T., Lowering the temperature of solid oxide fuel cells, Science, 2011, vol. 334, p. 935.
Sood, K., Singh, K., and Pandey, O.P., Co-existence of cubic and orthorhombic phases in Ba-doped LaInO3 and their effect on conductivity, Physica B., 2015, vol. 456, p. 250.
Byeon, D.-S., Jeong, S.-M., Hwang, K.-J., Yoon, M.-Y., Hwang, H.-J., Kim, S., and Lee, H.-L., Oxide ion diffusion in Ba-doped LaInO3 perovskite: A molecular dynamics study, J. Power Sources, 2013, vol. 222, p. 282.
Hwang, K.-J., Hwang, H.-J., Lee, M.-H., Jeong, S.-M., and Shin, T.-H., The Effect of Co-Doping at the A-Site on the Structure and Oxide Ion Conductivity in (Ba0.5 ‒ xSrx)La0.5InO3 – δ: A Molecular Dynamics Study, Materials, 2019, vol. 12, p. 3739.
Schober, T., Friedrich, J., and Krug, F., Phase transformation in the oxygen and proton conductor Ba2In2O5 in humid atmospheres below 300°C, Solid State Ionics, 1997, vol. 99, p. 9.
Fisher, C.A.J. and Islam, M.S., Detect, protons and conductivity in brounmillerite–structured Ba2In2O5, Solid State Ionics, 1999, vol. 118, p. 355.
Kakinuma, K., Yamamura, H., and Haneda, H., Oxide-ion conductivity of the perovskite–type solid–solution system, (Ba1 –x–ySrxLay)2In2O5 +y, Solid State Ionics, 2002, vol. 154, p. 571.
Ta, T.Q., Tsuji, T., and Yamamura, Y., Thermal and electrical properties of Ba2In2O5 substituted for In site by rare earth elements, J. Alloys Compd., 2006, vol. 408, p. 253.
Jarry, A., Quarez, E., and Kravchyk, K., Rare earth effect on conductivity and stability properties of doped barium indates as potential proton-conducting fuel cell electrolytes, Solid State Ionics, 2012, vol. 216, p. 11.
Tarasova, N. and Animitsa, I., The influence of anionic heterovalent doping on transport properties and chemical stability of F-, Cl-doped brownmillerite Ba2In2O5, J. Alloys Compd., 2018, vol. 739, p. 353.
Tarasova, N. and Animitsa, I., Anionic doping (F–, Cl–) as the method for improving transport properties of proton-conducting perovskites based on Ba2CaNbO5.5, Solid State Ionics, 2018, vol. 317, p. 21.
Tarasova, N., Animitsa, I., Galisheva, A., and Korona, D., Incorporation and Conduction of Protons in Ca, Sr, Ba-Doped BaLaInO4 with Ruddlesden-Popper Structure, Materials, 2019, vol. 12, p. 1668.
Tarasova, N., Animitsa, I., Galisheva, A., and Pryakhina, V., Protonic transport in the new phases BaLaIn0.9M0.1O4.05 (M = Ti, Zr) with Ruddlesden-Popper structure, Solid State Sciences, 2020, vol. 101, p. 106121.
Tarasova, N., Animitsa, I., and Galisheva, A., Electrical properties of new protonic conductors Ba1 +xLa1 –xInO4 – 0.5x with Ruddlesden–Popper structure, J. Solid State Electrochem., 2020, vol. 24, p. 1497.
Tarasova, N., Galisheva, A., and Animitsa, I., Improvement of oxygen-ionic and protonic conductivity of BaLaInO4 through Ti doping, Ionics, 2020, vol. 26, p. 5075.
Корона, Д.В., Обрубова, А.В., Козлюк, А.О., Анимица, И.Е. Гидратация и протонный транспорт в фазах со слоистой структурой BaCaxLa1 –xInO4 – 0.5x (x = = 0.1 и 0.2). Журн. физ. химии. 2018. Т. 92. С. 1439. [Korona, D.V., Obrubova, A.V., Kozlyuk, A.O., and Animitsa, I.E., Hydration and proton transport in BaCaxLa1– xInO4 – 0.5x (x = 0.1 and 0.2) phases with layered structure, Russ. J. Phys. Chem., 2018, vol. 92, p. 1727.]
Titov, Yu.A., Belyavina, N.M., and Markiv, V.Ya., Synthesis and crystal structure of BaLaInO4 and SrLnInO4 (Ln–La, Pr), Reports National Academy Sci. Ukraine, 2009, vol. 10, p. 160.
Troncoso, L., Alonso, J.A., Fernández-Díaz, M.T., and Aguadero, A., Introduction of interstitial oxygen atoms in the layered perovskite LaSrIn1 –xBxO4 + δ system (B = Zr, Ti), Solid State Ionics, 2015, vol. 82, p. 282.
Troncoso, L., Arce, M.D., Fernández-Díaz, M.T., Mogni, L.V., and Alonso, J.A., Water insertion and combined interstitial-vacancy oxygen conduction in the layered perovskites La1.2Sr0.8 –xBaxInO4 + δ, New J. Chem., 2019, vol. 43, p. 6087.
Тарасова, Н.А., Галишева, А.О., Анимица, И.Е., Корона, Д.В. Гидратация и состояние кислородо-водородных групп в сложном оксиде BaLaIn0.9Nb0.1O4.1 со структурой Раддлесдена–Поппера. Журн. физ. химии. 2020. Т. 94. С. 590. [Tarasova, N.A., Galisheva, A.O., Animitsa, I.E., and Korona, D.V., Hydration and the State of Oxygen–Hydrogen Groups in the Complex Oxide BaLaIn0.9Nb0.1O4.1 with the Ruddlesden–Popper Structure, Russ. J. Phys. Chem., 2020, vol. 94, p. 818.]
Дополнительные материалы отсутствуют.