Журнал физической химии, 2019, T. 93, № 4, стр. 516-520
Кинетические закономерности прививки функционально активных мономеров на хитозане
М. Л. Ерицян a, *, Г. С. Петросян b, Р. А. Карамян a, Л. Н. Ерицян b, А. М. Арустамян a
a Армянский государственный педагогический университет им. Х. Абовяна
0010 Ереван, Армения
b Ереванский государственный медицинский университет им. М. Гераци
0025 Ереван, Армения
* E-mail: mejlum.yeritsyan@mail.ru
Поступила в редакцию 04.07.2018
Аннотация
Изучена кинетика прививки функционально-активных мономеров: N-метилолморфолина, N-метилолакриламида и N-метилолметакриламида к молекуле хитозана. Oпределены значения констант скорости и энергии активации процессов прививки указанных мономеров к гликозоаминному полимеру. На основании полученных данных сделано заключение относительно активности прививки изученных N-метилольных производных мономеров к хитозану.
По функционально-активным производным хитозана (ХТЗ) достаточно много работ, из которых особого внимания заслуживают работы авторов [1–4]. Хитозан и его гомологи, являясь экологически чистыми продуктами, нашли широкое применение в медицине в качестве лекарственных препаратов нового поколения, а также при разработке адресных систем для доставки необходимых лекарств в больной участок живого организма [4–6]. Хитозан по сравнению с другими полисахаридами обладает значительным преимуществом, а именно наличием в его составе активной аминной функциональной группы, способствующей синтезу его новых производных с заданными свойствами.
Цель настоящей работы – исследование целенаправленной модификации хитозана для получения новых функционально-активных производных и дальнейшего их использования в качестве сорбентов для очистки сточных вод как от ионов тяжелых металлов (Hg2+, Cd2+, Cu2+, As5+, Pb2+, Pb4+ и др.), так и от токсичных неорганических и органических соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованы:
– хитозан (ХТЗ) марки “пищевой” с молекулярной массой 180 кДа (произведен по ТУ 9289-067-004-78124-03 ЗАО “Биопрогресс” ВНИТИБП п. Биокомбината г. Щелково Московской области);
– акриламид марки “х. ч.”, метилакриламид марки “ч. д. а.”, морфолин марки “ч. д. а.”,
– 38%-ный водный раствор формальдегида;
– N-метилолморфолин (ММ), N-метилолакриламид (МАА) и N-метилолметакриламид (ММАА) получены согласно [7].
Глубина прививки МАА, ММАА и ММ к молекуле ХТЗ определена элементным анализом на азот.
Методика эксперимента – процесса прививки МАА, ММАА и ММ на ХТЗ. 2 г ХТЗ растворяют в 90 г 2%-ного водного раствора уксусной кислоты, далее при постепенном перемешивании нагревают до 85°С и после достижения полной гомогенизации приготовленной смеси по каплям вводят 0.5 молярный водный раствор NaOH до достижения значения pH раствора, равного 5.6. Затем в реакционную массу вводят 2 г МАА (или ММАА), растворенного в 10 мл воды. В случае модификации ХТЗ соединением (ММ) в реакционную смесь, содержащую 2.7 г ХТЗ, вводят 1.05 г ММ, растворенного в 10 мл воды. При значениях времен проведения реакции, указанных в таблицах, отбирают пробу объемом 3 мл, и полимер высаживают в водно-спиртовом растворе (вода : спирт = = 1 : 1 по объему). Осадок неоднократно промывают этиловым спиртом и сушат под вакуумом (1.5–2 мм рт. ст.) при 60–65°С до достижения постоянной массы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Модификация хитозана путем прививки на нем функционально-активных соединений с целью их дальнейшего использования в качестве сорбентов для очистки сточных вод от ионов тяжелых металлов представляет определенный научный и практический интерес. Активность и эффективность полимерного сорбента зависят не только от природы и концентрации функциональных групп в модифицированном полимере, но и от их распределения в макромолекулярной цепи. Для придания макромолекуле хитозана сорбционных свойств проведена его модификация указанными функционально-активными соединениями. Для регулирования функционального состава модифицированного хитозана, для придания ему заданного свойства, необходимо оценить значения констант элементарных актов прививки приведенных выше мономеров к молекуле хитозана.
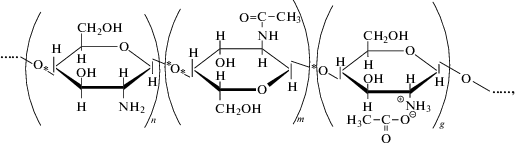
Звеньевой состав хитозана в 2%-ном водном растворе уксусной кислоты представляется в виде:
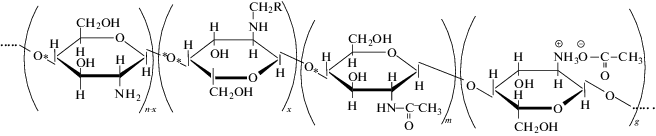
где индексы n, m и g представляют собой мольные доли звеньев: n = 0.47, m = 0.08 и g = 0.45.После модификации макромолекула хитозана имеет следующий звеньевой состав:
где х – доля аминогликозидных звеньев в хитозане, вступивших в реакции прививки с ММ, МАА и ММАА, соответственно; R – природа заместителя, представляющая собой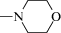 , или ‒NH–C(O)–CH=CH2, или –NH–C(O)–C(CH3)=CH2.
, или ‒NH–C(O)–CH=CH2, или –NH–C(O)–C(CH3)=CH2.
В табл. 1 представлены текущие значения концентрации МАА и гликозидных звеньев с NH2-группами [(Хтз–NH2)] в макромолекуле хитозана в зависимости от времени ведения реакции при различных температурах. Из данных табл. 1 следует, что реакция между (Хтз–NH2) и МАА является реакцией второго порядка, константа скорости которой, согласно [6], представляется уравнением
(1)
$k = \frac{1}{t}\frac{1}{{{{A}_{0}} - {{B}_{0}}}}\ln \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - x)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - x)}}.$Таблица 1.
Текущие значения концентрации (моль/л) звеньев МАА и (Хтз–NH2) в макромолекуле хитозана в зависимости от времени ведения реакции при различных температурах; [МАА]0 = A0 = 1.98 × 10–1 моль/л; [Хтз–NH2]0 = B0 = 6.8 × 10–2 моль/л, Х – концентрации гликозидных звеньев с N-замещенными группами в модифицированной макромолекуле хитозана, моль/л
| t, мин | 65°С | 70°С | 75°С | 80°С | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| X × 103 | A × 101 | B × 102 | $\lg \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ × 102 | X × 103 | A × 101 | B × 102 | $\lg \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ × 102 | X × 103 | A × 101 | B × 102 | $\lg \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ × 102 | X × 103 | A × 101 | B × 102 | $\lg \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ × 102 | |
| 10 | 1.48 | 1.96 | 6.65 | 0.6 | 2.2 | 1.95 | 6.58 | 0.86 | 3.2 | 1.94 | 6.48 | 1.3 | 3.4 | 1.94 | 6.45 | 1.4 |
| 20 | 3.0 | 1.95 | 6.5 | 1.3 | 4.3 | 1.93 | 6.37 | 1.7 | 6.5 | 1.91 | 6.15 | 2.2 | 6.5 | 1.91 | 6.15 | 2.7 |
| 30 | – | – | – | – | 6.0 | 1.92 | 6.2 | 2.4 | 7.0 | 1.89 | 6.1 | 3.0 | 8.6 | 1.89 | 5.94 | 4.0 |
| 40 | 4.8 | 1.93 | 6.3 | 2.0 | 7.0 | 1.91 | 6.1 | 3.0 | 11.0 | 1.87 | 5.7 | 4.4 | 14.0 | 1.82 | 5.2 | 5.2 |
| 50 | 5.6 | 1.92 | 6.24 | 2.5 | 8.4 | 1.89 | 5.96 | 3.86 | 13.0 | – | – | – | 18.0 | 1.82 | 5.0 | 6.4 |
| 60 | 8.8 | 1.89 | 5.92 | 3.9 | 13.0 | 1.85 | 5.5 | 5.1 | 16.0 | 1.79 | 6.5 | 6.5 | 29.0 | – | – | – |
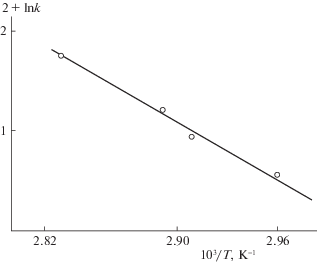
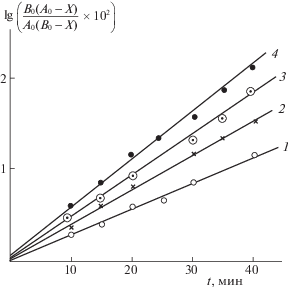
На рис. 1 графически представлены зависимости $\ln \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - x)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - x)}}$ от времени ведения реакции (t) при различных температурах, которые позволили оценить значения констант скорости (k, л моль–1 мин–1) взаимодействия Хтз с МАА при этих температурах:
Рис. 1.
Зависимости $\lg \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ от t при различных температурах: 1 – 65, 2 – 70, 3 – 75, 4 – 80°С.
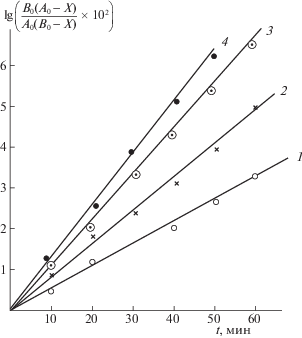
Исходя из уравнения Арениуса $k = A{{e}^{{ - {{A}_{{\text{a}}}}/RT}}}$ [6], приведенных констант скорости и приведенной на рис. 2 экспериментально установленной зависимости lnk от $\frac{1}{T}$ оценено значение энергии активации (Еа) реакции между МАА и XТЗ–NH2, которая оказалась равной 35 ± 0.1 ккал/моль.
Значения констант скорости (k, л моль–1 мин‒1) реакции между ММАА и Хтз–NH2 при изученных температурах приведены ниже:
Экспериментальные результаты аналогичных исследований реакции между ММАА и Хтз–NH2 при различных температурах представлены в табл. 2 и на рис. 3, 4 соответственно. Установленное по данным рис. 4 значение энергии активации реакции между XТЗ–NH2 и ММАА оказалось равным 19 ± ± 0.8 ккал/моль, что значительно ниже значения Еа для реакции XТЗ–NH2 с МАА (35 ± 0.1 ккал/моль). Столь резкое отличие указывает на большую активность молекулы ММАА по сравнению с МАА, которая, вероятнее всего, обусловлена индуктивным эффектом метильного радикала в ММАА.
Таблица 2.
Текущие значения концентраций (моль/л) звеньев ММАА и (Хтз–NH2) в макромолекуле хитозана в зависимости от времени ведения реакции при различных температурах; A0 = [ММАА]0 = 1.74 × 10–1 моль/л; B0 = = [Хтз–NH2] = 6.8 × 10–2 моль/л; Х – концентрации гликозидных звеньев с N-замещенными группами в модифицированной макромолекуле хитозана, моль/л
| t, мин | 65°С | 70°С | 75°С | 80°С | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| X × 103 | A | B | $\ln \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ × 101 | X × 103 | A | B | $\ln \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ × 101 | X × 103 | A | B | $\ln \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ × 101 | X × 103 | A | B | $\ln \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ × 101 | |
| 10 | 3.2 | 0.1706 | 0.0658 | 0.3 | 4.0 | 0.17 | 0.065 | 0.36 | 5.1 | 0.1689 | 0.0639 | 0.46 | 6.0 | 0.168 | 0.063 | 0.54 |
| 15 | 4.2 | 0.17 | 0.0648 | 0.4 | 6.0 | 0.168 | 0.063 | 0.57 | 7.1 | 0.1669 | 0.0619 | 0.64 | 8.6 | 0.1654 | 0.0604 | 0.8 |
| 20 | 6.3 | 0.168 | 0.0627 | 0.6 | 8.2 | 0.1658 | 0.0608 | 0.8 | 10.0 | 0.1642 | 0.0592 | 0.92 | 11.3 | 0.1627 | 0.0577 | 1.1 |
| 25 | 7.3 | 0.1667 | 0.0617 | 0.7 | 9.8 | 0.1642 | 0.0592 | 0.95 | 11.8 | 0.1622 | 0.0572 | 1.14 | 13.8 | 0.1602 | 0.0552 | 1.39 |
| 30 | 9.4 | 0.1646 | 0.0596 | 0.9 | 12.1 | 0.1619 | 0.0569 | 1.17 | 14.1 | 0.1599 | 0.0549 | 1.38 | 16.8 | 0.1572 | 0.0522 | 1.62 |
| 35 | 11.0 | 0.163 | 0.058 | 1.04 | 14.0 | 0.16 | 0.055 | 1.35 | 16.9 | 0.1571 | 0.0521 | 1.6 | 19.0 | 0.155 | 0.05 | 1.9 |
| 40 | 12.0 | 0.162 | 0.057 | 1.22 | 15.8 | 0.1582 | 0.0532 | 1.6 | 18.2 | 0.1556 | 0.0508 | 1.8 | 20.3 | 0.1537 | 0.0487 | 2.17 |
Рис. 3.
Зависимости $\ln \frac{{{{B}_{{\text{0}}}}({{A}_{{\text{0}}}} - X)}}{{{{A}_{{\text{0}}}}({{B}_{{\text{0}}}} - X)}}$ от t при различных температурах; 1–4 – см. рис. 1.
При различных температурах была изучена прививка мономера ММ к макроцепи хитозана (XТЗ–NH2). Динамика взаимодействия между указанными соединениями представлена в табл. 3.
Таблица 3.
Текущие значения концентраций (1/С, л/моль) звеньев ММ и (ХТЗ–NH2) в макромолекуле хитозана в зависимости от времени ведения реакции при различных температурах; [MM]0 = [ХТЗ–NH2]0 = 8.96 × × 10‒2 моль/л, Х – концентрации гликозидных звеньев с N-замещенными группами в модифицированной макромолекуле хитозана, моль/л
| t, мин | 65°С | 70°С | 75°С | 80°С | ||||
|---|---|---|---|---|---|---|---|---|
| X × 102 | $\frac{1}{C}$ | X × 102 | $\frac{1}{C}$ | X × 102 | $\frac{1}{C}$ | X × 102 | $\frac{1}{C}$ | |
| 10 | 0.97 | 12.51 | 1.16 | 12.82 | 1.39 | 13.2 | 1.69 | 13.75 |
| 14 | 1.4 | 13.23 | 1.68 | 13.73 | 2.01 | 14.39 | 2.4 | 15.24 |
| 25 | 2.2 | 14.79 | 2.7 | 15.24 | 3.17 | 17.24 | 3.8 | 19.38 |
| 37 | 3.0 | 16.78 | 3.7 | 17.36 | 4.0 | 20.16 | 4.4 | 21.2 |
| 50 | 4.0 | 19.0 | 4.32 | 21.55 | 4.75 | 23.75 | 5.03 | 25.44 |
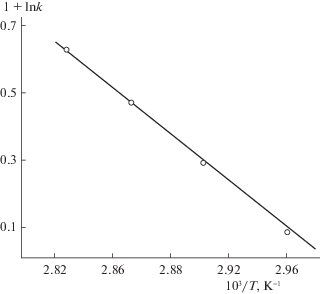
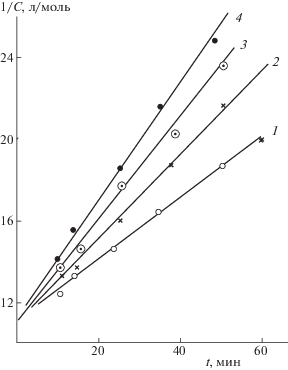
С использованием данных табл. 3, уравнения $\frac{1}{C} = \frac{1}{{{{C}_{0}}}} + kt$ для реакции второго порядка [6] и установленные зависимости $\frac{1}{C}$ от t при различных температурах (рис. 5) были определены значения констант скорости взаимодействия ММ с (XТЗ–NH2) при разных температурах (k, л моль–1 мин‒1):
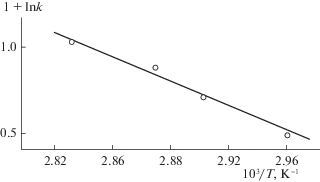
а из зависимости ln k от $\frac{1}{T}$ (рис. 6) оценена энергия активации реакции между ММ и ХТЗ–NH2, которая оказалась равной 18 ± 0.5 ккал/моль.
Таким образом, из сравнения значений для энергии активации, можно заключить, что по убыванию активности метилольных производных МАА, ММАА и ММ к прививке на (XТЗ–NH2) исследованные мономеры можно расположить в следующий ряд: ММ, ММАА, МАА.
Список литературы
Перминов П.А. Закономерности взаимодействия хитозана с глутаровым ангидридом и их использование при получении ферментсодержащих полимерных материалов: Автореф. дис. … канд. хим. наук. М.: Московский государственный текстильный университет им. А.Н. Косыгина, 2007. 16 с.
Пономарев В.С., Кожакова К.В., Шуленов И.Д. и др. // Изв. АН. Сер. хим. 2014. № 7. С. 1619.
Зубарева А.А., Овчинникова Е.В., Ильина А.В. и др. // Материалы 2-й международной школы “Наноматериалы и нанотехнологии в живых системах. Безопасность и наномедицина”. Пансионат “Заря”. Московская область. 19–24 сентября 2011 г. Тез. докладов. С. 76.
Болгoв А.А. Получение гомологов хитозана и его полимераналогичные превращения: Автореф. дис. … канд. хим. наук. М.: Московская академия тонкой химической технологии им. М.В. Ломоносова, 2009. 23 с.
Акопян Э.А., Маркарян А.А., Атарян О.С. и др. // Биол. журн. Армении. 2015. № 1. С. 45.
Эмануэль Н.М., Кнорре Д.Г. Курс химической кинетики. М.: Высшая школа, 1962. С. 168–170.
Барсегян Ж.Б. Синтез и изучение свойств новых сополимеров акриловой кислоты и акриламида: Автореф. дис. … канд. хим. наук. Ереван: НТЦ ОФХ НАН РА, 2013. 20 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии