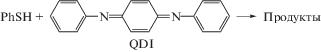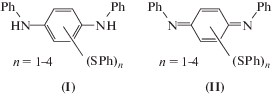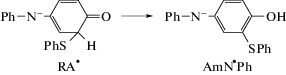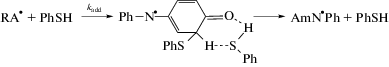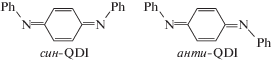Журнал физической химии, 2019, T. 93, № 4, стр. 521-528
Влияние пропанола-1 на реакцию тиофенола с N,N'-дифенил-1,4-бензохинондиимином в хлорбензоле
a Российская академия наук, Институт проблем химической физики
142432 Московской области, Черноголовка, Россия
* E-mail: varlamov@icp.ac.ru
Поступила в редакцию 11.07.2018
Аннотация
Установлено, что взаимодействие тиофенола с N,N'-дифенил-1,4-бензохинондиимином протекает по двум направлениям, одно из которых представляет собой радикально-цепную реакцию, а второе является нецепной реакцией между реагентами. Кинетические закономерности реакции существенно зависят от содержания пропанола-1 в его смеси с хлорбензолом. Показано, что при 343 K замена хлорбензола на пропанол-1 приводит к увеличению суммарной скорости реакции почти в 20 раз. Увеличение содержания пропанола-1 вызывает увеличение скорости обоих направлений реакции, но скорость нецепного направления увеличивается при этом в большей степени, чем скорость цепного направления. Вместе с этим наблюдается рост в 20−30 раз констант скорости как стадии генерирования радикалов по реакции между реагентами, так и константы скорости нецепной бимолекулярной реакции, хотя длина цепи цепной реакции при этом уменьшается. При замене хлорбензола на пропанол-1наблюдается уменьшение в 2 раза константы скорости лимитирующей стадии продолжения цепи (реакции хинондиимина с фенилтиильным радикалом), что связано с образованием H-комплексов между π-системой хинондиимина и протоном пропанола-1.
Реакции тиолов с хиноидными соединениями (хинонами и хинониминами) имеют важное значение в химии и биохимии. Протекание таких реакций приводит к превращению биологически важных тиолов (глутатиона, цистеиновых остатков белков и др.) в вещества с ковалентной C–S-связью, из которых исходные тиолы регенерироваться не могут. Это является одной из основных причин высокой токсичности хиноидных соединений [1–7].
Впервые подробное изучение реакций тиолов с хинонными соединениями в спирте и водно-спиртовых растворах было проведено в [8] на примере реакций с участием 1,4-бензохинона и его производных. На основании данных о составе и выходе продуктов было сделано заключение о том, что указанные реакции протекают по двум направлениям, а именно: a) окислительно-восстановительное превращение хинона в гидрохинон, а тиола – в дисульфид и b) путем присоединения тиола к кольцу хинона, при этом направление b) является преимущественным. Впоследствии для направления b) был принят механизм нуклеофильного 1,4-присоединения тиола к циклогексадиеновому кольцу хинона или хинонимина [9–12].
Кинетика реакций хиноидных соединений с тиолами изучена слабо, до последнего времени имелись только отдельные работы [13, 14]. Подробные исследования в этой области начались лишь недавно на примере реакций с участием хинониминов [15–19]. Были подтверждены литературные данные о том, что указанные реакции с самого начала протекают по двум направлениям. Большой неожиданностью явилось доказательство радикально-цепного механизма одного из направлений реакции, что ранее было неизвестно. Надо заметить, что образование радикалов по ходу реакций хиноидных соединений с тиолами отмечались и ранее (см., например, [20, 21]), однако эти наблюдения не привлекали внимания, и цепной механизм реакции не рассматривался.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучение показало, что скорость и состав продуктов реакции зависят от природы растворителя. Так, скорость реакции тиофенола с N,N'-дифенил-1,4-бензохинондиимином увеличивается почти на порядок при замене хлорбензола на пропанол-1 [19]. Из этих данных следовало, что кинетические закономерности реакции в бинарных растворителях хлорбензол + пропанол-1 можно использовать для получения дополнительной информации о механизмах обоих направлений реакции. Учитывая большое практическое значение реакций, в настоящей работе мы решили более подробно рассмотреть этот вопрос.
С этой целью мы проанализировали результаты изучения реакции тиофенола C6H5–SH PhSH с N,N'-дифенил-1,4-бензохинондиимином (C6H5–N=C6H4=N–C6H5) QDI в смешанных растворителях хлорбензол PhCl + пропанол-1 PrOH [17–19]. Изучение проводилось при T = 343 K, барботаж аргона, кинетические закономерности изучались по начальным скоростям расходования хинондиимина wQDI.
Необходимые для дальнейшего плотности d и относительные диэлектрические проницаемости ε хлорбензола и пропанола-1 представлены ниже [22]:
(1)
$\varepsilon ({\text{343}}\;{\text{K}}) = \varepsilon ({\text{298}}\;{\text{K}}) + {\text{45}}(\partial \varepsilon {\text{/}}\partial T),$(2)
$\varepsilon = {{v}_{{{\text{PhCl}}}}}{{\varepsilon }_{{{\text{PhCl}}}}} + {{v}_{{{\text{PrOH}}}}}{{\varepsilon }_{{{\text{PrOH}}}}},$Таблица 1.
Константы скорости стадий (I), (Iнц), (II), параметр k2/(2k4)1/2 [19] и рассчитанные по формулам (1) и (2) диэлектрические постоянные бинарных растворителей PhCl + PrOH в зависимости от мольной доли PrOH в смеси NPrOH. T = 343 K, барботаж аргона
| NPrOH | k1 | k1нц | $\frac{{{{k}_{2}}}}{{{{{(2k_{4}^{{}})}}^{{1/2}}}}}$ | k2 × 10–6, * | ε(298 K) | ε(343 K) |
|---|---|---|---|---|---|---|
| л моль–1 с–1 | (л моль–1 с–1)1/2 | л моль–1 с–1 | ||||
| 0 | 0.0084 ± 0.0015 | 0.25 ± 0.04 | 10.8 ± 0.3 | 1.2 | 5.62 | 4.89 |
| 0.106 | 0.021 ± 0.0063 | 0.50 ± 0.06 | 9.54 | 1.05 | 6.78 | 5.82 |
| 0.194 | 0.0414 ± 0.019 | 0.96 ± 0.42 | 8.0 ± 0.13 | 0.88 | 7.79 | 6.60 |
| 0.803 | 0.196 ± 0.081 | 3.2 ± 1.5 | 6.87 ± 0.13 | 0.75 | 16.5 | 12.0 |
| 1 | 0.196 ± 0.072 | 4.8 ± 1.0 | 5.6 ± 0.65 | 0.61 | 20.1 | 13.7 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Реакция PhSH с QDI протекает по уравнению
Продуктами являются фенилтиозамещенные по центральному кольцу N,N'-дифенил-1,4-фенилендиамины (I), фенилтиозамещенные хинондиимины (II) (схема 1), а также N,N'-дифенил-1,4-фенилендиамин H2QDI и дифенилдисульфид PhSSPh [8–10, 23, 24]. Раньше других образуются соединения I, которые затем под действием исходного диимина QDI и/или других окислителей превращаются в соответствующие тиозамещенные хинондиимины II. На начальных стадиях в условиях [PhSH] > [QDI] реакция не продвигается дальше стадии образования монотиозамещенного N,N'-дифенил-1,4-фенилендиамина I, n = 1.
Ниже представлена кинетическая схема реакции на неглубоких стадиях [16, 17]:
нецепная реакция
(i)
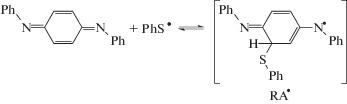
${\text{TPH}} \to {\text{P}}{{{\text{h}}}_{{\text{2}}}}{{{\text{N}}}^{ \bullet }}\;\xrightarrow{{ + {\text{PhSH}}}}\;{\text{Ph}}{{{\text{S}}}^{ \bullet }},\quad {{k}_{{\text{i}}}}$(I)
$\begin{gathered} {\text{QDI}} + {\text{PhSH}} \to {\text{HQD}}{{{\text{I}}}^{ \bullet }} + {\text{Ph}}{{{\text{S}}}^{ \bullet }},\quad {{k}_{1}} \hfill \\ {\text{HQD}}{{{\text{I}}}^{ \bullet }} + {\text{PhSH}} \to {{{\text{H}}}_{2}}{\text{QDI}} + {\text{Ph}}{{{\text{S}}}^{ \bullet }}, \hfill \\ \end{gathered} $(II)
${\text{Ph}}{{{\text{S}}}^{ \bullet }} + {\text{QDI}} \leftrightarrow {\text{R}}{{{\text{A}}}^{ \bullet }} \to {\text{Am}}{{{\text{N}}}^{ \bullet }}{\text{Ph}},\quad {{k}_{2}}$(III)
${\text{Am}}{{{\text{N}}}^{ \bullet }}{\text{Ph}} + {\text{PhSH}} \to ({\text{I}},\;n = 1) + {\text{Ph}}{{{\text{S}}}^{ \bullet }},\quad {{k}_{3}}$(IV)
${\text{Ph}}{{{\text{S}}}^{ \bullet }} + {\text{Ph}}{{{\text{S}}}^{ \bullet }} \to {\text{PhSSPh}}.\quad {{k}_{4}}$Согласно схеме, в отсутствие инициатора образование первичных фенилтиильного C6H5${{{\text{S}}}^{ \bullet }}$ (Ph${{{\text{S}}}^{ \bullet }}$) и 4-анилинодифениламинильного C6H5–${{{\text{N}}}^{ \bullet }}$–C6H4–NH–C6H5 (HQD${{{\text{I}}}^{ \bullet }}$) радикалов идет по бимолекулярной реакции (I) между QDI и PhSH. Радикалы HQD${{{\text{I}}}^{ \bullet }}$ затем по реакции с PhSH быстро заменяются на радикалы Ph${{{\text{S}}}^{ \bullet }}$, которые являются одним из двух сортов радикалов, ведущих цепь суммарной цепной реакции. Радикалы Ph${{{\text{S}}}^{ \bullet }}$ продолжают цепь, участвуя в сложной реакции (II), включающей в себя стадию образования нестабильного радикального аддукта R${{{\text{A}}}^{ \bullet }}$
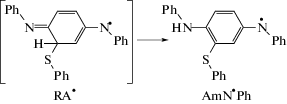
Обратимая реакция (a, f) ассоциации и фрагментации аддукта R${{{\text{A}}}^{ \bullet }}$ введена в механизм по аналогии с известной в литературе обратимой реакцией аддуктообразования между тиильными радикалами и ненасыщенными углеводородами [26–29]. В представленном механизме (см. схему 1) принято допущение о том, что радикальный аддукт R${{{\text{A}}}^{ \bullet }}$ может не только дефрагментироваться на исходные реагенты, но и изомеризоваться в тиозамещенный диариламинильный радикал Am${{{\text{N}}}^{ \bullet }}$Ph который играет роль второго сорта радикалов, ведущих цепь на стадии (III).
Реакция (iso) специально рассматривалась методами квантовой химии [30]. Было установлено, что вследствие высокой энергии активации эта реакция практически не идет путем внутримолекулярного переноса высокоподвижного атома Н связи С–Н кольца к атомам азота QDI (или к атомам O и N в случае реакции PhSH с N-фенил-1,4-бензохинонмоноимином (C6H5-N=C6H4=O), QMI). Например, энергия активации мономолекулярной изомеризации аддукта, образующегося при “прилипании” радикала
Ph${{{\text{S}}}^{ \bullet }}$ к QMI составляет ~200 кДж/моль, что даже больше прочности разрывающейся по ходу реакции связи С–Н (~160 кДж/моль) [30]. Для реакции (iso) был предложен альтернативный бимолекулярный механизм с участием тиола, встраивающегося в четырехчленное переходное состояние, расширяя его до шестичленного, выгодного для протекания реакции. По завершении реакции тиол регенерируется, т.е. он выступает в качестве катализатора цепной реакции на сложной стадии (II) продолжения цепи:
Экспериментальные данные свидетельствуют о том, что реакция (II) является лимитирующей стадией продолжения цепи [16, 17]. Вид выражения для скорости этой стадии (т.е. скорости wAmNPh образования Am${{{\text{N}}}^{ \bullet }}$Ph) зависит от соотношения констант скорости реакций ассоциации ka, фрагментации kf и изомеризации kadd радикального аддукта R${{{\text{A}}}^{ \bullet }}$. Если kadd[PhSH] $ \gg $ kf, то
(3а)
$\begin{gathered} {{w}_{{\text{2}}}} = {{k}_{{\text{2}}}}[{\text{QDI}}][{\text{Ph}}{{{\text{S}}}^{ \bullet }}] = {{w}_{{{\text{AmNPh}}}}} = \\ = \;{{k}_{{{\text{add}}}}}[{\text{PhSH}}][{\text{R}}{{{\text{A}}}^{ \bullet }}] = {{k}_{{\text{a}}}}[{\text{QDI}}][{\text{Ph}}{{{\text{S}}}^{\centerdot }}] \\ {\text{и }}\quad {{k}_{{\text{2}}}} = {{k}_{{\text{a}}}}. \\ \end{gathered} $откуда
(3b)
$\begin{gathered} {{w}_{{\text{2}}}} = {{k}_{{\text{2}}}}[{\text{QDI}}][{\text{Ph}}{{{\text{S}}}^{ \bullet }}] = {{w}_{{{\text{AmNPh}}}}} = \\ = {{k}_{{{\text{add}}}}}[{\text{PhSH}}][{\text{R}}{{{\text{A}}}^{ \bullet }}] = \\ = \;\left( {{{k}_{{{\text{add}}}}}{{k}_{{\text{a}}}}{\text{/}}{{k}_{{\text{f}}}}} \right)\left[ {{\text{PhSH}}} \right]\left[ {{\text{QDI}}} \right][{\text{Ph}}{{{\text{S}}}^{ \bullet }}], \\ {\text{и }}\quad {{k}_{{\text{2}}}} = \left( {{{k}_{{{\text{add}}}}}{{k}_{{\text{a}}}}{\text{/}}{{k}_{{\text{f}}}}} \right)\left[ {{\text{PhSH}}} \right]. \\ \end{gathered} $Эксперимент показывает, что главный параметр цепной реакции QDI с PhSH ${{k}_{2}}{\text{/}}k_{4}^{{1/2}}$(см. ниже) не зависит от концентрации PhSH [17–19]. Это указывает на то, что при протекании реакции выполняется соотношение (3a), т.е. что неравенство kadd[PhSH] $ \gg $ kf соблюдается даже при самых малых экспериментальных концентрациях PhSH. В этом случае можно ожидать, что значение k2, определенное по кинетическим закономерностям цепной реакции QDI с PhSH, совпадает со значением ka, т.е. константы скорости “прилипания” радикала PhS$^{ \bullet }$ к двойной С = С-связи циклогексадиенового кольца хинондиимина QDI. Получим оценку k2 из значений ${{k}_{2}}{\text{/}}k_{4}^{{1/2}}$ в табл. 1. Полагая, что константа скорости рекомбинации фенилтиильных радикалов PhS$^{ \bullet }$ близка к диффузионному пределу k4 = 6 × 109 л моль–1 с–1 [31, 32], получим k2 = 1.2 × 106 л моль–1 с–1 в хлорбензоле. Полученная оценка лежит в диапазоне экспериментально измеренных констант скорости реакций присоединения PhS$^{ \bullet }$ к олефинам разного строения в разных растворителях [32]. При допущении, что k4 не зависит от содержания пропанола-111, были получены значения k2 в смешанных растворителях хлорбензол + пропанол-1, которые представлены в табл. 1. Видно, что значение k2 уменьшается в 2 раза при замене растворителя с хлорбензола на пропанол-1.
Обсудим возможные причины уменьшения k2. В принципе, можно ожидать двойственное влияние пропанола-1 на k2. По-видимому, пропанол-1 может каталитически ускорять стадию изомеризации радикального аддукта RA$^{ \bullet }$ в радикал AmN$^{ \bullet }$Ph, аналогично рассмотренному выше тиофенолу PhSH [30]. Однако, ощутимого влияния пропанола-1 на скорость реакции ожидать не следует, даже несмотря на гораздо более высокую концентрацию спирта по сравнению с PhSH. Это следует из сделанного выше замечания о том, что PhSH уже при самые малых экспериментальных концентрациях очень эффективно катализирует изомеризацию RA$^{ \bullet }$ в AmN$^{ \bullet }$Ph, т.е. что выполняется неравенство kadd[PhSH] $ \gg $ kf.
Противоположное тормозящее действие пропанола-1 на стадию (II) можно ожидать вследствие комплексообразования хинонимина с пропанолом-1. Хинонимины образуют комплексы как с хлорбензолом, так и с пропанолом-1, при этом комплексы с пропанолом-1 гораздо прочнее [34]. Комплексообразование, в основном, обусловлено образованием Н-комплексов, при этом в качестве акцепторов протонов в хинониминах выступают как их гетероатомы (атомы N – в QDI а также атомы N и O – в QMI), так и π-электронные системы. Энтальпии образования ΔH водородосвязанных комплексов хинониминов с пропанолом-1, в которых акцепторами протонов являются гетероатомы хинониминов, были определены в [34] методами квантовой химии, а также в рамках аддитивно-мультипликативной модели водородной связи [35]. Для обоих хинониминов получены довольно высокие и близкие друг к другу значения: ΔH = –23 кДж моль–1.
При обсуждении влияния пропанола-1 на k2 гораздо больший интерес представляют, очевидно, термодинамические характеристики Н-комплексов, образующихся при взаимодействии протона спирта с π-электронными системами хинониминов – реакционными центрами реакции. Эти данные в [34] не представлены, поэтому мы вычислили энтальпию образования ΔH таких комплексов в настоящей работе, также используя для этого аддитивно-мультипликативную модель [35]. Эта модель позволяет вычислять энтальпию H-комплексообразования двух частиц с одним водородным мостиком при следующих стандартных условиях: 1) состав комплекса 1 : 1, 2) температура 298 К, 3) растворитель CCl4. Расчет ΔH ведется по формуле
На основании этих значений Ea и Ed получаем
Как видим, реакция образования π-комплексов является слабо экзотермической. Несмотря на оценочный характер полученной величины ΔH, эти данные показывают, что эта реакция действительно может внести определенный вклад в процессы в системе. Комплексообразование с пропанолом-1 приведет к блокировке π-систем хинониминов, т.е. к снижению их эффективных концентраций, являющихся реакционными центрами в реакции (2) “прилипания” радикалов PhS$^{ \bullet }$ к циклогексадиеновому кольцу хинонимина. Следствием указанного π-комплексообразования может стать уменьшение k2 при замене растворителя с хлорбензола на пропанол-1. Данные в табл. 1 согласуются с таким заключением.
Альтернативную интерпретацию влияния пропанола-1 на k2 можно получить также в рамках электростатических моделей неспецифической сольватации. Используя данные в табл. 1, мы построили зависимость lg k2 от функции Кирквуда (ε – 1)/(2ε + 1), см. рисунок 1.
(4)
$\begin{gathered} \lg {{k}_{2}} = \lg {{k}_{{2(0)}}} - \\ - \;\frac{1}{{2.303kT}}\frac{{\varepsilon - 1}}{{{\text{2}}\varepsilon + {\text{1}}}}\left( {\frac{{\mu _{{{\text{Ph}}{{{\text{S}}}^{ \bullet }}}}^{{\text{2}}}}}{{r_{{{\text{Ph}}{{{\text{S}}}^{ \bullet }}}}^{{\text{3}}}}} + \frac{{\mu _{{{\text{QDI}}}}^{{\text{2}}}}}{{r_{{{\text{QDI}}}}^{{\text{3}}}}} - \frac{{\mu _{ \ne }^{{\text{2}}}}}{{r_{ \ne }^{{\text{3}}}}}} \right), \\ \end{gathered} $Рис. 1.
Зависимость lg k2 от функции (ε – 1)/(2ε + 1) бинарного растворителя хлорбензол + пропанол-1; температура 343 K.
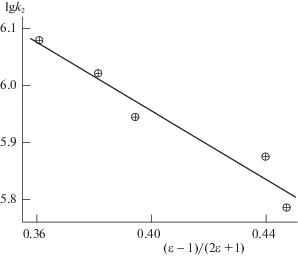
Как можно было ожидать, прямая имеет небольшой наклон, что характерно для радикальных реакций. Отрицательное значение тангенса угла наклона свидетельствует о том, что активированный комплекс менее полярен по сравнению с суммарной полярностью реагентов. Получение дополнительной информации наталкивается, однако, на затруднения, которые в значительной мере связаны с тем, что хинондиимин QDI существует в двух своих формах: син- и анти-, сильно различающихся по своим свойствам (в газовой фазе μсин- = 2.11 D, μанти- = 0 D [30]). В растворах обе формы присутствуют в соизмеримых концентрациях, но их абсолютные величины неизвестны
Обсудим влияние растворителя на скорости реакции по каждому направлению и на состав продуктов. Из кинетической схемы реакции получается следующее выражение для суммарной скорости реакции wQDI
(5)
$\begin{gathered} {{w}_{{{\text{QDI}}}}} = ({{k}_{1}} + {{k}_{{{\text{н ц }}}}})[{\text{QDI}}][{\text{PhSH}}]{\text{ }} + \\ + \;\frac{{{{k}_{2}}}}{{k_{4}^{{1/2}}}}[{\text{QDI}}]{{\left\{ {0.5{{w}_{{\text{i}}}} + {{k}_{{\text{1}}}}{\text{[QDI][PhSH]}}} \right\}}^{{1/2}}}, \\ \end{gathered} $В табл. 1 представлены усредненные значения k1 и k1нц, полученные в [19] из обработки по уравнению (5) результатов опытов как без инициатора, так и в его присутствии. Таблица 1 показывает, что при переходе от хлорбензола к пропанолу-1 значения k1 и k1нц увеличиваются почти в равной мере, приблизительно в 20 раз, при этом абсолютные значения k1 в 20−30 раз меньше соответствующих значений k1нц независимо от состава смешанного растворителя.
Используя константы скорости реакций из табл. 1, мы рассчитали скорости суммарной реакции wQDI и обоих ее направлений (нецепного wнц и цепного wц) при нескольких концентрациях реагентов [QDI]0 и [PhSH]0 из диапазона варьирования их значений в реальных экспериментах. Полученные результаты представлены в табл. 2. Здесь же для сравнения приведены экспериментальные данные для опытов при [QDI]0 = 8.6 × 10–5 и [PhSH]0 = 2.75 × 10–3 моль л–1.
Таблица 2.
Кинетические параметры реакции QDI с PhSH в зависимости от мольной доли пропанола-1 NPrOH в бинарных растворителях PhCl+PrOH, а также экспериментальные скорости реакции (значения в скобках) при [QDI]0 = 8.6 × 10–5 и [PhSH]0 = 2.75 × 10–3 моль л–1 [19]; T = 343 ± 0.2 K, барботаж аргона
| [QDI] × 104 | [PhSH] × 104 | wi(0) × 109 | wQDI × 108 | wнц × 108 | wц × 108 | wц/wQDI | Длина цепи |
|---|---|---|---|---|---|---|---|
| моль л–1 | моль л–1 с–1 | ||||||
| NPrOH = 0 | |||||||
| 1 | 1 | 0.168 | 1.66 | 0.252 | 1.41 | 0.848 | 83.3 |
| 3 | 1 | 0.504 | 8.05 | 0.756 | 7.30 | 0.906 | 144.3 |
| 1 | 5 | 0.84 | 4.43 | 1.26 | 3.17 | 0.716 | 37.3 |
| 3 | 5 | 2.52 | 20.2 | 3.78 | 16.4 | 0.813 | 64.5 |
| 0.86 | 27.5 | 3.97 | 12.0 | 5.96 | 6.05 | 0.504 | 14.7 |
| 0.86 | 27.5 | (13.7) | |||||
| NPrOH = 0.194 | |||||||
| 1 | 1 | 0.828 | 3.30 | 0.96 | 2.34 | 0.709 | 27.8 |
| 3 | 1 | 2.48 | 15.0 | 2.88 | 12.1 | 0.808 | 48.2 |
| 1 | 5 | 4.14 | 10.2 | 4.80 | 5.35 | 0.527 | 12.4 |
| 3 | 5 | 12.4 | 41.8 | 14.4 | 27.4 | 0.655 | 21.5 |
| 0.86 | 27.5 | 19.6 | 33.3 | 22.7 | 10.6 | 0.318 | 4.9 |
| 0.86 | 27.5 | (23.7) | |||||
| NPrOH = 0.803 | |||||||
| 1 | 1 | 3.93 | 7.70 | 3.20 | 4.50 | 0.585 | 11.0 |
| 3 | 1 | 11.8 | 32.6 | 9.6 | 23.0 | 0.705 | 19.0 |
| 1 | 5 | 19.7 | 26.6 | 16.0 | 10.6 | 0.399 | 4.9 |
| 3 | 5 | 58.9 | 101.0 | 48.0 | 53.0 | 0.525 | 8.5 |
| 0.86 | 27.5 | 92.9 | 98.3 | 75.7 | 22.7 | 0.230 | 1.9 |
| 0.86 | 27.5 | (124.5) | |||||
| NPrOH = 1 | |||||||
| 1 | 1 | 3.93 | 8.51 | 4.8 | 3.71 | 0.436 | 8.9 |
| 3 | 1 | 11.8 | 33.2 | 14.4 | 18.8 | 0.567 | 15.5 |
| 1 | 5 | 19.6 | 32.8 | 24.0 | 8.83 | 0.269 | 4.0 |
| 3 | 5 | 58.9 | 115.7 | 72.0 | 43.7 | 0.378 | 6.9 |
| 0.86 | 27.5 | 92.8 | 132.8 | 113.5 | 19.3 | 0.145 | 1.6 |
| 0.86 | 27.5 | (180.9) | |||||
Из табл. 2 видно, что скорость обоих направлений реакции увеличивается при увеличении NPrOH, причем скорость нецепного направления wнц растет быстрее, чем скорость цепного направления wц. Об этом же свидетельствуют результаты расчета отношения скорости цепного направления к скорости суммарной реакции wц/wQDI, см. табл. 2. Очевидно, что следствием уменьшения отношения wц/wQDI с ростом NPrOH является увеличение выхода продуктов нецепной реакции при замене растворителя с хлорбензола на пропанол-1. Кроме того, из данных табл. 2 следует, что такая замена растворителя сопровождается уменьшением длины цепи ν цепной реакции. Это означает, что при замене хлорбензола на пропанол-1 будет наблюдаться увеличение выхода продуктов, образующихся на стадиях инициирования и обрыва цепей, т.е. H2QDI и PhSSPh. Сделанные замечания согласуются с немногочисленными литературными данными, полученными, однако, при относительно больших глубинах превращения. Так, в работе [12] обнаружено значительное влияние природы растворителя на состав продуктов реакции QMI с тиолами.
Данные в табл. 2 и табл. 1 не находятся в кажущемся противоречии друг с другом. Действительно, при увеличении NPrOH значения k1 и k1нц в табл. 1 увеличиваются пропорционально друг другу. В то же время, из табл. 2 следует, что скорость нецепного направления wнц при этом растет быстрее, чем скорость цепного направления wц. В действительности такое “противоречие” объясняется уменьшением длины цепи ν цепной реакции с ростом NPrOH, см. последний столбец табл. 2.
Рассмотрим более подробно выражение для длины цепи ν. Для этого из уравнения (5) получим выражение для скорости цепной реакции wц = wQDI – wнц = wQDI – k1нц[QDI][PhSH] и разделим его на скорость зарождения цепей в неинициированной реакции wi(0) = 2k1[QDI][PhSH]:
(6)
$\begin{gathered} \nu = \frac{{{{w}_{{\text{ц }}}}}}{{{{w}_{{{\text{i(0)}}}}}}} = \frac{{{{w}_{{{\text{QDI}}}}} - {{w}_{{{\text{н ц }}}}}}}{{{\text{2}}{{k}_{1}}{\text{[QDI][PhSH]}}}} = \\ = \;0.5 + {\text{ }}\frac{{{{k}_{2}}}}{{2k_{4}^{{1/2}}k_{1}^{{1/2}}}}{{\left( {\frac{{[{\text{QDI}}]}}{{{\text{[PhSH]}}}}} \right)}^{{1/2}}}. \\ \end{gathered} $Первое слагаемое 0.5 в правой части (5) учитывает расходование QDI в реакции (I) радикалообразования, и при не очень коротких цепях этим слагаемым можно пренебречь.
Из (6) видно, что второй член в правой части при одном и том же отношении концентраций QDI и PhSH зависит от сомножителя k2/2(k4k1)1/2. Табл. 1 показывает, что параметр k2/(2k4)1/2 при переходе от хлорбензола к пропанолу-1 уменьшается всего в 2 раза, что недостаточно для объяснения довольно значительного уменьшения длины цепи при увеличении NPrOH. Более сильное влияние на ν оказывает, таким образом, рост k1, т.е. увеличение скорости инициирования с ростом NPrOH (почти 20 раз при переходе от хлорбензола к пропанолу-1, см. табл. 1), так как длина цепи обратно пропорциональна $k_{1}^{{1/2}}$.
На основании данных в табл. 2 можно сделать вывод о том, что состав продуктов на начальных стадиях реакции зависит не только от природы растворителя, но также и от соотношения концентраций исходных реагентов. Чтобы установить влияние концентраций QDI и PhSH на состав продуктов, получим из (5) выражение для wц/wQDI. Для упрощения пренебрежем k1 по сравнению с kнц в первом слагаемом в правой части (5), и тогда для неинициированной реакции (wi = 0) получим
(7)
$\frac{{{{w}_{{\text{ц }}}}}}{{{{w}_{{{\text{QDI}}}}}}} = {{\left[ {1 + \frac{{{{k}_{{{\text{1н ц }}}}}k_{4}^{{1/2}}}}{{k_{1}^{{1/2}}{{k}_{2}}}}{{{\left( {\frac{{[{\text{PhSH}}]}}{{[{\text{QDI}}]}}} \right)}}^{{1/2}}}} \right]}^{{ - 1}}}.$Как видим из (7), выход продуктов цепной реакции увеличивается с ростом концентрации QDI и уменьшается с ростом концентрации PhSH.
Итак, представленные выше результаты показывают, что закономерности двунаправленной реакции PhSH с QDI существенно зависят от содержания пропанола-1 в его смеси с хлорбензолом. При 343 K замена хлорбензола на пропанол-1 приводит к увеличению суммарной скорости реакции более чем на порядок, при этом скорость нецепного направления увеличивается в большей степени, чем скорость цепного направления. При увеличении содержания пропанола-1 уменьшается длина цепи цепной реакции, а это влияет на состав продуктов реакции PhSH с QDI. Замена хлорбензола на пропанол-1 вызывает уменьшение в 2 раза константы скорости лимитирующей стадии продолжения цепи (реакции хинондиимина с фенилтиильным радикалом), что можно удовлетворительно объяснить образованием H-комплексов между π-системой хинондиимина и протоном пропанола-1.
Работа выполнена при финансовой поддержке РАН.
Список литературы
O’Brien P.J. // Chem.-Biol. Interactions. 1991. V. 80. P. 1–41.
Monks T.J., Hanzlik R.P., Cohen G.M. et al. // Toxicology and Appl. Pharmacol. 1992. V. 112. P. 2.
Wlodek L. // Pol. J. Pharmacol. 2002. V. 54. P. 215.
Kumagai Y. // J. of Health Science. 2009. V. 55. № 6. P. 887.
Dahlin D.C., Miwa G.T., Lu A.Y., Nelson S.D. // Proc. Nat. Acad. Sci. USA. 1984. V. 81. P. 1327.
Cohen S.D., Khairallah E.A. // Drug. Metabol. Rev. 1997. V. 29. P. 59.
Li W.-W., Heinze J., Haehnel W. // J. Am. Chem. Soc. 2005. V. 127. № 17. P. 6140.
Snell J.M., Weissberger A. // J. Amer. Chem. Soc. 1939. V. 61. P. 450.
The Chemistry of the Quinoid Compounds. Ed. S. Patai. Vol. 1. Part 1–2. John Wiley and Sons, 1974, London-New York-Sydney-Toronto. 1247 p.
The Chemistry of the Quinoid Compounds. Ed. S. Patai, Z. Ruppoport. Vol. 2. Part 1–2. John Wiley and Sons, 1988. Chichester, New York, Brisbane, Toronto, Singapore. 1675 p.
Кутырев А.А., Москва В.В. // Успехи химии. 1991. Т. 60. С. 134.
Афанасьева Г.Б., Цой Е.В., Чупахин О.Н., Сидоров Е.О., Коновалов С.В. // Журн. орг. химии. 1985. Т. 21. С. 1926.
Vadnere M.K., Maggiora L., Mertes M.P. // J. Med. Chem. 1986. V. 29. P. 1714.
Lu S., Li W.W., Rotem D., Mikhailova E., Bayley H. // Nature Chemistry. 2010. V. 2. P. 921.
Гадомская А.В., Варламов В.Т. // Докл. АН. 2011. Т. 439. С. 767.
Гадомская А.В., Гадомский С.Я., Варламов В.Т. // Кинетика и катализ. 2012. Т. 53. С. 550.
Варламов В.Т., Гадомская А.В. // Журн. физ. химии. 2015. Т. 89. С. 10. DOI 7868/S0044453715040299
Варламов В.Т., Гадомский С.Я., Гадомская А.В. // Кинетика и катализ. 2015. Т. 56. С. 277. DOI 10.1134/S0023158415030222
Варламов В.Т., Гадомская А.В. // Изв. АН. Сер. хим. 2016. № 8. С. 2046. DOI 10.1007/s11172-016-1550-5
Takahashi N., Schreiber J., Fisher V., Mason R.P. // Arch. Biochem. Bbiophys. 1987. V. 252. № 1. P. 41.
Butler J., Hoey B.M. // Free Rad. Biol. Med. 1992. V. 12. P. 337.
Фиалков Ю.Я. Растворитель как средство управления химическим процессом. Л., Химия, 1990. 240 с.
Maender O.W., Rostek C.J., Katritzky A.R., Odens H.H., Voronkov M.V., US Pat. 7 718 722 (from 18.05.2010). www.archpatent.com/patents/7718722.
Gelling I.R., Knight G.T. // Plastics and Rubber: Processing September. 1977. P. 83.
Денисов Е.Т., Варламов В.Т. // Кинетика и катализ. 1997. Т. 38. С. 36.
Walling C., Helmreich W. // J. Am. Chem. Soc. 1959. V. 81. P. 1144.
Griesbaum K. // Angew. Chem. Int. Ed. 1970. V. 9. P. 273.
Chatgilialoglu Ch., Altieri A., Fischer H. // J. Am. Chem. Soc. 2002. V. 124. P. 12816.
Türün O., Meier M.A.R. // Eur. J. Lipid Sci. Techn. 2013. V. 115. P. 41.
Варламов В.Т., Крисюк Б.Э. // Изв. АН. Сер. хим. 2016. № 2. С. 401. DOI 10.1007/s11172-016-1312-4
Ito O., Nogami K., Matsuda M. // J. Phys. Chem. 1981. V. 85. P. 1365.
Ito O. Reactions of Aromatic Thiyl Radicals. In: The Chemistry of Free Radicals. S-Centered Radicals. Ed. by Z.B. Alfassi. Chichester; New York; Weinheim; Brisbane; Singapore; Toronto: John Wiley & Sons, 1999. Ch. 6.
Chatgilialoglu C., Asmus K.-D. // Sulfur-Centered Reactive Intermediates in Chemistry and Biology. NATO ASI Series A: Life and Science. New York: Plenum Press. 1990. V. 197. P. 327.
Варламов В.Т., Крисюк Б.Э., Григорьев В.Ю. // Изв. АН. Сер. хим. № 10. С. 851. DOI 10.1007/s11172-018-2298-x
Raevsky O.A., Grigor’ev V.Yu., Kireev D.B., Zefirov N.S. // Quant. Struct.-Act. Relat. 1992. V. 11. P. 49.
Раевский О.А., Григорьев В.Ю., Трепалин С.В. Свидетельство об официальной регистрации программы для ЭВМ HYBOT (Hydrogen Bond Thermodynamics) № 990090 от 26 февраля 1999 г., Москва, Федеральная служба по интеллектуальной собственности, патентам и товарным знакам.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии