Журнал физической химии, 2019, T. 93, № 4, стр. 497-502
Фазовые равновесные состояния в системах дифенилоксид–н-гептадекан и дифенил–дифенилоксид–н-гептадекан
И. Г. Яковлев a, *, И. К. Гаркушин a, А. В. Колядо a
a Самарский государственный технический университет
443100 Самара, Россия
* E-mail: yakovlev.ivan.g@gmail.com
Поступила в редакцию 19.09.2017
Аннотация
Проведен расчет точек нонвариантных равновесий в системах дифенилоксид–н-гептадекан и дифенил–дифенилоксид–н-гептадекан методом Шредера–Ле Шателье. По данным расчета было проведено планирование эксперимента и исследование двойной и тройной систем методом ДСК. Определены температуры плавления и составы двойной и тройной эвтектик. Проведено сравнение расчетных и экспериментальных данных. Измерены плотность и температура вспышки в открытом тигле.
Условия проведения некоторых высокотемпературных процессов на химических, нефтехимических и других производствах обуславливают невозможность применения прямого нагрева реакционных аппаратов и сопутствующего оборудования. В таком случае для достижения необходимых температур используют высококипящие теплоносители. В роли таких теплоносителей могут выступать индивидуальные органические вещества и их смеси. Для поддержания температуры в диапазоне от 373 до 673 К применяют высококипящие органические соединения, такие как дифенил, дифениловый эфир, нафталин, тетрахлордифенил (арохлор 1428), кремнийорганические соединения, глицерин и др., обладающие низким давлением насыщенных паров [1]. Индивидуальные органические соединения имеют высокие температуры плавления, что приводит к серьезным затруднениям при использовании их в качестве однокомпонентного теплоносителя из-за возможной кристаллизации в теплопередающих контурах химической аппаратуры, что особенно актуально в условиях холодного климата. В связи с этим необходимо предусматривать дополнительный обогрев коммуникаций и аппаратуры. Одним из способов решения проблемы кристаллизации теплоносителя в теплопередающих контурах является применение в качестве теплоносителя двух- и трехкомпонентных смесей органических веществ, обладающих более низкой температурой плавления, чем компоненты, входящие в их состав. На данный момент практическое применение в промышленности нашел двухкомпонентный теплоноситель Даутерм А с температурой плавления около 285.45 К (12.3°С) и плотностью при 298.15 К равной 1056 кг/м3. Даутерм А представляет собой эвтектический сплав, содержащий 26.5 мас. % дифенила и 73.5 мас. % дифенилоксида (дифениловый эфир) [2].
В настоящее время исследование новых эффективных теплоносителей с более низкой температурой плавления является важной задачей. Введение в теплоноситель Даутерм А третьего компонента, например н-алкана, позволит снизить температуру плавления и плотность.
Анализ открытых источников информации выявил отсутствие данных по экспериментальным исследованиям системы дифенилоксид–н-гептадекан. Для возможности расчета и дальнейшего изучения трехкомпонентной системы дифенил–дифенилоксид–н-гептадекан была изучена система дифенилоксид–н-гептадекан и в данной работе приведена экспериментальная фазовая диаграмма.
Кроме температуры плавления и составов эвтектических сплавов для эвтектик изученных систем были исследованы: плотность, энтальпия плавления, температура кипения и температура вспышки в открытом тигле. На основе полученных значений энтальпии плавления была рассчитана энтропия плавления эвтектик.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальные исследования проводили с использованием установки на базе среднетемпературного дифференциального сканирующего калориметра теплового потока [3], термостатирование холодных спаев осуществляли с помощью ультратермостата U-10. Точность измерения температуры составляла ±0.25 К, в качестве охлаждающего агента использовали сухой лед. Исследования проводили в диапазоне температур от 233.15 до 343.15 К. Скорость нагрева образцов составляла 4 К/мин. Для исследования использовали образцы массой от 10 до 15 мг. Калибровали установку по реперным веществам [4]. Содержание основного вещества в применяемых реактивах составляло не менее 99 мас. %.
Температуру вспышки определяли в открытом тигле на аппарате ТВО. Температуру измеряли с помощью термометра ТЛ-2 с ценой деления 1 К [5].
Плотность эвтектического состава при 298.15 К определяли пикнометрическим методом в соответствии с требованиями государственного стандарта [6].
Температуру кипения определяли для сплава эвтектического состава, нагревая колбу и регистрируя температуру с помощью термометра с ценой деления 0.5 К.
Для исследования использовали н-гептадекан [н-С17Н36] CAS 629-78-7 с содержанием основного вещества 99.0 мас. %, дифениловый эфир [(Ph)2O] CAS 101-84-8 с содержанием основного вещества 99.0 мас. % и дифенил [(Ph)2] CAS 92-52-4 с содержанием основного вещества 99.0 мас. % Исходные вещества заводского изготовления использовали без предварительной очистки.
Все экспериментальные исследования проводили при давлении 0.100 ± 0.002 МПа.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Расчет характеристик фазовых равновесий в исследуемых системах осуществляли с помощью уравнений Шредера–Ле Шателье. Коэффициенты активности компонентов в растворе принимали равными 1:
Методика построения фазовой диаграммы с использованием уравнения Шредера–Ле Шателье для двухкомпонентных органических систем приведена в работах [7, 8]. Расчет трехкомпонентной системы проводили в два этапа, основываясь на алгоритме расчета двухкомпонентных систем. Первый этап заключался в определении температуры плавления трехкомпонентной эвтектики и соотношения дифенилоксида и н-гептадекана в ее составе (расчет политермического разреза PO). Второй этап – расчет разреза (Ph)2 – Z. Так как из расчета разреза PO известна температура плавления эвтектики Е, решение уравнения Шредера–Ле Шателье сводится к установлению содержания дифенила в трехкомпонентной эвтектике при известном значении температуры плавления. Найденное значение в мольных долях представляет собой искомую величину содержания дифенила в сплаве эвтектического состава. Соотношение дифенилоксида и н-гептадекана в трехкомпонентной эвтектике известно из расчета разреза PO.
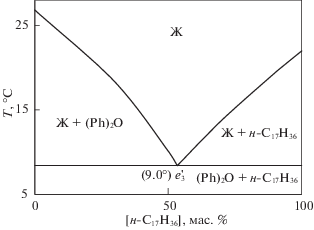
Перед экспериментальными исследованиями фазовые равновесия в системе дифенилоксид–н-гептадекан были рассчитаны с помощью уравнения Шредера–Ле Шателье без учета полиморфного превращения н-гептадекана. Расчетная фазовая диаграмма приведена на рис. 1.
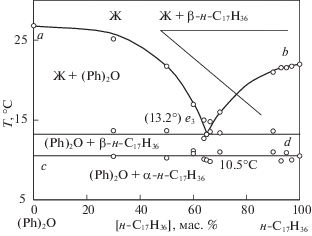
Фазовая диаграмма системы (Ph)2O – н-C17H36 построена по расчетным данным (рис. 1) и экспериментальным данным 11 составов (табл. 1), и представлена полем однофазного равновесия выше кривой ликвидуса ae3b → Ж и четырьмя двухфазными полями: Ж + (Ph)2O, Ж + β-н-C17H36, (Ph)2O + β-н-C17H36 и (Ph)2О + α-н-С17Н36 (рис. 2). Для каждого элемента фазовой диаграммы характерны следующие фазовые равновесия:
Таблица 1.
Экспериментально изученные составы системы (Ph)2O – н-C17H36
| Содержание компонентов | Т, °С | |||||
|---|---|---|---|---|---|---|
| н-С17Н36 | (Ph)2О | Ликвидуса | Солидуса | Полиморфного перехода | ||
| мас. % | мол. % | мас. % | мол. % | |||
| 30.0 | 23.3 | 70.0 | 76.7 | 25.2 | 13.7 | 10.5 |
| 50.0 | 41.5 | 50.0 | 58.5 | 21.8 | 13.7 | 10.3 |
| 60.0 | 51.5 | 40.0 | 48.5 | 17.0 | 11.2 | 10.8 |
| 64.0 | 55.7 | 36.0 | 44.3 | 15.0 | 12.7 | 10.1 |
| 65.0 | 56.8 | 35.0 | 43.2 | 13.2 | 13.2 | 10.0 |
| 66.3 | 58.2 | 33.7 | 41.8 | 14.8 | 13.5 | 9.8 |
| 70.0 | 62.3 | 30.0 | 37.7 | 16.0 | 13.4 | 11.0 |
| 90.0 | 86.4 | 10.0 | 13.6 | 21.0 | 13.6 | 11.0 |
| 93.0 | 90.4 | 7.0 | 9.6 | 21.6 | – | 9.9 |
| 95.0 | 93.1 | 5.0 | 6.9 | 21.6 | – | 10.9 |
| 97.0 | 95.8 | 3.0 | 4.2 | 21.8 | – | 10.0 |
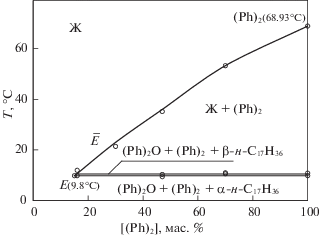
линия ae3: Ж ⇆ (Ph)2О (моновариантное равновесие),
линия e3b: Ж ⇆ β-н-C17H36 (моновариантное равновесие),
точка e3: Ж ⇆ (Ph)2О + β-н-C17H36 (нонвариантное равновесие).
Линии моновариантных равновесий пересекаются в точке e3 с координатами: температура 13.2°С и содержании н-C17H36 56.8 мол. % + (Ph)2О 43.2 мол. %. Минимальная линия кристаллизации (e3b) соответствует выпадению из расплава кристаллов β-н-C17H36.
В солидусе отмечается α/β полиморфный переход н-гептадекана. При температуре выше полиморфного перехода α/β-н-C17H36, в солидусе твердыми фазами являются смесь кристаллов (Ph)2О + β-н-С17Н36, при температуре ниже полиморфного перехода α/β-н-С17Н36 – смесь кристаллов (Ph)2О + α-н-С17Н36.
Сравнение экспериментальных и расчетных данных, полученным по системе дифенилоксид–н-гептадекан, приведено в табл. 2.
Таблица 2.
Сравнение расчетных и экспериментальных данных в системе дифенилоксид – н-гептадекан
| Метод | [н-С17Н36], мас. % | Te, К |
|---|---|---|
| Расчет методом Шредера – Ле Шателье | 53.4 | 281.55 |
| Эксперимент | 65.0 ± 2 | 286.35 ± 0.25 |
| Среднее относительное отклонение от экспериментальных данных, % | 17.8 | 1.68 |
Следовательно, эвтектики в ограняющих двухкомпонентных системах трехкомпонентной системы характеризуются следующими значениями:
– в системе дифенил–дифенилоксид температура плавления эвтектики составляет 285.45 К при содержании дифенила 26.5 мас. % и дифенилоксида 73.5 мас. %, энтальпия плавления эвтектического сплава – 98.2 кДж/кг [2];
– в системе дифенил–н-гептадекан температура плавления эвтектики составляет 290.35 К при содержании дифенила 18.7 мас. % и н-гептадекана 81.3% мас., энтальпия плавления эвтектического сплава – 117.3 кДж/кг [9];
– в системе дифенилоксид–н-гептадекан температура плавления эвтектики – 286.35 К, при содержании дифенилоксида 35.0 мас. % и н-гептадекана 65.0 мас. % энтальпия плавления эвтектического сплава – 117.9 кДж/кг.
В результате расчетов по приведенному алгоритму были определены характеристики трехкомпонентной эвтектики Е': 40.9% мас. н-гептадекана, 12.9 мас. % дифенила и 46/2 мас. % дифенилоксида, температура плавления TЕ = 266.25 К (рис. 3).
Рис. 3.
Фазовый комплекс системы дифенил–дифенилоксид–н-гептадекан с расчетными E ' и экспериментальными E данными (мас. %).
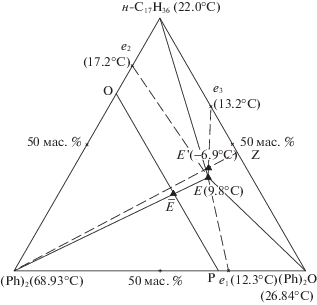
Экспериментальные исследования проводили согласно правилам проекционно-термографического метода (ПТГМ) [10]. На концентрационный треугольник нанесены данные по исходным компонентам (температуры плавления), по двухкомпонентным системам (температуры плавления и составы эвтектик e1, e2, e3). Фазовые равновесные состояния для элементов треугольника составов тройной системы приведены в табл. 3. Максимальное поле кристаллизации принадлежит более тугоплавкому компоненту (Ph)2.
Таблица 3.
Фазовые реакции в системе дифенил–дифенилоксид–н-гептадекан
| Элемент диаграммы | Условия равновесия | Фазовые реакции |
|---|---|---|
| (Ph)2e2Ee1, поле | Дивариантное | Ж ⇆ (Ph)2 |
| (Ph)2Oe3Ee1, поле | Дивариантное | Ж ⇆ (Ph)2O |
| н-C17H36e2Ee3, поле | Дивариантное | Ж ⇆ β-н-C17H36 |
| e2E, линия | Моновариантное | Ж ⇆ (Ph)2 + β-н-C17H36 |
| e3E, линия | Моновариантное | Ж ⇆ (Ph)2О + β-н-C17H36 |
| e1E, линия | Моновариантное | Ж ⇆ (Ph)2 + (Ph)2О |
| E, точка | Нонвариантное | Ж ⇆ (Ph)2 + (Ph)2О + β-н-C17H36 |
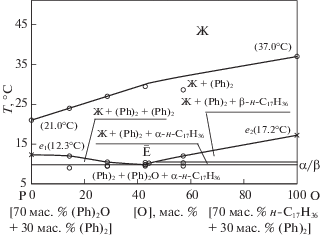
В поле кристаллизации дифенила для экспериментального исследования выбран политермический разрез PO [P: (Ph)2 30.9 мол. %, (Ph)2О 69.1 мол. %, O: (Ph)2 40.0 мол. %, н-C17H36 60.0 мол. %]. Двойные эвтектики e2 и е3 расположены возле вершины н-C17H36, поэтому при планировании эксперимента выбраны для изучения на микрокалориметре составы, отвечающие фигуративным точкам 1–5 и Ē (табл. 4).
Таблица 4.
Экспериментально изученные составы системы (Ph)2–(Ph)2O–н-C17H36
| Номер фигуратив-ной точки | Компоненты | Состав, мас. % | Т, °С |
|---|---|---|---|
| 1 | (Ph)2 (Ph)2О н-C17H36 |
70 17 13 |
t1 = 9.88 t2 = 10.88 t3 = 53.29 |
| 2 | (Ph)2 (Ph)2О н-C17H36 |
47 30 23 |
t1 = 10.61 t2 = 13.73 t3 = 35.22 |
| 3 | (Ph)2 (Ph)2О н-C17H36 |
30 60 10 |
t1 = 9.01 t2 = 12.0 t3 = 24.0 |
| 4 | (Ph)2 (Ph)2О н-C17H36 |
30 50 20 |
t1 = 9.5 t2 = 10.5 t3 = 27.0 |
| Ē | (Ph)2 (Ph)2О н-C17H36 |
30 40 30 |
t1 = 9.5 t2 = 10.37 t3 = 29.47 |
| 5 | (Ph)2 (Ph)2О н-C17H36 |
30 30 40 |
t1 = 9.5 t2 = 10.28 t3 = 12.01 t4 =28.62 |
| Е | (Ph)2 (Ph)2О н-C17H36 |
15 48.5 36.5 |
t1 = 9.8 t2 = 10.96 |
Из Т–х-диаграммы политермического разреза PO была определена температура плавления Е, выявлено направление Ē на эвтектику и установлено соотношение дифенилоксида и н-C17H36 в ней: (Ph)2O 57.1 мас. %, н-C17H36 42.9 мас. %. Т–х-диаграмма политермического разреза PO показана на рис. 4. Исследование Т–х-диаграммы разреза (Ph)2 → Ē → Е (рис. 5), исходящего из полюса кристаллизации (Ph)2 и проходящего через направление на эвтектику Ē, позволило выявить состав эвтектики E в трехкомпонентной системе. Эвтектический сплав содержит 15.0 мас. % дифенила + 48.5 мас. % дифенилового эфира + + 36.5 мас. % н-гептадекана; tпл = 9.8°C (282.95 К).
Рис. 5.
Т–х- диаграмма разреза (Ph)2 → Ē → Е в трехкомпонентной системе дифенил–дифенилоксид–н-гептадекан.
Сравнение данных, полученных методом Шредера–Ле Шателье и эксперимента, представлено в табл. 5.
Таблица 5.
Сравнение экспериментальных и расчетных данных в системе дифенил–дифенилоксид–н-гептадекан
| Метод | [н-С17Н36, %] мас. % | Te, К |
|---|---|---|
| Расчет методом Шредера – Ле Шателье | 40.9 | 266.5 |
| Эксперимент | 36.5 ± 2 | 282.9 ± 0.25 |
| Среднее относительное отклонение от экспериментальных данных | 12.1% | 5.8% |
Таблица 6.
Свойства сплава эвтектического состава
| Параметр | дифенилоксид – н-гептадекан | дифенил – дифенилоксид – н-гептадекан |
|---|---|---|
| ρ, г/см3 | 0.7926 ± 0.0005 | 0.9323 ± 0.0005 |
| Т, К | 133 ± 1.00 | 393.15 ± 1.00 |
| ${{\Delta }_{{\text{m}}}}H$, кДж/кг | 117.9 ± 12.0 | 84.69 ± 6.3 |
| ΔmS, Дж/(моль К) | 86.4 | 56.1 |
| Ткип, К | 565.65 ± 1.00 | 537.15 ± 1.00 |
Отклонение расчетных данных по температуре плавления и составе эвтектики от экспериментальных свидетельствует о наличии в исследуемой системе межмолекулярного взаимодействия, которое может быть учтено с помощью коэффициентов активности компонентов системы. Существующие расчетные методы определения коэффициентов активности (ASOG, UNIFAC и др.) используют константы взаимодействия групп, определение которых проводят с помощью экспериментальных данных по системам, близким к прогнозируемым. Учитывая, что количество данных по фазовым равновесиям в системах дифенил–дифенилоксид–н-алкан достаточно мало, прогнозирование с использованием указанных методов не представляется возможным.
Кроме температуры плавления для сплавов эвтектических составов систем дифенилоксид–н-гептадекан и дифенил–дифенилоксид–н-гептадекан дополнительно измерили плотность, температуру вспышки в открытом тигле, энтальпию плавления, температуру кипения. Значения энтропии плавления сплавов эвтектических составов исследуемых систем рассчитывали по формуле:
Выбор этих параметров обусловлен значимостью при выборе теплоносителя в процессе расчета теплообменного аппарата.
Таким образом, изучение фазовых равновесий методом ДТА позволило установить следующие значения температур плавления эвтектик и содержанию компонентов:
в двухкомпонентной системе дифенилоксид–н-гептадекан: TЕ = 286.35 К, (Ph)2О – 35.0 мас. % и н-С17Н36 – 65.0 мас. %;
в трехкомпонентной системе дифенил–дифенилоксид–н-гептадекан: TЕ = 282.95 К, (Ph)2 – 15.0 мас. %, (Ph)2О – 48.5 мас. % и н-С17Н36 – 36.5 мас. %.
Метод с использованием уравнения Шредера–Ле Шателье может быть использован для предварительного прогнозирования фазовых равновесий в подобных трехкомпонентных органических эвтектических системах.
В соответствии с полученными данными, составы, отвечающие эвтектике в системах дифенилоксид–н-гептадекан и дифенил–дифенилоксид–н-гептадекан могут быть рекомендованы к использованию в качестве теплоносителя, с температурным диапазоном эксплуатации от 286 до 560 К и от 290 до 537 К соответственно.
Работа выполнена в рамках базовой части государственного задания Самарского государственного технического университета. Проект № 4.5534.2017/8.9.
Список литературы
Каган С.З., Чечеткин А.В. Органические высокотемпературные теплоносители и их применение в промышленности. М.: “Гос. науч.-технич. изд. химич. литер.”, 1951. 172 с.
Чечеткин А.В. Высокотемпературные теплоносители. М.: Энергия, 1971. 496 с.
Мощенский Ю.В. // Приборы и техника эксперимента. 2003. № 6. С. 143–144.
ASTM E 967-97 “Standard Practice for Temperature Calibration of Differential Scanning Calorimeters and Differential Thermal Analyzers”.
ГОСТ 4333-87. Нефтепродукты. Методы определения температур вспышки и воспламенения в открытом тигле. М.: ФГУП “СТАНДАРТИНФОРМ”, 2008. 6 с.
ГОСТ 18995.1-73. Продукты химические жидкие. Методы определения плотности. М.: ИПК Издательство стандартов, 2004. 4 с.
Гаркушин И.К., Колядо А.В., Дорохина Е.В. Расчет и исследование фазовых равновесий в двойных системах из органических веществ. Екатеринбург: УрО РАН, 2011, 191 с.
Гаркушин И.К., Дорохина Е.В., Колядо А.В. // Бутлеровские сообщения. 2009. Т. 16. № 3. С. 41.
Гаркушин И.К., Колядо А.В., Яковлев И.Г. // Нефтяная провинция. 2016. № 3. С. 128.
Трунин А.С., Космынин А.С. Проекционно-термографический метод исследования гетерогенных равновесий в конденсированных многокомпонентной системе. Куйбышев, 1977. 68 с. – Деп. в ВИНИТИ 12.04.77. № 1372–77.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии