Журнал физической химии, 2019, T. 93, № 9, стр. 1322-1327
Кинетика окисления урацила и его производных озоном в водных растворах
А. А. Максютова a, Ю. С. Зимин a, *, А. Р. Гимадиева b, А. Г. Мустафин a, b
a Башкирский государственный университет
Уфа, Россия
b Российская академия наук, Уфимский федеральный исследовательский центр,
Уфимский институт химии
Уфа, Россия
* E-mail: ZiminYuS@mail.ru
Поступила в редакцию 28.12.2018
После доработки 22.02.2019
Принята к публикации 12.03.2019
Аннотация
Спектрофотометрическим методом изучена кинетика окисления урацила и его производных (тимина, 6-метилурацила, 5-бром-6-метилурацила, 5-нитро-6-метилурацила, 1,3-диметилтимина и 5‑гидрокси-1,3,6-триметилурацила) озоном в водных растворах. Показано, что реакции протекают по кинетическому закону второго порядка. В интервале 285–309 К исследована температурная зависимость констант скоростей реакций второго порядка и определены активационные параметры реакций.
Пиримидиновые основания характеризуются широким распространением в живой природе. Они играют важную роль в построении цепей рибонуклеиновых (РНК) и дезоксирибонуклеиновых (ДНК) кислот. Разрушение структур пиримидиновых колец и исчезновение карбонильных и аминогрупп приводят к тяжелым последствиям для организма. Несмотря на то, что существуют механизмы защиты и восстановления нуклеиновых кислот, окислительные процессы пиримидиновых оснований способны приводить к необратимым разрушениям мономерных звеньев цепей РНК и ДНК и, как следствие, к серьезным генетическим заболеваниям.
В настоящее время исследователи разных областей науки всерьез заинтересованы изучением процессов окисления РНК и ДНК. При этом исследования проводятся на модельных системах, среди которых чаще всего используются урацил и его производные (ПУ). К настоящему времени в литературе имеются данные по окислению ПУ молекулярным кислородом (в присутствии солей меди), перманганатом калия, пероксидом водорода, пероксильным, гидроксильным и гидропероксильным радикалами (см., например, работы [1–4] и цитируемую там литературу). При этом в качестве продуктов окисления были обнаружены различные химические соединения. Так, основным продуктом взаимодействия 5-гидрокси-6-метилурацила с молекулярным кислородом в присутствии хлорида меди (II) оказался 5,5,6-тригидрокси-6-метилпиримидин-2,4-дион [1]. Окисление 5-аминоурацила в таких же условиях приводит к образованию 5,5,6-тригидроксипиримидин-2,4(1Н,3Н)-диона [2]. При окислении урацила и тимина перманганатом калия в водной среде в качестве основных продуктов обнаружены соответствующие гликоли и производные барбитуровой кислоты [5]. Окисление урацилов пероксидными соединениями приводит к разрушению урацильного кольца и образованию мочевины и низших карбоновых кислот [6].
В то же время, среди используемых окислителей практически не представлен такой окислитель как озон, который в последние годы находит широкое применение в разных сферах деятельности человека: обеззараживание воды, очистка сточных вод, косметология, медицина и т.д. И если как окислитель “зеленой химии” озон укрепил свои позиции, то его целесообразное применение в общей терапии научно не было доказано или опровергнуто.
В связи с этим целью настоящей работы явилось изучение кинетики реакции озона с урацилом и рядом его производных в водных растворах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследований были использованы урацил и шесть его производных (тимин, 6-метилурацил, 5-бром-6-метилурацил, 5-нитро-6-метилурацил, 1,3-диметилтимин и 5-гидрокси-1,3,6-триметилурацил). Урацил, тимин и 6-метилурацил были произведены фирмой “Фармакон” (г. Санкт-Петербург). Остальные производные урацила синтезированы по методикам, описанным ранее [7–9]. Озон-кислородная смесь была получена с помощью озонатора, конструкция которого описана в работе [10]. Растворитель – свежеперегнанная бидистиллированная вода.
Кинетику реакции изучали спектрофотометрическим методом на приборе UV-2600 фирмы “Shimadzu” при равенстве начальных концентраций реагентов ([ПУ]0 = [О3]0), которое достигалось следующим образом. Вначале определяли концентрацию озона в воде, которую создавал озонатор в день проведения эксперимента. Для этого в пробирку помещали 4 мл бидистиллированной воды и подавали в нее озон-кислородную смесь до насыщения. Дополнительными опытами было установлено, что максимальная концентрация озона в 4 мл воды достигалась за 2 мин барботажа О3–О2-смеси. Далее спектрофотометрически по закону Бугера–Ламберта–Бера определяли эту концентрацию О3 в воде (${{\varepsilon }_{{{{{\text{O}}}_{3}}}}}$ = = 2700 л моль–1 см–1 при = 270 нм [11]). Затем готовили 4 мл водного раствора ПУ такой же концентрации (из заранее приготовленного раствора большей концентрации).
Перед началом кинетического эксперимента вновь насыщали 4 мл бидистиллированной воды
озон-кислородной смесью. Далее, после смешения 2 мл озонового раствора с 2 мл водного
раствора ПУ, наблюдали за изменением оптической плотности полученной реакционной смеси.
Поскольку оба реагента поглощают в ультрафиолетовой области, кинетику озонированного
окисления урацила и его производных исследовали на длинах волн (λmax), равных максимумам поглощения сопряжения  урацильного кольца11. При этом оптическая плотность в каждый отдельный момент времени представляла собой
сумму двух оптических плотностей:
урацильного кольца11. При этом оптическая плотность в каждый отдельный момент времени представляла собой
сумму двух оптических плотностей:
Стехиометрические соотношения реагентов (ПУ и О3) определяли с помощью барботажной установки [11, 12], продувая озон-кислородную смесь через водные растворы урацилов и следя за изменением [О3] в газовой фазе на выходе из реактора. Методика проведения данных экспериментов подробно описана в работе [13].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно [14–16], урацил и его производные в водных растворах при рН < 7.0 существуют преимущественно в дикето-форме. Исследования показали, что pH водных растворов изученных урацилов в диапазоне используемых нами концентраций не превышает 5.8. На основании данного факта можно утверждать, что в условиях наших экспериментов урацилы представлены главным образом дикето-формой.
На первом этапе исследований были определены коэффициенты экстинкции урацила и его производных в водных растворах (по закону Бугера–Ламберта–Бера), которые в дальнейшем будут использованы для расчетов остаточных концентраций ПУ. Было установлено, что линейная зависимость между оптическими плотностями изученных урацилов и их концентрациями в водных растворах четко выполняется до [ПУ] = 2 × 10–4 моль/л. По тангенсам углов наклона зависимостей А = f ([ПУ]) были определены коэффициенты экстинкции урацилов, значения которых представлены в табл. 1.
Таблица 1.
Значения коэффициентов экстинкции изученных урацилов
| Урацилы | εПУ × 10–3, л моль–1 см–1 | λmax, нм |
|---|---|---|
| Урацил | 8.4 ± 0.2 | 257 |
| Тимин | 6.8 ± 0.1 | 264 |
| 6-Метилурацил | 9.0 ± 0.1 | 260 |
| 5-Бром-6-метилурацил | 7.8 ± 0.1 | 275 |
| 5-Нитро-6-метилурацил | 9.4 ± 0.1 | 260 |
| 1,3-Диметилтимин | 10.0 ± 0.1 | 267 |
| 5-Гидрокси-1,3,6-триметилурацил | 7.9 ± 0.1 | 283 |
На следующем этапе была изучена кинетика реакции озона с урацилами. Как отмечено в экспериментальной части, реакцию проводили при равенстве начальных концентраций реагентов: [ПУ]0 = [О3]0 = С0. Анализ кинетических кривых изменения концентрации С показал, что они достаточно хорошо линеаризуются в координатах уравнения реакции второго порядка (рис. 1):
где k – константа скорости реакции озона с ПУ, r – коэффициент корреляции. По тангенсам углов наклона прямых (рис. 1) были рассчитаны константы скоростей k реакции озона со всеми исследованными урацилами.Рис. 1.
Линеаризация кинетических кривых изменения концентрации С в координатах уравнения (1); 305 К, 1 – 6-метилурацил, 2 – 5-нитро-6-метилурацил, 3 – тимин.
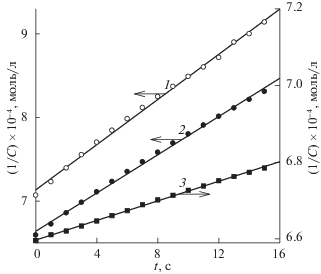
Далее с помощью барботажной установки, описанной в работах [11, 12], была изучена кинетика поглощения озона водными растворами урацилов. Опыты проводили при комнатной температуре (295 К). На рис. 2 в качестве примера приведены кривые изменения оптической плотности озона для воды (верхняя кривая) и водного раствора 6-метилурацила (6-МУ) (нижняя кривая).
Рис. 2.
Кривые изменения оптической плотности озона для воды (верхняя кривая) и водного раствора 6-метилурацила (нижняя кривая); 295 К, [6-МУ]0 = = 1 × 10–3 моль/л, Wгаз = 6 л/ч.

Количество озона, поглощенное реакционной смесью, пропорционально площади, заключенной между кривыми оптического поглощения S (рис. 2). Зная количество озона, приходящееся на единицу площади рисунка, можно рассчитать количество поглощенного озона. Для этого сначала определяли количество О3, соответствующее площади оценочного прямоугольника Sпр [11, 12]:
(2)
${{[{{O}_{3}}]}_{{пр}}} = \frac{{{{W}_{{газ}}}}}{V}\frac{{\Delta {{A}_{{пр}}}\Delta {{t}_{{пр}}}}}{{\varepsilon \,l\,3600}},$(3)
${{[{{O}_{3}}]}_{р}} = {{[{{O}_{3}}]}_{{пр}}}\frac{{\text{S}}}{{{{{\text{S}}}_{{пр}}}}},\;моль{\text{/л}}{\kern 1pt} .$Количество 6-метилурацила, израсходованного к данному моменту времени, находили по формуле:
где [6-МУ]0 – начальная концентрация 6-метилурацила, [6-МУ]t –концентрация 6-метилурацила, оставшаяся к моменту времени t. Остаточную концентрацию 6-МУ определяли методом УФ-спектроскопии после охлаждения отбираемых проб (с помощью снега) и выдувки озона (с помощью аргона).В табл. 2 приведены данные по зависимости количеств поглощенного озона [О3]р и израсходованного урацила [6-МУ]р от времени подачи озон-кислородной смеси через водный раствор субстрата. Из приведенных данных следует, что в начальные моменты времени (вплоть до 2 мин) исходные вещества – озон и 6-метилурацил – реагируют в соотношении 1 : 1. Отметим, что для начальных стадий окисления остальных изученных урацилов озоном имело место аналогичное соотношение (1 : 1). Отсюда становится понятным второй порядок озонированного окисления урацилов по данным спектральных исследований. Очевидно, изучаемая реакция имеет первый порядок по ПУ и первый порядок по озону:
Таблица 2.
Зависимость количеств поглощенного озона и израсходованного 6-метилурацила от времени подачи озон-кислородной смеси через водный раствор субстрата; 295 К, [6-МУ]0 = 1 × 10–3 моль/л, Wгаз = 6 л/ч
| t, с | [О3]р × 103, моль/л | [6-МУ]р × 103, моль/л | [О3]р : [6-МУ]р |
|---|---|---|---|
| 60 | 0.5 | 0.5 | 1.0 |
| 120 | 1.0 | 1.0 | 1.0 |
| 180 | 1.4 | 1.0 | 1.4 |
| 240 | 1.9 | 1.0 | 1.9 |
| 300 | 2.3 | 1.0 | 2.3 |
| 360 | 2.8 | 1.0 | 2.8 |
Обращает на себя внимание тот факт, что на более глубоких стадиях соотношение [О3]р : [6-МУ]р превышает единицу (табл. 2). Повышенный расход озона, очевидно, связан с дальнейшим окислением образующихся продуктов.
В настоящей работе для урацила и шести его производных в интервале 285–309 К была изучена температурная зависимость k, значения которых суммированы в табл. 3. Согласно данным этой таблицы наблюдается следующий порядок реакционной способности урацилов по отношению к озону (285 К): 1,3-диметилтимин > 5-бром-6-метилурацил > урацил, 6-метилурацил > 5-нитро-6-метилурацил > 5-гидрокси-1,3,6-триметилурацил > тимин. Из приведенного ряда следует, что тимин обладает наиболее выраженными антиокислительными свойствами. Отсюда становится понятным, почему именно тимин входит в состав ДНК.
Таблица 3.
Температурная зависимость констант скоростей реакции озона с урацилами
| T, K | Урацил | Тимин | 6-Метил-урацил | 5-Бром-6-метилурацил | 5-Нитро-6-метилурацил | 1,3-Диме-тилтимин | 5-Гидрокси-1,3,6-триме-тилурацил |
|---|---|---|---|---|---|---|---|
| k × 10–1, л моль–1 с–1 | |||||||
| 285 | 4.5 ± 0.3 | 0.67 ± 0.01 | 4.50 ± 0.04 | 6.2 ± 0.2 | 3.10 ± 0.05 | 6.64 ± 0.4 | 0.74 ± 0.06 |
| 289 | 5.7 ± 0.4 | 0.85 ± 0.01 | 5.3 ± 0.1 | 7.4 ± 0.2 | 4.4 ± 0.1 | 8.7 ± 0.5 | 0.86 ± 0.05 |
| 293 | 6.6 ± 0.4 | 0.89 ± 0.01 | 7.0 ± 0.2 | 8.1 ± 0.3 | 6.1 ± 0.1 | 9.35 ± 0.6 | 1.19 ± 0.04 |
| 297 | 7.8 ± 0.5 | 1.10 ± 0.02 | 8.6 ± 0.4 | 10.2 ± 0.3 | 7.6 ± 0.1 | 13.5 ± 0.8 | 1.70 ± 0.04 |
| 301 | 8.5 ± 0.6 | 1.20 ± 0.02 | 11.5 ± 0.3 | 11.2 ± 0.5 | 9.7 ± 0.1 | 16.9 ± 1.0 | 2.4 ± 0.1 |
| 305 | 11.4 ± 0.5 | 1.29 ± 0.02 | 13.9 ± 0.4 | 12.4 ± 0.6 | 11.9 ± 0.2 | 18.3 ± 1.5 | 3.0 ± 0.1 |
| 309 | 12.1 ± 0.8 | 1.46 ± 0.03 | 17.2 ± 0.5 | 15.3 ± 0.5 | 15.0 ± 0.3 | 24.8 ± 1.1 | 4.7 ± 0.1 |
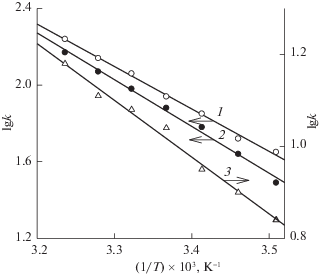
Обработка данных табл. 3 в координатах уравнения Аррениуса позволила определить активационные параметры изучаемых реакций (табл. 4). В качестве примера на рис. 3 приведены результаты линеаризации в координатах lg k = f(1/Т) температурных зависимостей констант скоростей реакции озона с тремя урацилами (6-метилурацилом, 5-нитро-6-метилурацилом и тимином).
Таблица 4.
Активационные параметры реакции озона с урацилами
| Урацилы | lg A, л моль–1 с–1 | E, кДж/моль |
|---|---|---|
| Урацил | 7.4 ± 0.7 | 30.3 ± 4.2 |
| Тимин | 5.1 ± 0.5 | 23.2 ± 2.8 |
| 6-Метилурацил | 9.4 ± 0.5 | 42.4 ± 2.9 |
| 5-Бром-6-метилурацил | 6.6 ± 0.6 | 26.3 ± 3.2 |
| 5-Нитро-6-метилурацил | 10.2 ± 0.8 | 47.4 ± 4.4 |
| 1,3-Диметилтимин | 9.0 ± 1.1 | 39.5 ± 3.7 |
| 5-Гидрокси-1,3,6-триметилурацил | 12.9 ± 1.3 | 66.4 ± 7.1 |
Рис. 3.
Температурные зависимости констант скоростей k реакции озона с 6-метилурацилом (1), 5-нитро-6-метилурацилом (2) и тимином (3) в координатах уравнения Аррениуса.
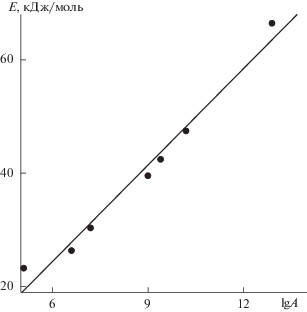
На основании анализа данных табл. 4 было установлено, что между энергиями активации Е и логарифмами предэкспоненциальных множителей lg A удовлетворительно (рис. 4, r = 0.988) выполняется линейная зависимость – компенсационный эффект [17]. Данный факт может свидетельствовать о едином механизме лимитирующей стадии окисления
изученных урацилов озоном. Уменьшение сигнала, относящегося к поглощению сопряжения
 урацильного кольца, свидетельствует об участии этой группы в реакции с О3. С учетом данного факта, а также кинетического уравнения (5), можно ожидать, что окисление ПУ лимитирует стадия присоединения озона по
урацильного кольца, свидетельствует об участии этой группы в реакции с О3. С учетом данного факта, а также кинетического уравнения (5), можно ожидать, что окисление ПУ лимитирует стадия присоединения озона по 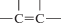 связи урацильного кольца.
связи урацильного кольца.
Таким образом, в настоящей работе изучена кинетика озонированного окисления урацила и шести его производных в водных растворах. Показано, что исследуемые реакции протекают по кинетическим уравнениям второго порядка (первого – по урацилу и первого – по озону). В интервале 285–309 К исследована температурная зависимость констант скоростей второго порядка и определены активационные параметры реакций. Для ряда изученных урацилов в водной среде установлена корреляционная зависимость между значениями энергий активации и логарифмами предэкспоненциальных множителей.
Список литературы
Нугуманов Т.Р. Окислительные превращения 5-гидрокси-6-метилурацила под действием молекулярного кислорода в присутствии хлорида меди (II), гидроксильных и пероксильных радикалов: Дис. … канд. хим. наук. Уфа: Институт органической химии УНЦ РАН, 2009. 98 с.
Закирьянова О.В. Взаимодействие 5-аминоурацила с молекулярным кислородом в водных растворах в присутствии хлорида меди (II): Дис. … канд. хим. наук. Уфа: Институт органической химии УНЦ РАН, 2011. 98 с.
Ахатова Г.Р. Антиокислительная эффективность производных урацила: Дис. … канд. хим. наук. Уфа: Башкирский государственный университет, 2012. 115 с.
Зимин Ю.С., Хайруллина Л.Р., Кутлугильдина Г.Г., Мустафин А.Г. // Журн. физ. химии. 2015. Т. 89. № 12. С. 1864.
Bui C.T., Cotton R.G.H. // Bioinorg. Chem. 2002. V. 30. P. 133.
Subbaraman L.R., Subbaraman J., Behrman E.J. // J. Org. Chem. 1971. T. 36. № 9. C. 1256.
Фаттахов А.Х., Лобов А.Н., Гимадиева А.Р. и др. // Вестн. Башк. ун-та. 2012. Т. 17. № 4. С. 1710.
Кривоногов В.П., Толстиков Г.А., Муринов Ю.И. и др. 6-Метилурацил-5-аммонийсульфат в качестве исходного соединения для синтеза оксипроизводных 6-метилурацила: Пат. № 2000298 РФ // Б.И. 1993. № 33-36.
Адамович А.И., Витенберг А.Г. Способ получения 5‑амино-4-метилурацила: А.с. 130044 СССР // Б.И. 1960. № 14.
Вендилло В.П., Емельянов Ю.М., Филиппов Ю.В. // Заводск. лаборатория. 1959. Т. 25. № 11. С. 1401.
Шафиков Н.Я. Кинетика, продукты и механизм окисления этанола озоном: Дисс. … канд. хим. наук. Уфа: Институт химии БФАН СССР, 1985. 166 с.
Зимин Ю.С. Кинетика и механизм озонированного окисления спиртов, эфиров, кетонов и олефинов в водной среде: Дисс. … докт. хим. наук. Уфа: Институт органической химии УНЦ РАН, 2006. 302 с.
Зимин Ю.С., Комиссаров В.Д. // Вестн. Башк. ун-та. 2004. № 4. С. 31.
Iza N., Gil M., Marcillo J. // J. Mol. Struct. 1988. V. 175. № 1. P. 31.
Yekeler H., Ozback D. // J. Mol. Model. 2001. V. 7. № 4. P. 103.
Иванов С.П. Изучение кето-енольного равновесия некоторых производных урацила в водных растворах: Дис. … канд. хим. наук. Уфа: Институт органической химии УНЦ РАН, 2003. 143 с.
Денисов Е.Т., Саркисов О.М., Лихтенштейн Г.И. Химическая кинетика. М.: Химия, 2000. 568 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии