Журнал физической химии, 2020, T. 94, № 4, стр. 510-515
Диэлектрические свойства жидкой фазы высших алканолов на линии равновесия пар–жидкость
В. И. Журавлев a, *, Т. М. Усачева a
a Московский государственный университет имени М.В. Ломоносова. Химический факультет
Москва, Россия
* E-mail: zhura-061@yandex.ru
Поступила в редакцию 10.04.2019
После доработки 14.06.2019
Принята к публикации 17.09.2019
Аннотация
Измерены статические диэлектрические проницаемости высших 1-алканолов выше температур кипения. Подробно рассмотрена конструкция ячейки и самой установки. Проведен анализ результатов полученных другими авторами. Проведено сравнение температурных зависимостей статической диэлектрической проницаемости εs(Т) на линии равновесия пар−жидкость в окрестности критической температуры жидкостей с водородными (Н) и без водородных связей. Проанализированы требования к выбору геометрии угла ассоциации О–Н…О–Н в молекулярно-динамических (МД)-моделях для точного описания экспериментальных статических диэлектрических проницаемостей 1-алканолов.
Работа посвящена исследованию температурных зависимостей статических диэлектрических проницаемостей εseliq(Т) растворителей: таких как метанол, этанол, 1-бутанол при давлениях 91.3 кПа на частоте 1 МГц с точностью δεseliq = 0.05% [1], что позволило учесть их влияние на константы равновесия и константы скоростей реакций при физических и биологических исследованиях [2]. Особую роль в этих измерениях играет конструкция ячейки, выдерживающая большой перепад давлений.
Развитие молекулярной теории жидких систем опирается на фундаментальные исследования их структуры, природы межмолекулярных взаимодействий, динамических процессов, протекающих в жидкостях при тепловом движении молекул. Анализ диэлектрических данных позволяет определить ряд параметров, характеризующих структуру вещества [3].
Исследование температурных зависимостей статических диэлектрических проницаемостей εseliq(Т) растворителей таких как метанол, этанол, 1-бутанол при давлениях 91.3 кПа на частоте 1 МГц с точностью δεseliq = 0.05% [2] позволило учесть их влияние на константы равновесия и константы скоростей реакций при физических и биологических исследованиях.
Для определения критических температур Тсr при сверхточных измерениях давления паров чистых жидкостей [4] и давления паров Рсr растворов на линии равновесия пар−жидкость [5] исследованные вещества достигали степени чистоты 99.95; 99.92; 99.94 мас. %. Измерения температурных зависимостей давления паров Рv(Т) высших алканолов 1-гексанола, 1-гептанола, 1-октанола [6] позволили уточнить их температуры кипения Тb (табл. 1).
Таблица 1.
Критические константы алканолов и диэтилового эфира (ДЭЭ) [7]
| Параметр | Метанол | Этанол | 1-Пропанол | вт-Пропанол | 1-Бутанол | вт-Бутанол | изо-Бутанол | трет-Бутанол |
|---|---|---|---|---|---|---|---|---|
| Tb, K | 337.8 | 351.44 | 370.4 | 355.5 | 390.88 | 372.66 | 381.04 | 355.6 |
| tb, °C | 97.15 | 82.5 | 117.73 | 99.5 | 108.11 | |||
| Tcr, K | 512.5 | 514.0 | 536.8 | 508.3 | 563.0 | 536.2 | 547.8 | 506.2 |
| pcr, MПа | 8.084 | 613.7 | 5.169 | 4.754 | 4.414 | 4.202 | 4.295 | 3.972 |
| 1-пентанол | изо-пентанол | 1-гексанол | 1-гептанол | 1-окганол | вт-окганол | 1-декаанол | ДЭЭ [8] | |
| Tb, K | 411.13 | 400.7 | 432.323a | 452.97a | 465.288a | 452.5 | 504.3 | 248.4 |
| Tcr, K | 588.1 | 577.2 | 610.3 | 632.6 | 652.5 | 629.6 | 687.3 | 467 ± 1.0 |
| pcr, MПa | 3.779 | 3.930 | 3.455 | 3.121 | 2.928 | 2.81136 | 2.533 | 1.360 |
Необходимо отметить, что при исследовании температурной зависимости диэлектрической проницаемости εse(Т) на линии равновесия пар–жидкость, включая критическую область, необходимо одновременно измерять εsv(Т) пара и εseliq(Т) жидкой фазы.
В работе [9] для низших алканов на линии равновесия пар–жидкость были изучены зависимости εsе(Т) только жидкой фазы в интервале температур от 298 до 553 K, которые на 10–15 K были ниже критических температур Тсr (табл. 1). При измерениях использовалась герметичная трехэлектродная ячейка с толстыми стенками. Изменение давления внутри ячейки при нагревании не измерялось [9]. Использование подвижной коаксиальной ячейки небольшой высоты [10] позволило исключить влияние градиента плотностей в критической области и измерить зависимости εsе(Т) пара и εseliq(Т) жидкой фазы 1-пропанола и 1-бутанола в широком интервале температур, включая критическую область. Значения εseliq(Т) [10] согласовывались с εse(Т) [9]. В работах [11, 12] представлен анализ экспериментальных данных разных авторов εsе(Т) метанола во всем интервале температур существования жидкой фазы от плавления до критической области.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для высших алканолов современные исследования равновесия пар–жидкость до критической области ограничиваются температурными зависимостями давления в паре и жидкой фазе [6], реже плотности и отсутствуют измерения диэлектрических проницаемостей пара εsv(Т) и жидкой фазы εseliq(Т). В связи с этим была создана установка (рис. 1), которая позволила измерить диэлектрическую проницаемость εseliq(Т) жидкой фазы высших алканолов на линии равновесия пар−жидкость. В отличие от работы [9] нам удалось компенсировать давление насыщенных паров с помощью разделительной камеры с сильфоном [13] (см. рис. 1).
Рис. 1.
Установка для измерения статической диэлектрической проницаемости жидкой фазы на линии равновесия жидкость–пар: 1 – двухэлектродная ячейка, 2 – измеритель индуктивностей и емкостей Е12-1, 3 – термостат, 4 – пресс, 5 – вентиль, 6 – образцовый манометр, 7 – гибкое соединение, 8 – разделительная камера.

Ячейка (1) представляла собой двухэлектродный герметичный цилиндрический конденсатор из нержавеющей стали. Внешний цилиндр диаметром 28 мм был заземлен. Внутренний электрод с внешним диаметром 24 мм и высотой 47 мм выполнял роль электровывода к высокочастотному измерителю индуктивностей и емкостей Е12-1 и центрировался тефлоновым уплотнителем. Измерение емкости ячейки Сε(T) с исследуемой жидкостью проводилось на частоте 700 кГц. Погрешность измерения статических диэлектрических проницаемостей δεseliq(Т) высших алканолов жидкой фазы высших алканолов не превышала ±3.5%.
Используемая система регулировки давления до 150 бар, сконструированная для изучения дисперсии диэлектрической проницаемости методом цилиндрического стержня [13], позволяла проводить измерения εse жидкой фазы алканолов на линии равновесия жидкость–пар выше их температур кипения Tb (табл. 1). Плавное изменение давления Pe обеспечивалось прессом (4) и контролировалось образцовым манометром (6) МО 160 × 160 ат. (159 бар). Жидкость, передающая давление, герметично отделялась от исследуемой жидкости гибким соединением (7) и разделительной камерой с сильфоном (8).
Температура внутри ячейки поддерживалась постоянной в точностью ±0.2–0.3 K термостатом Гепплера типа HB с термостатирующей жидкостью ПФМС-4. К сожалению, из-за недостатков системы нагрева измерения εse можно было проводить только в интервале температур от 293 до 513 K. Модифицированная Gnomix appapatus (200 МПа) [14] позволила провести аналогичные PVT-измерения на линии равновесия пар−жидкость 2-этил-1-гексанола.
Результаты измерений диэлектрических проницаемостей жидкой фазы высших спиртов εseliq(Т) в интервале температур приведены в табл. 2 и на рис. 2.
Таблица 2.
Температурные зависимости εseliq(Т) высших алканолов
| Т, K | 1-Пентанол | 1-Гексанол | 1-Гептанол | 1-Окганол | 1-Декаанол | вт-Бутанол | изо-Пентанол | вт-Окганол |
|---|---|---|---|---|---|---|---|---|
| εse | εse | εse | εse | εse | εse | εse | εse | |
| 293 | 15.14 | 13.03 | 11.75 | 10.30 | 7.94 | 17.06 | 15.63 | 8.13 |
| 313 | 13.03 | 11.04 | 9.82 | 8.57 | 6.66 | 13.93 | 13.18 | 6.46 |
| 333 | 10.96 | 9.20 | 8.13 | 7.10 | 5.65 | 11.15 | 10.72 | 5.30 |
| 353 | 9.28 | 7.73 | 6.78 | 6.00 | 4.92 | 8.95 | 8.95 | 4.67 |
| 373 | 7.85 | 6.61 | 5.70 | 5.13 | 4.30 | 7.40 | 7.45 | 4.17 |
| 393 | 6.68 | 5.78 | 5.00 | 4.50 | 3.87 | 6.25 | 6.31 | 3.87 |
| 413 | 5.70 | 5.07 | 4.47 | 4.07 | 3.58 | 5.39 | 5.37 | 3.59 |
| 433 | 5.01 | 4.50 | 4.07 | 3.74 | 3.35 | 4.71 | 4.68 | 3.35 |
| 453 | 4.41 | 4.06 | 3.75 | 3.46 | 3.16 | 4.18 | 4.17 | 3.16 |
| 473 | 3.98 | 3.70 | 3.45 | 3.20 | 2.98 | 3.66 | 3.76 | 2.98 |
| 493 | 3.60 | 3.39 | 3.19 | 3.00 | 2.82 | 3.19 | 3.38 | 2.82 |
| 513 | 3.27 | 3.09 | 2.98 | 2.82 | 2.69 | 2.77 | 3.09 | 2.69 |
Рис 2.
Температурные зависимости статической диэлектрической проницаемости εseliq(Т) алканолов от: а – εseliq(Tcr – T) [7]: 1 – метанол (Tcr = 512.5 K), 2 – этанол (Tcr = 514.0 K), 3 – 1-пропанол (Tcr = 536.8 K), 4 – вт-пропанол (Tcr = 508.3 K), 5 – 1-бутанол (Tcr = = 563.0 K), 6 – изо-бутанол (Tcr = 547.8 K), 7 – вт-бутанол (Tcr = 536.2 K), 8 – вт-бутанол на данной установке, 9 – трет-бутанол (Tcr = 506.2 K): вставка εseliq(Т) 1-бутанол [10]; б – εseliq(Т): 1 – 1-пентанол, 2 – изо-пентанол, 3 – 1-гептанол, 4 – 1-октанол, 5 – 1-деканол, 6 – изо-пентанол, 7 – вт-бутанол, 8 – вт-октанол: вставка – εsv(Т) пара и εseliq(Т) ДЭЭ [8].
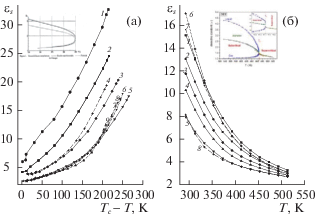
Диэлектрические проницаемости пара εsv(T) и жидкой фазы εsliq(T) диэтилового эфира (ДЭЭ) в отсутствие Н-связей были изучены на частоте 100 кГц [8] при термостатировании с точностью ΔT = ±0.03 K как ниже Tcr, так и в сверхкритической области (вставка рис. 2б). Возможное влияние градиента плотности в критической области устранялось ультразвуковым перемешиванием.
При сравнении температурных зависимостей статической диэлектрической проницаемости εsliq(T) на линии равновесия пар−жидкость в окрестности критической температуры жидкостей с водородными (Н) и без водородных связей наблюдались следующие различия. При T < Tcr экспериментальные данные εsliq(T) ДЭЭ [8] были описаны степенными функциями температурной зависимости диаметра d(T) линии равновесия пар−жидкость (бинодали)
(1)
$\begin{gathered} d{\text{(}}T{\text{)}} = \frac{{{{\varepsilon }_{{{\text{sliq}}}}} + {{\varepsilon }_{{{\text{sv}}}}}}}{{\text{2}}} = \varepsilon _{{{\text{cr}}}}^{d} + {{B}_{{\text{d}}}}{{({{T}_{{{\text{cr}}}}} - T)}^{{{\text{2}}\beta }}} + \\ + \;{{A}_{{\text{d}}}}{{({{T}_{{{\text{cr}}}}} - T)}^{{{\text{1}} - \alpha }}} + {{C}_{{\text{d}}}}({{T}_{{{\text{cr}}}}} - T) \\ \end{gathered} $(2)
$M{\text{(}}T{\text{)}} = {{\varepsilon }_{{{\text{sliq}}}}}(T) - {{\varepsilon }_{{{\text{sv}}}}}(T) = {{B}_{\varepsilon }}{{({{T}_{{{\text{cr}}}}} - T)}^{\beta }} + ...\;.$Линейная зависимость диэлектрических свойств ДЭЭ наблюдалась в координатах lg(εsliq(T) – ‒ εsv(T) от lg(T – Tcr) [13]. Во всем интервале существования жидкой фазы величина εsliq(T) уменьшалась от εsliq(330 K) ∼ 4.5 до εsliq(Tcr = 467 K) ∼ 1.5. Аналогичные зависимости наблюдались для неполярных жидкостей и неассоциированных галогенводородов CFCl3, C6H5Cl, C6H5F [10] во всем интервале температур существования жидкой фазы. Но на той же установке [10] εsliq(T) 1-бутанола менялось от 3.2 до 1.8 только в узком интервале 523–563.0 K критической области.
Авторы [10] отметили, что такие отличия обусловлены различием молекулярных структур жидкой фазы, которые характеризуются фактором корреляции g, равным отношению среднестатистического квадрата дипольного момента молекулы $\mu _{{\text{m}}}^{2}$ в жидкой фазe к квадрату дипольного момента молекулы в вакууме $\mu _{{\text{v}}}^{2}$. Используя ряд допущений, они рассчитали по уравнению Онзагера–Кирквуда–Фрелиха [10] только фактор корреляции g(T) галогенводородов:
(3)
$g = \frac{{\mu _{{\text{m}}}^{2}}}{{\mu _{{\text{v}}}^{2}}} = \frac{{9{{k}_{{\text{B}}}}T{{V}_{{\text{m}}}}}}{{4\pi {{N}_{{\text{A}}}}\mu _{{\text{v}}}^{2}}}\frac{{({{\varepsilon }_{{{\text{sliq}}}}} - {{\varepsilon }_{\infty }})(2{{\varepsilon }_{{{\text{sliq}}}}} + {{\varepsilon }_{\infty }})}}{{{{\varepsilon }_{{{\text{sliq}}}}}{{{({{\varepsilon }_{\infty }} + 2)}}^{2}}}}$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
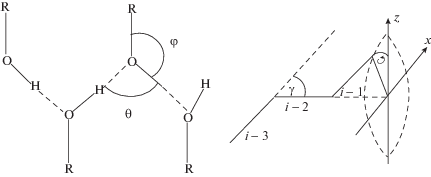
Экспериментальные данные εsliq(T) высших алканолов были описаны нами моделью цепочечной ассоциации алканолов [15–17] с заторможенным вращением (рис. 3).
При расчете фактора корреляции g(T) по уравнению (3) деформационная диэлектрическая проницаемость ε∞ при бесконечно большой частоте определялась по уравнению Клаузиуса–Мосотти:
(4)
${{\varepsilon }_{\infty }} = \frac{{{{V}_{{\text{m}}}} + 2{{P}_{\infty }}}}{{{{V}_{{\text{m}}}} - {{P}_{\infty }}}}.$Деформационная поляризация алканолов рассчитывалась через поляризации связей Р∞2 = = nCHР∞(С–Н) + nCCР∞(С–С) + 2Р∞(C–OH), где Р∞(С–Н) = 1.70 cм3 моль–1, Р∞(С–С) = 1.22 cм3 моль–1, Р∞(C–OH) = 4.76 cм3 моль–1 [15].
Согласно модели 1 рассчитанный параметр заторможенного вращения молекул 1-алканолов внутри цепочек вокруг Н-связей η = cos φ1 = 0.250–0.378 [16] возрастал с увеличением длины углеводородного радикала (табл. 3).
Таблица 3.
Сравнение εseliq(Т) [9] и εsmd(Т) 1-алканолов
| Параметр | Метанол | Этанол | 1-Пропанол | 1-Бутанол | 1-Пентанол | 1-Гексанол | 1-Гептанол | 1-Октанол | Ссылка |
|---|---|---|---|---|---|---|---|---|---|
| T, K | 298 | 298 | 298 | 298 | 298 | 298 | 295 | 293 | |
| εsexp | 32.6 | 24.3 | 20.1 | 17.51* | 13.9 | 13.3 | 12.1 | 10.3 | [20] |
| εsmd | 27.7 | 18.9 | 14.5 | 11.4 | 8.9 | 8.6 | 8.9 | 2.9 | [19] |
| δεs, % | –15.1 | –22.2 | –27.9 | 34.9 | –36.0 | –35.3 | –26.4 | –71.8 | |
| T, K | 293 | ||||||||
| εsexp | 33.0 | 25.3 | 20.8 | 17.8 | 15.1 | 13.0 | 10.3 | [20] | |
| εsmd | 34.3 | 24.8 | 20.7 | 18.4 | 14.9 | 12.9 | 10.0 | [11] | |
| θmd, ° | 118.6 | 122.1 | 126.8 | 128.6 | 130.4 | 128.0 | 132.4 | ||
| φ1, ° | 104.48 | 107.34 | 109.27 | 110.85 | 111.22 | 111.72 | 112.03 | 112.21 | [15] |
| (θmd − φ1), ° | 14.1 | 14.8 | 17.5 | 17.7 | 19.2 | 16.3 | 20.2 | ||
| εs exp | 20.8 | 18.13 | 15.14 | 13.03 | 11.75 | 10.30 | [16] | ||
| εsth | 21.2 | 17.52 | 15.20 | 12.87 | 11.81 | 10.36 | [10] | ||
| δεs, % | 1.9 | 3.36 | 0.4 | 1.23 | 0.5 | 0.6 | [14] | ||
Обзор МД-моделей метанола [18] показал, что рассчитанные значения εseliq(Т) (298 K) = 17.7–32 ± ± 4 могли отличаться от экспериментального εse = = 32.7 до 1.8 раза. В рамках предлагаемой МД-модели [18] была показана необходимость учитывать дипольную корреляцию кластер−кластер, которая вносит дополнительный 20%-й вклад в величину εsmd.
При анализе возможностей МД-модели [19], учитывающей полярность гидроксильной группы рассчитанные εsmd(298 K) 1-алканолов (nC = 1–8) сравнивались с величинами εse [20]. С увеличением длины углеводородного радикала от метанола до 1-деканола погрешность заниженных значений εsmd возрастала от –15.15 до –71.8% (табл. 3).
Наиболее точные результаты были получены в термодинамической МД-модели 2 (рис. 4), учитывающей геометрическую конфигурацию структуры водородой связи [11].
Рис. 4.
Структура димера и цепочек при ассоциации за счет образования zij межмолекулярных водородных (Н) связей в термодинамической модели 2 цепочечной ассоциации 1-алканолов [11].
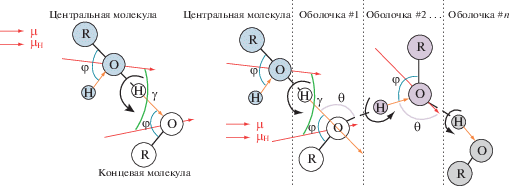
На основании предварительных МД-расчетов фактора корреляции gmax метанола [11] был выбран внутримолекулярный тетраэдрический угол φ2 = 109.47°, при котором образовывались максимум три Н-связи (две от кислорода и одна с водородом).
Фиксируя данную величину φ2 для анализируемых алканолов, авторы подбирали два основных параметра геометрии ассоциации: угол О–Н..О–Н=θmd при образовании водородных связей и cos(φ2) и рассчитали фактор корреляции gmax [11].
(5)
${{g}_{{\max }}}(T) = 1 + \frac{{{{z}_{{ij}}}\cos {{\gamma }_{{ij}}}}}{{\cos {{\theta }_{{ij}}} + 1}}.$Данные расчеты коррелируют с моделью 1 цепочечной ассоциации алканолов [15–17]. В МД-модели 1 величины φ1, определяющие угловое положение звена цепочки внутри ее валентного конуса (φ1 = 0 для транс-положения) приведены в табл. 3. Они меньше МД-параметра θmd. С ростом длины углеводородного радикала различие (θij – φij)° увеличивалось от 14.1 до 20.2° (табл. 3).
Таким образом, приведенные исследования показали, что статические диэлектрические проницаемости 1-алканолов выше температур кипения отражают различие их молекулярных структур за счет разрыва межмолекулярных Н-связей. Полученные требования к выбору геометрии угла ассоциации О–Н…О–Н в молекулярно-динамических моделях позволили получить более точное описание экспериментальных статических диэлектрических проницаемостей 1-алканолов.
Список литературы
Mohsen-Nia M., Amiri H., Jazi B. // J. Sol. Chem. 2010. V. 39. P. 701.
Vishwam T., Parvateesam K., Shaik Babu, Sreehari Sastry S., Murthy V.R.K. // Indian. J. Pure Appl. Phys. 2016. V. 54. P. 597.
Журавлев В.И. // Журн. физ. химии. 1992. Т. 66. № 1. С. 225.
Feng X., Hu X.X., Lin H., Duan Y. // Fluid Phase Equil. 2010. V. 290. P. 127.
Hou S.-X., Duan Y.-Y. // Fluid Phase Equil. 2010. V. 290. P. 121.
$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{C} encsky$ M., $Roha\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{c} $ V., $R\dot {u}\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{z} i\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{c} ka$ K., Fulem M., Aim K. // Fluid Phase Equil. 2010. V. 298. P. 192.
CRC Handbook of Chemistry and Physics. 84th Ed. D.R. Lide 2003–2004. CRC Press.
Drozd-Rzoska A., Rzoska S.J. // J. Chem. Phys. 2016. V. 144. P. 224506.
Dannhauser W., Bahe L.W. // J. Chem. Phys. 1964. V. 40. P. 3058.
Gerschel A., Brot C. // Mol. Phys. 1971. V. 20. № 2. P. 279.
Maribo-Mogensen B., Kontogeorgis G.M., Thomsen K. // J. Phys. Chem. B. 2013. V. 117. № 12. P. 3389.
Durov V.A., Shilov I.Y . // J. Mol. Liquid. 2007. V. 137. P. 300.
Левин В.В., Усачева Т.М., Петросян В.Г. // Приборы и техника эксперимента. 1971. № 2. С. 167.
Fragiadakis D., Roland C.M., Casalini R. // J. Chem. Phys. 2010. V. 132. P. 144505 DRS 2-ethyl-11-hexsanol.
Левин В.В. // Физика и физико-химия жидкостей. Вып. 1. М.: Изд-во МГУ, 1972. С. 176.
Левин В.В., Усачева Т.М. // Вестн. Моск. универ. 1976. № 2. С. 238.
Усачева Т.М., Шахпаронов М.И. // Сб. Современные проблемы физической химии. Изд-во МГУ, 1981. Т. 12. С. 259.
Shilov I.U. // Molecular Physics. 2015. V. 113. № 6. P. 570.
Kulschewski T., Pleiss J. // Molecular Simul. 2013. V. 39. № 9. P. 754.
Maryott A.A., Smith E.R. Table of dielectric constants of pureliquids. G.P.O. Washington. 1951
Design Institute for Physical Properties (DIPPR) Project 801 Database, 2012 ed. http://www.aiche.org/dippr.
The Landolt-Börnstein Database, http://www.springermaterials. com (accessed Aug 1, 2012).
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии