Журнал физической химии, 2021, T. 95, № 4, стр. 594-605
Адсорбция бензола на нанопористых силикагелях с привитыми полифторалкильными слоями и смачиваемость
Т. М. Рощина a, *, Н. К. Шония a, **, О. П. Ткаченко b, Л. М. Кустов a, b
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
119991 Москва, Россия
b Российская академия наук, Институт органической химии им. Н.Д. Зелинского
119991 Москва, Россия
* E-mail: 2474747@mail.ru
** E-mail: natalyashonija@gmail.com
Поступила в редакцию 24.05.2020
После доработки 24.05.2020
Принята к публикации 28.05.2020
Аннотация
Методами газовой хроматографии (ГХ), статической адсорбции и ИК-спектроскопии диффузного отражения проведено комплексное исследование особенностей процесса адсорбции бензола в полифторалкильных слоях разного строения, привитых к поверхности силикагеля SG. После модифицирования константы Генри по данным ГХ и величины адсорбции бензола, полученные статическим методом, снижаются в ряду: SG > SG‑F(III) > SG‑F > SG‑isoF(III), где для получения образцов SG‑F(III), SG‑F и SG‑isoF(III) использованы силаны nC6F13(CH2)2SiCl3, nC6F13(CH2)2Si(CH3)2Cl и isoC3F7(CH2)2SiCl3 соответственно. Обнаружено, что энергетические характеристики бензола и других углеводородов на образце SG‑F(III) с линейным трифункциональным модификатором превосходят на 3–7 кДж/моль величины, полученные на исходном носителе. На основе десорбционных данных в области капиллярно-конденсационного гистерезиса изотерм адсорбции бензола рассчитаны углы смачивания на нанопористых силикагелях с полифторалкильными слоями.
Известно, что материалы, в состав которых входят поверхностные перфторалкильные группы, могут обладать чрезвычайно высокими гидрофобными и олеофобными свойствами [1]. В связи с этим полифторорганические соединения применяются для создания покрытий с водоотталкивающими и незагрязняющимися, антикоррозионными и антибактериальными свойствами в мембранных технологиях [2–6], электронике [6, 7], автомобильной и текстильной промышленности [8–12], медицине [3, 13, 14], архитектуре [15] и других областях.
Выделяют два принципиально различных метода получения поверхностей с полифторорганическим покрытием – адсорбционное и химическое модифицирование. Адсорбционный метод – наиболее простой и удобный [16]. Например, Фторопласт-42 в растворе ацетона предназначен для получения атмосферо-, радиационно- и химически стойких покрытий на самых разных поверхностях, включая металлы и стекла [17].
Однако адсорбционные модифицирующие слои часто оказываются недостаточно термически стабильными или нестойкими к воздействию растворителей и паров. Поэтому для получения материалов со стабильными свойствами, включая стационарные фазы для хроматографии [18, 19], а также для создания эффективных водо- и грязезащитных покрытий полифторорганический слой должен быть как можно более прочно связан с подложкой, и, следовательно, необходимо ковалентное связывание модификатора с поверхностью.
При исследовании физико-химических характеристик поверхностей с полифторорганическим покрытием используют разнообразные методы. Основной метод оценки лиофобности привитых слоев – определение краевых углов смачивания θ. По мнению авторов [1], “тест на смачиваемость является одним из самых быстрых и, вероятно, самым чувствительным методом контроля качества гидрофобных поверхностей и плотности упаковки привитых молекул”. Установлено [1, 2, 20], что по степени гидрофобизации и олеофобизации поверхности полифторалкильные привитые слои существенно превосходят алкильные и полиметилсилоксановые. В [6] детально исследовано влияние длины перфторированного радикала в монослоях фторзамещенных гексадекантиолов на золоте на углы смачивания полярными протонными (вода и глицерин) и полярными апротонными (ДМФ и ацетонитрил) жидкостями. Показано, что при замене атомов водорода в метильной группе на атомы фтора наблюдается заметное снижение угла смачивания. Однако при увеличении длины полностью фторированной углеродной цепочки угол смачивания увеличивается и, начиная с числа атомов углерода 4, практически не изменяется. Важно отметить, что метод смачивания неинформативен для слоев, закрепленных на пористых и дисперсных материалах. Поскольку применение таких материалов на практике непосредственно связано с физико-химическими свойствами модифицированной поверхности, актуально изучение адсорбционных равновесий с их участием.
В работе [21], первой, по нашим сведениям, посвященной применению адсорбционно-статического метода для исследования кремнеземов с привитыми полифторалкильными группами, показано, что на октадецилкремнеземе наблюдается почти столь же высокая адсорбция бутана, выбранного авторами для оценки олеофобных свойств поверхности, как и на исходном носителе, в то время как на фторсодержащих поверхностях соответствующие величины в несколько раз меньше. Олеофобный характер тем больше, чем выше содержание фторалкильных групп на поверхности, т.е. в случае покрытия полимерного типа. Подобное уменьшение адсорбции гексана отмечено в [22] при переходе от алкил- к полифторалкилкремнеземам.
В работах [23, 24] исследованы свойства поверхности кремнеземов, модифицированных моно-, би- и трихлорсиланами с перфторгексильными группами с образованием плотных монослоев (концентрация привитых групп не менее 2 нм–2), методами статической адсорбции, газовой хроматографии и ИК-спектроскопии. В качестве исходного носителя выбран аэросилогель (коммерческое название Силохром), поскольку эта разновидность кремнезема обладает высокой химической однородностью поверхности, широкими порами (эффективный диаметр 40–50 нм) и достаточно развитой удельной поверхностью (100 м2/г), что способствует исследованиям методом ГХ [16]. Установлено, что такое модифицирование приводит к снижению констант Генри и величин адсорбции как н-алканов, так и ароматических углеводородов, при этом ключевую роль в описании адсорбционных процессов часто играет энтропийный фактор. Предположительно при модифицировании би- и трифункциональными модификаторами появляются новые, более активные, по сравнению с исходным носителем, центры. В случае использования трихлорсилана привитые покрытия обладают наиболее высокими экранирующими свойствами по отношению к бензолу при давлении насыщенных паров, а в случае монохлорсилана получаются наиболее олеофобные и неполярные покрытия.
Согласно [25], чем выше концентрация и меньше длина привитой цепи, тем более резко (от 2 до 25 раз) снижаются величины адсорбции углеводородов в результате модифицирования кремнезема монофункциональными полифторалкилсиланами, в состав которых входило 3, 4 или 6 полностью фторированных атомов углерода. Это отражает увеличение степени олеофобизации поверхности при образовании полифторорганических покрытий в данном направлении.
Согласно ИК-спектроскопическим данным [23–25], к общим свойствам химически модифицированных аэросилогелей, независимо от концентрации привитых полифторалкильных групп, относится отсутствие полос поглощения свободных силанольных групп.
Следует отметить, что силикагели относятся к наиболее востребованным для практического применения разновидностям кремнезема [1, 16]. Поэтому наша работа [26] была посвящена изучению методами адсорбции и ГХ поверхностных свойств силикагелей, модифицированных трифункциональными полифторалкилсиланами nC6F13(CH2)2SiCl3 и isoC3F7(CH2)2SiCl3, в сопоставлении с силикагелем с привитым монофункциональным силаном nC6F13(CH2)2Si(СН3)2Cl. Обнаружено существенное различие в ходе изотерм адсорбции–десорбции азота и гексана в области капиллярно-конденсационного гистерезиса, связанное с лиофобностью полифторалкильных слоев. Совокупность адсорбционно-статических и ГХ данных указывает на то, что наиболее низкая адсорбционная активность в отношении алканов характерна для образца, в состав которого входит привитая группа разветвленного строения. Согласно термогравиметрическому анализу, термическая стабильность образцов достаточно высока – деструкция привитого слоя в токе сухого азота начинается при температуре выше 650 К.
В настоящей работе получены новые данные по исследованию силикагеля и химически модифицированных кремнеземов (ХМК) с привитыми полифторалкильными группами на его основе методами газовой хроматографии, статической адсорбции и ИК-спектроскопии. Связь строения привитого слоя со свойствами поверхности ХМК изучалась в основном на основе данных по адсорбции паров бензола – традиционного адсорбционного зонда.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сорбенты
Образцы ХМК синтезированы по методикам, приведенным в работах [23, 25]. Обозначения, состав модификатора и отдельные характеристики образцов приведены в табл. 1.
Таблица 1.
Обозначения, модификатор и характеристики образцов
| Величина | SG | SG-F | SG-F(III) | SG-isoF(III) |
|---|---|---|---|---|
| – | nC6F13(CH2)2Si(CH3)2Cl | nC6F13(CH2)2SiCl3 | isoC3F7(CH2)2SiCl3 | |
| N | – | 1.3 | 2.1 | 2.7 |
| m | – | 0.205 | 0.291 | 0.253 |
| KГ | 0.028 | 0.014 | 0.017 | 0.0093 |
| а | 1.06 | 0.41 | 0.49 | 0.26 |
| V (по N2) | 1.19 | 0.84 | 0.73 | 0.77 |
| V (по бензолу) | 1.18 | 0.82 | 0.59 | 0.68 |
| d (по N2) | 13.2 | 11.6 | 11.0 | 11.6 |
| dm (по бензолу) | 11.3 | 17.3 | 17.7 | 19.5 |
| sуд (по N2) | 297 | 249 | 246 | 239 |
| sуд (расчет) | 236 | 211 | 222 | |
| sуд (по бензолу) | 282 | 59 | 74 | 39 |
Обозначения: концентрация привитых групп (N, нм–2), массовая доля привитого соединения в образце (m), константа Генри (KГ) гексана при 403 К, величина адсорбции (а, мкмоль/м2) гексана при относительном давлении паров p/p0 = 0.2 и 298 К, объем пор (V, мл/г), эффективный диаметр пор (d, нм), эффективный диаметр мениска (d, нм), удельная поверхность (sуд, м2/г))
Методы
Согласно [26], концентрацию привитых групп определяли по результатам элементного анализа на углерод (прибор Perkin Elmer 2400 CHN Analyzer, Schwarzkopf Microanalytical Lab., Woodside, NY) по формуле, приведенной в [1]. Погрешность определения ≤0.7%. Изотермы адсорбции азота измеряли на сорбтометре ASAP-2020 (Micromeritics, Norcross, GA, USA) при 77 К [26]. Перед измерениями образцы подвергали термообработке в вакууме при 423 К, 10–5 мм рт. ст. в течение 10–12 ч. Изотермы адсорбции паров бензола всеми изучаемыми образцами получали весовым статическим методом (пружинные весы Мак-Бэна–Бакра [27]) при 298 К. Перед измерениями образцы подвергали вакуумной термообработке при 423 К и давлении 10–5 мм рт. ст. Время установления адсорбционного равновесия составляло от 15–30 мин в области до относительного давления p/p0 → → 0.7–0.8 и до 8–10 ч в области p/p0 → 1.
Газохроматографические исследования ХМК выполняли на хроматографе “Хром-5” с пламенно-ионизационным детектором, гелием в качестве газа-носителя (расход газа 15–25 мл/мин) и стеклянными колонками (длина 1 м, внутренний диаметр 2–2.5 мм). Перед проведением измерений образцы подвергали термообработке в токе гелия при температуре 450 К в течение 30 ч. Пробы веществ в виде разведенных в 2–30 раз паров вводили с помощью шприца в количестве 0.1–0.2 мл.
Константы Генри адсорбционного равновесия ${{K}_{\Gamma }}$ рассчитывали из измеряемых ГХ параметров по формулам, приведенным в [16, 27]. В качестве стандартных состояний вещества использовали: 1 мкмоль/мл в газовой фазе и 1 мкмоль/м2 в адсорбированном состоянии. Начальные (область Генри) теплоты адсорбции q и стандартные энтропии адсорбции ΔS° в приближении их независимости от температуры рассчитывали из температурных зависимостей ${{K}_{\Gamma }}$ по уравнению [16, 27]:
где q = –∆U, ∆U – дифференциальное мольное изменение внутренней энергии при адсорбции. Погрешность определения q и ΔS° составляла от 2 до 5%. Вклады специфического взаимодействия ΔGsp оценивали согласно уравнению [16]: где ΔG° – энергия Гиббса адсорбции и ΔGd – энергия дисперсионных сил исследуемого соединения, равная значению ΔGd реального или гипотетического н-алкана с той же поляризуемостью.ИК-спектры диффузного отражения (DRIFTS) регистрировали при комнатной температуре на спектрометре NICOLET “Protege” 460, оснащенном разработанной в ИОХ им. Н.Д. Зелинского приставкой [28], в интервале 6000–400 см–1 с шагом 4 см–1. Для удовлетворительного соотношения сигнал/шум число накоплений составляло 500 спектров. Перед измерением спектров образцы разбавляли порошком CaF2, а затем подвергали термовакуумной обработке при 423 К и давлении 10–3 мм рт. ст. в течение 4 ч (скорость нагрева 5 К/мин). Адсорбцию C6Н6 проводили при комнатной температуре и давлении насыщенных паров 85 мм рт. ст. Интенсивность полос поглощения в спектрах выражали в единицах Кубелки–Мунка [27, 29]. Регистрацию и обработку спектров вели по программе OMNIC.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
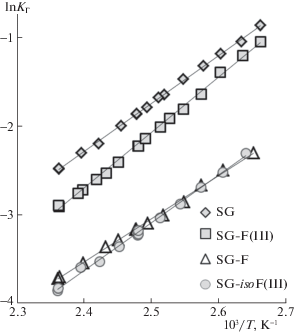
Газовая хроматография. Исследованы термодинамические характеристики адсорбции бензола, а также толуола и этилбензола, при введении проб адсорбата в количестве менее наномоля, т.е. в области предельно малых заполнений поверхности. Как следует из рис. 1, константы Генри ${{K}_{\Gamma }}$ бензола, определенные в интервале температур 374–423 К, снижаются после модифицирования. В группе модифицированных образцов самые высокие значения ${{K}_{\Gamma }}$ наблюдаются на SG‑F(III), далее следуют ${{K}_{\Gamma }}$ на SG‑F, а затем величины ${{K}_{\Gamma }}$ немного падают на SG‑isoF(III). Подобные закономерности наблюдаются и в случае толуола и этилбензола, а также н‑алканов, но степень снижения ${{K}_{\Gamma }}$ последних относительно исходного носителя на SG‑isoF(III) по сравнению с SG‑F выражена заметнее, например, для гексана в 1.5 раза больше на SG‑isoF(III) (табл. 1). В отличие от ${{K}_{\Gamma }}$ энергетические характеристики на образце SG‑F(III) превосходят на 3–7 кДж/моль величины, полученные на исходном носителе (табл. 2). Это относится к теплотам адсорбции q не только аренов, но и н‑алканов [26], например, октана (табл. 2). На SG‑F и SG‑isoF(III) значение q меньше (за исключением бензола на SG‑isoF(III)), чем на исходном носителе, но на SG‑isoF(III) выше, чем на образце с монофункциональным модификатором SG‑F, хотя концентрация привитых групп на SG‑F наименьшая.
Таблица 2.
Теплоты (q, кДж/моль) и стандартные энтропии (ΔS°, Дж/(моль К)) адсорбции
| Сорбат | SG | SG-F | SG-F(III) | SG-isoF(III) | ||||
|---|---|---|---|---|---|---|---|---|
| q | –ΔS° | q | –ΔS° | q | –ΔS° | q | –ΔS° | |
| Октан | 38 | 124 | 33 | 118 | 41 | 136 | 35 | 128 |
| Бензол | 45 | 135 | 40 | 134 | 52 | 155 | 45 | 145 |
| Толуол | 51 | 144 | 45 | 141 | 56 | 160 | 49 | 152 |
| Этилбензол | 57 | 154 | 47 | 143 | 60 | 165 | 52 | 157 |
Эти факты можно объяснить, если учесть, что на силикагелях, синтезированных с помощью трифункциональных модификаторов, т.е. на SG‑F(III) и SG‑isoF(III), в отличие от кремнезема с привитым монофункциональным модификатором SG‑F, существуют дополнительные активные адсорбционные центры в модифицирующем слое. Это, прежде всего, – доступные для адсорбции гидроксильные группы у якорного атома кремния, образовавшиеся в результате гидролиза непрореагировавших атомов хлора в молекулах трифункциональных модификаторов. Тем не менее, следует учесть, что на аэросилогеле с привитым трифункциональным силаном с неполярными октильными радикалами величина q аренов ниже, чем на исходном носителе [30]. Следовательно, необходимо учесть дополнительное взаимодействие с полярными фрагментами –+δСН2––δСF2– или –+δСН2––δСF‑ привитой цепи. Высокая концентрация и разветвленное строение привитых групп на SG–isoF(III) способствуют лучшему экранированию как дополнительных гидроксильных групп, образовавшихся при синтезе, так и остаточных силанолов носителя, что снижает теплоты адсорбции углеводородов в сравнении с образцом SG‑F(III) (табл. 2).
Анализ данных по энтропиям адсорбции показывает, что наименьшие значения ΔS° характерны для образца SG‑F(III). Следовательно, уменьшение значения ${{K}_{\Gamma }}$ на SG‑F(III) по сравнению с полученным на SG обусловлено понижением энтропии адсорбции, обычно на 10–20 Дж/(моль К) (табл. 2). Можно предположить, что это связано с формированием сравнительно структурированных привитых слоев на SG‑F(III), образованных с помощью линейного трифункционального силана, снижающих подвижность адсорбированных молекул. Причина уменьшения констант Генри на SG‑isoF(III) по сравнению с SG‑F также лежит в снижении ΔS° на первом (табл. 2).
Таким образом, в системах с участием ХМК особенно внимательно следует относиться к энтропийному фактору, который оказывает немаловажное, а часто и определяющее влияние на закономерности адсорбции соединений.
С целью оценки вклада специфических взаимодействий в адсорбцию бензола, π‑связи молекулы которого способны к образованию водородных связей и электростатическому взаимодействию, результаты сопоставлены с полученными для гексана, адсорбирующегося преимущественно за счет универсальных дисперсионных взаимодействий. Как видно из рис. 2, на котором представлены температурные зависимости $\ln K_{\Gamma }^{{{\text{отн}}}}$ , где $K_{\Gamma }^{{{\text{отн}}}}$ – отношения констант Генри бензола к гексану, величина $K_{\Gamma }^{{{\text{отн}}}}$ на исходном носителе ниже, чем на образце SG‑F(III), но выше, чем на SG‑isoF(III), а наименьшие значения $K_{\Gamma }^{{{\text{отн}}}}$ характерны для SG‑F. В том же порядке изменяется наклон температурных зависимостей $\ln K_{\Gamma }^{{{\text{отн}}}}$, определяющий разности теплот адсорбции этих молекул Δq (кДж/моль), равные 19, 16, 15 и 13 на SG‑F(III), SG, SG‑isoF(III) и SG‑F соответственно. Следовательно, так называемая полярность [16] поверхности снижается в ряду SG‑F(III) > SG > > SG‑isoF(III) > SG‑F. Индексы удерживания Ковача, например, для бензола 984, 956 и 847 на SG‑F(III), SG‑isoF(III) и SG‑F соответственно [26], и вклады специфических взаимодействий аренов в адсорбцию (табл. 3) изменяются на модифицированных образцах в том же направлении. Полученные данные связаны не только с наличием дополнительных гидроксилов у якорного атома кремния на SG‑F(III) и SG‑isoF(III). Следует также обратить внимание на возможно более активное участие в адсорбции полярного фрагмента привитой полифторалкильной цепи ‒+δСН2––δСF2– или –+δСН2––δСF–, сформированной с помощью трифункционального модификатора, присутствие которого способствует увеличению вклада специфического взаимодействия.
Рис. 2.
Зависимости $\ln K_{\Gamma }^{{{\text{отн}}}}$ ($K_{\Gamma }^{{{\text{отн}}}}$ = KГ(бензол)/KГ(гексан)) от обратной температуры.
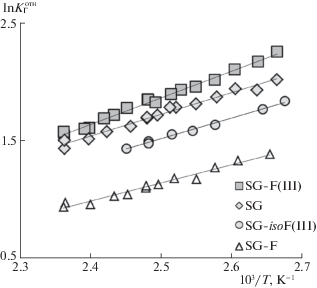
Таблица 3.
Вклады энергии специфических взаимодействий (–ΔGsp, кДж/моль) в энергию Гиббса адсорбции при 403 K
| Адсорбат | SG | SG-F | SG-F(III) | SG-isoF(III) |
|---|---|---|---|---|
| Бензол | 7 | 5 | 7 | 6 |
| Толуол | 8 | 5 | 8 | 7 |
| Этилбензол | 8 | 5 | 8 | 6 |
Адсорбция в статических условиях. В табл. 1 приведены текстурные характеристики образцов, рассчитанные из изотерм адсорбции азота [26] и бензола. Общий объем пор V уменьшается после модифицирования, причем тем в большей мере, чем выше массовая доля привитого слоя в образце. Для исходного носителя и образца SG‑F значения V по азоту и по бензолу одинаковы, что соответствует правилу Гурвича [31], а для образцов с трифункциональными модификаторами значения V по азоту выше, чем по бензолу на ≈10%. Можно предположить, что плотность бензола, адсорбированного в порах SG‑F(III) и SG‑isoF(III), меньше плотности жидкого бензола.
Значения удельной поверхности sуд (по N2), рассчитанные по уравнению Брунауэра–Эммета–Теллера (БЭТ) с использованием площадки молекулы азота 0.162 нм2 [31], неплохо согласуются с рассчитанными sуд (расчет) по уравнению, подобному приведенному в [1]: sуд(ХМК) = = sуд(SG)(1 – m), где sуд(ХМК) и sуд(SG) – удельные поверхности ХМК и исходного носителя соответственно, m – массовая доля привитого соединения в образце (табл. 1). Заметим, что именно это уравнение используют для определения величины концентрации привитых групп на ХМК [1]. Применение уравнения БЭТ к изотермам адсорбции бензола дает хорошие линейные зависимости на всех образцах в области относительных давлений 0.05–0.3 (коэффициент корреляции ≥ 0.998). С использованием площадки молекулы бензола 0.49 нм2 [31] для исходного носителя SG величина sуд (по бензолу) практически равна sуд (по N2) (табл. 1). Однако для модифицированных образцов это не так (табл. 1). Для согласия данных по азоту и бензолу требуется увеличить значение площадки молекулы бензола в 3–6 раз, что противоречит физическому смыслу и указывает на высокую степень разреженности монослоя молекул бензола. Таким образом, если при определении текстурных параметров кремнезема можно использовать как азот, так и бензол, то в случае ХМК целесообразно остановиться на азоте.
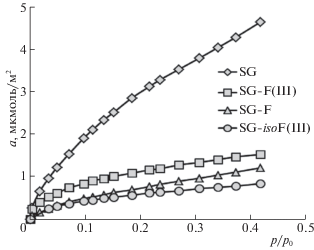
Величины адсорбции бензола а, полученные статическим методом при 298 К (рис. 3), снижаются после модифицирования в ряду SG > > SG‑F(III) > SG‑F > SG‑isoF(III). Как уже отмечено, аналогично меняются и константы Генри ${{K}_{\Gamma }}$ бензола, определенные методом газовой хроматографии (рис. 1). Тенденции в изменении величин а для гексана от образца к образцу (табл. 1) такие же, как и для бензола (рис. 3). Однако степень снижения а для гексана, как и ${{K}_{\Gamma }}$, относительно исходного носителя на SG‑isoF(III) по сравнению с SG‑F выражена заметнее, чем для бензола, например, значение а для гексана при p/p0 = 0.2 и 298 К падает в 1.6 раза сильнее на SG‑isoF(III) (табл. 1).
Отношения величин адсорбции бензола и гексана (α), которые коррелируют с вкладом специфических взаимодействий в адсорбцию бензола, при p/p0= 0.2 и 298 К: α=2.6, 2.4 и 1.9 на SG‑F(III), SG‑isoF(III) и SG‑F соответственно. Это также согласуется с ГХ-данными по $K_{\Gamma }^{{{\text{отн}}}}$ (рис. 2). Таким образом, возможно наличие двух метильных групп вместо дополнительных ОН-групп у якорного атома кремния на SG‑F приводит к наименьшим значениям $K_{\Gamma }^{{{\text{отн}}}}$, Δq и α.
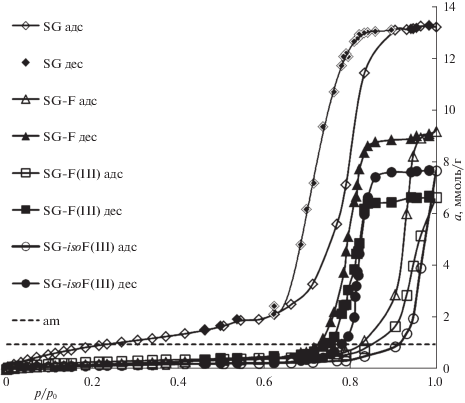
Полные изотермы адсорбции–десорбции бензола приведены на рис. 4. Вследствие уменьшения объема пор при модифицировании обе ветви петли капиллярно‑конденсационного гистерезиса (ККГ) бензола на ХМК располагаются ниже, чем на исходном носителе. Однако, в отличие от азота [26], изотермы бензола на ХМК заметно смещаются в область более высоких, по сравнению с SG, величин р/р0. Заполнения монослоя am (ммоль/г), рассчитанного с учетом размера молекулы бензола с помощью sуд для исходного носителя (am = sуд/wNA, где w – площадка молекулы бензола, принятая равной 0.49 нм2, NA – число Авогадро), на всех ХМК не происходило вплоть до р/р0 = 0.8–0.9, что связано с существенным снижением поверхностной энергии и смачиваемости фторсодержащих покрытий углеводородами. Так, $\cos \theta $ (θ – краевой угол смачивания), измеренный для бензола на кремниевой пластинке, модифицированной монофункциональным перфторгексилсиланом, меньше 1 [32], причем, по данным для гексадекана [20], поверхностное натяжение которого (27.5 мН/м) близко к значению для бензола (28.2 мН/м), $\cos \theta $ уменьшается при переходе от пластинки с монофункциональным модификатором к пластинке с трифункциональным силаном, что согласуется с последовательностью смещения изотерм адсорбции бензола.
Рис. 4.
Полные изотермы адсорбции–десорбции бензола (аm (ммоль/г) – расчетная емкость монослоя). Темные точки – десорбция.
Оценка θ выполнена на основе кривых десорбции бензола, как и ранее в [26] для гексана, полученных на ХМК. Использовали простую модель [31, 32], которая чаще всего служит основой расчетов распределения пор по размерам, – уравнение Кельвина для цилиндрических пор: ${{d}_{{\text{m}}}} = \frac{{4\sigma {{V}_{{\text{m}}}}}}{{RT{\text{ln}}({{p}_{0}}{\text{/}}p)}}$, где dm – диаметр полусферического мениска, σ (для бензола 28.2, для гексана 17.9 мН/м) и Vm – поверхностное натяжение и мольный объем жидкого адсорбата соответственно при температуре опыта T, R – газовая постоянная. Соотношение между диаметром мениска dm, диаметром коры dС, толщиной адсорбционной пленки τ и диаметром пор dр следует из рис. 5 [31]. При полном смачивании $\cos \theta $ = 1, dm = dС и dp = = dC + 2τ, что предполагается на исходном носителе. При неполном смачивании 0 < $\cos \theta $ < 1 и dC = dm$\cos \theta $. Поскольку в литературе отсутствуют сведения о величинах τ на поверхностях с полифторалкильными слоями, в качестве опорных данных мы использовали полные изотермы адсорбции N2 и бензола на широкопористых аэросилогелях ASG и ASG-F. Выбор обусловлен тем, что эти образцы детально исследованы в наших работах [22, 25] с применением комплекса физико‑химических методов, концентрация привитых групп, таких же, как у SG‑F, ASG‑F (N = 1.1 нм–2) близка к SG‑F, широкие поры (по бензолу ≈50 нм) обеспечивают то, что основание ККГ для бензола и гексана находится при р/рS ≥ 0.8 [32]. Поэтому для расчета средних значений τ использовали известное уравнение для непористых адсорбентов: τ = аVm/sуд, где а (ммоль/г) – величина адсорбции при измеряемом р/р0. Значения τ на ASG и ASG‑F для N2 лежат в области литературных данных, полученных на непористом гидроксилированном SiO2, т.е. азот практически не чувствителен к влиянию природы поверхности [32]. Поскольку критическое поверхностное натяжение полифторсодержащих поверхностей лежит в интервале 10–15 мН/м [1], азот (σ = 8.9 мН/м), вероятнее всего, полностью смачивает ($\cos \theta $ = 1) полифторалкильные слои на кремнеземе. Величины τ для бензола и гексана на ASG очень близки и также соответствуют опубликованным данным для С6Н6 на SiO2. Это позволяет использовать традиционные в адсорбционных экспериментах уравнения при расчете τ для азота на SG‑F, а также τ для углеводородов на SG.
Рис. 5.
Сечение цилиндрической поры с адсорбатом; dС – диаметр коры, dm – диаметр мениска, dp – диаметр поры, θ – краевой угол смачивания, τ – толщина адсорбционной пленки.
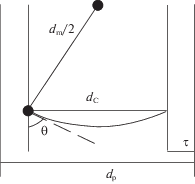
Для углеводородов τ на ASG-F много ниже, и в области, соответствующей ККГ на фторкремнеземах, составляют не более 0.33 нм [32]. Это – меньше толщины одного слоя для молекул бензола (0.37 нм) или гексана (0.4 нм). Учитывая близкие значения τ для углеводородов в области основания ККГ на SG‑F и на ASG-F, можно предположить, что сплошная адсорбционная пленка на перфторгексильных слоях не образуется вследствие ухудшения смачивания (понижением $\cos \theta $) поверхности молекулами углеводородов. Результаты расчетов диаметров, характеризующих поры, в приближении, что объем заполненных пор равен объему адсорбированной жидкости (в мл/г) при данном значении р/р0, показывают, что эффективные (наиболее вероятные) кельвиновские диаметры мениска (dm) для бензола на фторкремнеземах больше диаметра пор на исходном носителе (d = 12.6 нм) и, тем более, диаметра коры (табл. 1). Следовательно, можно оценить угол смачивания по уравнению: $\cos \theta $ = dC/dm, для чего необходимо определить dC. Использовали несколько вариантов расчета dC (во всех случаях выбраны наиболее вероятные значения размеров) [32]. Например, для системы бензол и SG‑F расчеты проводили следующим образом.
1) Принимали, что размер коры dС SG‑F по бензолу равен dС SG по бензолу, так как полагали, что dp(SG) > dp(SG-F), τ(SG) > τ(SG-F).
2) Считали, что неизвестный диаметр пор SG‑F по бензолу равен dp SG‑F по азоту, отсюда dC SG‑F (по С6Н6) = dp SG‑F (по N2) – 2τ, (здесь и далее τ находили из данных для системы бензол и опорный адсорбент ASG-F).
3) Диаметр пор $d_{{\text{p}}}^{*}$ оценивали по уравнению $\frac{{V({\text{SG}})}}{{V({\text{SG - F}})}} = {{\left( {\frac{{{{d}_{{\text{p}}}}({\text{SG}})}}{{d_{{\text{p}}}^{*}({\text{SG - F}})}}} \right)}^{2}}$, в приближении, что ”длина” цилиндрического капилляра не меняется после модифицирования, а зависит только от эффективного (и постоянного для каждого образца) размера пор. При этом использовали экспериментальные значения суммарных объемов V по бензолу (для SG рассчитан объем, соответствующий содержанию в 1 г образца SG‑F [1]) и рассчитанные значения dp (по бензолу на SG), следовательно, dС SG‑F (по С6Н6) = $d_{{\text{p}}}^{*}$ – 2τ.
4) Диаметр пор $d_{{\text{p}}}^{{**}}$ оценивали по уравнению $d_{{\text{p}}}^{{**}}$ = 4$V$/sуд, где V – по бензолу на SG‑F, а sуд для SG‑F определяли по адсорбции азота, отсюда dС SG‑F (по С6Н6) = $d_{{\text{p}}}^{{**}}$ – 2τ.
Аналогичные варианты расчетов для определения dC были использованы и для системы гексан и SG‑F.
Результаты показывают, что рассчитанные из изотерм десорбции бензола на SG‑F величины $\cos \theta $, равные 0.65, 0.63, 0.64 и 0.72 для вариантов 1, 2, 3 и 4 соответственно, неплохо согласуются со значением, полученным методом сидящей капли на модифицированной тем же силаном кремниевой пластинке (F/Si) $\cos \theta $ = 0.55. Для гексана на SG‑F получены $\cos \theta $ = 0.89, 0.75, 0.77 и 0.84 для вариантов 1, 2, 3 и 4 соответственно, а на F/Si – 0.87. При этом в согласии с традиционными представлениями, чем больше поверхностное натяжение жидкости, тем хуже смачивание ($\cos \theta $ понижается).
Оценка краевых углов смачивания с помощью вариантов 1 и 2 показала, что на SG‑F(III) значения $\cos \theta $ = 0.64 и 0.58, а на SG‑isoF(III) – 0.58 и 0.56, т.е. можно отметить рост олеофобности ХМК, полученных с помощью трифункциональных силанов. Подобные тенденции были отмечены в [26] при сравнении значений $\cos \theta $, рассчитанных с помощью варианта 2 из изотерм десорбции гексана.
Таким образом, предложены подходы к оценке углов смачивания для углеводородов на полифторалкильных поверхностях, которые приводят к объяснению нетривиальных зависимостей, связанных с влиянием модифицирования на свойства кремнеземов в области капиллярно-конденсационного процесса в лиофобных порах.
ИК-спектроскопия. На рис. 6 представлены ИК-спектры диффузного отражения образца SG в диапазоне 3900–2700 см–1 до (а) и после (б) адсорбции С6Н6. В спектре образца, обработанного в вакууме при 423 К, присутствует полоса при 3738 см–1, характерная для валентных колебаний изолированных групп Si–OH. Полоса при 3672 см–1 относится к колебаниям возмущенных водородной связью ОН-групп [33, 34].
Рис. 6.
ИК-спектры образца SG до (1) и после (2) адсорбции C6H6 в области основных частот колебаний ОН-групп и их разностный спектр (б).
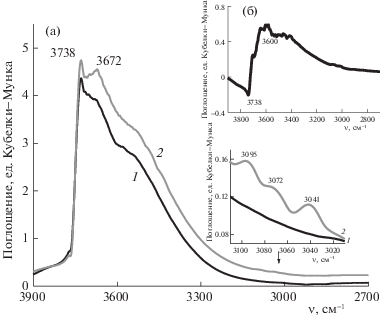
При адсорбции бензола на предварительно ваккумированном образце в спектре появляются три полосы поглощения, видные на вставке увеличенного масштаба. Полоса при 3096 см–1 характеризует валентные колебания С–Н-связи, полосы при 3072 и 3041 см–1 являются составными тонами валентных колебаний С–Н- и С–С-связей и деформационных колебаний цепи С‒С–С в плоскости бензольного кольца [33].
Адсорбция бензола на этом образце приводит к падению интенсивности полос валентных колебаний силанольных ОН-групп и увеличению интенсивности возмущенных водородной связью ОН-групп. Сдвиг полосы ОН-групп, найденный по разности спектров после и до адсорбции С6Н6 (рис. 6б), составляет 138 см–1, что свидетельствует о присутствии на поверхности исходного немодифицированного силикагеля SG гидроксильных групп, способных слабо взаимодействовать с бензолом.
На рис. 7 представлены ИК-спектры модифицированного монофункциональным силаном образца SG-F в диапазоне 3900–2700 см–1 до (а) и после (б) адсорбции С6Н6. В спектре образца, обработанного в вакууме при 423 К, отсутствует полоса, характерная для валентных колебаний изолированных Si–OH-групп [33, 34], присутствующая в спектре немодифицированного силикагеля SG (рис. 6а). В спектре вакуумированного образца SG-F в районе валентных колебаний ОН-групп наблюдаются полосы при 3695 и широкое плечо с центром при 3540 см–1, характеризующие колебания возмущенных слабой водородной связью ОН-групп. Природа такой слабо возмущенной водородной связи, возникающей в результате модифицирования, была описана ранее [23]. Кроме того, в спектре наблюдаются полосы поглощения при 2963 и 2907 см–1, характеризующие валентные колебания С–Н-связи в привитых группах [33].
Рис. 7.
ИК-спектры образца SG-F до (1) и после (2) адсорбции C6H6 в области основных частот колебаний ОН-групп и их разностный спектр (б).
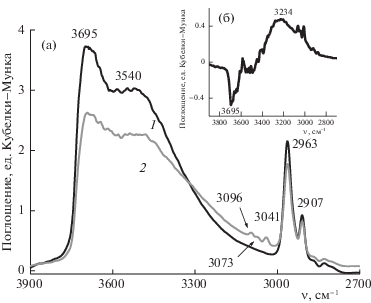
При адсорбции бензола на образце SG-F в спектре появляются три полосы поглощения. Полоса при 3096 см–1 характеризует валентные колебания С–Н-связи, полосы при 3073 и 3041 см–1 являются составными тонами валентных колебаний С–Н- и С–С-cвязей и деформационных колебаний цепи С–С–С в плоскости бензольного кольца [33].
При адсорбции бензола полосы поглощения, относящиеся к колебаниям метильных и метиленовых групп привитой цепи, остались без изменения. В районе валентных колебаний ОН-групп заметно как общее уменьшение интенсивности полос, так и изменение отношения интенсивностей. Сдвиг полосы ОН-групп, найденный по разности спектров после и до адсорбции С6Н6 (рис. 7б) составляет 461 см–1, что свидетельствует о присутствии на поверхности образца SG-F гидроксильных групп, способных достаточно сильно взаимодействовать с бензолом.
На рис. 8 представлены ИК-спектры модифицированного трифункциональным силаном образца SG-F(III) в диапазоне 3900–2700 см–1 до (а) и после (б) адсорбции С6Н6. В спектре образца, обработанного в вакууме при 423 К, отсутствуют полосы валентных и составных колебаний изолированных поверхностных Si–OH-групп, присутствующих в спектре исходного силикагеля SG [33, 34]. В спектре вакуумированного образца SG-F(III) в районе валентных колебаний ОН-групп наблюдаются полосы при 3672 и ~3464 см–1, относящиеся к колебаниям возмущенных водородной связью ОН-групп. Кроме того, в спектре образца, обработанного в вакууме, наблюдаются полосы поглощения при 2978, 2955 и 2920 см–1, характеризующие валентные колебания С–Н-связи в привитых группах.
Рис. 8.
ИК-спектры образца SG-F(III) до (1) и после (2) адсорбции C6H6 в области основных частот колебаний ОН-групп (а) и их разностный спектр (б).
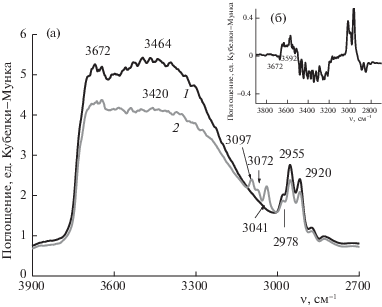
При адсорбции бензола на предварительно ваккумированном образце SG-F(III) в спектре появляются три полосы поглощения: полоса при 3097 см–1 характеризует валентные колебания С‒Н-связи, полосы при 3072 и 3041 см–1 являются составными тонами валентных колебаний С‒Н- и С–С-cвязей и деформационных колебаний цепи С–С–С в плоскости бензольного кольца [33].
При адсорбции бензола полосы поглощения, относящиеся к колебаниям метиленовых групп привитой цепи, остались без изменения. В районе валентных колебаний ОН-групп (рис. 8а) заметно уменьшение интенсивности обеих полос. Сдвиг полосы ОН-групп, найденный по разности спектров после и до адсорбции С6Н6 (рис. 8 б) составляет 80 см–1, что свидетельствует о присутствии на поверхности обработанного трифункциональным модификатором силикагеля SG-F(III) гидроксильных групп, способных слабо взаимодействовать с бензолом.
На рис. 9 представлены ИК-спектры модифицированного трифункциональным силаном образца SG-isoF(III) в диапазоне 3900–2700 см–1 до (а) и после (б) адсорбции С6Н6. В спектре образца, обработанного в вакууме при 423 К, отсутствуют полосы валентных и составных колебаний изолированных поверхностных Si–OH-групп, присутствующих в спектре исходного силикагеля SG [33, 34]. В спектре вакуумированного образца SG-isoF(III) в районе валентных колебаний ОН-групп наблюдаются полосы при 3663 и плечо ~3487 см–1, относящиеся к колебаниям возмущенных водородной связью ОН-групп. Кроме того, в спектре образца, обработанного в вакууме, наблюдаются полосы поглощения при 2974, 2944 и 2923 см–1, характеризующие валентные и составные колебания С–Н-связи в привитых группах.
Рис. 9.
ИК-спектры образца SG-isoF(III) до (1) и после (2) адсорбции C6H6 в области основных частот колебаний ОН-групп (a) и их разностный спектр (б).
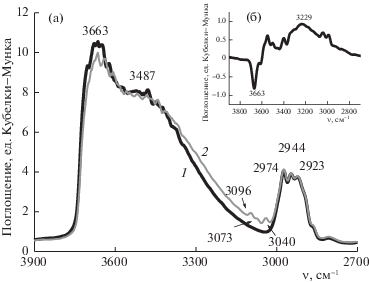
При адсорбции бензола на предварительно ваккумированном образце SG-isoF(III) в спектре появляется три полосы поглощения: полоса при 3096 см–1, характеризует валентные колебания С–Н-связи, полосы при 3073 и 3040 см–1 являются составными тонами валентных колебаний С‒Н- и С–С-cвязей и деформационных колебаний цепи С–С–С в плоскости бензольного кольца [33]. При адсорбции бензола полосы поглощения, относящиеся к колебаниям метиленовых групп привитой цепи, остались без изменения. В районе валентных колебаний ОН-групп заметно небольшое снижение интенсивности полосы при 3663 см–1. При этом интенсивность полосы при 3487 см–1 остается неизменной и заметно уширение этой полосы со стороны меньших частот. Сдвиг полосы ОН-групп, найденный по разности спектров после и до адсорбции С6Н6 (рис. 9б) составляет 434 см–1, что свидетельствует о присутствии на поверхности обработанного трифункциональным модификатором силикагеля SG-isoF(III) гидроксильных групп, способных сильно взаимодействовать с бензолом. По силе кислотности поверхностных ОН-групп можно составить ряд: SG-F > SG-isoF(III) > SG > SG-F(III).
Как показано выше, вклады специфических взаимодействий в адсорбцию бензола, оцененные с помощью разных подходов, изменяются на модифицированных образцах в противоположном направлении. Можно предположить, что основное влияние на рост специфических, в основном, диполь-квадрупольных взаимодействий, оказывает увеличение полярности модифицированных силикагелей, возможно, за счет перераспределения электронной плотности в привитых группах под влиянием дополнительных гидроксилов, что наиболее ярко выражено у образца с линейным трифункциональным силаном SG-F(III).
Результаты данной работы целесообразно использовать для получения материалов с полифторалкильными слоями с предсказуемыми адсорбционными свойствами и объяснения малоизученных капиллярных явлений в лиофобных порах.
Работа выполнена в соответствии с планом научного совета РАН по физической химии, регистрационный номер темы 18-03-460-15.
Список литературы
Химия привитых поверхностных соединений / Под ред. Г.В. Лисичкина. М.: Физматлит, 2003. 592 с.
Ma M., Hill R.M. // Curr. Opin. Colloid Interface Sci. 2006. V. 11. P. 193.
Trewy B., Victor S.Y. // Chem. Eng. J. 2007. V. 137. P. 23.
Yang J.P., Yuan D.X., Zhou B. et al. // J. Coll. Interface Sci. 2011. V. 359. P. 269.
Steele A., Bayer I. Loth E. // Nano Lett. 2009. V. 9. № 1. P. 501.
Barriet D., Randall L.T. // Curr. Opin. Colloid Interface Sci. 2003. V. 8. P. 236.
Matsuo Y. // J. Fluorine Chem. 2007. V. 128. P. 336.
Burunkaya E., Kiraz N., Kesmez O., Asilturk M. // J. Sol-Gel Sci. Technol. 2010. V. 56. P. 99.
Hozumi A., Kim B., McCarthy T.J. // Langmuir. 2009. V. 25. P. 6834.
Vilcnik A., Jerman I., Vuc A.S. et al. // Ibid.2009. V. 25. P. 5869.
Kessman A.J., Huckaby D.K., Snyder C.R. et al. // WEAR. 2009. V. 267. P. 614.
Cao L.L., Price T.P., Weiss M., Gao D. // Langmuir. 2008. V. 24. P. 1640.
Yoshino N., Yamauchi T., Kondo Y. et al. // Reactiv. Funct. Polym. 1998. V. 37. P. 271.
Sawada H., Koizumi M., Tojo T. et al. // Polym. Adv. Technol. 2005. V. 16. P. 459.
Ярош А.А., Круковский С.П., Сахаров А.С. и др. // Изв. АН. Сер. хим. 2014. № 2. С. 546.
Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии. М.: Высш. школа, 1986. 360 с.
Трофимов Д.Н., Колесниченко В.В., Логинова Н.Н. // Тез. докладов 9-й Всероссийской конференции “Химия фтора”. М., 2012. P. 44.
Glatz H., Blay C., Engelhardt H. // Chromatographia. 2004. V. 59. P. 567.
Ashu-Arrah B.A., Glennon J.D., Albert K. // J. Chromatogr. A. 2013. V. 1273. P. 34.
Fadeev A.Y. Encyclopedia of Surface and Colloid Science / Ed. by P. Somasundaran. N.Y.: Taylor & Francis, 2006. P. 2854.
Monde T., Nakayama N., Yano K. et al. // J. Coll. Interface Sci. 1997. V. 185. P. 111.
Gurevich K.B., Roshchina T.M., Shonia N.K. et al. // Ibid. 2002. V. 254. P. 39.
Рощина Т.М., Шония Н.К., Лагутова М.С. и др. // Журн. физ. химии. 2007. Т. 81. № 7. С. 1282.
Рощина Т.М., Шония Н.К., Лагутова М.С. и др. // Там же. 2009. Т. 83. № 2. С. 361.
Рощина Т.М., Шония Н.К., Таякина О.Я. и др. // Там же. 2012. Т. 86. № 3. С. 508.
Рощина Т.М., Шония Н.К., Тегина О.Я. и др. // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 4. С. 354.
Экспериментальные методы в адсорбции и молекулярной хроматографии / Под ред. Ю.С Никитина, Р.С. Петровой. М.: Изд-во МГУ, 1990. 318 с.
Kustov L.M. // Topics in Catalysis. 1995. V. 4. P. 131.
Боровков В.Ю. Природа и свойства кислотно-основных центров аморфных алюмосиликатов, высококремнеземных цеолитов и оксидов алюминия по данным ИК-спектроскопии в диффузно-рассеянном свете: Дис. … докт. хим. наук: М.: Ин-т органической химии им. Н.Д. Зелинского РАН, 1988. 336 с.
Рощина Т.М., Шония Н.К., Таякина О.Я., Фадеев А.Ю. // Журн. физ. химии. 2011. Т. 85. № 2. С. 352.
Грег С., Синг К. Адсорбция, удельная поверхность, пористость. М.: Мир, 1970. 310 с.
Roshchina T.M., Shoniya N.K., Bernadoni F., Fadeev A.Y. // Langmuir. 2014. V. 30. P. 9355.
Киселев А.В., Лыгин В.И. Инфракрасные спектры поверхностных соединений и адсорбированных молекул. М.: Наука, 1972. С. 110–143, 179–246.
Гордон А., Форд Ф. Спутник химика, М.: Мир, 1976. 541 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии