Известия РАН. Серия биологическая, 2022, № 1, стр. 54-69
Разнообразие и филогения азиатских краснощеких белок (Rodentia, Sciuridae, Dremomys) в Восточном Индокитае
А. Е. Балакирев 1, 2, *, А. В. Абрамов 2, 3, Буй Суан Фыонг 2, В. В. Рожнов 1, 2
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Российско-Вьетнамский тропический научно-исследовательский и технологический центр
Ханой, ул. Нгуйен Ван Хуйен, 63, Вьетнам
3 Зоологический институт РАН
199034 Санкт-Петербург, Университетская наб., 1, Россия
* E-mail: alexbalakirev@mail.ru
Поступила в редакцию 13.08.2021
После доработки 17.08.2021
Принята к публикации 18.08.2021
- EDN: WFVOJX
- DOI: 10.31857/S1026347022010048
Аннотация
На основе новых молекулярных данных o митохондриальных (Cyt b) и ядерных генов (IRBP, RAG1), а также обширных морфологических материалов исследованы таксономия и взаимоотношения внутри рода азиатских краснощеких белок Dremomys, распространенных на территории восточного Индокитая и южного Китая. Филогенетический анализ показал, что азиатские краснощекие белки, которых в настоящее время относят к D. rufigenis, не являются гомогенной группой, а подразделяются на две независимые клады видового уровня – северную и южно-центральную. Последняя по Cyt b, в свою очередь, также подразделяется на две глубоко дивергентные клады, между которыми прослеживаются лишь незначительные морфологические отличия в строении черепа, выявляемые методами многомерной математической статистики (метод главных компонент, PCA), что дает основание рассматривать их в качестве криптических видов. На основании наших данных краснощекие белки, населяющие северный Вьетнам и южный Китай, обычно относимые к D. rufigenis, должны рассматриваться в качестве отдельного вида D. ornatus (Thomas, 1914). Белки, населяющие южные и центральные районы Вьетнама, на основании их специфической внешней морфологии должны быть отнесены к D. rufigenis, а именно к подвидам D. r. fuscus (Bonhote, 1907) и D. r. laomache (Bonhote, 1921) соответственно.
Краснощекие или, длинноносые белки рода Dremomys (Heude, 1898) это широко распространенная группа древесных млекопитающих, представленная в фаунах Индокитая, Малайского п-ва и Китая (Corbet, Hill 1992; Thorington, Hoffmann, 2005; Thorington et al., 2012). Таксономический состав этого рода долгое время оставался дискуссионным. После серии ревизий (Pocock, 1923; Osgood, 1932; Ellerman, 1940; Moore, Tate, 1965; Thorington, Hoffmann, 2005) род был определен в составе шести видов: D. lokriah Hodgson, 1836, D. everetti Thomas, 1890, D. gularis Osgood, 1932, D. pernyi Milne-Edwards, 1867, D. pyrrhomerus Thomas, 1895 и D. rufigenis Blanford, 1878. По самым последним данным (Hawkins et al., 2016) было показано, что D. everetti, по-видимому, принадлежит к роду Sundasciurus. Таким образом, краснощекие белки оказываются полностью ориентальной группой, отсутствующей на территории Зондской суши.
Среди краснощеких белок большое количество форм предлагалось исторически в качестве подвидов D. rufigenis. Мур и Тат (Moore, Tate, 1965) предлагали лишь три подвида: D. r. rufigenis Blanford, 1878, D. r. belfieldi Bonhote, 1908 и D. r. opimus Thomas et Wroughton, 1916, в более поздних сводках (Corbet, Hill, 1992; Thorington, Hoffmann, 2005) было предложено еще два таксона fuscus Bonhote, 1907) и ornatus Thomas, 1914, при этом opimus стал рассматриваться в качестве младшего синонима adamsoni Thomas, 1914.
В соответствии с последними сводками для Вьетнама описаны два подвида: D. r. rufigenis, населяющий северный Вьетнам и Юньнань в Китае, и D. r. fuscus, распространенный на юге Вьетнама и в Лаосе (Thorington et al. 2012).
Главной целью настоящей работы явилось исследование морфологической и генетической вариабельности D. rufigenis во Вьетнаме для оценки таксономического состава и морфологической вариабельности этого таксона.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы Dremomys из Вьетнама были получены в ходе серии экспедиций Российско-Вьетнамского тропического научно-исследовательского и технологического центра в период с 1998 по 2018 гг. Данные материалы были собраны в полном соответствии с действующим законодательством Вьетнама в сфере охраны природы и биологического разнообразия. При сборе образцов и обращении с живыми зверьками мы также следовали рекомендациям Американского маммалогического общества (Gannon et al. 2011). Всего было исследовано 64 черепа, 107 шкурок и 7 фиксированных в этаноле образцов D. rufigenis, а также 12 черепов и 13 шкурок D. pernyi. В целом, образцы были получены из 47 локалитетов в Индокитае и южном Китае (рис. 1, приложение 1 ), материалы находятся в фондах Зоологического института РАН (ZIN), Санкт-Петербург, Россия, Зоологического музея Московского государственного университета им. М.В. Ломоносова (ZMMU), Москва, Музея Ханойского университета (HUS), Ханой, Вьетнам и Биологического музея Института экологии и биоресурсов Национальной академии наук Вьетнама (IEBR).
Рис. 1.
Карта локалитетов исследованных образцов. Показано географическое распространение митохондриальных линий Dremomys в Индокитае. Генотипированные образцы показаны закрашенными, морфологические материалы представлены пустыми квадратами и кружками для черепов и шкурок соответственно. Типовые локалитеты D. rufigenis s. lato отмечены звездочками. Нумерация локалитетов как в приложении 1 .
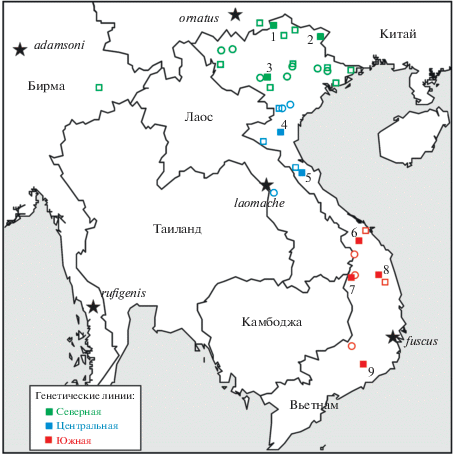
Для морфометрических измерений и сравнения было использовано 58 интактных черепов взрослых D. rufigenis из 20 локалитетов во Вьетнаме (приложение 1 ). Возраст зверьков оценивали по степени износа моляров и состоянию черепных швов. В качестве сравнительного материала использовали 9 черепов D. pernyi из коллекций ZIN, IEBR и ZMMU. С помощью электронного штангенциркуля с точностью до 0.1 мм на черепе измеряли 19 краниодентальных параметров: наибольшая длина черепа (ONL), длина костного неба (PL), межорбитальная ширина (IB), ширина мозговой капсулы (BBC), высота мозговой капсулы (HBC), скуловая (зигоматическая) ширина (ZB), ширина между надглазничными отростками (SB), длина диастемы (LD), длина носовых костей (NL), небная длина (LBP), постнебная длина (PPL), длина ряда верхних моляров (CLM), длина ряда нижних моляров (CLm), ширина костного неба на уровне первых моляров (BBP1), ширина костного неба на уровне третьих моляров (BBP3), длина резцовых отверстий (LIF), ширина крыловидной ямки (BMF), длина слуховых барабанов (LB), высота слуховых барабанов (HB). Дополнительно рассчитывали 11 индексов: длины слухового барабана (ILB = LB/ONL), скуловой ширины (IZB = = ONL/ZB), межглазничный (IOB = ONL/IB), небный 1 (ILBP1 = LBP/ONL), небный 2 (ILBP2 = = LBP/PL), молярный (IMOL = CLM/ONL), общий краниальный (GCI = PL/PPL), глазничных отростков (OPI = ZB/IB), высоты черепа (IBH = = HBC/ONL), краниальный (CI = Sqrt(BBC × × HBC)) и площади костного неба (PI = = Sqrt(BBP1 × BBP3) × LBP).
Для теста межгрупповых различий для всех промеров черепа и индексов применяли однофакторный анализ вариации (ANOVA). Для оценки морфологического разнообразия внутри популяций и видов Dremomys был применен метод главных компонент (PCA). Все статистические расчеты и процедуры выполняли с использованием программного пакета Statistica 8.0 (StatSoft Inc., Tulsa, OK, USA).
Тотальную ДНК выделяли из фиксированной 96%-ным этанолом мышечной ткани с помощью стандартного фенол-хлороформного метода с обработкой протеиназой К (Kocher et al., 1989; Sambrook et al., 1989). Далее ДНК очищали двукратным переосаждением этанолом или с помощью набора DNA Purification Kit (Fermentas, Thermo Fisher Scientific Inc., Pittsburgh, PA, США).
Мы исследовали четыре гена, два митохондриальных и два ядерных, в отношении которых была показана пригодность для филогенетического анализа азиатских Sciuridae (Oshida et al., 2000, 2006; Mercer, Roth, 2003; Steppan et al., 2004; Chang et al., 2011; Li et al., 2008, 2013; Hawkins et al., 2016). Три из этих генов, а именно полный ген цитохрома b (Cyt b, 1140 п.н.), фрагмент (до 1.610 п.н.) первого экзона ретиноид связывающего протеина (IRBP, также известен как RBP3) и часть (1.571 п.н.) первой субъединицы гена фактора активации рекомбинации (RAG1) использовали во всех анализах. Для некоторых образцов мы также секвенировали 5'-проксимальный участок гена первой субъединицы цитохром оксидазы (COI) длиной 680 п.н. (Hebert et al., 2003).
Цитохром b амплифицировали с парой универсальных праймеров L14723 и H15915 (Irwin et al., 1991), для COI были использованы универсальные консервативные праймеры BatL 5310 и R6036R (Kocher et al., 1989; Irwin et al., 1991). Амплификацию обоих митохондриальных фрагментов проводили по следующему общему ПЦР-протоколу: первичная денатурация в течение 90 с при 95°C, затем 35 циклов денатурации 30 с при 95°C, отжиг в течение 60 с при 52°C и элонгация в течение 30 с при 72°C, с финальной элонгацией в течение 2 мин при 72°C. ПЦР проводили в объеме 30–50 мкл в реакционной смеси, содержащей 2.5–3 мкл 10× стандартного ПЦР буфера (Fermentas, Thermo Fisher Scientific Inc., Pittsburgh, PA), 50 mM дезоксирибонуклеотидов, 2 mM MgCl2, 10–12 пмоль праймеров, 1 ед Taq DNA полимеразы (Fermentas, Thermo Fisher Scientific Inc., Pittsburgh, PA) и 0.5 мкл (20–50 нг) тотальной ДНК-матрицы на пробирку. Ген IRBP амплифицировали с помощью набора праймеров IRBP125f, IRBP223, IRBP1435r, IRBP1125r, и IRBP1801r (Suzuki et al., 2000) по методу Stanhope (Stanhope et al., 1992). Фрагмент гена RAG1 был получен с ранее известными праймерами S70 и S71; те же праймеры использовали как для первичной ПЦР, так и для прямого сиквенирования как описано в работе Степпана (Steppan et al., 2004).
ПЦР-продукты очищали с помощью набора DNA Purification Kit, двуцепочечная ДНК была прямо сиквенирована по обеим цепям по методу Sangera на секвенаторе ABI PRISM 3730xl Genetic Analyzer (Applied Biosystems, CШA) с использованием набора реагентов BigDye® Terminator v3.1 Cycle Sequencing Kit в соответствии с протоколом производителя. Все полученные нуклеотидные последовательности депонированы в GenBank (KX171231 – KX171276).
В целом, нами было генотипировано 17 особей из 8 географических локалитетов: 17 по Cyt b, 12 по IRBP, 12 по RAG1 и 4 по COI (табл. S2 приложения). Для сравнения мы привлекли все последовательности генов Cyt b, IRBP и RAG1 представителей Dremomys на настоящий момент, доступные в базах GenBank/NCBI/JNDB, а также несколько последовательностей видов Callosciurus, которые были использованы в качестве внешней группы для укоренения филогенетических древ (приложение 2 ).
Нуклеотидные последовательности выравнивали с помощью программ BioEdit v 7.0 (Hall, 1999) и Clustal W (встроена в BioEdit и MEGA 6) и верифицировали вручную. Расчет базовых параметров последовательностей (число вариабельных сайтов, парсимониально-информативных сайтов, сдвиг нуклеотидного состава, частоты оснований и таблицы частот нуклеотидных замен), а также оценку наилучшей модели нуклеотидных замен и меж- и внутригрупповой дивергенции проводили в программе MEGA 6 (Tamura et al., 2013). Мы использовали наиболее применяемые алгоритмы построения филогенетических деревьев, такие как метод минимальной эволюции (ME), максимальной парсимонии (MP) и максимального правдоподобия (ML). Филогенетические древа были построены на основе индивидуальных последовательностей трех генов: Cyt b (1-1140), RAG1 (1141-2712) и IRBP (2713-3824 нуклеотидные положения) и обобщенной конкатенированной последовательности. Модели нуклеотидной эволюции тестировались при помощи соответствующего модуля программного пакета MEGA 6. Для Cyt b лучшей оказалась модель HKY + G (Hasegawa-Kishino-Yano, параметр gamma =0.16), тогда как для RAG1 более оптимальной оказалась модель K2 (Kimura 2 parameter); для гена IRBP и обобщенной последовательности лучшей оказалась более комплексная модель GTR + + G + I (General Time Reversible, параметр gamma = = 0.21). Параметр формы gamma во всех случаях оценивался непосредственно из исследуемого набора данных. В силу обнаруженного значительного насыщения последовательность гена COI не использовалась для непосредственной филогенетической реконструкции и представлена здесь лишь как генетический ваучер для ДНК-баркодинга и сравнения генетических дистанций. Устойчивость топологии деревьев оценивали методом бутстрепа при 1000 повторениях. Деревья строили и визуализировали непосредственно в программе MEGA 6 или с помощью TreeView 1.6.6 (Page, 1996).
Генетические дистанции оценивали с помощью MEGA 6 как парные дистанции по генам Cyt b и COI, используя наиболее комплексную вероятностную модель эволюции и T3P (Tamura 3 parameter) алгоритм (Tamura et al., 2004). Для оценки равенства скоростей эволюции в различных филогенетических линиях был использован тест Тажимы (Tajima’s Relative Rate Test), также выполненный в программе MEGA 6, который показал отсутствие оснований отвергнуть нуль-гипотезу о равенстве скоростей эволюции между линиями. Оценка возраста клад была проведена по референс точкам, указанным для некоторых событий бифуркации (Hawkins et al., 2016) в модуле ML Clock Test, реализованном в MEGA 6 (Tajima, 1993) на базе ML-дерева гена Cyt b.
Для уточнения генеалогического родства и исследования эволюции генетических линий внутри Dremomys также была построена парсимониальная сеть на базе гаплотипов гена Cyt b. Мы исследовали эволюционные взаимоотношения внутри этой максимально-парсимониальной сети по методу объединения медиан (Median-Joining method) (Bandelt et al., 1999), как реализовано в программе Network 5.0 (http://www.fluxus-engineering.com/sharenet.htm) с использованием параметров по умолчанию (Polzin, Daneschmand, 2003) и без применения MP-релаксации сети.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Филогенетический анализ. Мы обнаружили высокое генетическое разнообразие среди видов Dremomys из популяций, населяющих Индокитай (приложение 3 ). По гену Cyt b генетические дистанции между обнаруженными в северном, центральном и южном Вьетнаме филогруппами (d = = 11.5–19.3%, T3P) соответствуют типичным межвидовым дистанциям, наблюдаемым у грызунов (Bradley, Baker, 2001).
Филогенетические древа для Cyt b, RAG1 и IRBP генов представлены на рис. 2. Внутри Dremomys наблюдается сложная филогенетическая структура и наиболее сложный паттерн демонстрируют именно восточно-индокитайские популяции. По гену Cyt b выявляются три достоверные высоко-дивергентные филогенетические линии D. rufigenis (рис. 2а), положение других клад не всегда устойчиво. Мы называем здесь эти ветви как северная (N) и сестринские по отношению к ней центральная (С) и южная (S) клады. Уровень поддержки для этих трех вьетнамских линий остается достоверным при использовании любого применяемого метода кластеризации. Одновременно, для ряда китайских клад, относимых к D. pernyi, D. lokriah и D. pyrrhomerus, отмечаются более низкие значения поддержки (бутстрепа), что может указывать на базальную радиацию этих ветвей.
Рис. 2.
Деревья филогенетической радиации линий Dremomys. а − Cyt b, ML-дерево (HKY + G); б − ген IRBP, ML-дерево (GTR + G + I); в − ген RAG1 ML-дерево (K2). Значения поддержки (для различных методов кластеризации ML/ME/MP, /*/ если = 100) указаны над узлами. Названия и коды ветвей (в скобках) для главных филогенетических линий как показано на рис. 1.
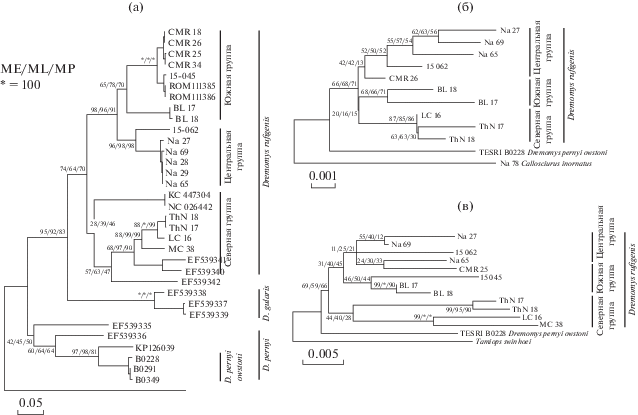
Нуклеотидные последовательности, полученные из GenBank и помеченные как образцы NC026442 и KC447304, для которых неизвестен исходный локалитет, представляют наиболее нестабильную в топологическом отношении ветвь древа. Она может появляться как сестринская к вьетнамским D. rufigenis, или к китайским D. pernyi, или даже к D. pyrrhomerus в зависимости от применяемого метода кластеризации, но неизменно с низкими значениями поддержки узла бифуркации. Три вышеуказанные вьетнамские ветви D. rufigenis, соответствующие северной, центральной и южной кладам (рис. 2б), выявляются и на дереве гена IRBP, хотя и с более низкой достоверностью. Структура древа IRBP оказывается более сложной, вероятно в силу того, что этот ген является одним из наиболее консервативных, медленно эволюционирующих и маловариабельных среди генов, используемых в филогении млекопитающих (Stanhope et al., 1992). Дерево, полученное для гена RAG1 (рис. 2в), выглядит наиболее интригующе. Несмотря на довольно низкий уровень поддержки (что вероятнее всего вызвано очень короткой длиной имеющихся в наличии последовательностей, представляющих китайские популяции D. pernyi), топология дерева остается неизменной при любом методе кластеризации, алгоритме расчета и базовых параметрах. При этом образцы с севера Вьетнама кластеризуются вместе с D. pernyi, а прочие формируют отдельную сестринскую группу.
Столкнувшись с ситуацией, когда, с одной стороны, очевидно наличие глубоко дивергентных филогенетических линий, а с другой – их взаимоотношение не может быть достоверно определено по тому или иному индивидуальному гену, мы провели анализ конкатенированных последовательностей для улучшения достоверности топологии результирующих деревьев. Анализ комбинированной последовательности трех генов дал дерево с хорошими поддержками узлов (рис. 3), на котором хорошо выявляются две главные филогенетические клады D. rufigenis из Вьетнама – северная группа (N) и группа, объединяющая южную и центральную группы (С + S).
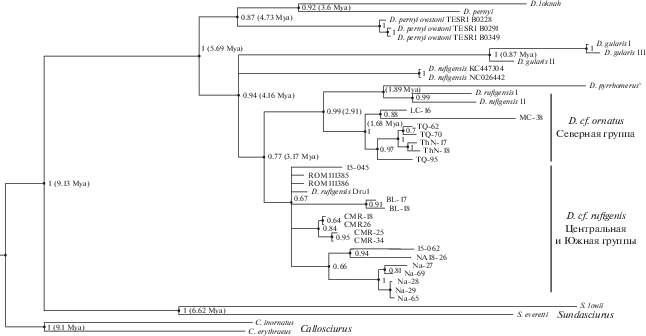
Рис. 3.
Филогенетическое древо для видов Dremomys (ML), построенное по конкатенированным последовательностям Cyt b + IRBP + RAG1 гены (GTR + G + I; 1-2-3 позиции), уровень поддержки указан в узлах ветвления, в скобках приведено оценочное время дивергенции.
Анализ структуры медианной сети также показывает, что вьетнамские Dremomys представлены двумя независимыми субпопуляциями (рис. 4). Одну субпопуляцию формируют гаплотипы, относящиеся к северной филогенетической ветви, они формируют т. н. “торсо сети” и тяготеют к китайским D. pyrrhomerus. Гаплотипы из центральных и южных вьетнамских популяций формируют другую линию, которая может быть присоединена к “торсо” только через южные гаплотипы, а гаплотипы центральной группы значительно более дистантны от северных. Такой филогенетический паттерн не соответствует современным представлениям о характере распространения видов этой группы, однако определенно указывает на то, что южные и центральные популяции D. rufigenis следует рассматривать в качестве независимых от северных популяций.
Рис. 4.
Парсимониальная сеть (метод объединения медиан) для взаимоотношений Dremomys, построенная на основе гаплотипов гена Cyt b. Медианные векторы не показаны. Для главных ветвей видового/подвидового уровня цифрами указано количество нуклеотидных замен.
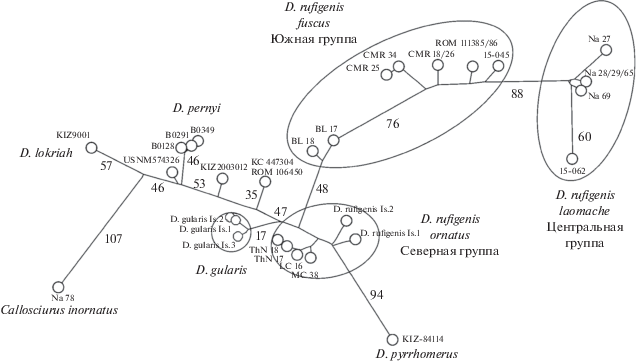
Восточноиндокитайские линии выявляются как отдельные от объединенного “торсо”, что демонстрирует независимость их эволюции. Эволюционная траектория северной клады показывает явную широтную направленность и длинные ветви. Эволюция же в южно-центральной кладе (S-C clade) проявляется в виде постепенного перехода от южных к более северным гаплотипам внутри этой группы, что может отражать естественную историю ее распространения c юга на север.
Сеть также проясняет положение некоторых северных ветвей D. rufigenis и D. pyrrhomerus, демонстрируя неустойчивость филогенетического древа (рис. 2а). Северные популяции D. rufigenis представляются наиболее дивергентной кладой, берущей начало от общего пула северных филогенетических линий. Значительная длина некоторых филогенетических ветвей в ней соответствует их видовому статусу, в то время как другие, более короткие, следует рассматривать в контексте внутривидовой изменчивости.
Анализ внешней морфологии. Окраска шкурки и некоторые другие характеристики меха у азиатских краснощеких белок подвержены значительной индивидуальной изменчивости (Dao, 1969; Cao, 1984; Dao, Cao 1990). Это наиболее характерно для популяций из провинций Тхайнгуйен, Виньфук, Нгеан, Куагнинь и Лангшон. Брюшная сторона шкурки у животных, отловленных в одном и том же географическом районе, может варьировать по окрасу от ярко-белой до грязно-желтой или серой. Окраска спинной стороны и щек тоже очень вариабельна. У некоторых экземпляров голова, спина и бедра окрашены в светло-коричневый цвет с желтым оттенком, тогда как другие демонстрируют явный коричневый окрас с рыжим оттенком. Этот паттерн может отражать и сезонную вариабельность окраски, потому что большинство светлоокрашенных индивидов были отловлены с мая по июль.
Зверьки из центрального Вьетнама (провинции Тханьхоа, Ниньбинь и Нгеан) и центрального Лаоса имеют заметно более светлую окраску с желто-рыжим и коричневатым оттенком окраски меха дорзальной стороны. Эта окраска соответствует морфе laomache, особой светлой расе, ранее описанной из Лаоса (Thomas, 1921).
Самыми характерными отличительными чертами большинства популяций D. rufigenis являются светлые пятна за ушами и текстура меха. Белки из популяций, относящихся к северной группе, имеют за ушами желтые или охристые пятна, которые хорошо просматриваются при взгляде сбоку. У зверьков, относящихся к южной и центральной популяциям, белые пятна хорошо заметны только при взгляде сзади или сверху. Наличие белых пятен за ушами было специально отмечено при первоописании D. rufigenis (Blanford, 1878) и впоследствии указывалось для экземпляров из Малайзии (Bonhote, 1908) и Бирмы (Thomas, Wroughton, 1916; Moore, Tate, 1965), а также для D. fuscus из южного Вьетнама (Нячанг) (Bonhote, 1907), тогда как для D. ornatus из Китая и D. adamsoni из северной Бирмы указывались желтые пятна за ушами (Thomas, 1914).
Анализ краниальной морфологии. Средние, пределы и стандартные отклонения промеров черепа и зубов, а также индексы для всех трех групп, идентифицированных генетически, представлены в приложении 4 . Как показывает ANOVA, образцы южной группы значимо отличаются от северной и центральной по многим промерам, в частности у них значимо меньше ZB, BBC, LB, HB, LB, HB, CLM, PL и CLm; значимо у южной группы отличаются и некоторые индексы (IZB и ILB). Различия между образцами северной и центральной групп были низкими: единственный промер, показавший значимые отличия – ширина костного неба на уровне первых моляров (BBP1), которая оказалась больше у северных популяций.
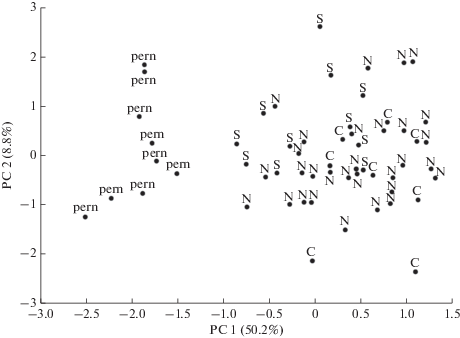
Комплексная морфологическая вариабельность у 58 черепов Dremomys на базе всего набора из тридцати промеров и индексов черепа была проанализирована при помощи метода главных компонент (PCA). Большинство из промеров показали положительную корреляцию с первой факторной осью PC1 (приложение 5 ), что указывает на то, что ось PC1 отражает различия в общих размерах черепа. Вторая факторная ось PC2 показала сильную корреляцию с длиной ушных барабанов (LB). Образцы D. pernyi и D. rufigenis s. lato формируют две явно дискретные группы (рис. 5). Однако даже с применением мультифакторного анализа не удается обнаружить каких-либо ясных, визуально заметных черт строения черепа, пригодных для видовой идентификации исследуемых популяций D. rufigenis s. lato без применения специальных статистических процедур.
Рис. 5.
Разделение не группированных морфометрических данных Dremomys Восточного Индокитая (метод главных компонент, PCA) в пространстве осей. Данные промеров черепа и индексов (см. приложение 4 ). Символы: pern – D. pernyi, N, C, и S – образцы D. rufigenis s. lato, относящиеся к северной, центральной и южной филогенетической группам соответственно.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таксономические выводы. Ранее черепа D. rufigenis из нескольких локалитетов в Индокитае были исследованы Эндо с соавт. (Endo et al., 2003). Эти авторы показали, что белки из южных районов (Малайзия) существенно крупнее белок из северных (южный Вьетнам, Лаос и Таиланд), в частности, по наибольшей длине черепа (51.47мм SD = 1.24 против 50.32 мм, SD = 1.44 и 48.9 мм, SD = 2.32) для взрослых самцов. Малайские популяции демонстрировали большую длину сплахнокраниума и более узкую межглазничную ширину по сравнению с популяциями из Вьетнама-Лаоса и Таиланда. Однако при отсутствии каких-либо генетических данных, авторы не выдвинули никаких таксономических выводов, основанных на этих наблюдениях.
Полученные нами результаты позволяют констатировать, что белки, населяющие северный Вьетнам и южный Китай, которых обычно относят к D. rufigenis, должны рассматриваться в качестве отдельного криптического вида D. ornatus (Thomas, 1914), а не одноименного подвида D. rufigenis. Как отмечено выше, молекулярно-генетическое разнообразие внутри исследованных популяций оказалось существенно выше морфологического. Эта ситуация не уникальна: сегодня известно много пар и групп видов, которые могут демонстрировать полное отсутствие морфологических различий, при этом оставаясь валидными видами. Криптические, или генетические, виды были выявлены, в основном или даже всецело основываясь на их значительных генетических отличиях (Baker, Bradley, 2006). Примером их могут быть такие виды млекопитающих, как Loxodonta cyclotis (Roca et al., 2001), Carollia sowelli (Baker et al., 2002; Solari, Baker, 2006), Neotoma macrotis (Matocq, 2002), Myotis occultus (Piaggio et al., 2002), Notiosorex cockrumi (Baker et al., 2003), Lophostoma equatorialis (Baker et al., 2004), Peromyscus schmidlyi (Bradley et al., 2004a), Reithrodontomys bakeri (Bradley et al., 2004b), Lagidium boxi (Spotorno et al., 2004) и Thylamys cinderella (Braun et al., 2005), которые были выделены и описаны лишь на основе данных о последовательностях ДНК. Известно и множество других примеров описания видов на основе использования иных генетических маркеров, в частности в родах Sicista, Microtus, Sylvaemus (см. Sokolov et al., 1981, 1986; Sokolov, Baskevich, 1988; Chelomina et al., 1998; Conroy, Cook, 2000; Hille et al., 2002).
Ситуация с белками Dremomys, с которой мы столкнулись, требует представить здесь формальное описание и реформирование D. ornatus в качестве независимого таксона в соответствии с его первоописанием, сделанным Томасом (Thomas, 1914).
Dremomys ornatus (Thomas, 1914) – аннамская краснощекая белка
Голотип. (British Museum of Natural History) BMNH 12.7.25.20, старая самка, череп, шкурка, отловлена 4 февраля 1910 г. мистером H. Orii.
Типовой локалитет. Около Монгзе (Mongtze, провинция Юньнань, Китай, 23°22′ N, 103°26′ E).
Описание. Как указано у Томаса (Thomas, 1914: с. 26): “В целом напоминает rufigenis, но строение черепа как у belfieldi. Окраска почти в точности как rufigenis, но спина более светло-оливковая без каких-либо грязно или тускло-коричневых оттенков, крестец почти полностью или в значительной степени коричневый. Нижняя сторона как у rufigenis. Боковые стороны головы ярко-ржавые, ржавый цвет распространяется далее по бокам на верхнюю поверхность морды почти до уровня ушей. Пятна за ушами желтые (buffy). Череп отличается от такового rufigenis, но неотличим от belfieldi. Крупнее чем у rufigenis, морда очень длинная, узкая, сжатая с боков; носовые кости длинные, их задние оконечности направлены трансверсально. Лобные кости широкие, плоские с более трансверсально направленными задними отростками. Черепная коробка крупная. Скуловые дуги широкораспростертые. Задняя ступня, 44. Череп: наибольшая длина 58.2; кондило-резцовая длина 50.3; скуловая ширина 31.6; длина насалий 21.7; межглазничная ширина 16.7; ширина мозговой коробки 25; длина костного неба 24.2; p4 с тремя другими молярами 9.7”.
Диагноз. “Отличается от rufigenis своим более крупным черепом и длинной мордой, а от belfieldi более яркой окраской” (Thomas, 1914). D. ornatus хорошо отличается от прочих Dremomys по митохондриальным (Cyt b, COI) или ядерным (RAG1, IRBP) генам. Уровень дивергенции от других линий видового уровня составляет d T3P 0.187–0.269 для Cyt b и 0.0418-0.047 для COI. Нуклеотидные последовательности, депонированные в GenBank (KX171244–KX171247; KX171258–KX171260; KX171264, а также KX171273–KX171276), могут быть использованы в качестве генетических ваучеров этого вида.
Сравнение. D. ornatus – криптический генетический вид, родственный D. rufigenis. Общий паттерн окраски довольно вариабельный и зависит от сезона и локальных особенностей популяций. Наиболее заметной чертой внешней морфологии является цвет пятен за ушами и текстура меха. Уши D. ornatus хорошо опушенные, с хорошо видными при взгляде сбоку желтыми пятнами за ними (рис. 6), в отличие от D. rufigenis, у которого они покрыты лишь редкими волосками, а пятна за ушами ярко белого цвета и заметны лишь при взгляде сзади и сверху (рис. 7). Череп (приложение 6–7 ) у D. ornatus обычно крупнее (ONL до 58 мм и более), но ясных морфологических отличий, пригодных для уверенного различения его от D. rufigenis по морфологии черепа, на настоящий момент не выявлено.
Рис. 6.
Dremomys ornatus. Взрослая самка. Провинция Каобанг, уезд Халанг (Hạ Lang), близ Тханьнят (Thanh Nhat). Внешний вид (фото А.Е. Балакирева), ZMMU S-191977 (череп, шкурка, тушка в этаноле), генетический ваучер ThN 17.

Рис. 7.
Dremomys rufigenis fuscus. Взрослый самец. Провинция Ламдонг, уезд Баолок (Bao Loc), близ Баолам (Bao Lam), южный Вьетнам. Внешний вид (фото А.Е. Балакирева), ZMMU S-191975 (череп и шкурка), генетический ваучер BL 17.

Распространение. Генетически подтвержденные образцы D. ornatus известны из северного Вьетнама (провинции Хазянг, Каобанг и Шонла). Морфологические данные свидетельствуют, что этот вид распространен повсюду в северном Вьетнаме, к северу распространен в китайских провинциях Юньнань и, вероятно, Гуаньси. На территории провинций Шонла и Йенбай D. ornatus контактирует с родственным видом D. rufigenis, представленным здесь формой laomache. Таким образом, южная граница его распространения лежит где-то между 17°30′ и 17°45′ с.ш. Генетических подтверждений симпатрии не имеется, однако присутствие особей с необычной окраской именно на территории контакта между видами оставляет возможность предполагать естественную гибридизацию между ними. Хвост таких особей по вентральной стороне окрашен очень светло, от беловато-желтого до полностью белого (рис. 8), тогда как у большинства популяций этих видов он имеет оранжево-красную окраску. Такие необычно окрашенные особи, которые составляют заметную часть популяции краснощеких белок в центральном Вьетнаме, даже побудили некоторых исследователей (Dao, 1969) причислять их к краснощекой белке Пирни D. pernyi flavior, что является явной ошибкой.
Рис. 8.
Сравнение паттернов окраски меха D. pernyi, D. rufigenis и D. ornatus из Вьетнама. а – брюшная сторона; б – спинная сторона. Слева на право: IEBR SL-767, D. r. ornatus особый паттерн окраски, провинция Шонла, уезд Моктяу (Moc Chau); IEBR CB-55 и CB-37 D. pernyi, провинция Каобанг, уезд Чунгкхань (Trung Khanh); IEBR SL-792, D. r. ornatus стандартный паттерн окраски, провинция Шонла, уезд Моктяу (Moc Chau); в – брюшная сторона. HUS M0163, D. r. laomache особый паттерн окраски, провинция Тханьхоа, уезд Танфук (Tan Phuc); г и д – брюшная и спинная сторона соответственно: HUS M2000, провинция Ниньбинь, уезд Кукфыонг (Cuc Phuong), D. r. laomache особый паттерн окраски.

Замечания о таксономическом составе D. rufigenis sensu stricto. Судя по наблюдаемому уровню генетической обособленности, как центральная, так и южная линии должны быть отнесены к D. rufigenis, эти клады можно рассматривать в качестве отдельных подвидов. В соответствии с действующим Кодексом зоологической номенклатуры (ICZN 1999) для них существует лишь два пригодных названия – laomache и fuscus (см. рис. 1, на котором указаны все типовые локалитеты для азиатских краснощеких белок в Индокитае).
Как указывал в первоописании Томаса (Thomas, 1921 с. 182–183), бледная окраска меха является главной характеристической чертой D. r. laomache: “Бледная, сильно седоватая раса D. rufigenis. Общие черты примерно те же, что и у истинного rufigenis, череп сходных пропорций, не особенно вытянут, пятна за ушами не особенно заметны, нижняя поверхность примерно той же степени серости. Однако дорзальная окраска светлее и серее, и значительно более крапчатая, желтые предтерминальные кольца на волосах имеют более 2 мм в длину, по сравнению со значительно менее 1 мм у rufigenis и прочих подвидов. Рыжая голова даже ярче чем у rufigenis. Заушные пятна небольшие или очень неясные, их волосы белые с желтыми окончаниями, более пространственно желтые чем у rufigenis… [Этот вид] реально отличить по палевой окраске и относительно крапчатой спине от любой иной расы, описываемой здесь. Его ближайший сосед в Аннаме, D. r. fuscus, является темноокрашенной формой с примечательными белыми пятнами за ушами”.
В первоописании ни о каких иных морфологических признаках, кроме паттерна окраски, не сообщалось (Thomas, 1921), что находится в полном соответствии с результатами проделанного нами краниометрического анализа. Следует отметить, что под приведенное описание полностью подпадает паттерн окраски лаосского образца (ZIN 98317), отловленного в непосредственной близости от типового локалитета D. r. laomache. Большинство зверьков из центрального Вьетнама нельзя назвать совершенно палевыми, однако многие из них, действительно, окрашены заметно светлее, чем и южный D. r. fuscus, и северный D. ornatus. Таким образом, наличие светлоокрашенных особей является характерной чертой центральновьетнамской филогенетической линии (C), которую мы предлагаем относить к D. r. laomache Thomas, 1921. В свою очередь, южная линия (S-lineage) может быть ассоциирована с D. r. fuscus, чей подвидовой ранг в целом принимается, и генетическая привязка не вызывает вопросов.
Нет сомнений, что таксономический состав D. rufigenis sensu stricto требует дальнейшей ревизии. В отсутствии доступных образцов в настоящий момент сложно точно оценить границы распространения номинального подвида D. r. rufigenis, а также его отношения с морфологически отличными южно-малайскими популяциями (Endo et al., 2003) и северным D. lokriah. Возможно, что первые могли бы быть отнесены к D. r. belfieldi Bonhote, 1908, описанному из Селангора, Малайзия.
Распространение и формирование ареала. Краснощекие белки жестко связаны с лесными экосистемами и их распространение ограничивается линией древостоя. Они не могут выходить за пределы этой границы или преодолевать широкие открытые пространства. Главным событием естественной истории, которое, вероятно, повлияло на их распространение, сегрегацию популяций и события видообразования – это регулярные дизъюнкции-воссоединения природных популяций, которые, в свою очередь, были связаны с осцилляциями территорий, покрытых тропическими лесами в позднем миоцене-голоцене (Hall, 1998).
В настоящее время древнейший ископаемый представитель рода, D. primitivus Qiu, 2002, известен из Люфенга (Lufeng) (Китай, провинция Юньнань) и датирован периодом 8–9 млн лет (Qiu, 2002). Согласно Хокинс с соавторами (Hawkins et al., 2016), время существования ближайшего общего предка всех краснощеких белок оценивается в 5.97 млн лет назад (95% HPD 4.34–7.95), а последнее событие видообразования датируется 2.9 млн лет (95% HPD 1.77–4.17, между D. gularis и одной из китайских линий D. rufigenis s. lato). Средний возраст современных видов оценивается в 4.4 млн лет (в интервале 5.97–2.9 млн). На основании этих оценок дивергенция между исходными южно-центральной (S-C группа) и северной (N‑группа) вьетнамскими популяциями произошла ~2.41 млн лет назад (в промежутке 1.75–3.08 млн). Время разделения южной и центральной филогрупп оценивается в среднем в 1.80 млн лет (в интервале 1.3–2.31 млн). Эти временные оценки совпадают с двумя крупнейшими последними регрессиями уровня мирового океана (до 60–70 м ниже современного уровня моря), имевшими место в плейстоцене (Haq et al., 1987). Этот факт поддерживает предположение о длительной изоляции исследуемых популяций и позволяет предполагать их видовой статус.
В ходе плейстоценовых оледенений граница леса располагалась на более низких высотах (Cox, Moore, 2000). Показано также значительное сокращение площади лесов в материковой Малайзии и на Палаване (Wurster et al., 2010) во время последнего оледенения. На протяжении длительных отрезков времени в течение четвертичного периода бóльшая часть территории региона была покрыта саваннами (Cranbrook, 2000; Gathorne-Hardy et al., 2002).
Современные исследования в области биогеографии и палеоклиматов Зондского шельфа предполагают, что взаимодействие между климатом, колебаниями уровня моря и их воздействием на распространение флоры и фауны может быть значительно более сложным (van den Bergh et al., 2001; Mercer, Roth, 2003; Meijaard, Groves, 2006). Многие острова на Зондском шельфе во время понижений уровня моря в плейстоцене (Mercer, Roth, 2003) соединялись друг с другом коридорами лесных экосистем (Anshari et al., 2000; Kershow et al., 2001; Meijaard, 2003; Cannon et al., 2009; Woodruff, 2010; Raes et al., 2014; Leonard et al., 2015). Сходным образом, непрерывный лесной покров существовал и в континентальном Индокитае на протяжении значительных периодов и в плиоцене, и плейстоцене (Meijaard, Groves, 2006). Это делало возможным прямой контакт, распространение и генетический обмен западно- и восточно-индокитайских популяций, который в настоящее время прерван обширными обезлесенными территориями в центральном Таиланде и западной Камбодже. Отсутствие сравнительно-генетических данных о малайских популяциях не позволяет прямо подтвердить это предположение. Тем не менее, основываясь на данных о персистенции тропических лесов и данных по распространению ассоциированных с лесами видов фауны на островах Южно-Китайского моря и особенностях распространения других арбореальных видов в регионе (Meijaard et al., 2003; Balakirev et al., 2021), прямая связь южного Вьетнама с Малаккским полуостровом может быть более вероятна, чем с пенинсулярным Таиландом. Сложная палеоистория региона вылилась в значительный уровень биоразнообразия и сложную внутривидовую структуру, наблюдаемую у многих видов в Индокитае, южном Китае и на пространстве Зондской суши (de Bruyn et al., 2014; Abramov et al., 2014; Leonard et al., 2015; Hu et al., 2021). В течение жарких и аридных периодов лесопокрытые территории сохранялись лишь на возвышенностях. Изолированные популяции Dremomys, по-видимому, существовали в этих лесных рефугиумах на протяжении исторически долгих периодов. Экологические барьеры, такие как упоминавшиеся выше саванноподобные территории, раз за разом появлялись в низменных областях, что нарушало генетический обмен между популяциями, населяющими изолированные горные леса, благоприятствуя таким образом их генетической диверсификации и событиям видообразования. Климат этого периода благоприятствовал существованию влажных горных лесов на плато Далат, Контум и в более северных районах вдоль хребта Аннамских гор, таких как плато Болавен, Фуан и Накай. Орография гор Юньнаня и еще более сложна и в еще большей степени благоприятствует событиям видообразования. Возможно, что дальнейшие исследования Dremomys приведут к открытию новых видов этих белок в горах южного Китая и на Малайском полуострове, как это уже произошло для данного рода (Li et al., 2008) и для родственных групп, таких как Tamiops (Chang et al., 2011) и Petaurista (Li et al., 2013).
Тектонические подвижки между ледниковыми периодами и в межледниковья, имевшие место в плейстоцене, а также продолжающийся подъем Гималаев приблизительно 2–3 млн лет назад (Zheng et al., 2000), могли послужить главными факторами, ответственными за повышенный уровень генетического разнообразия и симпатрическое распространение ряда видов Dremomys, таких как D. ornatus, D. gularis и D. pyrrhomerus в южном Китае. Современные популяции D. r. fuscus и D. r. laomache также могли возникнуть в результате таких благоприятных взаимообменов. Как явствует из генетических данных и внешней морфологии, эти популяции вполне могут происходить от популяций западного Индокитая, а не китайских, с которыми они пришли в соприкосновение значительно позднее в результате вторичного контакта в ходе недавнего расширения своего ареала. Подобные сценарии предполагались ранее для некоторых других арбореальных видов грызунов Юго-Восточной Азии (Balakirev et al., 2012, 2021; Meschersky et al., 2016; Balakirev, Rozhnov, 2019;).
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов: Все авторы участвовали в сборе образцов, AEБ провел генетический анализ и написал большую часть текста, AEБ и AВA вместе провели морфологический анализ и подготовили иллюстрации; БСФ организовывал бóльшую часть полевых экспедиций во Вьетнаме и осуществлял контакты с вьетнамскими музеями и другими организациями, ВВР редактировал текст, организовывал финансирование проекта и осуществлял общую координацию работы в России и во Вьетнаме.
Благодарности. Работа выполнена на базе Российско-Вьетнамского тропического научно-исследовательского и технологического центра, Ханой, Вьетнам. Мы благодарны С.В. Крускопу (Зоомузей МГУ), О.В. Макаровой (ЗИН РАН), Ву Динь Тонгу (IEBR) и администрации Музея Ханойского университета за возможность работы с коллекциями. Мы благодарим также В.В. Сунцова и Г.В. Кузнецова, чьи сборы составили значительную часть исследованного морфологического материала. Мы благодарны сотрудникам Российско-Вьетнамского тропического центра Нгуен Данг Хою, Чан Куанг Тиену и Чан Хыу Кою, которые приложили значительные усилия для организации экспедиций. Наконец, мы хотим выразить благодарность администрациям заповедников и национальных парков Кего (Ke Go) и Чумомрай (Chu Mom Ray) за их помощь в проведении наших исследований. Мы также очень благодарны Марсело Векслеру, Пьер-Анри Фабру за конструктивную критику ранних версий данной работы.
Финансирование. Работа частично выполнена при поддержке РНФ (грант 20-14-00036) и программы Зоологического института РАН (АААА-А19-119082990107-3).
Список литературы
Abramov A.V., Balakirev A.E., Rozhnov V.V. An enigmatic pygmy dormouse: molecular and morphological evidence for the species taxonomic status of Typhlomys chapensis (Rodentia: Platacanthomyidae) // Zool. Studies. 2014. V. 53. P. 34. https://doi.org/10.1186/s40555-014-0034-2
Anshari G., Kershaw A.P., van der Kaars S. A late Pleistocene and Holocene pollen and charcoal record from peat swamp forest, Lake Sentarum Wildlife Reserve, West Kalimantan, Indonesia // Palaeogeography Palaeoclimat and Palaeoecology. 2000. V. 171. P. 213–228. https://doi.org/10.1016/S0031-0182(01)00246-2
Baker R.J., Solari S., Hoffmann F.G. A new Central American species from the Carollia brevicauda complex // Occasional Paper, Museum of Texas Technological University. 2002. V. 217. P. 1–12. https://doi.org/10.5962/bhl.title.156831
Baker R.J., O’Neill M.B., McAliley L.R. A new species of desert shrew, Notiosorex, based on nuclear and mitochondrial sequence data // Occasional Paper, Museum of Texas Technological University. 2003. V. 222. P. 1–12. https://doi.org/10.5962/bhl.title.157011
Baker R.J., Fonseca R.M., Parish D.A., Phillips C.J., Hoffmann F.G. New bat of the genus Lophostoma (Phyllostomidae: Phyllostominae) from northwestern Ecuador // Occasional Paper, Museum of Texas Technological University. 2004. V. 232. P. 1–16.
Baker R.J., Bradley R.D. Speciation in mammals and the genetic species concept // J. Mammalogy. 2006. V. 87. P. 643–662. https://doi.org/10.1644/06-MAMM-F-038R2.1
Balakirev A.E., Abramov A.V., Rozhnov V.V. Taxonomic revision of Niviventer (Rodentia, Muridae) from Vietnam: a morphological and molecular approach // Rus. J. Theriology. 2012. Vol. 10. P. 1–26. https://doi.org/10.15298/rusjtheriol.10.1.01
Balakirev A.E., Rozhnov V.V. Taxonomic revision of beautiful squirrels (Callosciurus, Rodentia: Sciuridae) from the Callosciurus erythraeus/finlaysonii complex and their distribution in eastern Indochina // Raffles Bulletin of Zoology. 2019. V. 67. P. 459–489. https://doi.org/10.26107/RBZ-2019-0037
Balakirev A.E., Abramov A.V., Rozhnov V.V. Distribution pattern and phylogeography of tree rats Chiromyscus (Rodentia, Muridae) in eastern Indochina // Zoosystem. Evol. 2021. V. 97(1) P. 83–95. https://doi.org/10.3897/zse.97.57490
Bandelt H.-J., Forster P., Rohl A. Median-joining networks for inferring intraspecific phylogenies // Molecular Biology and Evolution. 1999. V. 16. P. 37–48. https://doi.org/10.1093/oxfordjournals.molbev.a026036
van den Bergh G.D., de Vos J., Sondaar P.Y. The late quaternary palaeogeography of mammal evolution in the Indonesian Archipelago // Palaeogeography Palaeoclimat and Palaeoecology. 2001. V. 171. P. 385–408. https://doi.org/10.1016/S0031-0182(01)00255-3
Blanford W.T. On some mammals from Tenasserim // J. Asian Soc. Bengal. 1878. V. 47. P. 150–167.
Bonhote J.L. On a collection of mammals made by Dr. Vassal in Annam // Proc. Zool. Soc. (London). 1907. V. 77. P. 3–11.
Bonhote J.L. Report on the mammals // J. Fed. Malay States Museums. 1908. V. 3. P. 1–11.
Bradley R.D., Baker R.J. A test of the genetic species concept: cytochrome-b sequences and mammals // J. Mammalogy. 2001. V. 82. P. 960–973. https://doi.org/10.1644/1545-1542(2001)082%3C0960: ATOTGS%3E2.0.CO;2
Bradley R.D., Carroll D.S., Haynie M.L., Martinez R.M., Hamilton M.J., Kilpatrick C.W. A new species of Peromyscus from western Mexico // J. Mammalogy. 2004a. V. 85. P. 184–193. https://dx.doi.org/10.1644%2F06-MAMM-F-038R2.1
Bradley R.D., Mendez-Harclerode F., Hamilton M.J., Ceballos G. A new species of Reithrodontomys from Guerrero, Mexico // Occasional Paper, Museum of Texas Technological University. 2004b. V. 231. P. 1–12. https://www.jstor.org/stable/4094590
Braun J.K., van den Bussche R.A., Morton P.K., Mares M.A. Phylogenetic and biogeographic relationships of mouse opossums Thylamys (Didelphimorphia, Didelphidae) in southern South America // J. Mammalogy. 2005. V. 86. P. 147–159. https://doi.org/10.1644/1545-1542(2005)086<0147: PABROM>2.0.CO;2
de Bruyn M., Stelbrink B., Morley R.J., Hall R., Carvalho G.R., Cannon C.H., van den Bergh G., Meijaard E., Metcalfe I., Boitani L., Maiorano L., Shoup R., von Rintelen T. Borneo and Indochina are major evolutionary hotspots for Southeast Asian biodiversity // Systematic Biology. 2014. V. 63. P. 879–901. https://doi.org/10.1093/sysbio/syu047
Cao V.S. Inventaire des rongeurs du Vietnam // Mammalia. 1984. V. 48. P. 391–395. [In French]. https://doi.org/10.1515/mamm.1984.48.3.391
Cannon C.H., Morley R.J., Bush A.B.G. The current refugial rainforests of Sundaland are unrepresentative of their biogeographic past and highly vulnerable to disturbance // Proc. Nat. Acad. Sci.USA. 2009. V. 106. P. 11188–11193. https://doi.org/10.1073/pnas.0809865106
Chang S.-W., Oshida T., Endo H., Nguyen T.S., Dang N.C., Nguyen X.N., Jiang X., Li Z.-J., Lin L.-K. Ancient hybridization and underestimated species diversity in Asian striped squirrels (genus Tamiops): inference from paternal, maternal and biparental markers // J. Zoology. 2011. V. 285. P. 128–138. https://doi.org/10.1111/j.1469-7998.2011.00822.x
Chelomina G.N., Pavlenko M.V., Kartavtseva I.V., Boeskorov G.G., Lyapunova E.A., Vorontsov N.N. Genetic differentiation of Caucasian wood mice: Comparison of isozymic, chromosomal and molecular divergence // Rus. J. Genetics. 1998. V. 34(2). P. 213–225.
Conroy C.J., Cook J.A. Molecular systematics of Holarctic rodent (Microtus: Muridae) // J. Mammalogy. 2000. V. 81. P. 344–359. https://doi.org/10.1644/1545-1542(2000)081%3C0344: MSOAHR%3E2.0.CO;2
Cox C.B., Moore P.D. Biogeography: an ecological and evolutionary approach. 6th (edn.) Oxford: Blackwell Science Ltd. 2000.
Corbet G.B., Hill J.E. The mammals of the Indo-Malayan region: a systematic review. Oxford: Oxford Univ Press, 1992.
Cranbrook E. Northern Borneo environments of the past 40 000 years: archaeozoological evidence // Sarawak Museum J. 2000. V. 55. P. 62–109.
Dao V.T. Sur l’existence des deux formes de l’écureuil de Perny, Dremomys pernyi pernyi Milne-Edwards et D. p. flavior G. Allen au Nord-Vietnam // Zool. Abhandl Staat Museum Tierk Dresden. 1969. V. 30. P. 83–87 [in French].
Dao V.T., Cao V.S. Six new Vietnamese rodents // Mammalia. 1990. V. 54. P. 233–238 [in French]. https://doi.org/10.1515/mamm-1990-0207
Gannon W.L., Sikes R.S. American Society of Mammalogists. Guidelines of the American Society of Mammalogists for the use of wild animals in research // J. Mammal. 2011. V. 92(1). P. 235–253. https://doi.org/10.1644/10-MAMM-F-355.1
Gathorne-Hardy F.J., Syaukani, Davies R.G., Eggleton P., Jones D.T. Quaternary rainforest refugia in south-east Asia: using termites (Isoptera) as indicators // Biol. J. Linn. Soc. 2002. V. 75. P. 453–466. https://doi.org/10.1046/j.1095-8312.2002.00031.x
Ellerman J.R. The families and genera of living rodents. Vol.1. Rodents other than Muridae. London: Publ. House of British Museum (Nat Hist). 1940.
Endo H., Kimura J., Oshida T., Stafford B.J., Rerkamnuaychoke W., Nishida T., Sasaki M., Hayashida A., Hayashi Y. Geographical variation of skull morphology and its functional significances in the red-cheeked squirrel // J. Veter. Med. Sci. 2003. V. 60. P. 1179–183. https://doi.org/10.1292/jvms.65.1179
Hall R. The plate tectonics of Cenozoic Southeast Asia and the distribution of land and sea // Hall R., Hollway J.D. (eds). Biogeography and geological evolution of SE Asia. Backhuys, Leiden: 1998. P. 99–131.
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. // Nucleic Acids Symposium Serial. 1999. V. 41. P. 95–98. https://doi.org/10.1021/bk-1999-0734.ch008
Haq B.U., Hardenbol J., Vail P.R. The chronology of fluctuating sea level since the Triassic // Science. 1987. V. 235. P. 1156–1167. https://doi.org/10.1126/science.235.4793.1156
Hawkins M.T.R., Helgen K.M., Maldonado J.E., Rockwood L.L., Tsuchiya M.T.N., Leonard J.A. Phylogeny, biogeography and systematic revision of plain long-nosed squirrels (genus Dremomys, Nannosciurinae) // Mol. Phylogen. Evolution. 2016. V. 94. P. 752–764. https://doi.org/10.1016/j.ympev.2015.10.023
Hebert P.D.N., Cywinska A., Ball S.L., de Waard J.R. Biological identifications through DNA barcodes // Proc. Royal Soc. of London, Ser B. 2003. V. 270. P. 313–321. https://doi.org/10.1098/rspb.2002.2218
Hille A., Tarkhnishvili D., Meinig H., Hutterer R. Morphometric, biochemical and molecular traits in Caucasian wood mice (Apodemus/Sylvaemus), with remarks on species divergence // Acta Theriologica. 2002. V. 47. P. 389–416. https://doi.org/10.1007/BF03192465
Hu Ting-Li, Cheng Feng, Xu Zhen, Chen Zhong-Zheng, Yu Lei, Ban Qian, Li Chun-Lin, Pan Tao, Zhang Bao-Wei. Molecular and morphological evidence for a new species of the genus Typhlomys (Rodentia: Platacanthomyidae) // Zool. Res. 2021. Vol. 42(1). P. 100–107. https://doi.org/10.24272/j.issn.2095-8137.2020.132
ICZN International Code of Zoological Nomenclature. 4th edn. International Trust for Zoological Nomenclature, London. 1999.
Irwin D., Kocher T.D., Wilson A.S. Evolution of the cytochrome b gene of mammals // J. Mol. Evol. 1991. V. 32. P. 128–144. https://doi.org/10.1007/BF02515385
Kershaw A.P., Penny D., Kaars van der S., Anshari G., Thamotherampillai A. Vegetation and climate in lowland Southeast Asia at the last glacial maximum // Metcalfe I., Smith J.M.B., Morwood M., Davidson I. (eds) Faunal and floral migration and evolution in SE Asia-Australasia. Lisse: Balkema Publishers. 2001. P. 227–236.
Kocher T.D., Thomas W.K., Meyer A., Edwards S.V., Paabo S., Villablanca F., Wilson A. Dynamics of mitochondrial DNA evolution in animals: amplification and sequencing with conserved primers // Proc. Nat. Acad. Sci. USA. 1989. V. 86. P. 6196–6200. https://doi.org/10.1073/pnas.86.16.6196
Leonard J.A., den Tex R.-J., Hawkins M.T.R., Muñoz-Fuentes V., Thorington R., Maldonado J.E. Phylogeography of vertebrates on the Sunda Shelf: a multi-species comparison // J. Biogeography. 2015. V. 42. P. 871–879. https://doi.org/10.1111/jbi.12465
Li S., Yu F., Yang S., Wang Y., Jiang X., McGuire P.M., Feng Q., Yang J. Molecular phylogeny of five species of Dremomys (Rodentia: Sciuridae), inferred from cytochrome b gene sequences // Zool. Scripta. 2008. V. 37. P. 349–354. https://doi.org/10.1111/j.1463-6409.2008.00335
Li S., He K., Yu F.-H., Yang Q.-S. Molecular phylogeny and biogeography of Petaurista inferred from the cytochrome b gene, with implications for the taxonomic status of P. caniceps, P. marica and P. sybilla // PLoS ONE. 2013. V. 8. P. e70461. https://doi.org/10.1371/journal.pone.0070461
Matocq M.D. Morphological and molecular analysis of a contact zone in the Neotoma fuscipes species complex // J. Mammalogy. 2002. V. 83. P. 866–883. https://doi.org/10.1644/1545-1542(2002)083%3C0866: MAMAOA%3E2.0.CO;2
Meschersky I.G., Abramov A.V., Lebedev V.S., Chichkina A.N., Rozhnov V.V. Evidence of a complex phylogeographic structure in the Indomalayan pencil-tailed tree mouse Chiropodomys gliroides (Rodentia: Muridae) in eastern Indochina // Bioch. System. Ecology. 2016. V. 65 P. 147–157. https://doi.org/10.1016/j.bse.2016.02.015
Meijaard E. Mammals of south-east Asian islands and their Late Pleistocene environments // J. Biogeography. 2003. V. 30. P. 1245–1257. https://doi.org/10.1046/j.1365-2699.2003.00890.x
Meijaard E., Groves C.P. The geography of mammals and rivers in mainland Southeast Asia // Lehman S.M., Fleagle J.G. (eds) Primate biogeography. N.Y.: Springer. 2006. P. 305–329.
Mercer J.M., Roth V.L. The effects of Cenozoic global change on squirrel phylogeny // Science. 2003. V. 299. P. 1568–1572. https://doi.org/10.1126/science.1079705
Moore J.C., Tate G.H.H. A study of the diurnal squirrels, Sciurinae, of the Indian and Indochinese subregions. Fieldiana: Zoology. V. 48. 1965. 351 p.
Osgood W.H. Mammals of the Kelley-Roosevelts and Delacour Asiatic expeditions // Fields Mus. Nat. History. Zool. Ser. 1932. V. 18. P. 193–339.
Oshida T., Lin L.K, Masuda R., Yoshida M.C. Phylogenetic relationships among Asian species of Petaurista (Rodentia, Sciuridae), inferred from mitochondrial cytochrome b gene sequences // Zool. Science. 2000. V. 17. P. 123–128. https://doi.org/10.2108/zsj.17.123
Oshida T., Lee J.K., Lin L.K., Chen Y.J. Phylogeography of the Pallas’s squirrel in Taiwan: geographical isolation in an arboreal small mammal // J. Mammalogy. 2006. V. 87. P. 247–254. https://doi.org/10.1644/05-MAMM-A.-123R1.1
Page R.D.M. Tree View: an application to display phylogenetic trees on personal computers] // Bioinformatics. 1996. V. 12. P.357–358. https://doi.org/10.1093/bioinformatics/12.4.357
Piaggio A.J., Valdez E.W., Bogan M.A., Spicer G.S. Systematics of Myotis occultus (Chiroptera: Vespertilionidae) inferred from sequences of two mitochondrial genes // J. Mammalogy. 2002. V. 83. P. 386–395. https://doi.org/10.1644/1545-1542(2002)083%3C0386: SOMOCV%3E2.0.CO;2
Pocock R.I. The classification of Sciuridae // Proc. Zool. Soc. of London. 1923. V. 1. P. 209–246.
Polzin T., Daneschmand S.V. On Steiner trees and minimum spanning trees in hypergraphs // Oper. Res. Letters. 2003. V. 31. P. 12–20. https://doi.org/10.1016/S0167-6377(02)00185-2
Qiu Zhu-Ding. Sciurids from the later Miocene Lufeng Hominoid Locality, Yunnan // Vertebrata PalAsiatica. 2002. Vol. 40. P. 177–193. [in Chinese]
Raes N., Cannon C.H., Hijmans R.J., Piessens T., Saw L.G., van Welzen P.C., Slik J.W.F. Historical distribution of Sundaland’s dipterocarp rainforests Quaternary glacial maxima // Pros. Nat. Acad. Sci.USA. 2014. V. 111. P. 16790–16795. https://doi.org/10.1073/pnas.1403053111
Roca A.L., Georgiadis N., Pecon-Slattery J., O’Brien S.J. Genetic evidence for two species of elephant in Africa // Science. 2001. Vol. 293. P. 1473–1477. https://doi.org/10.1126/science.1059936
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor: Cold Spring Harbor Laboratories. 1989.
Sokolov V.E., Baskevich M.I. A new species of birch mouse Sicista armenica sp. n. (Rodentia, Dipodoidea) from the Lesser Caucasus // Zool. Zh. 1988. V. 67. P. 300–304 [in Russian].
Sokolov V.E., Baskevich M.I., Kovalskaya Y.M. Revision of birch mice of the Caucasus: sibling species Sicista caucasica (Vinogradov, 1925) and S. kluchorica sp. n. (Rodentia, Dipodidae) // Zool. Zh. 1981. V. 60. P. 1386–1393 [in Russian].
Sokolov V.E., Baskevich M.I., Kovalskaya Y.M. Sicista kazbegica sp. n. (Rodentia, Dipodidae) from the upper reaches of the Terek River basin // Zool. Zh. 1986. V. 65. P. 949–951 [in Russian].
Solari S., Baker R.J. Mitochondrial DNA sequence, karyotypic, and morphological variation in the Carollia castanea species complex (Chiroptera: Phyllostomidae) with description of a new species // Occas. Paper, Museum of Texas Technol. Univ. 2006. V. 254. P. 1–16. https://doi.org/10.5962/bhl.title.156889
Spotorno A.E., Valladares J.P., Marin J.C., Palma R.E., C. Zuleta A.R. Molecular divergence and phylogenetic relationships of chinchillids (Rodentia: Chinchillidae) // J. Mammal. 2004. V. 85. P. 384–388. https://doi.org/10.1644/BRB-119
Stanhope M.J., Czelusniak J., Si J.-S., Nickerson J., Goodman M. A molecular perspective on mammalian evolution from the gene encoding interphotoreceptor retinoid binding protein, with convincing evidence for bat monophyly // Mol. Phylogen. Evol. 1992. V. 1. P. 148–160. https://doi.org/10.1016/1055-7903(92)90026-D
Steppan S.J., Storz B.J., Hoffmann R.S. Nuclear DNA phylogeny of the squirrels (Mammalia, Rodentia) and the evolution of arboreality from c-myc and RAG1 // Mol. Phylogen. Evol. 2004. V. 30. P. 703–719. https://doi.org/10.1016/S1055-7903(03)00204-5
Suzuki H., Tsuchiya K., Takezaki N. A molecular phylogenetic framework for the Ryukyu endemic rodents Tokudaia osimensis and Diplothrix legata // Mol. Phylog. Evol. 2000. V. 15. P. 15–24. https://doi.org/10.1006/mpev.1999.0732
Tajima F. Simple methods for testing molecular clock hypothesis // Genetics. 1993. V. 135. P. 599–607.
Tamura K., Nei M., Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method // Pros.Nat. Acad. Sci.USA. 2004. V. 101. P. 11030–11035. https://doi.org/10.1073/pnas.0404206101
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular evolutionary genetics analysis, version 6.0. // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729. https://doi.org/10.1093/molbev/mst197
Thomas O. Scientific results of the mammal survey. No.7. // J. Bombay Nat. History Soc. 1914. V. 23. P. 23–31.
Thomas O. A new monkey and a new squirrel from the Middle Mekong, on the eastern frontier of Siam // Ann. Magazine Nat. History. 1921. V. 7. P. 181–183.
Thomas O., Wroughton R.C. Scientific results from the mammal survey. No. XII. On the squirrels obtained by Messrs. Shortridge and Macmillan on the Chindwin River, Upper Burma // J. Bombay Nat. History Soc. 1916. V 24. P. 224–239.
Thorington R.W., Hoffmann R.S. Family Sciuridae // Wilson D.E., Reeder D.M. (eds). Mammal species of the world. A taxonomic and geographic reference, 3rd edn. Baltimore: Johns Hopkins University Press. 2005. P. 754–818.
Thorington R.W., Koprowski J.L., Steele M.A., Whatton J.F. Squirrels of the world. Baltimore: Johns Hopkins Univ Press. 2012. 459 p.
Woodruff D.S. Biogeography and conservation in Southeast Asia: how 2.7 million years of repeated environmental fluctuations affect today’s patterns and the future of the remaining refugial-phase biodiversity // Biodiver. Conserv. 2010. V. 19. P. 919–941. https://doi.org/10.1007/s10531-010-9783-3
Wurster C.M., Bird M.I., Bull I.D., Creed F., Bryant C., Dungait J.A., Paz V. Forest contraction in north equatorial southeast Asia during the last glacial period // Pros. Nat. Acad. Sci. USA. 2010. Vol. 107. P. 15508–15511. https://doi.org/10.1073/pnas.1005507107
Zheng H., Powell C.M., An Z., Zhou J., Dong G. Pliocene uplift of the northern Tibetan Plateau // Geology. 2000. V. 28. P. 715–718. https://doi.org/10.1130/0091-7613(2000)28<715: PUOTNT>2.0.CO;2
Дополнительные материалы
- скачать ESM_1.docx
- Список образцов D. rufigenis, D. ornatus и D. pernyi использованных для генетических и морфологических анализов.
- скачать ESM_2.docx
- Список образцов использованных в филогенетическом анализе.
- скачать ESM_3.docx
- Оценки межгрупповой эволюционной дивергенции Dremomys вычисленные по последовательности гена Cyt b (1140 пн., d T3P).
- скачать ESM_4.docx
- Описательные статистики (средние, пределы и стандартные отклонения) для промеров черепа и краниальных индексов (в мм) взрослых Dremomys rufigenis s. lato из восточного Индокитая.
- скачать ESM_5.docx
- Факторные нагрузки и объяснённая вариация для главных компонент в PCA анализе.
- скачать ESM_6.jpg
- Череп Dremomys rufigenis fuscus. Взрослый самец (ZMMU S-191975, генетический ваучер BL-17) уезд Баолок, близ Бао Лам, провинция Ламдонг, южный Вьетнам.
- скачать ESM_7.jpg
- Череп Dremomys ornatus. Взрослая самка (ZMMU S-191977, генетический ваучер ThN 17) уезд Халанг, близ Тханьнят, провинция Каобанг, северный Вьетнам
Инструменты
Известия РАН. Серия биологическая


