Кинетика и катализ, 2019, T. 60, № 2, стр. 227-234
Промотирующий эффект ниобия в селективном каталитическом восстановлении NO аммиаком на катализаторе CeAlOx, модифицированном Nb
R. Shi 1, 2, 3, *, Y. Zhang 3, B. Yuan 3, Z. Zheng 3, L. Ni 3, R. Feng 1, 2, 3, X. Lin 1, 3, L. Dai 1, 2, 3
1 Fujian Indoor Environmental Engineering Technology Research Center,
350118 Fuzhou, China
2 Chemical Safety Institute of Fujian University of Technology,
350118 Fuzhou, China
3 College of Ecological Environmental and Urban Construction, Fujian University of Technology
350118 Fuzhou, China
* E-mail: shironghui@fjut.edu.cn
Поступила в редакцию 24.07.2018
После доработки 14.10.2018
Принята к публикации 19.10.2018
Аннотация
В гидротермальных условиях приготовлена серия катализаторов CeAlOx, модифицированных Nb, и исследовано поведение этой системы в селективном каталитическом восстановлении NO аммиаком. Наиболее высокую активность и повышенную устойчивость к отравлению серой показал катализатор с мольным отношением Nb/Al = 1 : 1. Катализаторы охарактеризованы методоми БЭТ, РСА, ТПВ-H2, ТПД-NH3, РФЭС и диффузной отражательной спектроскопии (ДОС) in situ. Полученные результаты показывают, что введение Nb увеличивает окислительно-восстановительную способность и поверхностную кислотность катализатора. Одновременно возрастает количество атомов Oα и ионов Ce3+, адсорбированных на поверхности катализатора. Кроме того, с применением ДОС in situ установлено, что допирование ниобием увеличивает адсорбционную емкость по аммиаку, но снижает способность адсорбировать смесь NO + O2. Все эти факторы способствуют улучшению каталитического поведения катализаторов в селективном восстановлении NO аммиаком.
Оксиды азота (NO and NO2), образующиеся при сжигании ископаемого топлива, являются причиной многих экологических проблем, таких как кислотные дожди, фотохимический смог, истощение озонового слоя и тепличные эффекты [1]. Селективное каталитическое восстановление NOx аммиаком (NH3-СКВ) зарекомендовало себя как наиболее распространенный метод борьбы с выбросами оксидов азота угольными тепловыми электростанциями. Широкое применение в качестве катализаторов этого процесса нашли системы V2O5–WO3(MoO3)/TiO2, которые с высокой эффективностью удаляют NOx и устойчивы к отравляющему действию SO2. Однако ванадиевые системы обладают рядом недостатков, среди которых можно назвать узкий температурный интервал реакции (300–400°С), низкую селективность по азоту, а также биологическую токсичность V2O5 по отношению к окружающей среде и организму человека [2]. Отсюда понятна необходимость разработки альтернативных экологически безопасных каталитических систем.
В последнее время внимание исследователей привлекла разработка цериевых катализаторов процесса NH3-СКВ, для которых характерны необычайно мощная окислительно-восстановительная способность, большая емкость по кислороду и устойчивость к соединениям серы. В литературе появились сообщения о том, что цериевые катализаторы, такие как CeO2/TiO2 [3], α-MnO2, допированный церием [4], смешанная оксидная система Ce–Cu–Zr [5] и CeZrOx, модифицированный Sb [6], проявили высокую активность в модельных реакциях NH3-СКВ. Было показано, что введение Nb способствует увеличению активности катализаторов в NH3-СКВ и селективности по N2. Промотирующее влияние Nb на активность в NH3-СКВ наблюдали в присутствии катализаторов CeO2–Nb2O5 [7], Cu/Ti–Nb [8], Mn–Nb [9] и NbOx–CeO2–ZrO2 [10]. Насколько нам известно, исследования поведения катализаторов CeAlOx, допированных Nb, в реакции NH3-СКВ пока не проводились.
В данной работе описано приготовление серии катализаторов CeAlOx, модифицированных Nb, в гидротермальных условиях и их поведение в NH3-СКВ. Для характеристики катализаторов использовали следующие методы: определение поверхности по адсорбции азота (БЭТ), рентгенофазовый анализ (РФА), температурно-программируемое восстановление водородом (ТПВ-H2), температурно-программируемая десорбция аммиака (ТПД-NH3), рентгеновская фотоэлектронная спектроскопия (РФЭС) и диффузная отражательная спектроскопия (ДОС) in situ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Серию катализаторов CeAlOx, модифицированных Nb с эквимолярным отношением Ce/Al и различным мольным отношением Nb/Al, готовили в гидротермальных условиях. Навески Ce(NO3)3 · 6H2O, NbCl5 и Al(NO3)3 · 9H2O растворяли в деионизованной воде и перемешивали при комнатной температуре в течение 1 ч. В приготовленный таким образом раствор добавляли водный раствор аммиака. Когда значение pH увеличивалось до 10, водную суспензию помещали в тефлоновый автоклав. После герметизации реакционную смесь выдерживали в автоклаве при 150°С в течение 24 ч. Затем осадок собирали на фильтре, промывали деионизованной водой, высушивали при 110°С в течение 12 ч и прокаливали при 500°С в течение 5 ч.
Исследование каталитической активности в NH3-CКВ
Каталитическую активность в реакции NH3-СКВ исследовали в реакторе с неподвижным слоем катализатора, через который пропускали реакционную смесь следующего состава: NO – 500 м. д., NH3 – 500 м. д., O2 – 5 об. %, SO2 – 100 м. д. (в ряде экспериментов), H2O – 5 об. % (в ряде экспериментов) и N2 для поддержания баланса системы. Навеска катализатора составляла 0.6 мл, объемная скорость 500 мл/мин. Концентрацию газа определяли непрерывно с помощью ИК-Фурье-спектрометра Nicolet Nexus 670 (“Nicolet Instrument Corp.”, США). Конверсию NOx и селективность по N2 рассчитывали по следующим уравнениям:
Здесь нижний индекс “вх“ означает концентрацию газа на входе в реактор, а “вых“ – на выходе из реактора.
Характеризация катализатора
Изотермы адсорбции–десорбции N2 на катализаторах были измерены при 77 K на установке Micromeritics Tristar-3000 (“Micromeritics”, США). Перед адсорбционными измерениями, катализаторы вакуумировали при 300°С в течение 5 ч. Удельные поверхности катализаторов определяли методом БЭТ по данным, полученным в интервале относительных давлений 0.05–0.3. Общий объем пор рассчитывали по десорбционной ветви изотерм адсорбции N2 по уравнению BJH.
Порошковый рентгенофазовый анализ (РФА) катализаторов проводили на дифрактометре Rigaku D/max 2200 (“Rigaku”, Япония), используя CuKα-излучение. Образцы сканировали в области 2θ от 10° до 90° со скоростью 5°/мин с шагом 0.07°.
Эксперименты по ТПВ-H2 и ТПД-NH3 проводили в хемосорбционном анализаторе Micromeritics Auto Chem II 2920 (“Micromeritics”). В каждом опыте по ТПВ-H2 в кварцевый реактор загружали навеску катализатора (100 мг), затем через реактор, нагретый до 400°С, пропускали гелий (50 мл/мин), содержащий 20 об. % O2. Через 1 ч реактор охлаждали до комнатной температуры в токе Не. После этого температуру со скоростью 10°С/мин поднимали от 30 до 800°С в токе гелия, содержащего 10% H2. Количество поглощенного водорода определяли с помощью детектора по теплопроводности. Перед каждым опытом по ТПД-NH3 в реактор загружали навеску катализатора (100 мг) и обрабатывали ее при 400°С в течение 1 ч в токе гелия, содержащего 20 об. % O2. После охлаждения до 30°С катализаторы насыщали в токе NH3, который подавали со скоростью 40 мл/мин в течение 1 ч. На заключительном этапе температуру поднимали до 600°С в токе He при скорости нагревания 10°С /мин.
Для экспериментов, выполненных с применением диффузионной отражательной спектроскопии (ДОС) in situ использовали ИК-Фурье-спектрометр Nicolet Nexus 670 (“Nicolet Instrument Corp.”), оборудованный интеллектуальным коллектором и MCT-детектором, охлаждаемым жидким азотом. Перед каждым экспериментом катализатор обрабатывали при 500°С в течение 1 ч в токе N2, содержащего 20 об. % O2 и затем охлаждали до 200°С. Спектр фона, зарегистрированный в токе N2, автоматически вычитали из спектра образца. Реакцию проводили при следующем составе реакционной смеси: NH3 – 500 м. д., NO – 500 м. д., O2 – 5 об. % и N2 – для поддержания баланса системы. Спектры регистрировали с разрешением 4 см−1 и накоплением 100 сканов.
Измерения методом РФЭС проводили на спектрометре ESCALab 220i-XL (“VG Scientific”, Великобритания) мощность 300 Ватт, MgKα-излучение). В полученных спектрах шкалу Ce3d калибровали по энергии связи линии C1s (энергия связи 284.8 эВ), которую использовали в качестве репера.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
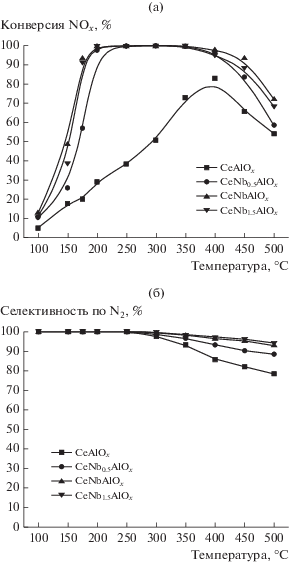
При исследовании поведения катализаторов CeAlOx в реакции СКВ-NH3 в присутствии и отсутствие в них модифицирующей добавки Nb были получены результаты, приведенные на рис. 1. Как видно на рис. 1a, значения конверсии NO на катализаторе CeAlOx невелики и максимальная степень превращения даже при 400°С составляет ~83%. Однако после допирования ниобием конверсия NO на трех катализаторах превышает 90% в области температур 200–400°С. Согласно данным рис. 1б, катализатор CeAlOx проявляет низкую селективность по N2 при температурах выше 300°С. С увеличением мольного отношения Nb/Al от 0.5 до 1.0 селективность по азоту для катализаторов CeAlOx, модифицированных ниобием, в высокотемпературной области значительно возрастает. Однако при дальнейшем увеличении мольного отношения Nb/Al до 1.5 заметного улучшения селективности по N2 не наблюдается. Когда температура реакции превышает 300°С, на поверхности катализатора может протекать неполное окисление аммиака, что, возможно, снизит селективность по N2. Подобное наблюдение ранее уже было описано в литературе [9]. Отсюда можно сделать вывод, что наилучшие показатели в реакции СКВ-NH3 проявляет катализатор CeNbAlOx с эквимольным отношением Nb/Al.
Рис. 1.
Температурная зависимость активности (a) и селективности по N2 (б) в реакции СКВ-NH3 в присутствии катализаторов CeAlOx и CeAlOx, модифицированных Nb.
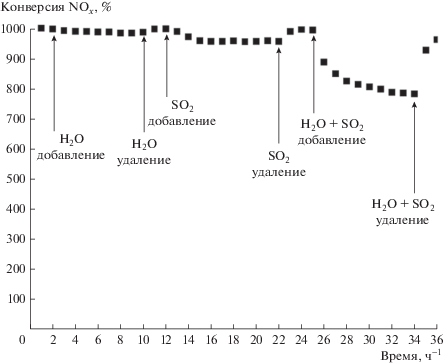
Присутствие H2O и SO2 в отходящих газах обычно приводит к отравлению катализаторов и снижению активности в реакции СКВ-NH3. Поэтому было интересно проследить за влиянием H2O/SO2 на активность катализаторов CeNbAlOx в реакции СКВ-NH3. На рис. 2 приведены данные, которые показывают, как продолжительность реакции влияет на активность катализаторов CeNbAlOx при 250°С в присутствии добавок чистой H2O или добавок смеси Н2О с SO2. Видно, что конверсия NO несколько снижается при введении чистых добавок H2O или SO2. Однако активность в СКВ-NH3 можно вновь вернуть на прежний уровень, если прекратить напуск H2O или SO2. Подача смеси, содержащей 100 м. д. SO2 и 5 об. % H2O, вызывает постепенное снижение конверсии NOx при 250°С. После того как подача SO2 и H2O прекращается, конверсия NO восстанавливается от 78.2 до 96.2%. Можно предположить, что потеря активности в реакции СКВ-NH3 вызвана осаждением на поверхности катализаторов NH4HSO4 или (NH4)2SO4 [6].
Рис. 2.
Активность катализатора CeNbAlOx в реакции СКВ-NH3 в присутствии 100 м. д. SO2 или/и 5 об. % H2O при 250°С.
В табл. 1 сведены данные о размере поверхности, объему пор и среднему диаметру пор, полученные для образцов катализатора CeAlOx, содержащего и не содержащего модифицирующую добавку Nb. По сравнению с немодифицированным образцом модифицированный ниобием катализатор CeAlOx отличается большими значениями объема пор и среднего диаметра пор. Таким образом, адсорбционные данные указывают на то, что допирование Nb вызывает определенные изменения пористой структуры.
Таблица 1.
Размер поверхности SВЭТ, объем пор и средний диаметр пор катализаторов CeAlOx и допированного ниобием CeAlOx
| Образец | SBЭT, м2/г | Vпор, cм3/г | Средний размер пор, нм |
|---|---|---|---|
| CeAlOx | 155 | 0.15 | 4.2 |
| CeNb0.5AlOx | 132 | 0.21 | 5.4 |
| CeNbAlOx | 110 | 0.29 | 7.8 |
| CeNb1.5AlOx | 104 | 0.24 | 6.2 |
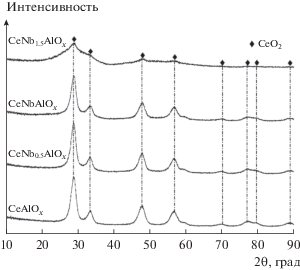
На рис. 3 приведены рентгенограммы катализатора CeAlOx и образцов CeAlOx, модифицированных ниобием. На этих рентгенограммах отчетливо видны отражения при значениях 2θ, равных 28.8°, 33.2°, 47.8°, 56.5°, 70.2°, 76.9°, 79.6° и 88.7°, соответствующих дифракционной картине CeO2 со структурой церионита [11]. Ни на одной рентгенограмме не обнаружены максимумы, характерные для соединений Al или Nb. Это можно объяснить либо тем, что эти соединения присутствуют в аморфном состоянии, либо тем, что образованные ими кристаллиты очень малы. По мере увеличения мольного отношения Nb/Al от 0.5 до 1.5 интенсивность максимумов, относящихся к CeO2, постепенно ослабевает. Очевидно, при введении Nb размер кристаллитов CeO2 в модифицированных образцах катализаторов CeAlOх уменьшается.
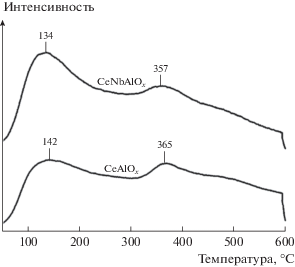
Для определения адсорбционной емкости катализаторов CeAlOx и CeNbAlOx по аммиаку использовали метод ТПД-NH3. Соответствующие кривые термодесорбции регистрировали в области 50–600°С (рис. 4). На термодесорбционных кривых катализатора CeAlOx заметны два максимума: при 142 и 365°С. Пик при 142°С можно отнести к слабо адсорбированному аммиаку, а пик при 365°С – к аммиаку, прочно удерживаемому на поверхности катализатора. Общую кислотность катализатора CeAlOx можно оценить величиной 423.1 мкмоль/г. На кривых, полученных на образцах, модифицированных Nb, положения десорбционных максимумов NH3 сдвигается в область низких температур, а величина общей кислотности увеличивается до 612.4 мкмоль/г. Можно предположить поэтому, что допирование ниобием усиливает кислотность катализатора CeAlOx.
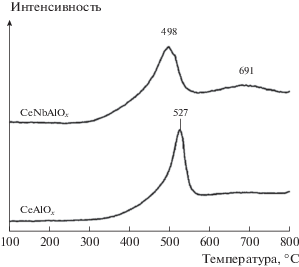
Также важную роль в реакции СКВ-NH3 играют окислительно-восстановительные свойства катализатора. Эксперименты по ТПВ-H2 преследовали цель выяснить окислительно-восстановительную способность катализаторов CeAlOx и CeNbAlOx (рис. 5). На кривой ТПВ для катализатора CeAlOx пик с максимумом при 527°С, по-видимому, отражает восстановление иона Ce4+ до Ce3+ на поверхности катализатора [12]. На кривой, полученной для Nb-содержащего образца CeNbAlOx, обнаружены два восстановительных пика с максимами при 498 и 691°С. Первый пик при 498°С, который можно отнести к процессу восстановления на поверхности CeO2, сдвинут в область более низких температур по сравнению с аналогичным пиком для катализатора CeAlOx. Второй пик при 691°С можно отнести к восстановлению массивного CeO2 [13]. Полученные результаты указывают, что добавки Nb усиливают окислительно-восстановительную способность катализатора CeNbAlOx.
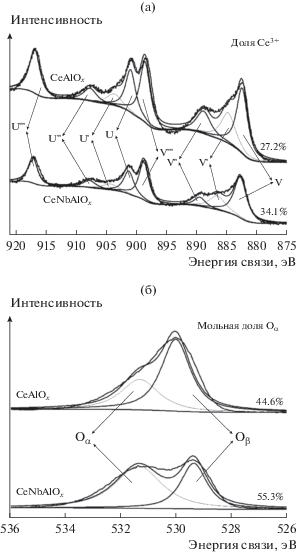
Для анализа состояния церия и кислорода на поверхности был использован метод РФЭС. Спектры Ce3d-электронов на поверхности катализаторов CeAlOx и CeNbAlOx приведены на рис. 6a. Положение линий Ce3d найдено путем подбора оптимальной комбинации гауссовых полос. Подуровни, обозначенные как u' и v', представляют исходное электронное состояние 3d104f1-электронов, соответствующее окислительному состоянию ионов Ce3+, а подуровни u, u′′, u″′, v, v'' и v''' отвечают 3d104f 0-электронам иона Ce4+ [6]. Отношение Ce3+/(Ce3+ + Ce4+) для образца CeNbAlOx (34.1%) было выше, чем для катализатора CeAlOx (27.2%). Это указывает на обогащение поверхности катализатора CeNbAlOx кислородными вакансиями.
На рис. 6б приведены РФЭ-спектры O1s-электронов. Подбор оптимального сочетания гауссовых полос позволяет описать эти спектры двумя подуровнями. Подуровень при 529.4–530.0 эВ можно отнести к атомам кислорода решетки (Oβ), а подуровень при 531.0–531.6 эВ – к атомам кислорода, адсорбированным на поверхности (Oα) [14]. Поверхностный кислород более подвижен и поэтому обладает более высокой реакционной способностью, чем кислород решетки. Поскольку отношение Oα/(Oα + Oβ) в катализаторе CeNbAlOx (55.3%) выше, чем у образца CeAlOx (44.6%), можно предположить, что после допирования ниобием часть ионов Ce4+ превращается в ионы Ce3+. Это может вызвать образование кислородных вакансий и повысить содержание кислорода, адсорбированного на поверхности. Таким образом, увеличение доли поверхностного кислорода Oα усиливает процесс окисления NO до NO2 и поэтому способствует протеканию реакции СКВ-NH3.
ДОС in situ
Спектры диффузионной отражательной спектроскопии адсорбированного NH3 и адсорбированной смеси NO + O2 были зарегистрированы in situ при 200°С, чтобы с помощью адсорбции выяснить свойства поверхности катализаторов CeAlOx и CeNbAlOx (рис. 7).
Рис. 7.
Спектры диффузионной отражательной спектроскопии адсорбированного NH3 (а) и адсорбированной смеси NO + O2 (б), зарегистрированные in situ при 200°С для катализаторов CeAlOx и CeNbAlOx.
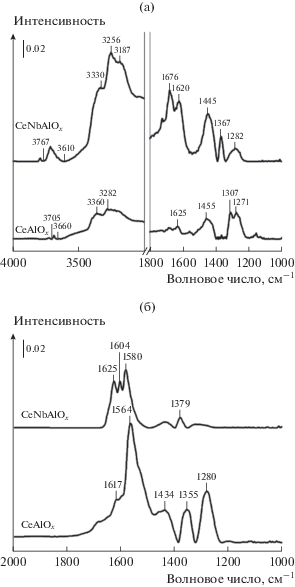
Как видно на рис. 7a, после напуска NH3 на поверхности катализатора CeAlOx аммиак находится в различных формах. Полоса при 1271 см–1 относится к симметричным и антисимметричным колебаниям NH3 адсорбированных на льюисовских кислотных центрах [15]. Полоса при 1307 см–1 обусловлена ножничными колебаниями NH2-групп [16], а полосу при 1455 см–1 можно приписать симметричным и антисимметричным деформационным колебаниям ионов ${\text{NH}}_{4}^{ + },$ адсорбированных на бренстедовских кислотных центрах [17]. Присутствие полосы при 1625 см–1 вызвано антисимметричными деформационными колебаниями ионов NH3, координационно-связанных с поверхностью катализатора [18]. Полосы при 3360 и 3282 см–1 соответствуют валентным колебаниям групп NH [19], а еще две полосы при 3660 и 3705 см–1 можно приписать валентным колебаниям поверхностных OH-групп [20, 21]. Допирование ниобием приводит к появлению в спектре полосы при 1367 cм–1, которая обусловлена присутствием адсорбированных частиц в окисленном состоянии [22]. Можно заметить, что полосы при 1282 и 1620 см–1, отнесенные к льюисовским кислотным центрам, и полосы при 1445 и 1676 см–1, соответствующие бренстедовским кислотным центрам, значительно сильнее на допированных катализаторах, чем на катализаторе CeAlOx [11, 23, 24]. Более того, на поверхности катализатора CeNbAlOx появляются более интенсивные полосы при 3178, 3266 и 3366 см–1, отнесенные к валентным колебаниям NH-групп [19].
На рис. 7б показаны результаты исследования адсорбции смеси NO + O2 при 200°С, полученные методом диффузионной отражательной спектроскопии in situ. После адсорбции NO + O2 и последующей продувки N2 в спектре катализатора CeAlOx появляется ряд полос, отнесенных к монодендатным нитратам (1434 см–1) [25], бидендатным нитратам (1280 и 1564 см–1) [26, 27], мостиковым нитратам (1617 см–1) [28] и M–NO2-нитрогруппам (1355 см–1) [29]. При увеличении содержания добавки Nb полосы, соответствующие нитрогруппам M–NO2 и монодендатным нитратным лигандам, полностью исчезли. Полосы адсорбированных нитратов не только стали менее интенсивными, но и сместились (1379 и 1580 см–1 бидендатные нитраты и 1604 и 1625 см–1 мостиковые центры) [30–33]. Отсюда можно сделать вывод, что введение Nb значительно ограничивает количество адсорбированных нитратов, а также изменяет их формы. Очевидно, введение Nb увеличивает содержание льюисовских и бренстедовских кислотных центров, что сопровождается снижением концентрации оснόвных центров. Все это улучшает процесс СКВ-NH3.
ВЫВОДЫ
Исследована реакция селективного каталитического восстановления NOx аммиаком на катализаторе CeAlOx, допированном ниобием в гидротермальных условиях. В условиях, выбранных для модельной реакции, наиболее высокую активность, селективность по N2 и устойчивость к присутствию SO2/H2O проявил катализатор CeNbAlOx с эквимольным отношением Nb/Al. Изучение катализаторов показало, что добавка Nb улучшает кислотность поверхности, окислительно-восстановительные свойства и повышает содержание поверхностных атомов кислорода Oα и ионов Ce3+. Введение ниобия усиливает адсорбцию аммиака и ослабляет адсорбцию NOx. Все упомянутые качественные особенности способствуют улучшению поведения промотированных ниобием катализаторов в реакции СКВ-NH3.
БЛАГОДАРНОСТИ
Авторы благодарят за финансовую поддержку Фонд поддержки научных исследований провинции Фуджиан (№№ 2017J01568 и 2017J01673), Проект департамента образования провинции Фуджиан (№№ JAT160327 и JAT170386) и Фонд поддержки научных исследований Технологического университета провинции Фуджиан (грант № GY-Z14007).
Список литературы
Bosch H., Janssen F. // Catal. Today. 1988. V. 2. P. 369.
Shan W., Liu F., He H., Shi X., Zhang C. // Catal. Today. 2012. V. 184. P.160.
Yao X., Zhao R., Chen L., Du J., Tao C., Yang F., Dong L. // Appl. Catal. B. Environ. 2017. V. 208. P. 82.
Wei Y., Liu J., Su W., Sun Y., Zhao Y. // Catal. Sci. Technol. 2017. V. 7. P. 1565.
Ali S., Chen L., Yuan F., Li R., Zhang T., Leng X., Niu X., Zhu Y. // Appl. Catal. B. Environ. 2017. V. 210. P. 223.
Shi R., Lin X., Zheng Z., Feng R., Liu Y., Ni L., Yuan B. // React. Kinet. Mech. Catal. 2018. V. 124. P. 217.
Stosic D., Bennici S., Rakic V., Auroux A. // Catal. Today. 2012. V. 192. P. 160.
Wang X., Shi Y., Li S., Li W. // Appl. Catal. B. Environ. 2018. V. 220. P. 234.
Lian Z., Liu F., He H., Shi X., Mo J., Wu Z. // Chem. Eng. J. 2014. V. 250. P. 390.
Ding S., Liu F., Shi X., He H. // Appl. Catal. B. Environ. 2016. V. 180. P. 766.
Li X., Li Y. // J. Mol. Catal. A. Chem. 2014. V. 386. P. 69.
Li X., Li Y. // Catal. Lett. 2014. V. 144. P. 165.
Gao X., Jiang Y., Fu Y., Zhong Y., Luo Z., Cen K. // Catal. Commun. 2010. V. 11. P. 465.
Shan W., Liu F., He H., Shi X., Zhang C. // Appl. Catal. B. Environ. 2012. V. 115. P. 100.
Liu K., Liu F., Xie L., Shan W., He H. // Catal. Sci. Technol. 2015. V. 5. P. 2290.
Zhang X., Wang H., Wang Z., Qu Z. // Appl. Surf. Sci. 2018. V. 447. P. 40.
Wang P., Zhao H., Sun H. // RSC. Adv. 2017. V. 4. P. 48 912.
Xie G., Liu Z., Zhu Z., Liu Q., Ge J., Huang Z. // J. Catal. 2004. V. 224. P. 42.
Larrubia M.A., Arrighi L., Ramis G. // Catal. Today. 2005. V. 107. P. 139.
Wang L., Li W., Qi G., Weng D. // J. Catal. 2012. V. 289. P. 21.
Li X., Li Y., Deng S., Rong T.A. // Catal. Commun. 2013. V. 40. P. 47.
Cao F., Xiang J., Su S., Wang P., Hu S., Sun L. // Fuel Process. Technol. 2015. V. 135. P. 66.
Sultana A., Nanba T., Haneda M., Sasaki M., Hamada H. // Appl. Catal. B. Environ. 2010. V. 101. P. 61.
Liu F., He H. // Catal. Today. 2010. V. 153. P. 70.
Liang H., Gui K., Zha X. // Can. J. Chem. Eng. 2016. V. 94. P. 1668.
Schraml-Marth M., Wokaun A., Baikert A. // J. Catal. 1992. V. 138. P. 306.
Qu R., Peng Y., Sun X., Li J., Gao X., Cen K. // Catal. Sci. Technol. 2016. V. 6. P. 2136.
Zhu L., Zhong Z., Yang H., Wang C. // J. Environ. Sci. 2017. V. 56. P. 169.
Liu Z., Liu Y., Chen B., Zhu T., Ma L. // Catal. Sci. Technol. 2016. V. 6. P. 6688.
Chen Y., Zhang Z., Liu L., Mi L., Wang X. // Appl. Surf. Sci. 2016. V. 366. P. 139.
Liu Z., Liu Y., Li Y., Su H., Ma L. // Chem. Eng. J. 2016. V. 283. P. 1044.
Liu K., Liu F., Xie L., Shan W., He H. // Catal. Sci. Technol. 2015. V. 5. P. 2290.
Zhang P., Li D. // Catal. Lett. 2014. V. 144. P. 165.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ