Коллоидный журнал, 2021, T. 83, № 3, стр. 269-276
Числа переноса одно-, двух- и трехзарядного катионов в пористых стеклах
Л. Э. Ермакова 1, *, **, А. С. Кузнецова 1, 2, Т. В. Антропова 2
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
2 Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Адмирала Макарова, 2, Россия
* E-mail: ermakova3182@yandex.ru
** E-mail: l.ermakova@spbu.ru
Поступила в редакцию 08.12.2020
После доработки 21.12.2020
Принята к публикации 25.12.2020
Аннотация
Исследованы числа переноса противоионов натрия, никеля и лантана в микропористых (средний радиус пор r = 2–3.4 нм) и макропористых (r = 16–27 нм) стеклах, не содержащих и содержащих магнетит в структуре матрицы. Установлено, что соотношение чисел переноса исследованных катионов в случае микропористых стекол определяется, в первую очередь, структурой вторичного кремнезема в поровых каналах. Для мембран из макропористых стекол значения чисел переноса катионов в поровом пространстве зависят от величины поверхностного заряда, а также от структуры двойного электрического слоя.
ВВЕДЕНИЕ
Числа переноса ионов являются важными транспортными характеристиками мембранных систем, знание которых необходимо для понимания взаимосвязи механизмов процессов переноса через мембраны, возникающих при наложении внешних полей, со структурными и электроповерхностными параметрами мембран различного химического состава. Представляет также интерес анализ влияния заряда противоиона на транспортные характеристики пористых стекол (ПС). Эти стекла могут использоваться в качестве мембран для разделения жидких сред и функциональных элементов микроаналитических систем (микрофлюидных чипов, электроосмотических насосов и др.) [1–7], а селективность и другие рабочие характеристики таких мембранных систем связаны с числами переноса и подвижностью ионов в поровом пространстве.
В качестве объектов исследования нами были выбраны ПС, полученные из натриевоборосиликатного стекла, а также ПС, содержащие в своей структуре гематит, для которых ранее были изучены структурные и электрокинетические характеристики в растворах различных электролитов [8–12]. Сопоставление их транспортных характеристик проводили в растворах хлоридов натрия, никеля и лантана. Это позволило проанализировать влияние заряда противоиона (катиона) на свойства таких мембранных систем, обладающих отрицательным зарядом поверхности, при постоянном коионе – ионе хлора.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
ПС со средним радиусом пор r = 1.3 нм (микропористые, МИП) были получены в Институте химии силикатов им. И.В. Гребенщикова РАН из монолитных двухфазных стекол путем сквозного кислотного выщелачивания (3 М соляная или азотная кислота, 100°C) термообработанного двухфазного натриевоборосиликатного стекла с двухкаркасной структурой [10]. По условиям синтеза оно имело следующий состав (мол. %): Na2O – 8, B2O3 – 22, SiO2 – 70. Макропористые (МАП) стекла 8В-НТ со средними радиусами пор 19.7–25.5 нм готовили путем щелочной обработки МИП-стекол 0.5 М раствором KOH при комнатной температуре. Полученные ПС содержали более 95% оксида кремния, т.е. являлись типичными высококремнеземными канальными наноструктурами. Объемная пористость образцов (отношение объема пор к общему объему мембраны) составляла 0.23–0.24 для МИП-стекол и 0.51–0.61 для МАП-стекол.
В ходе проведения измерений чисел переноса средний радиус пор мембраны 8В-НТ МИП возрастал до 2–3.4 нм за счет выхода растворенного вторичного кремнезема из порового пространства. Для мембраны 8В-НТ МАП увеличение размера поровых каналов происходило за счет небольшого растворения кремнеземного скелета и было невелико – значения r возрастали до 20–27 нм [12].
Гематит вводили в стекло, добавляя оксид железа в шихту при его варке. Полученное монолитное стекло (Fe-4-5), содержавшее 11.16 мол. % оксидов железа, подвергали термообработке для достижения фазового разделения, а затем использовали для изготовления микро- и макропористых стекол путем кислотного выщелачивания и щелочной обработки [9, 12]. Содержание железа составляло в среднем по объему 21.1 ± 1 мас. % для свежеприготовленных микро- и макропористых мембран и 15.6 мас. % для мембран, длительное время контактировавших с растворами электролита [12]. Средний радиус пор мембран Fe-4-5 МИП составлял 1.8–1.9 нм, мембран Fe-4-5 МАП – 16.5–18.1 нм. Объемная пористость была равна 0.19 и 0.45 для МИП- и МАП-образцов соответственно. Средний радиус пор железосодержащих мембран при длительном контакте с электролитами увеличивался до 2.4–3 нм для МИП-образцов и до 17–19 нм для МАП-образцов [9, 12].
Мембраны всех типов, использовавшиеся при измерениях чисел переноса ионов, представляли собой диски толщиной около 1 мм и диаметром 30 мм. В маркировке мембран указаны условия их получения.
Число переноса i-го иона (ni, transport number) – это доля электричества, переносимая ионами типа i по отношению к общему количеству электричества. Молярное число переноса (ti, transference number) i-го иона – это число молей i-го сорта, переносимое одним фарадеем электричества через поперечное сечение проводника в направлении электрического тока [13]. При таком определении необходимо учитывать, что молярное число переноса анионов отрицательно. Для чисел переноса справедливо соотношение
где zi – заряд иона с учетом знака. Отметим, что для 1 : 1-зарядного электролита величины ni и ti совпадают, для анионов – с точностью до знака.Если считать, что молярные числа переноса ионов обоих знаков – величины положительные, то можно записать:
Одним из методов экспериментального определения молярных чисел переноса является метод мембранного потенциала. Мембранный потенциал измерялся в концентрационной цепи с переносом, э. д. с. которой равна Е. Схема концентрационной цепи с переносом имеет следующий вид:
| Обратимый электрод Ag/AgCl | Раствор 1 а±(1) |
Мембрана | Раствор 2 а±(2) |
Обратимый электрод Ag/AgCl | |||
| Электродный потенциал | $\varphi _{{\text{D}}}^{{\text{I}}}$ | $\varphi _{{\text{D}}}^{{{\text{II}}}}$ | Электродный потенциал | ||||
| Диффузионный потенциал в мембране | |||||||
Здесь $\varphi _{{\text{D}}}^{{\text{I}}}$ и $\varphi _{{\text{D}}}^{{{\text{II}}}}$ – потенциалы Доннана, а±(1) и а±(2) – средние активности растворов электролитов, контактирующих с мембраной. Измерения обычно проводят при отношении а±(1)/а±(2) ≈ 2.
Величина E является суммой мембранного диффузионного потенциала EM и разности электродных потенциалов. В том случае, когда используются растворы хлоридов в качестве электролитов и обратимые хлорсеребряные электроды, измеряемая разность электродных потенциалов ΔEE включает концентрационный потенциал EC и потенциал асимметрии электродов EAS.
Предполагая, что в достаточно узком концентрационном интервале числа переноса ионов в мембране слабо зависят от концентрации электролита, мы использовали следующее уравнение связи величин EM и t− – числа переноса ионов Cl− (будем считать, что t− > 0), которые для отрицательно заряженных ПС являются коионами [13]:
(3)
${{E}_{{\text{M}}}} = - \frac{{RT}}{{{{z}_{{\text{ + }}}}F}}\left[ {{\text{ln}}\frac{{{{a}_{{{\text{ + (2)}}}}}}}{{{{a}_{{{\text{ + (1)}}}}}}} - {\text{(}}{{z}_{{\text{ + }}}} - {{z}_{ - }}{\text{)}}{{t}_{ - }}{\text{ln}}\frac{{{{a}_{{{{ \pm (2)}}}}}}}{{{{a}_{{{{ \pm (1)}}}}}}}} \right].$(4)
$\Delta {{E}_{{\text{E}}}} = {{E}_{{\text{C}}}} + {{E}_{{{\text{AS}}}}} = \frac{{RT}}{{{{z}_{ - }}F}}{\text{ln}}\frac{{{{a}_{{ - {\text{(2)}}}}}}}{{{{a}_{{ - {\text{(1)}}}}}}} + {{E}_{{{\text{AS}}}}},$(5)
${{E}_{{\text{M}}}} + {{E}_{{\text{C}}}} = \frac{{RT{\text{(}}{{z}_{ + }} - {{z}_{ - }})}}{{{{z}_{{\text{ + }}}}{{z}_{ - }}F}}{\text{ln}}\frac{{{{a}_{{{\text{ + (2)}}}}}}}{{{{a}_{{{\text{ + (1)}}}}}}}(1 + {{z}_{ - }}{{t}_{ - }}).$(6)
${{t}_{{\text{ + }}}} = \frac{1}{{{{z}_{ + }}}}{{n}_{ + }} = \frac{{{{z}_{ - }}(\Delta {{E}_{{\text{E}}}} - {{E}_{{{\text{AS}}}}})}}{{\frac{{{\text{(}}{{z}_{ + }} - {{z}_{ - }}{\text{)}}RT}}{F}{\text{ln(}}{{{{а}_{{ \pm (2)}}}} \mathord{\left/ {\vphantom {{{{а}_{{ \pm (2)}}}} {{{а}_{{ \pm (1)}}}}}} \right. \kern-0em} {{{а}_{{ \pm (1)}}}}})}}.$(7)
${{t}_{{\text{ + }}}} = {{n}_{ + }} = \frac{{\Delta {{E}_{{\text{E}}}} - {{E}_{{{\text{AS}}}}}}}{{\frac{{{\text{2}}RT}}{F}{\text{ln(}}{{{{а}_{{ \pm (1)}}}} \mathord{\left/ {\vphantom {{{{а}_{{ \pm (1)}}}} {{{а}_{{ \pm (2)}}}}}} \right. \kern-0em} {{{а}_{{ \pm (2)}}}}})}}.$(8)
${{n}_{i}} = {{{{\lambda }_{i}}} \mathord{\left/ {\vphantom {{{{\lambda }_{i}}} {\sum\limits_i {{{\lambda }_{i}}} }}} \right. \kern-0em} {\sum\limits_i {{{\lambda }_{i}}} }} = {{{{U}_{i}}} \mathord{\left/ {\vphantom {{{{U}_{i}}} {\sum\limits_i {{{U}_{i}}} }}} \right. \kern-0em} {\sum\limits_i {{{U}_{i}}} }}.$Растворы готовили на деионизованной воде (κV ≤ 1.5 × 10−6 Ом−1 см−1, система очистки воды Аквалаб AL Plus) с использованием реактивов марки “ос. ч.” или “х. ч.”. Погрешность определения величин n+ не превышала ±0.02–0.03.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование и сопоставление транспортных характеристик микро- и макропористых стекол различного состава в растворах хлоридов натрия, никеля и лантана проводили при одинаковой ионной силе растворов I = $0.5\sqrt {\sum\nolimits_i {z_{i}^{2}{{C}_{i}}} } $ (10–4–10–1 М). Это обеспечивало постоянство величин приведенной толщины двойного электрического слоя (ДЭС) и практически одинаковые степени перекрывания ДЭС в поровых каналах мембран при близких величинах среднего радиуса пор.
Рассмотрим сначала характеристики исследованных катионов в свободных растворах соответствующих электролитов. Известно, что в растворах электролитов типа NaCl процессы гидролиза практически отсутствуют. В растворах хлоридов никеля и лантана образование гидролизованных форм катионов возможно, поэтому были проведены оценки степени гидролиза h исходя из параметров 1-ой ступени гидролиза – констант диссоциации соответствующих гидроксокомплексов KD, которые равны 10–3.08 и 10–3.3 для никеля и лантана соответственно [17]:
(9)
$h = \sqrt {{{{{K}_{{\text{H}}}}} \mathord{\left/ {\vphantom {{{{K}_{{\text{H}}}}} C}} \right. \kern-0em} C}} = \sqrt {{{{{K}_{{\text{W}}}}} \mathord{\left/ {\vphantom {{{{K}_{{\text{W}}}}} {{{K}_{{\text{D}}}}C}}} \right. \kern-0em} {{{K}_{{\text{D}}}}C}}} ,$Таблица 1.
Степень гидролиза и концентрация гидролизованных форм катионов никеля и лантана
| I, моль/л | NiCl2 | LaCl3 | ||||
|---|---|---|---|---|---|---|
| C, моль/л | h | CK, моль/л | C, моль/л | h | CK, моль/л | |
| 3 × 10−1 | 1.00 × 10−1 | 1.10 × 10−5 | 1.10 × 10−6 | 5 × 10−2 | 2.00 × 10−5 | 1.00 × 10−6 |
| 10−1 | 3.33 × 10−2 | 1.90 × 10−5 | 6.32 × 10−7 | 1.67 × 10−2 | 3.46 × 10−5 | 5.78 × 10−7 |
| 10−2 | 3.33 × 10−3 | 6.01 × 10−5 | 2.00 × 10−7 | 1.67 × 10−3 | 1.09 × 10−4 | 1.82 × 10−7 |
| 10−3 | 3.33 × 10−4 | 1.90 × 10−4 | 6.32 × 10−8 | 1.67 × 10−4 | 3.46 × 10−4 | 5.78 × 10−8 |
| 10−4 | 3.33 × 10−5 | 6.01 × 10−4 | 2.00 × 10−8 | 1.67 × 10−5 | 1.09 × 10−3 | 1.82 × 10−8 |
Радиусы исследованных катионов при координационном числе, равном 6, по Гольдшмиту rG [17], Белову и Бокию rB [18], Шеннону и Превиту rSh [19], а также их эквивалентные электропроводности при бесконечном разбавлении λ0 (при 25°C) [20] суммированы в табл. 2. В этой же таблице приведены значения стоксовского радиуса этих ионов
(10)
${{r}_{{{\text{St}}}}} = \frac{{\left| {{{z}_{i}}} \right|{{F}^{2}}}}{{6\pi \eta N{{\lambda }_{0}}}}$Таблица 2.
Структурные и электрохимические характеристики катионов натрия, никеля и лантана
| Параметр | Na+ | Ni2+ | La3+ |
|---|---|---|---|
| rG, нм | 0.098 | 0.078 | 0.122 |
| rB, нм | 0.098 | 0.074 | 0.104 |
| rSh, нм | 0.102 | 0.069 | 0.103 |
| λ0, Ом–1 г-экв–1 см2 | 50.1 | 54 | 69.7 |
| rSt, нм | 0.184 | 0.341 | 0.396 |
| rcor, нм | 0.33 | 0.43 | 0.46 |
| (V – VС), нм3 | 0.146 | 0.331–0.332 | 0.403–0.406 |
| k | 5 | 11 | 13–14 |
Величины rcor были использованы для расчета объема гидратированных ионов V и числа молекул воды в гидратной оболочке k:
(11)
$k = {{(V - {{V}_{{\text{C}}}})} \mathord{\left/ {\vphantom {{(V - {{V}_{{\text{C}}}})} {{{V}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}},}}} \right. \kern-0em} {{{V}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}},}}$Результаты расчета чисел переноса катионов из измеренных величин мембранного потенциала в исследованных системах, а также имеющиеся в литературе значения чисел переноса в свободных растворах исследованных электролитов (приведенные на графиках точки для самых разбавленных растворов соответствуют предельному разбавлению) [20] представлены на рис. 1–6.
Рис. 1.
Зависимости чисел переноса катионов от эквивалентной концентрации электролитов для пористых стекол 8В-НТ. 1 – 8В-НТ (3 М HCl) МИП, NaCl; 2 – 8В-НТ (3 М HCl) МИП, NiCl2; 3 – 8В-НТ МИП, LaCl3; 4 – 8В-НТ (3 М HNO3, 0.5 M KOH) МАП, Na-Cl; 5 – 8В-НТ (3 М HCl, 0.5 M KOH) МАП, NiCl2; 6 – 8В-НТ (3 М HNO3, 0.5 M KOH) МАП, LaCl3. 7, 8 и 9 – свободные растворы NaCl, NiCl2 и LaCl3 соответственно.
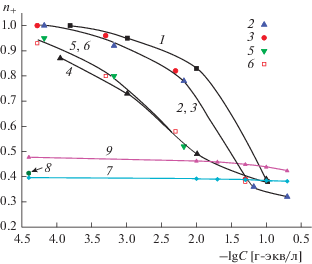
Рис. 2.
Зависимости чисел переноса катионов от эквивалентной концентрации электролитов для пористых стекол Fe-4-5. 1 – Fe-4-5 (3 М HCl) МИП, NaCl [9]; 2 – Fe-4-5 (3 М HCl) МИП, LaCl3; 3 – Fe-4-5 (3 М HCl, 0.5 М КОН) МАП, NaCl [9]; 4 – Fe-4-5 (3 М HCl, 0.5 М КОН) МАП, LaCl3. 5 и 6 – свободные растворы NaCl и LaCl3 соответственно.
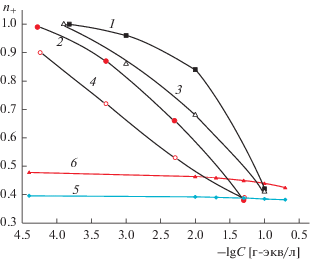
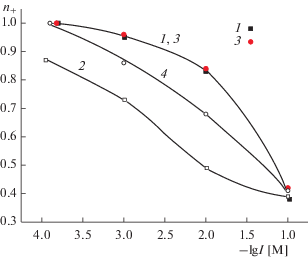
Рис. 3.
Зависимости чисел переноса катионов от ионной силы электролитов для пористых стекол 8В-НТ. 1 – 8В-НТ (3 М HCl) МИП, NaCl; 2 – 8В-НТ (3 М HCl) МИП, NiCl2; 3 – 8В-НТ МИП (3 М HCl), LaCl3; 4 – 8В-НТ (3 М HNO3, 0.5 M KOH) МАП, NaCl; 5 – 8В-НТ (3 М HCl, 0.5 M KOH) МАП, NiCl2; 6 – 8В-НТ (3 М HNO3, 0.5 M KOH) МАП, LaCl3. 7, 8 и 9 – свободные растворы NaCl, NiCl2 и LaCl3 соответственно.
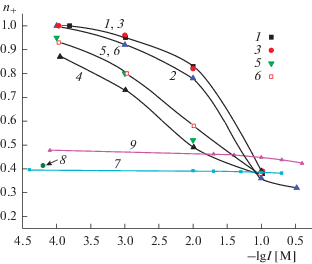
Рис. 4.
Зависимости чисел переноса катионов от ионной силы электролитов для пористых стекол Fe-4-5. 1 – Fe-4-5 (3 М HCl) МИП, NaCl [9]; 2 – Fe-4-5 (3 М HCl) МИП, LaCl3; Fe-4-5 (3 М HCl, 0.5 М КОН) МАП, NaCl [9]; 4 – Fe-4-5 (3 М HCl, 0.5 М КОН) МАП, LaCl3. 5 и 6 – свободные растворы NaCl и LaCl3 соответственно.
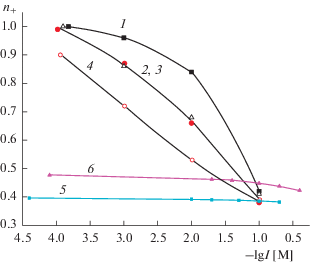
Рис. 6.
Зависимости чисел переноса катионов от ионной силы растворов LaCl3: 1 – 8В-НТ (3 М HCl) МИП, 2 – 8В-НТ (3 М HNO3, 0.5 M KOH) МАП, 3 – Fe-4-5 (3 М HCl) МИП, 4 – Fe-4-5 (3 М HCl, 0.5 М КОН) МАП.
Поскольку все справочные электрохимические данные для одно- и многозарядных ионов в растворах приводятся при одинаковых значениях эквивалентной концентрации, т.е. в расчете на один заряд, то аналогичные зависимости были построены и для чисел переноса в ПС (рис. 1, 2). Видно, что во всех случаях наблюдаются обычные зависимости n+ от концентрации электролита – в поровом пространстве числа переноса противоионов с разными величинами заряда возрастают с разбавлением, достигая единицы в самых разбавленных растворах для всех МИП-стекол. Мембраны становятся идеально селективными, поскольку в этом случае степень перекрывания ДЭС в поровом пространстве велика – значения электрокинетического радиуса κr ($\kappa = {{\left[ {{{\left( {{{F}^{{\text{2}}}}\sum\nolimits_i {z_{i}^{{\text{2}}}} {{С}_{i}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{F}^{{\text{2}}}}\sum\nolimits_i {z_{i}^{{\text{2}}}} {{С}_{i}}} \right)} {\varepsilon {{\varepsilon }_{0}}RT}}} \right. \kern-0em} {\varepsilon {{\varepsilon }_{0}}RT}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ – параметр Дебая) в исследованных МИП-стеклах лежат в интервале 0.08–0.14. Это означает, что коионы в мембраны практически не входят, и их концентрация на несколько порядков меньше, чем концентрация противоионов [22].
При одной и той же концентрации равновесного раствора в интервале 1.8 × 10−4 < C < 1 × × 10−1 г-экв/л максимальные значения n+ наблюдаются для ионов Na+ в МИП-стеклах обоих типов. В самом концентрированном растворе NaCl (0.1 М) числа переноса ионов Na+ в микро- и макропористых мембранах 8В-НТ практически совпадают со значением, соответствующим свободному раствору, а для мембран Fe-4-5 незначительно превышают таковое (0.41–0.42 против 0.385 в растворе).
В свободных растворах переход от однозарядного иона Na+ к двухзарядному иону Ni2+ приводит к небольшому росту числа переноса (рис. 1), поскольку эквивалентная электропроводность и, следовательно, подвижность иона также почти не изменяются (табл. 1), так как наряду с ростом заряда иона увеличивается размер его гидратной оболочки (величина k возрастает в 2 раза). При дальнейшем увеличении заряда катиона, т.е. при переходе к иону La3+, изменение размеров гидратной оболочки уже не столь значительно, поэтому наблюдается рост значений эквивалентной электропроводности, подвижности и числа переноса, по сравнению с ионами натрия и никеля.
В поровом пространстве мембран 8В-НТ МИП при равновесных концентрациях меньших, чем 1.8 × 10–4 г-экв/л, число переноса ионов натрия больше, чем многозарядных ионов, причем для ионов Ni2+ и La3+ величины n+ совпадают в пределах погрешности эксперимента (рис. 1, зависимости 1–3). Это свидетельствует о существенном снижении подвижности ионов Ni2+ и La3+, размеры которых больше, чем иона Na+, в порах МИП-стекол, содержащих вторичный кремнезем. Отметим также, что при одинаковой эквивалентной концентрации молярная концентрация уменьшается при переходе от 1 : 1 к 2 : 1 и, далее, к 3 : 1 зарядному электролиту, что может приводить к увеличению степени набухания вторичного кремнезема и снижению подвижности многозарядных катионов в порах. По-видимому, играет роль и то, что при примерно одинаковых размерах катионов взаимодействие двух- и трехзарядных ионов с поверхностью поровых каналов сильнее за счет большего кулоновского притяжения к отрицательно заряженной поверхности оксида кремния, что вызывает более значительное снижение подвижности катионов Ni2+ и La3+ по сравнению с их подвижностью в свободных растворах.
Переход от микропористых стекол 8В-НТ к макропористым приводит к обычно наблюдающемуся уменьшению значений n+ вследствие роста размеров поровых каналов, сопровождающегося снижением степени перекрывания ДЭС и ростом концентрации коионов в поровом пространстве. Селективность МАП-мембран в самом разбавленном растворе достаточно высока – n+ = = 0.91 ± 0.4, поскольку величины электрокинетических радиусов лежат в интервале 0.18–0.28 и степень перекрывания ДЭС остается большой. Отметим, что для макропористых стекол 8В-НТ, в порах которых тонкодисперсный вторичный кремнезем отсутствует, при C > 3.2 × 10–4 г-экв/л величины n+ для всех трех электролитов близки между собой. В области меньших концентраций влияние электростатического взаимодействия ионов с поверхностью на их подвижность ослабляется вследствие уменьшения абсолютной величины поверхностного заряда |σ0|, что приводит к небольшому росту значений n+ для ионов никеля и лантана по сравнению с ионами натрия. В случае железосодержащих ПС Fe-4-5, поверхностный заряд |σ0| которых выше, чем ПС 8В-НТ [11], снижение подвижности ионов лантана в МИП-мембране настолько велико, что значения n+ при радиусе пор 3–3.4 нм становятся меньше, чем в МАП-мембране с радиусом пор 17–19 нм (рис. 2, зависимости 2, 3).
Следует также отметить, что в самых концентрированных растворах, когда абсолютная величина заряда поверхности максимальна, снижение подвижности многозарядных ионов в поровой жидкости для всех исследованных мембран приводит к тому, что числа переноса ионов Ni2+ и La3+ становятся меньше, чем в соответствующих свободных растворах, чего не наблюдалось для ионов Na+.
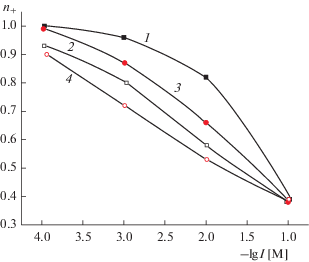
Зависимости чисел переноса исследованных катионов от ионной силы растворов электролитов I представлены на рис. 3, 4. Это позволяет сравнивать транспортные свойства мембранных систем в условиях постоянства приведенной толщины ДЭС δ = 1/κ, т.е. при одинаковой степени перекрывания ДЭС во всех электролитах. Видно, что при I = const для мембраны 8В-НТ МИП наблюдается совпадение величин n+ для катионов Na+ и La3+, а число переноса ионов Ni2+ несколько меньше (рис. 3, зависимости 1–3). Проведенные ранее исследования показали, что в МИП-стеклах поверхностный заряд в электролитах, содержащих противоионы с разной величиной заряда, при I = const также является практически постоянным [23]. Поэтому основными факторами, влияющими на величины чисел переноса, по-видимому, являются снижение подвижности противоионов в порах, содержащих вторичный кремнезем, и электростатическое взаимодействие противоионов с разной величиной заряда с поверхностью при постоянной величине |σ0|.
Для МИП-стекол 8В-НТ при одинаковых зарядах поверхности и степенях перекрывания ДЭС характер зависимости числа переноса от заряда катиона становится близким к наблюдающемуся в свободных растворах (рис. 3). Особенности, связанные с ионным транспортом в заряженных мембранах, проявляются при I ≤ 3 × 10–3 М – числа переноса ионов Ni2+ и La3+ становятся практически одинаковыми (рис. 3, зависимости 4–6). Полученные результаты позволяют также сделать вывод о том, что при одинаковой структуре ДЭС в поровом пространстве основное влияние на подвижность и число переноса противоионов оказывает, наряду с зарядом поверхности, определяющим количество ко- и противоионов в порах, наличие (или отсутствие) вторичного кремнезема в поровых каналах.
Результаты определения величин n+ в железосодержащих мембранах при постоянной ионной силе показывают, что увеличение поверхностного заряда приводит к такому снижению подвижности трехзарядного катиона, что числа переноса ионов лантана в МИП-стекле становятся равными числам переноса ионов натрия в МАП-стекле (рис. 4, зависимости 2, 3).
На рис. 5 и 6 представлены зависимости чисел переноса катионов Na2+ и La3+ от ионной силы растворов электролитов для микро- и макропористых стекол различного состава. Оказалось, что при постоянной ионной силе и близких величинах среднего радиуса пор (2–2.5 нм и 2.5–3 нм для ПС 8В-НТ МИП и Fe-4-5 МИП соответственно) состав МИП-стекла практически не влияет на число переноса ионов натрия (рис. 5, зависимости 1, 3). Числа переноса ионов La3+ в ПС Fe-4-5 МИП меньше, чем в ПС 8В-НТ МИП (рис. 6, зависимости 1, 3), что подтверждает высказанное ранее [12] предположение о разной структуре вторичного кремнезема в порах содержащих и не содержащих магнетит мембран. Более высокий поверхностный заряд и меньшие размеры поровых каналов ПС Fe-4-5 МАП приводят и к более высоким, по сравнению с ПС 8В-НТ МАП, значениям чисел переноса ионов Na+ и La3+ (рис. 5 и 6, зависимости 2, 4).
ЗАКЛЮЧЕНИЕ
Для микро- и макропористых стекол различного состава исследовано влияние заряда противоионов на примере катионов натрия, никеля и лантана (при постоянном коионе Cl–) на их числа переноса (n+) в поровых каналах. Для каждого из электролитов наблюдаются классические закономерности: увеличение концентрации равновесного раствора и размера поровых каналов при постоянном составе стекла приводит к снижению значений n+ вследствие уменьшения вклада ионов ДЭС в транспортные процессы. В самых разбавленных растворах, при ионной силе I = 10–4 М, как макропористые, так и микропористые мембраны обладают высокой селективностью – значения n+ лежат в интервале 0.87–1.0. Следует отметить, что в случае самых концентрированных растворов (I ≥ 0.1 М) числа переноса многозарядных катионов Ni2+ и La3+ меньше, чем в соответствующих свободных растворах, чего не наблюдается в случае хлорида натрия.
Анализ полученных результатов также показывает, что соотношение чисел переноса противоионов в том или ином микропористом стекле обусловлено влиянием на их подвижность структуры находящегося в порах вторичного кремнезема. Это влияние проявляется как при постоянной ионной силе, обеспечивающей одинаковые величины заряда поверхности и степени перекрывания ДЭС в разных электролитах, так и при переменной структуре ДЭС в условиях постоянства эквивалентной концентрации растворов. Для макропористых стекол, в порах которых нет вторичного кремнезема, соотношение величин n+ становится при I < 0.1 М близким к наблюдающемуся в свободных растворах электролитов. Влияние состава микропористых стекол на число переноса противоиона натрия при постоянной ионной силе (одинаковой степени перекрывания ДЭС в поровых каналах) практически отсутствует. В то же время в железосодержащем ПС Fe-4-5 МИП числа переноса противоионов лантана меньше, чем в ПС 8В-МИП, что связано с различной структурой вторичного кремнезема в этих пористых стеклах.
Список литературы
Мазурин О.В., Роскова Г.П., Аверьянов В.И., Антропова Т.В. Двухфазные стекла: структура, свойства, применение. Л.: Наука, 1991.
Yairi M., Richter C. // Sens. Actuators, A. 2007. V. 137. P. 350.
Evstrapov A.A., Esikova N.A., Rudnitskaja G.E., Antropova T.V. // Opt. Appl. 2008. V. 38. P. 31.
He F., Liao Y., Lin J., Song J., Qiao L., Cheng Y., Sugioka K. // Sensors. 2014. V. 14. P. 19402.
Заколдаев Р.А., Сергеев М.М., Сиверс А.Н., Данилов П.А., Вейко В.П., Кудряшов С.И., Костюк Г.К., Ионин А.А., Анфимова И.Н., Антропова Т.В. // Физика и химия стекла. 2018. Т. 44. С. 534.
Andreeva Y.M., Sergeev M.M., Zakoldaev R.A., Gabysheva U.E. et al., Veiko V.P., Kudryashov S.I., Ionin A.A., Vocanson F., Itina T.E., Antropova T.V., Medvedev O.S. // J. Laser Micro/Nanoeng. 2018. V. 13. P. 193.
Veiko V.P., Zakoldaev R.A Sergeev M.M., Danilov P.A., Kudryashov S.I., Kostiuk G.K., Sivers A.N., Ionin A.A., Antropova T.V., Medvedev O.S. // Opt. Express. 2018. V. 26. P. 28152.
Волкова А.В., Ермакова Л.Э., Кашпурина Е.А., Пшенко О.А., Антропова Т.В. // Физика и химия стекла. 2016. Т. 42. С. 446.
Ермакова Л.Э., Гринкевич Е.А., Волкова А.В., Антропова Т.В. // Коллоид. журн. 2018. Т. 80. С. 518.
Ермакова Л.Э., Антропова Т.В., Волкова А.В., Кузнецова А.С., Гринкевич Е.А., Анфимова И.Н. // Физика и химия стекла. 2018. Т. 44. С. 346.
Ермакова Л.Э., Гринкевич Е.А., Волкова А.В., Кузнецова А.С., Куриленко Л.Н., Антропова Т.В. // Коллоид. журн. 2019. Т. 81. С. 306.
Ермакова Л.Э., Кузнецова А.С., Антропова Т.В., Волкова А.В., Анфимова И.Н. // Коллоид. журн. 2020. Т. 82. С. 310.
Гельферих Ф. Иониты. Основы ионного обмена. М.: ИЛ, 1962.
Герасимов Я.И., Древинг В.П., Еремин Е.Н. и др. Курс физической химии. Т. 2. М.: Химия, 1973.
Справочник по электрохимии / Под ред. А.М. Сухотина. Л.: Химия, 1981.
Григоров О.Н., Козьмина З.П., Маркович А.В., Фридрихсберг Д.А. Электрокинетические свойства капиллярных систем. М.–Л.: Изд-во АН СССР, 1956.
Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник. М.: Дрофа, 2006.
Справочник химика. Т. 1 / Под ред. Б.П. Никольского. М.–Л.: Химия, 1966.
Shannon R.D., Prewitt C.T. // Acta Cryst. B. 1969. V. 25. P. 925.
Справочник химика. Т. 3 / Под ред. Б.П. Никольского. М.–Л.: Химия, 1965.
Робинсон Р., Стокс Р. Растворы электролитов. М.: ИЛ, 1963.
Ермакова Л.Э., Волкова А.В. // Коллоид. журн. 2017. Т. 79. С. 410
Ермакова Л.Э. Электроповерхностные явления в нанодисперсных системах. Дис. … докт. хим. наук. СПб.: СПбГУ, 2001.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал