Коллоидный журнал, 2023, T. 85, № 3, стр. 296-306
Наноэмульсии полиоксиэтилен (4) лаурилового эфира с солюбилизированным основанием хлоргексидина
Н. М. Задымова 1, *, А. А. Малашихина 1
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, ГСП-1, Ленинские горы, д. 1, строение 3, химический факультет, Россия
* E-mail: zadymova@colloid.chem.msu.ru
Поступила в редакцию 07.02.2023
После доработки 04.03.2023
Принята к публикации 07.03.2023
- EDN: ZOGCMN
- DOI: 10.31857/S0023291223600074
Аннотация
Получены наноэмульсии (НЭ) простого состава, в которых полиоксиэтилен (4) лауриловый эфир (Бридж L4, Бр-4) является дисперсной фазой и стабилизатором, а вода − дисперсионной средой. Изучены свойства НЭ: распределение частиц по размерам, солюбилизационная емкость и транспортные свойства по отношению к липофильному биоциду основанию хлоргексидина (ХГ). Подтверждена агрегативная устойчивость НЭ в течение длительного времени (месяцы) и эффективный массоперенос ХГ частицами дисперсной фазы НЭ в водной среде. Обнаружен уникальный эффект самопроизвольного уменьшения размеров капель НЭ при солюбилизации ХГ, при этом их средний диаметр уменьшается с 52 ± 6 до 19 ± 3 нм. Причиной эффекта является образование на поверхности капель комплексов между молекулами Бр-4 и ХГ, которые лучше растворимы в воде, нежели Бр-4. Молекулы Бридж L4, вошедшие в состав комплексов, переносятся с поверхности капель в дисперсионную среду, что и приводит к уменьшению размеров. Комплексообразование происходит за счет образования множественных водородных связей N⋅⋅⋅H⋅⋅⋅O. В полиоксиэтилированном слое капель Бр-4 локализовано от 84 до 96% солюбилизированного в НЭ биоцида, что также обусловлено Н-связями.
ВВЕДЕНИЕ
В последнее время вследствие возрастающей резистентности патогенных микроорганизмов, а также острой необходимости профилактики вирусных и бактериальных инфекций заметно возрос интерес к препаратам, обладающим антисептическими свойствами. Известны два основных типа действия антисептиков: бактериостатическое (ингибирование размножения патогена) и бактерицидное (разрушение клеточных мембран микроорганизмов и их уничтожение) [1]. Одним из основных направлений фармацевтического дизайна в последние десятилетия является разработка наноэмульсий (НЭ) с широким спектром антимикробной активности в отношении бактерий, оболочечных вирусов, грибов и спор [2]. Наноэмульсии убивают патогены, взаимодействуя с их мембранами, что значительно снижает вероятность появления резистентных штаммов [2].
Особый интерес представляют прямые наноэмульсии (НЭ), их отличает кинетическая стабильность в течение длительного времени, способность солюбилизировать липофильные целевые компоненты и эффективно проникать через биологические мембраны [3, 4]. Наноэмульсии являются дисперсными системами типа жидкость/жидкость со средним диаметром (dcp) частиц в диапазоне от 10 до 200 нм и узким распределением по размерам, длительное время сохраняющими метастабильное (квазиравновесное) состояние [5–7]. Для НЭ характерны оптическая прозрачность или незначительная опалесценция, пониженная вязкость и высокоразвитая межфазная поверхность.
Для получения наноэмульсий с антисептической активностью используются различные подходы:
1. Применение бактерицидных эфирных масел в качестве дисперсной фазы НЭ;
2. Использование в качестве эмульгаторов катионных ПАВ с антисептическим действием;
3. Солюбилизация биоцидов в прямых НЭ.
Первый подход проиллюстрирован в работах [8–15], где представлены составы и свойства НЭ, перечень патогенных микроорганизмов, относительно которых подтверждено бактерицидное действие.
Эффективность применения катионных ПАВ в составе НЭ с антисептическими свойствами отражена в исследованиях [16–20]. Например, на основе бинарных композиций Твин 20 + бензалконий хлорид и Плюроник F127 + цетилпиридиний хлорид разработаны НЭ для местного противомикробного лечения ожоговых ран [18]. В качестве дисперсной фазы НЭ использовалось рафинированное соевое масло, водная дисперсионная среда содержала этиловый спирт и хелатирующий агент (ЭДТА). Показано, что при применении НЭ значительно снижается рост грамположительных и грамотрицательных бактерий в ожоговых ранах и наблюдается противовоспалительный эффект [18]. В работе [19] при использовании смеси неионогенного и катионного ПАВ (Твин 20 + хлорид бензалкония) в качестве стабилизаторов методом гомогенизации приготовлена НЭ, проявляющая антимикробную активность относительно золотистого стафилококка (резистентного к метициллину) в опытах in vitro на инфицированных образцах кожи мышей и свиней. При этом в качестве дисперсной фазы НЭ применялось соевое масло, а водная дисперсионная среда содержала глицерин и ЭДТА [19].
Третий подход к разработке НЭ масло/вода с антисептическими свойствами представлен публикациями [21–23]. Например, в работе [23] липофильное противовоспалительное, анальгезирующее и антисептическое вещество (цитраль) было солюбилизировано в дисперсной фазе НЭ, которая состояла из триацилглицерида средней длины цепи с незначительной добавкой ундекана, а водная дисперсионная среда представляла собой буферный раствор (лимонная кислота/цитрат натрия, pH 3.0). В качестве стабилизатора разработанной прямой НЭ использовали смесь Твин 20 и желатина (1 : 3, мас.). Полученные НЭ оставались стабильными в течение 14 дней при температуре хранения 30°C [23].
Несмотря на очевидные достоинства НЭ в качестве носителей липофильных антисептических веществ, общим недостатком описанных наноэмульсий является сложный многокомпонентный состав, и зачастую, высокие концентрации стабилизаторов или их смесей. При этом в литературе практически отсутствуют сведения о НЭ простого состава.
Наноэмульсии, где Твин 85 (немицеллообразующее липофильное полиоксиэтилированное неионогенное ПАВ (НПАВ)) выступает одновременно в роли дисперсной фазы и стабилизатора, впервые были получены в работах [24, 25]. Показано, что при определенных условиях Твин 85 диспергируется в воде с образованием агрегативно устойчивых в течение длительного времени НЭ. Обнаружено, что наноразмерные капли Твин 85 являются эффективными носителями липофильных веществ (антисептика основания хлоргексидина (ХГ) [24] и гипотензивного лекарственного вещества фелодипина [25]) в водной среде. Для НЭ с солюбилизированным ХГ подтверждена высокая антимикробная активность по отношению к Staphylococcus aureus [24]. Поскольку данный подход является новым, возникла необходимость проверки гипотезы об универсальности немицеллообразующих полиоксиэтилированных НПАВ с гидрофильно-липофильным балансом (ГЛБ) в диапазоне от 9 до 11 в качестве базиса универсальных наноразмерных носителей липофильных антисептических веществ в водной среде.
Целью данной работы стало изучение коллоидно-химических свойств полиоксиэтилен (4) лаурилового эфира (Бридж L4, Бр-4) и получение прямых наноэмульсий на его основе для инкорпорирования липофильного антисептического вещества.
ЭСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
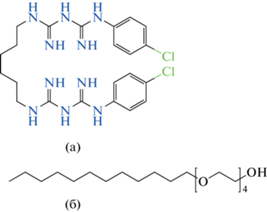
Хлоргексидин в форме основания (ХГ − 1,1'-гексаметилен-бис[5-(4-хлорфенил)бигуанидин]) был выбран в качестве липофильного антисептического вещества. Молекулярная масса ХГ составляет 505.45 Да, температура плавления − 134 ± 2°С, плотность − 1.07 × 103 кг/м3 (25°С), растворимость в воде − 1.81 × 10–4 М [24]. Структурная формула ХГ приведена на рис. 1а. В работе использовался препарат фирмы “Medichem” (Испания) со степенью чистоты 99%.
Полиоксиэтилен (4) лауриловый эфир (Бридж L4, Бр-4) является немицеллообразующим в водной среде липофильным НПАВ (ГЛБ = 9), которое при комнатной температуре находится в жидком агрегатном состоянии и легко диспергируeтся в водной среде, что послужило основанием его выбора в качестве дисперсной фазы прямых наноэмульсий. Использовали Бр-4 от фирмы “Sigma Aldrich” (США), его плотность равна 950 кг/м3 (25°С), молекулярная масса ∼ 362 Да. Данные о растворимости в воде и другие важнейшие коллоидно-химические характеристики в литературе отсутствуют. Структурная формула Бр-4 приведена на рис. 1б.
Для приготовления растворов и прямых НЭ использовали дистиллированную воду с удельной электропроводностью 1.5 мкСм/см (22°С).
Полиэтиленгликоль 400 (ПЭГ400) марки “для синтеза” от фирмы “Merck” (Германия) и н-пропиловый спирт марки “х.ч.” от “Sigma Aldrich” (США) использовали без дополнительной очистки.
Методы исследования
• Метод турбидиметрии основан на явлении рассеяния света коллоидными частицами, находящимися в дисперсионной среде. Если исследуемое вещество бесцветно, то в видимой области спектра (при длине волны λ ≥ 400 нм) для его истинных растворов оптическая плотность будет равна нулю. При увеличении концентрации вещества сверх его растворимости и появлении частиц оптическая плотность (А) будет возрастать вследствие рассеяния света. Методика прецизионной турбидиметрии для определения растворимости в воде липофильных НПАВ была разработана и подробно описана в работе [26]. Эта методика основана на анализе спектров A(λ) для серии предельно разбавленных прямых эмульсий НПАВ с известными молярными концентрациями. При выбранной в видимой области спектра длине волны (λ = const) оптическая плотность линейно зависит от молярной концентрации НПАВ и описывается уравнением A = –α + βC (где α и β – положительные численные коэффициенты). Экстраполяция данной линейной зависимости А(С) к нулевому значению оптической плотности дает значение растворимости НПАВ в воде:
Значения S определяют для нескольких выбранных длин волн и вычисляют среднее значение растворимости НПАВ для данного времени t. Этот метод позволяет исследовать кинетику растворения. Измерения повторяют через определенные промежутки времени вплоть до установления равновесного значения растворимости.
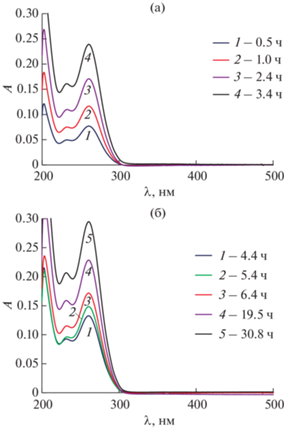
Спектры А(λ) в диапазоне λ = 200–800 нм регистрировали (относительно воды) с помощью однолучевого спектрофотометра Agilent 8453 (США). Для измерений использовались кварцевые кюветы толщиной 1 см. Точность определения оптической плотности составляла ±1 × 10–4.
• Тензиометрия. При измерении межфазного натяжения (σ) на границе раздела Бридж L4/вода методом висящей капли использовали горизонтальный микроскоп со встроенной цифровой видеокамерой DCM-130. Методика основана на анализе изображения капли с помощью программы Drop Shape Analysis (Kruss), базирующейся на численном интегрировании уравнения Юнга–Лапласа, что обеспечивает точность измерений межфазного натяжения ±0.1 мН/м.
• Дисперсность наноэмульсий исследовали методом динамического рассеяния света на высокоскоростном анализаторе ZetatracTM NPA152 (Microtrac Inc., Nikkiso), использующeм запатентованные алгоритмы обработки спектра мощности доплеровских сдвигов при броуновском движении частиц [27]. Диапазон измерения размеров составляет от 0.8 нм до 6.5 мкм. В качестве источника когерентного монохроматического излучения используется лазерный диод с длиной волны 780 нм. Управление анализатором и обработка результатов производится с помощью программного обеспечения Microtrac FLEX. Измерения проводили без предварительного разбавления НЭ. В качестве образца сравнения использовали воду, поскольку она является дисперсионной средой наноэмульсий. Опыты повторяли не менее трех раз для каждого времени хранения НЭ. Получали дифференциальные кривые распределения по размерам, характеризующие объемную долю (или об. %) частиц каждого диаметра.
• УФ-спектроскопия использовалась для определения растворимости (солюбилизации) основания хлоргексидина в НЭ. Наноэмульсии насыщали ХГ, периодически через определенные промежутки времени отбирали пробы наноэмульсии над осадком ХГ, фильтровали и разбавляли н-пропиловым спиртом, который хорошо растворяет ХГ. Для растворов ХГ в н-пропиловом спирте известны длина волны, соответствующая максимуму поглощения (λmax = 261 нм), и молярный коэффициент экстинкции (E261 = 35 357 ± 60 М–1 см–1) [24]. Спектры поглощения разбавленных проб фиксировали относительно НЭ такого же состава (но без ХГ) при одинаковом разбавлении н-пропиловым спиртом. Растворимость SХГ рассчитывали по формуле:
где А261 – оптическая плотность, соответствующая максимуму поглощения ХГ в н-пропиловом спирте; Р – разбавление пробы.Измерения проводили вплоть до установления равновесных значений SХГ. Спектрофотометр и кварцевые кюветы аналогичны приведенным выше (см. метод турбидиметрии).
• Исследование массопереноса солюбилизированного ХГ проводили с помощью диффузионной ячейки Франца, состоящей из донорной и акцепторной частей с расположенным между ними отверстием, на которое помещают мембрану. Размер пор мембраны должен заметно превышать размер наноносителей, чтобы скорость массопереноса не лимитировалась свойствами мембраны. В работе использована мембрана MF-Millipore из биологически инертной смеси эфиров целлюлозы (диаметр пор − 0.8 мкм, толщина − 150 мкм и пористость − 75%). Известные объемы образца и приемной среды помещали соответственно в донорную и акцепторную части ячейки Франца. Водный раствор ПЭГ400 (12.5 мас. %) был выбран в качестве приемной среды, поскольку растворяет ХГ в 33 раза больше, чем вода [24]. Пробы приемной среды отбирали через определенные промежутки времени, разбавляли н-пропиловым спиртом, для которого известен молярный коэффициент экстинкции ХГ, и переносили в спектрофотометрическую кювету. После отбора пробы в акцепторную часть ячейки Франца добавляли приемную среду в том же объеме. Отобранное количество ХГ, содержащееся в пробе (мкг), учитывали при расчетах. В качестве образца сравнения при спектрофотометрических измерениях использовали приемную среду, разбавленную н-пропиловым спиртом в такое же число раз, что и проба образца.
Количество ХГ, перенесенное через единицу площади мембраны за время t, рассчитывали по формуле:
где СХГ – концентрация ХГ (мкг/см3) в приемной среде на момент времени t, рассчитанная по уравнению 2; V – объем приемной среды (7.4 см3) и a0 – площадь, через которую идет диффузия, равная площади отверстия ячейки Франца (0.71 см2).• Просвечивающая электронная микроскопия (ПЭМ). Размеры частиц дисперсной фазы НЭ определяли с помощью просвечивающего электронного микроскопа Leo 912 AB Omega. При подготовке образца для исследования каплю НЭ наносили на медную сеточку диаметром 3.05 мм, покрытую тонкой полимерной пленкой, подвергали сушке на воздухе в течение нескольких минут. Далее контрастировали 2% водным раствором фосфорновольфрамовой кислоты H3[P(W3O10)4] ⋅ H2O и высушивали в течение 3−5 мин. Толщина образца на просвет не превышала 0.5 мкм. Изображения частиц были получены с разрешением до 100 нм. При помощи встроенного программного обеспечения измеряли необходимые параметры наночастиц.
• Наноэмульсии Бридж L4 в воде получали с помощью ультразвукового диспергатора УЗДН (Россия) на частоте 22 кГц. К точным навескам Бр-4 добавляли известные объемы воды. С учетом плотности Бр-4 рассчитывали его молярные концентрации в НЭ. Найден оптимальный режим диспергирования: трехкратное ультразвуковое воздействие (каждое в течение 15 с), чередующееся с паузами (по 5 мин) в условиях охлаждения.
• Для оценки эффективности наноэмульсий Бридж L4 в качестве носителей липофильного антисептического вещества их насыщали ХГ. Процедура заключалась в следующем: в НЭ добавляли ХГ таким образом, чтобы всегда присутствовало небольшое количество его осадка, образцы хранили в защищенном от света месте при периодическом осторожном перемешивании с помощью магнитной мешалки. Через определенные промежутки времени аккуратно отбирали пробы над осадком, фильтровали их через фильтры “Millipore” с диаметром пор 0.8 мкм с использованием одноразовых игл и шприцов. В течение нескольких месяцев систематически проводили дисперсионный анализ, а также исследовали кинетику растворения ХГ.
Во всех случаях исследования проводили при комнатной температуре 23 ± 2°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
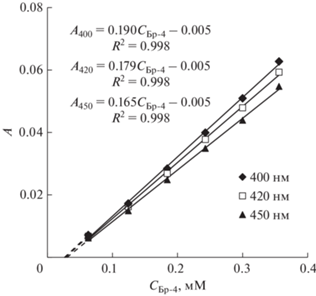
Растворимость Бридж L4 в воде была определена методом прецизионной турбидиметрии. При ультразвуковом диспергировании получали базовую НЭ (СБр-4 = 30.22 мМ), которую хранили в течение 2-х недель для достижения равновесных значений растворимости Бр-4 в водной дисперсионной среде. Наноэмульсия была агрегативно устойчива, о чем свидетельствует неизменность распределения частиц по размерам и постоянство среднего диаметра частиц (dср ≈ 60 нм) в течение всего периода наблюдения. При разбавлении водой исходной НЭ готовили серию наноэмульсий с различной концентрацией Бридж L4 (СБр-4 = (6.28 – 35.61) × 10–2 мМ), для которых регистрировали спектры A(λ) в широком диапазоне длин волн 200 – 800 нм (рис. 2). Из спектров A(λ) при выбранных длинах волн (400, 420 и 450 нм) получены линейные зависимости А(СБр-4), представленные на рис. 3. На основе численных коэффициентов линейных уравнений, описывающих эти зависимости (рис. 3), была определена растворимость Бридж L4 в воде SБр-4 = (2.8 ± 0.2) × 10–2 мМ.
Рис. 2.
Спектры А(λ) для наноэмульсий Бридж L4 с различными его концентрациями (через 14 дней): 1 – 0.063; 2 – 0.124; 3 – 0.184; 4 – 0.243; 5 – 0.300 и 6 – 0.356 мМ.
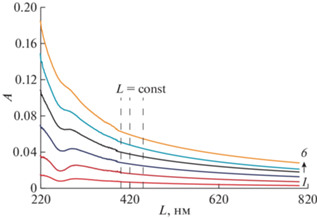
Рис. 3.
Зависимости оптической плотности предельно разбавленных прямых наноэмульсий Бридж L4 от его концентрации при длинах волн 400, 420 и 450 нм.
Для определения межфазного натяжения (σ) на границе раздела фаз Бридж L4/вода был применен метод висящей капли. Поскольку плотность воды превышает плотность Бр-4, воду помещали в капилляр, кончик которого находился в масляной фазе (Бр-4). На кончике капилляра формировался столбик воды, а не капля, поэтому оказалась возможна лишь приближенная оценка межфазного натяжения. Форма “столбика” может быть аппроксимирована цилиндром, основание которого имеет радиус, равный радиусу капилляра (r), а его нижний конец представляет собой полусферу с радиусом, соответственно равным радиусу капилляра (рис. 4). При этом силы межфазного натяжения компенсируют вес “водного цилиндрика” (с учетом силы Архимеда) в течение нескольких минут, что позволяет записать следующее соотношение:
где Δρ – разность плотностей воды и Бр-4, равная 46.9 кг/м3; g − ускорение свободного падения (9.81 м/с2); Vw – объем “столбика” воды, удерживаемого на кончике капилляра (Vw = πr2l – πr3/3). По нашим данным r = 7.5 × 10–4 м, l = 1.2 × 10–2 м, а Vw = 2.1 × 10–8 м3. Рассчитанное из уравнения (4) значение межфазного натяжения на границе раздела фаз Бридж L4/вода составляет ∼2.0 × 10–3 Н/м.Рис. 4.
Аппроксимация формы “столбика” воды, удерживающегося на кончике капилляра при измерении межфазного натяжения на границе раздела Бридж L4/вода.

В работе были получены наноэмульсии с различным содержанием Бридж L4 (СБр-4 варьировали от 55.5 до 193.5 мМ). Поскольку растворимость Бр-4 в воде пренебрежимо мала по сравнению с исследованными концентрациями Бр-4, можно считать, что они соответствуют концентрации данного НПАВ в дисперсном состоянии. В течение всего времени наблюдения (4 мес.) эти НЭ сохраняли практически неизменными средний размер частиц (dср = 52 ± 6 нм) и мономодальное узкое распределением частиц по размерам (индекс полидисперсности (ИПД) равен 0.078 ± 0.010). На рис. 5 в качестве примера приведены дифференциальные кривые распределения частиц по размерам для НЭ (СБр-4 = = 84.1 мМ) при различных временах хранения.
Рис. 5.
Дифференциальные кривые распределения частиц по размерам наноэмульсии Бридж L4 (CБр-4 = = 84.1 мМ) при различных временах хранения (время указано в легенде).
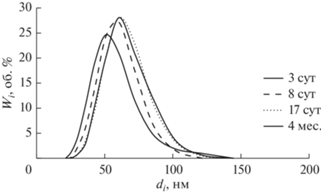
Дисперсионный анализ для НЭ, представленный в табулированной форме, содержит данные о вкладах (Wi, об. %) каждой фракции с частицами определенного диаметра (di) в общий объем дисперсной фазы. С учетом сферической формы капель НЭ суммарная площадь поверхности дисперсной фазы массой m может быть выражена следующим образом:
(5)
${{S}_{\Sigma }} = \frac{{6m}}{{100\rho }}\sum\limits_i {\left( {{{W}_{i}}{\text{/}}{{d}_{i}}} \right)} ,$На основе данных дисперсионного анализа при нормировании на единицу массы дисперсной фазы (m = 1 г) из уравнения (5) рассчитывали удельную поверхность (Sуд, м2/г) полученных наноэмульсий Бридж L4, которая во всех случаях в среднем составила Sуд = 121 ± 10 м2/г. Независимость величины Sуд от концентрации Бридж L4 и от времени хранения свидетельствует об агрегативной устойчивости полученных наноэмульсий, которая, по-видимому, обусловлена низкой растворимостью вещества дисперсной фазы (т.е. Бридж L4) в воде, что ингибирует изотермическую перегонку. Кроме того, достаточно малое межфазное натяжение на границе раздела Бр-4/вода способствует устойчивости этих НЭ к коагуляции, а значит и к коалесценции. При этом усредненная площадь поверхности дисперсной фазы наноэмульсий в расчете на 1 л НЭ (S*, м2/л) линейно зависит от концентрации Бр-4 (S* = 50.1СБр-4 – 663.2; R2 = 0.998).
Таким образом, прямые наноэмульсии Бридж L4 находятся в неизменном метастабильном (квазиравновесном) состоянии в течение длительного времени, что позволяет классифицировать их как псевдолиофильные дисперсные системы [28]. При этом поверхность капель экранирована гидрофильными полиоксиэтилированными цепями молекул Бр-4, что обеспечивает сглаживание разности полярностей между дисперсной фазой и дисперсионной средой и снижает межфазную энергию. Полученные двухкомпонентные НЭ, в которых Бридж L4 выполняет функции дисперсной фазы и стабилизатора, характеризуются высокоразвитой межфазной поверхностью, площадь которой можно целенаправленно регулировать, варьируя концентрацию Бр-4.
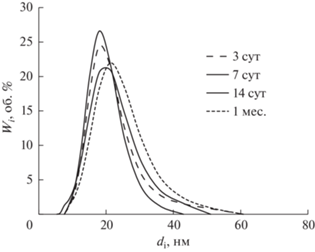
Результаты дисперсионного анализа для НЭ с солюбилизированным ХГ, полученные при различных временах хранения, подтверждают их агрегативную устойчивость. Иллюстрацией, например, служит рис. 6, на котором приведены дифференциальные кривые распределения частиц по размерам для НЭ (CБр-4 = 166.8 мМ) с ХГ при варьировании времени хранения от 3 суток до 1 мес. Кроме того, для всех НЭ с солюбилизированным ХГ значения среднего диаметра частиц и удельной поверхности (dср = 19 ± 3 нм и Sуд = 324 ± 35 м2/г), а также мономодальный узкий характер распределения по размерам (ИПД = 0.089 ± 0.012) не зависят от времени. При этом зависимость площади межфазной поверхности S* (м2/л НЭ) линейно возрастает с увеличением концентрации Бридж L4: S* = 112.3СБр-4 – 144.4 (где СБр-4 выражена в мМ). Таким образом, наноэмульсии Бр-4 с солюбилизированным ХГ также можно отнести к квазиравновесным системам.
Рис. 6.
Дифференциальные кривые распределения частиц по размерам для наноэмульсий Бридж L4 (CБр-4 = 166.8 мМ) с ХГ при различных временах хранения (время указано в легенде).
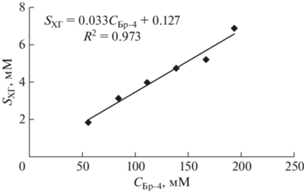
Растворимость (солюбилизация) ХГ во времени в наноэмульсиях с различным содержанием Бридж L4 была исследована методом УФ-спектроскопии. В качестве примера на рис. 7 приведены спектры поглощения ХГ в пробах НЭ различных концентраций через 14 сут, что соответствует условиям равновесия. Как упомянуто выше, пробы НЭ с ХГ разбавляли н-пропиловым спиртом. Зависимость растворимости основания х-лоргексидина в НЭ от концентрации Бр-4 является линейной: SХГ = 0.033СБр-4 + 0.127 (рис. 8). Линейность данной функции подтверждает аналогию с солюбилизацией липофильных веществ в водных мицеллярных растворах ПАВ [29]. Линейность изотермы солюбилизации наблюдается в широком интервале концентраций ПАВ, при этом солюбилизационная емкость (СЕ) мицелл относительно солюбилизата, характеризуемая отношением числа молей солюбилизата к числу молей ПАВ, находящегося в мицеллярной форме, определяется тангенсом угла наклона изотермы к оси концентраций (т.е. равна соответствующему численному коэффициенту линейного уравнения) [30, 31]. Обнаруженная аналогия позволяет определить солюбилизационную емкость наноэмульсий относительно ХГ: СЕ = 0.033 ± 0.001 моль ХГ/моль Бр-4 (рис. 8). Для исследованного интервала концентраций Бридж L4 растворимость ХГ в наноэмульсиях по сравнению с его растворимостью в воде возрастает в 10–38 раз.
Рис. 7.
Спектры поглощения для определения растворимости ХГ в наноэмульсиях Бридж L4 различных концентраций через 14 сут. Значения СБр-4 приведены в легенде. Пробы разбавляли н-пропиловым спиртом в 251 раз.
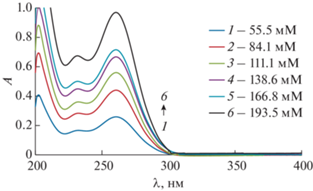
Рис. 8.
Квазиравновесная изотерма солюбилизации основания хлоргексидина в наноэмульсиях Бридж L4 при 22°С.
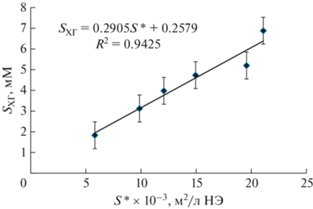
Показано, что солюбилизация ХГ линейно возрастает с увеличением площади поверхности дисперсной фазы НЭ Бридж L4 (рис. 9), вследствие чего можно предположить, что ХГ локализован на поверхности капель НЭ. Подтверждает эту гипотезу также то, что Бридж L4 является не только дисперсной фазой, но и стабилизатором разработанных прямых НЭ и его гидрофильные полиоксиэтилированные цепи находятся на поверхности капель, при этом в каждой цепи содержится 5 атомов кислорода, способных служить акцепторами протонов при формировании водородных связей [32]. Кроме того, молекула ХГ содержит 6 иминогрупп, которые являются донорами протона при формировании водородных связей [33]. Таким образом, каждая солюбилизированная в НЭ молекула ХГ может удерживаться во внешнем полиоксиэтилированном слое, окружающем капли наноэмульсий, за счет формирования множественных водородных связей N···H···O.
Рис. 9.
Зависимость растворимости (солюбилизации) ХГ от площади поверхности дисперсной фазы наноэмульсий Бридж L4 (в расчете на 1 л НЭ).
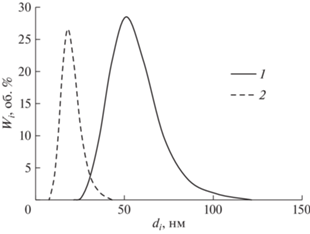
Важно подчеркнуть, что солюбилизация ХГ приводит к заметному уменьшению размеров капель НЭ, это иллюстрирует рис. 10, на котором сопоставлены дифференциальные кривые распределения частиц по размерам НЭ Бридж L4 (CБр-4 = = 166.8 мМ) с ХГ и без него при одинаковом времени хранения. Аналогичные результаты были получены для всех исследованных НЭ (СБр-4 = 55.5–193.5 мМ). При этом значение среднего диаметра частиц дисперсной фазы уменьшается примерно в 2.7 раза, а удельная поверхность наноэмульсии Sуд соответственно возрастает в 2.7 раза. Это очень неожиданный результат. Как правило, введение липофильных добавок в прямые наноэмульсии приводит к ухудшению их агрегативной устойчивости и, следовательно, к увеличению размеров капель.
Рис. 10.
Дифференциальные кривые распределения частиц по размерам наноэмульсий Бридж L4 (CБр-4 = = 166.8 мМ) без ХГ (1) и с инкорпорированным ХГ (2) через 7 сут.
Для подтверждения наблюдаемого нами неожиданного эффекта уменьшения размеров частиц НЭ при солюбилизации биоцида наноэмульсия Бридж L4 (СБр-4 = 166.8 мМ) с ХГ была исследована методом ПЭМ. Результаты ПЭМ представлены на рис. 11 и находятся в соответствии с данными дисперсионного анализа.
Рис. 11.
Микрофотография наноэмульсии Бридж L4 (СБр-4 = 166.8 мМ) с ХГ, полученная методом ПЭМ через 1 мес. хранения.

Причиной наблюдаемого эффекта, на наш взгляд, может быть формирование на поверхности частиц НЭ комплекса между молекулами Бр-4 и ХГ, который лучше растворим в воде, нежели вещество дисперсной фазы (Бр-4). Действительно, в дисперсионной среде вследствие малых концентраций обоих компонентов образования комплекса не происходит, тогда как на поверхности капель НЭ, где сконцентрированы оксиэтильные группы Бр-4 и солюбилизированный ХГ, формирование комплекса за счет Н-связей весьма вероятно. В данном случае оказывается уместной аналогия с мицеллярным и микроэмульсионным катализом, когда концентрирование компонентов в частицах дисперсной фазы обеспечивает протекание химических реакций. Поскольку в дисперсионной среде комплексов нет, будет происходить их массоперенос с поверхности капель в дисперсионную среду (по градиенту химического потенциала) вплоть до установления равновесия. Если комплекс лучше растворим в водной среде по сравнению с Бридж L4, то некоторое количество его молекул в составе комплекса будет переходить с поверхности дисперсной фазы в дисперсионную среду, что и приведет к уменьшению размеров частиц НЭ.
При оценке вероятного состава комплекса необходимо учитывать структурные особенности молекул ХГ и Бр-4:
• Молекула ХГ имеет симметричное строение, содержит две полярные бигуанидиновые группы (рис. 1а), топографическая площадь каждой группы составляет ∼ 0.89 нм2 [33].
• Молекула Бр-4 характеризуется дифильным строением (рис. 1б), топографическая площадь полярной полиоксиэтилированной части молекулы равна ∼0.57 нм2 [34].
Поскольку только полярные участки молекул Бридж L4 и ХГ способны формировать водородные связи, приводящие к комплексообразованию, учет размеров полярных участков и структуры молекул обоих типов позволяет предположить, что комплекс может состоять из 2-х молекул НПАВ и молекулы биоцида (2Бр-4:1ХГ) или же из молекулы НПАВ и молекулы ХГ (1Бр-4:1ХГ). Растворимость данных комплексов в водной дисперсионной среде (Sк) может быть примерно оценена, исходя из аддитивности вкладов компонентов, входящих в их состав:
(6)
${{S}_{{\text{к}}}} = {{X}_{{{\text{Бр - 4}}}}}{{S}_{{{\text{Бр - 4}}}}} + {{X}_{{{\text{ХГ}}}}}{{S}_{{{\text{ХГ}}}}},$Для комплекса 2Бр-4:1ХГ, по нашим расчетам, XБр-4 = 0.59 и XХГ = 0.41, а для комплекса 1Бр-4:1ХГ − XБр-4 = 0.42 и XХГ = 0.58. Расчеты по уравнению (6) показали, что Sк для комплексов составов 2Бр-4:1ХГ и 1Бр-4:1ХГ, соответственно, составляет 9.09 × 10–5 и 1.17 × 10–4 М. Поскольку количество комплексов каждого состава невозможно оценить, а полученные значения Sк различаются лишь на ±12.5%, то целесообразно растворимость комплексов в воде приближенно принять равной среднему значению Sк ≈ (1.04 ± 0.13) × 10–4 М, что в ∼3.7 раза превышает растворимость Бр-4 в воде.
Следует отметить, что ХГ присутствует в дисперсионной среде НЭ как в виде индивидуальных молекул, так и в виде комплексов с молекулами Бридж L4. Поэтому растворимость ХГ в дисперсионной среде (SДС) является суммой растворимостей в воде обеих форм данного биоцида и составляет 2.85 × 10–4 М. С учетом значения SДС и данных о растворимости ХГ в наноэмульсиях (рис. 8) можно утверждать, что от 84 до 96% биоцида локализовано в полиоксиэтилированном слое капель (по сути, адсорбировано). Адсорбция ХГ на поверхности наноносителей может быть оценена из следующего соотношения:
(7)
$\Gamma \approx \frac{{\left( {{{S}_{{{\text{ХГ}}}}} - {{S}_{{{\text{ДС}}}}}} \right)}}{{S{\kern 1pt} {\text{*}}}}.$Значения адсорбции ХГ на поверхности капель НЭ, рассчитанные для всех исследованных концентраций Бридж L4, приведены в таблице 1, из которой следует, что значения Г совпадают с точностью ±6.9%, при этом среднее значение адсорбции ХГ составило (2.9 ± 0.2) × 10–7 моль/м2.
Таблица 1.
Значения адсорбции ХГ на поверхности капель НЭ с различными концентрациями Бридж L4
| СБр-4 × 103, М | Г × 107, моль/м2 |
|---|---|
| 55.5 | 2.7 |
| 84.1 | 2.9 |
| 111.1 | 3.1 |
| 138.6 | 3.0 |
| 166.8 | 2.5 |
| 193.5 | 3.1 |
Полученные результаты подтверждают нашу гипотезу о механизме самопроизвольного уменьшения размеров капель НЭ при солюбилизации ХГ, когда исключительно на поверхности капель формируются комплексы Бр-4:биоцид, более растворимые в воде по сравнению с Бр-4, и происходит их массоперенос в водную фазу вплоть до установления адсорбционного равновесия.
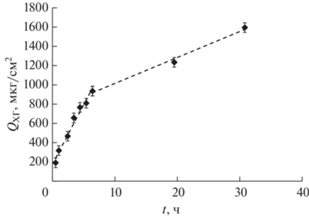
Кинетика массопереноса основания хлоргексидина частицами дисперсной фазы НЭ (CБр-4 = 166.8 мМ) изучалась методом УФ-спектроскопии с использованием диффузионной ячейки Франца. Концентрацию ХГ (СХГ) в приемной среде для разных значений t оценивали из уравнения (2) на основе спектров поглощения, приведенных на рис. 12а, 12б. Установлено, что уже через 1 ч СХГ = 30.5 мкг/см3, что превышает минимальную ингибирующую концентрацию (МИК), которая в случае ХГ для широкого круга патогенных микроорганизмов составляет от 1 до 20 мкг/см3 [35].
Рис. 12.
Спектры поглощения проб приемной среды из ячейки Франца при различных временах наблюдения (время указано в легенде) для определения массопереноса ХГ частицами дисперсной фазы наноэмульсий Бридж L4 (CБр-4 = 166.8 мМ). Пробы разбавлены н-пропиловым спиртом (а – в 16.7 раз; б – в 34.3 раза). Раствор сравнения – приемная среда, разбавленная н-пропиловым спиртом в такое же количество раз.
На основе уравнения 3 рассчитывали количество ХГ, перенесенное наноразмерными каплями Бр-4 через единицу площади мембраны при различных значениях времени. Кинетика массопереноса ХГ представлена на рис. 13, из которого видно, что на зависимости Q(t) можно выделить два линейных участка, характеризующихся постоянными скоростями массопереноса, равными 126 ± 5 и 26 ± 1 мкг см–2 ч–1. Таким образом, наблюдается эффективный массоперенос ХГ наноразмерными каплями Бридж L4 в водной среде.
ЗАКЛЮЧЕНИЕ
Определена растворимость Бридж L4 в воде и межфазное натяжение на границе раздела Бридж L4/вода. При незначительном ультразвуковом воздействии получены наноэмульсии простого состава, в которых липофильное немицеллообразующее НПАВ (Бридж L4, Бр-4) является дисперсной фазой и стабилизатором. Дисперсионный анализ подтвердил, что НЭ находятся в неизменном метастабильном (квазиравновесном) состоянии в течение длительного времени (месяцы). Солюбилизация ХГ не повлияла на агрегативную устойчивость полученных НЭ, однако стала причиной уникального эффекта существенного уменьшения размеров капель Бридж L4 и увеличения удельной поверхности НЭ. В качестве вероятной причины данного эффекта рассматривается образование на поверхности частиц дисперсной фазы комплексов между молекулами Бр-4 и ХГ, которые лучше растворимы в воде, нежели Бр-4, и их массоперенос в дисперсионную среду. Для исследованных НЭ от 84 до 96% солюбилизированного основания хлоргексидина локализовано в полиоксиэтилированном слое капель Бр-4, что, как и комплексообразование, обусловлено образованием множественных водородных связей N⋅⋅⋅H⋅⋅⋅O между молекулами ХГ и Бр-4. Подтвержден эффективный массоперенос ХГ каплями Бр-4 в водной среде. Весьма вероятно, что наноэмульсии с солюбилизированным ХГ послужат базисом новых эффективных форм антисептиков.
Список литературы
Gomes C.F., Gomes J.H., da Silva E.F. Bacteriostatic and bactericidal clays: An overview // Environmental Geochemistry and Health. 2020. V. 42. № 11. P. 3507–3527. https://doi.org/10.1007/s10653-020-00628-w
Najmeh Shams, Mohammad Ali Sahari. Nanoemulsions: Preparation, structure, functional properties and their antimicrobial effects // Applied Food Biotechnology. 2016. V. 3. № 3. P. 138−149. https://doi.org/10.22037/afb.v3i3.11773
Gupta A., Eral B., Hatton T.A., Doyle P.S. Nanoemulsions: Formation, properties and applications // Soft Matter. 2016. V. 12. № 11. P. 2826−2841. https://doi.org/10.1039/c5sm02958a
Horstmann Risso N., Ottonelli Stopiglia C. D, Oliveira M.T., Haas S.E., Ramos Maciel T., Reginatto Lazzari N., Kelmer E.L., Pinto Vilela J.A., Beckmann D.V. Chlorhexidine nanoemulsion: A new antiseptic formulation // International Journal of Nanomedicine. 2020. V. 15. P. 6935–6944. https://doi.org/10.2147/IJN.S228280
Malode G.P., Ande S.N., Chavhan S.A., Bartare S.A., Malode L.L., Manwar J.V., Bakal R.L. A critical reveiw on nanoemulsion: Advantages, techniques and characterization // World Journal of Advanced Research and Reviews. 2021. V. 11. № 03. P. 462–473. https://doi.org/10.30574/wjarr.2021.11.3.0431
Solans C., Izquierdo P., Nolla J., Azemar N., Garcia-Celma M.J. Nanoemulsions // Current Opinion in Colloid and Interface Science. 2005. V. 10. № 3−4. P. 102−110. https://doi.org/10.1016/j.cocis.2005.06.004
Королёва М.Ю., Юртов Е.В. Наноэмульсии: свойства, методы получения и перспективные области применения // Успехи химии. 2012. Т. 81. № 1. С. 21−43. https://doi.org/10.1070/RC2012v081n01ABEH004219
Chuesiang P., Siripatrawan U., Sanguandeekul R., McLandsborough L.A., McClements D.J. Optimization of cinnamon oil nanoemulsions using phase inversion temperature method: Impact of oil phase composition and surfactant concentration // Journal of Colloid and Interface Science. 2018. V. 514. P. 208−216. https://doi.org/10.1016/j.jcis.2017.11.084
Liang R., Xu S., Shoemaker C.F., Li Y., Zhong F., Huang Q. Physical and antimicrobial properties of peppermint oil nanoemulsions // Journal of Agricultural and Food Chemistry. 2012. V. 60. № 30. P. 7548−7555. https://doi.org/10.1021/jf301129k
Moradi S., Barati A. Essential oils nanoemulsions: Preparation, characterization and study of antibacterial activity against Escherichia coli // International Journal of Nanoscience and Nanotechnology. 2019. V. 15. № 3. P. 199−210.
Ghosh V., Mukherjee A., Chandrasekaran N. Ultrasonic emulsification of food-grade nanoemulsion formulation and evaluation of its bactericidal activity // Ultrasonics Sonochemistry. 2012. V. 20. № 1. P. 338−344. https://doi.org/10.1016/j.ultsonch.2012.08.010
Donsì F., Annunziata M., Vincensi M., Ferrari G. Design of nanoemulsion-based delivery systems of natural antimicrobials: Effect of the emulsifier // Journal of Biotechnology. 2012. V. 159. № 4. P. 342−350. https://doi.org/10.1016/j.jbiotec.2011.07.001
Wulansari A., Jufri M., Budianti A. Studies on the formulation, physical stability, and in vitro antibacterial activity of tea tree oil (Melaleuca alternifolia) nanoemulsion gel // International Journal of Applied Pharmaceutics. 2017. V. 9. № 1. P. 135−139. https://doi.org/10.22159/ijap.2017.v9s1.73_80
Sonu K.S., Mann B., Sharma R., Kumar R., Singh R. Physico-chemical and antimicrobial properties of d‑limonene oil nanoemulsion stabilized by whey protein–maltodextrin conjugates // J. Food Sci. Technol. 2018. V. 55. № 7. P. 2749–2757. https://doi.org/10.1007/s13197-018-3198-7
Fu X., Gao Y., Yan W., Zhang Z., Sarker S., Yin Y., Liu Q., Feng J., Chen J. Preparation of eugenol nanoemulsions for antibacterial activities // RSC Adv. 2022. V. 12. P. 3180–3190. https://doi.org/10.1039/d1ra08184e
Lallemand F., Daull P., Benita S., Buggage R., Garrigue J.S. Successfully improving ocular drug delivery using the cationic nanoemulsion, Novasorb // Journal of Drug Delivery. 2012. Article ID 604204. P. 1−17. https://doi.org/10.1155/2012/604204
Lee V.A., Ramalingam K., Rawls H.R., Amaechi T. Anti-cariogenic effect of a cetylpyridinium chloride-containing nanoemulsions // Journal of Dentistry. 2010. V. 38. № 9. P. 742−749. https://doi.org/10.1016/j.jdent.2010.06.001
Dolgachev V.A., Ciotti S., Eisma R., Grason S., Wilkinson J., Baker J.R., Hemmila M.R. Nanoemulsion therapy for burn wounds is effective as a topical antimicrobial against Gram-negative and Gram-positive bacteria // Journal of Burn Care & Research. 2016. V. 37. № 2. P. e104−e114. https://doi.org/10.1097/BCR.0000000000000217
Cao Z., Spilker T., Fan Y., Kalikin L.M., Ciotti S.M., LiPuma J.J., Makidon P.E., Wilkinson J.E., Baker J.R., Wang S.H. Nanoemulsion is an effective antimicrobial for methicillin-resistant Staphylococcus aureus in infected wounds // Nanomedicine. 2017. V. 12. № 10. P. 1177–1185. https://doi.org/10.2217/nnm-2017-0025
Daull P., Lallemand F.J., Garrigue S. Benefits of cetalkonium chloride cationic oil-in-water nanoemulsions for topical ophthalmic drug delivery // Journal of Pharmacy and Pharmacology. 2014. V. 66. № 4. P. 531−541. https://doi.org/10.1111/jphp.12075
Rao J., McClements D.J. Lemon oil solubilization in mixed surfactant solutions: Rationalizing microemulsion & nanoemulsion formation // Food Hydrocolloids. 2012. V. 26. № 1. P. 268–276. https://doi.org/10.1016/j.foodhyd.2011.06.002
Zhao Q., Ho C.T., Huang Q. Effect of ubiquinol-10 on citral stability and off-flavor formation in oil-in-water (O/W) nanoemulsions // Journal of Agricultural and Food Chemistry. 2013. V. 61. № 31. P. 7462−7469. https://doi.org/10.1021/jf4017527
Tian H., Li D., Xu T., Hu J. Citral stabilization and characterization of nanoemulsions stabilized by a mixture of gelatin and Tween 20 in an acidic system // Journal of the Science of Food and Agriculture. 2016. V. 97. № 9. P. 2991−2998. https://doi.org/10.1002/jsfa.8139
Задымова Н.М., Тао М., Потешнова М.В. Прямые наноэмульсии Твин 85 с инкорпорированным основанием хлоргексидина // Коллоид. журн. 2018. Т. 80. № 2. С. 168−176. https://doi.org/10.7868/S0023291218020052
Задымова Н.М., Куруленко В.В. Наноэмульсии с инкорпорированным липофильным лекарственным веществом фелодипином и микрогетерогенные полимерные адгезивные матрицы на их основе // Коллоид. журн. 2022. Т. 84. № 1. С. 23−33. https://doi.org/10.31857/S0023291222010141
Задымова Н.М., Кармашева Н.В., Потешнова М.В., Цикурина Н.Н. Новый метод определения растворимости липофильных неионногенных ПАВ в воде // Коллоид. журн. 2002. Т. 64. № 4. С. 449−454. https://doi.org/10.1023/A:1016803616982]
https://docs.yandex.ru/docs/view?tm=1677234737&tld=ru&lang=en&name=Zetatrac.pdf&text=принцип %20работы%20Micro.
Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2007.
Задымова Н.М., Ямпольская Г.П. Термодинамически устойчивые дисперсные системы // Практикум по коллоидной химии. Ред. Куличихин В.Г., Москва, Вузовский учебник: ИНФРА-М, 2012. Гл. 6. С. 141−172.
Edwards D.A., Luthy R.G., Liu Z. Solubilization of polycyclic aromatic hydrocarbons in micellar nonionic surfactant solutions // Environ. Sci. Technol. 1991. V. 25. № 1. P. 127−133. https://doi.org/10.1021/ES00013A014
Задымова Н.М., Цикурина Н.Н., Потешнова М.В. Солюбилизация перфтордекалина в водных растворах додекаоксиэтилированного нонилфенола // Коллоид. журн. 2003. Т. 65. № 3. С. 347–351.
Москва В.В. Водородная связь в органической химии // Соросовский образовательный журнал. 1999. Т. 5. № 2. С. 58−64.
Chlorhexidine Base. https://pubchem.ncbi.nlm.nih.gov/ compound/Nolvasan.
Brij L4. https://pubchem.ncbi.nlm.nih.gov/compound/ 78933#section=Chemical-and-Physical-Properties. Accessed Jan. 23, 2023.
Musial W., Voncina B., Pluta J., Kokol V. The study of release of chlorhexidine from preparations with modified thermosensitive poly-N-isopropylacrylamide microspheres // The Scientific World Journal. 2012. Article ID 243707. https://doi.org/10.1100/2012/243707
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал