Координационная химия, 2019, T. 45, № 7, стр. 427-431
Уточнение молекулярной структуры пентахлороакваферрата аммония (NH4)2[FeCl5(H2O)]
О. В. Ковальчукова 1, 2, С. Б. Страшнова 1, *, А. Н. Утенышев 3, П. В. Страшнов 4
1 Российский университет дружбы народов
Москва, Россия
2 Российский государственный университет им. А.Н. Косыгина
Москва, Россия
3 Первый Московский государственный медицинский университет им. И.М. Сеченова
Москва, Россия
4 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: sstrashnova@mail.ru
Поступила в редакцию 26.07.2018
После доработки 20.12.2018
Принята к публикации 26.12.2018
Аннотация
Уточнена кристаллическая структура пентахлороакваферрата аммония (NH4)2[FeCl5(H2O)] (CIF file CCDC № 1831198). Показано, что соединения состава (А)х[FeCl5(H2O)], где А – органический или неорганический анион, х = 1–2, кристаллизуются в ромбической сингонии. Геометрия и структурные параметры аниона [FeCl5(H2O)]2– практически не зависят от природы противоиона.
Соединения, относящиеся к классу сегнетоэлектриков, проявляющие одновременно сегнетоэлектрические и (анти)ферромагнитные свойства в одной фазе, в последнее время привлекают особое внимание [1–5]. Обычно они имеют сложные неколлинеарные спиновые структуры. В зависимости от силы и направленности магнитного поля в них могут возникать такие явления, как обращение, вращение или подавление электрической поляризации, намагничивание и др., что интересно не только с точки зрения фундаментальной физики, но и как возможность использования подобных материалов для производства систем хранения информации и сенсорных систем.
Традиционно к сегнетоэлектрикам относятся двойные оксиды переходных металлов, например LnMnO3 (Ln = Tb, Dy), Ni3V2O8, LiCu2O2, MnWO4 и др. [6], а также некоторые неоксидные материалы (CuCl2, K3Fe5F15) [7, 8]. В последние годы сегнетоэлектрические свойства были обнаружены для соединений типа эритрозерита общей формулы A2[FeX5(H2O)], где А – катион щелочного металла или аммония, Х – галогенид-ион [1, 9], которые выделяются при щелочном гидролизе преимущественной формой существования катионов железа(III) в подкисленных растворах – тетрахлороферрат-анионов [10]. Высокое спиновое число катиона железа (d5), как и высокоспиновое состояние центрального иона (S = 5/2) приводит к низкой магнитной анизотропии [11] и привлекает внимание исследователей начиная с 90-х годов прошлого века [12–14] и активно продолжается в наши дни [1, 9, 15].
Впервые пентахлороакваферрат был синтезирован Линдквистом в 1947 г. упариванием растворов, содержащих смесь хлоридов железа(III) и аммония [16], а годом позже [17] были определены параметры кристаллический ячейки и предложено строение соединения. В 1978 г. Фиггис с соавторами [18] расшифровал кристаллическую структуру (NH4)2[FeCl5(H2O)], впоследствии уточненную в [19]. Однако ссылки на структуру пентахлороакваферрата в структурных базах данных отсутствуют, что дало нам возможность еще раз вернуться к настоящему вопросу.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пентахлороакваферрат аммония (NH4)2[FeCl5(H2O)] получали в виде оранжево-красных кристаллов в качестве побочного продукта в синтезе комплексного соединения железа(III) с 4-(2-(1,5-диметил-3-оксо-2-фенилпиразолидинил)гидразоно)-3-метил-1-фенилпиразолоном-5 (HL) медленным смешиванием при нагревании равных объемов эквимолярных спиртовых растворов исходного лиганда и хлорида железа(III). Горячий маточный раствор нейтрализовали 10%-ным водным раствором аммиака, охлаждали до комнатной температуры и выдерживали в течение 2 сут, после чего осадок отфильтровывали и под микроскопом отделяли монокристаллы (NH4)2[FeCl5(H2O)] от поликристаллического комплексного соединения.
| Найдено, %: | Fe 19.53; | N 9.81; | Cl 61.98; | Н 3.48. |
| Для (NH4)2[FeCl5(H2O)] (М = 287.20) | ||||
| вычислено, %: | Fe 19.45; | N 9.75; | Cl 61.72; | Н 3.51. |
РСА оранжево-красных кристаллов (NH4)2[FeCl5(H2O)] в форме ромбов размером 0.560 × 0.085 × 0.50 мм выполнен на автоматическом дифрактометре КМ4 фирмы KUMA DIFFRACTION, Польша (λ(МоКα) = 0.71073 Å, графитовый монохроматор, ω/2θ сканирование) при 120.0(1) К. Структуры расшифрованы прямым методом [20]. Позиционные и температурные параметры неводородных атомов уточнены в анизотропном приближении полноматричным МНК [21]. Позиции атомов водорода выявлены из разностных синтезов Фурье и уточнены с наложением ограничений по модели “всадника”. Все расчеты выполнены по комплексу программ SHELXTL [22]. Основные кристаллографические данные и характеристики эксперимента для соединения I представлены в табл. 1.
Таблица 1.
Основные кристаллографические данные и парaметры уточнения для соединения I
| Параметр | Значение |
|---|---|
| M | 287.20 |
| Сингония | Ромбическая |
| Пр. гр. | Pnma |
| a, Å | 13.581(3) |
| b, Å | 9.925(2) |
| c, Å | 6.9498(14) |
| Z | 4 |
| ρ(выч.), г/см3 | 2.036 |
| V, Å3 | 936.8(3) |
| F(000) | 572 |
| Область сканирования, град | 2.99–31.42 |
| Значения индексов | –19 ≤ h ≤ 12, –14 ≤ k ≤ 11, –9 ≤ l ≤ 4 |
| Число измеренных/независимых отражений | 3283/1483 |
| Rint | 0.0181 |
| Отражений с I > 2σ(I) | 1312 |
| Число уточняемых параметров | 64 |
| GOOF | 1.057 |
| R1, wR2 для I > 2σ(I) | 0.0274, 0.0674 |
| R1, wR2 по всем данным | 0.0322, 0.0719 |
| Остаточная электронная плотность (min/max), e Å–3 | –1.042/0.479 |
Кристаллографические данные для структуры I депонированы в Кембриджском банке структурных данных (CCDC № 1831198; www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Общий вид пентахлороакваферрата аммония представлен на рис. 1. Атом Fe лежит на плоскости m. Координационный полиэдр центрального катиона Fe(III) – искаженный октаэдр, в координационную сферу которого входят пять хлорид-анионов и молекула воды. Длина аксиальных связей Fe–O 2.098(2) Å, Fe–Cl(1) 2.3221(8) Å. Четыре экваториальных связи Fe–Cl неравноценны по длине. Три из них (Fe–Cl(2), Fe–Cl(3) и Fe–Cl(3a)) несколько длиннее (2.3930(8)–2.3919(6) Å), что может быть связано с участием этих атомов в более прочных водородных связях (ВС) с атомами водорода катионов аммония. Четвертая связь Fe–Cl(4) существенно короче (2.3494(8) Å). Валентные углы между связями в координационном полиэдре FeCl5O лежат в интервале 85.58(1)°–94.416(13)°, причем углы с участием атомов О и Cl(2) меньше 90°.
Рис. 1.
Молекулярная структура (NH4)2[FeCl5(H2O)]. Тепловые эллипсоиды приведены с 50%-ной вероятностью.
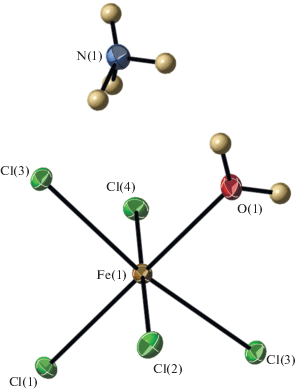
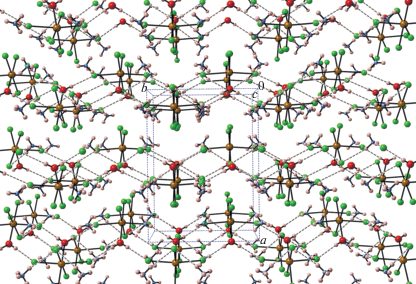
Молекула воды участвует в слабой межмолекулярной ВС с атомом Cl(3) (1 – x, –y, 1 – z): O(1)···Cl(3) 3.178(4) H(w)···Cl(3) 2.38 Å, угол O(1)H(w)Cl(3) 177°. Катион аммония участвует в двух слабых межмолекулярных связях с атомами Cl(2) (1 – x, –y, 1 – z) и Cl(4) (x, y, z): N(1)···Cl(2) 3.289(4), H(3)···Cl(2) 2.76 Å, угол N(1)H(3)Cl(2) 132.0° и N(1)···Cl(4) 3.290(4), H(2)···Cl(4) 2.79 Å, угол N(1)H(2)Cl(4) 126.3°. Фрагмент упаковки молекул (NH4)2[FeCl5(H2O)] с BC приведен на рис. 2.
Рис. 2.
Фрагмент упаковки (NH4)2[FeCl5(H2O)] в кристалле. Водородные связи показаны штриховыми линиями.
В связи с тем что сегнетомагнитные и сегнетоэлектрические свойства образцов могут определяться искажениями кристаллической структуры, представляло интерес сравнить, как изменяются характеристики [FeCl5(H2O)]2– аниона и кристаллографические характеристики образцов в зависимости от природы внешнесферного катиона (размера, природы, возможности участия в образовании ВС). Для сравнения были выбраны кристаллические структуры, содержащие пентахлороакваферрат-анион и катионы калия, рубидия, цезия, аммония, гидроксония и диэтилентриаммония (табл. 2).
Таблица 2.
Сравнительные структурные характеристики некоторых соединений, содержащих анион [FeCl5(H2O)]2–
| Соединение | Пр. гр. | Параметры кристаллической решетки (a, b, c), Å | Длина связи, Å | Валентные углы, град | Литература | |
|---|---|---|---|---|---|---|
| Fe–Cl | Fe–O | |||||
| K2[FeCl5(H2O)] | Pnma | 13.5862(9) | 2.324(1) | 2.078(4) | 86.5(0)–93.5(0) | [23] |
| 9.7087(5) | 2.392(1) | |||||
| 7.0177(5) | 2.355(1) | |||||
| 2.369(1) | ||||||
| Rb2[FeCl5(D2O)] | Pnma | 13.8015(2) | 2.321(5) | 2.035(7) | 85.55(9)–94.45(9) | [23] |
| 9.9049(1) | 2.394(4) | |||||
| 7.0783(1) | 2.356(4) | |||||
| 2.378(2) | ||||||
| Cs2[FeCl5(H2O)] | Cmcm | 7.426(4) | 2.379(1) | 2.176(7) | 85.7(1)–94.3(1) | [24] |
| 17.306(7) | 2.379(1) | |||||
| 8.064(2) | 2.379(1) | |||||
| 2.379(1) | ||||||
| 2.888(2) | ||||||
| (H3O)2[FeCl5(H2O)] | Pcmn | 7.038(1) | 2.352(1) | 2.107(4) | 85.59(2)–94.41(2) | [25] |
| 9.926(3) | 2.328(1) | |||||
| 13.720(8) | 2.383(1) | |||||
| 2.394(1) | ||||||
| (NH4)2[FeCl5(H2O)] | Pnma | 13.706(2) | 2.3828(8) | 2.110(4) | 85.60(2)–94.40(2) | [18] |
| 9.924(1) | 2.390(1) | |||||
| 7.024(1) | 2.323(1) | |||||
| 2.350(1) | ||||||
| (NH4)2[FeCl5(H2O)] | Pnma | 13.760(1) | 2.396(2) | 2.119(5) | 85.59(4)–94.41(3) | [19] |
| 9.960(1) | 2.333(2) | |||||
| 7.060(1) | 2.363(2) | |||||
| 2.390(1) | ||||||
| 2.390(1) | ||||||
| (NH4)2[FeCl5(H2O)] | Pnma | 13.581(3) | 2.3221(8) | 2.098(2) | 85.582(14)–94.416(13) | Настоящая работа |
| 9.925(2) | 2.3494(8) | |||||
| 6.9498(14) | 2.3919(6) | |||||
| 2.3930(8) | ||||||
| (DienH3) [FeCl5(H2O)]Cl* | Pna21 | 30.0352(6) | 2.4037(5) | 2.146(2) | 80.38(4)–94.13(2) | [9] |
| 6.2551(1) | 2.3460(5) | |||||
| 7.4881(1) | 2.3257(5) | |||||
| 2.4450(5) | ||||||
| 2.3151(5) | ||||||
Как видно из табл. 2, во всех представленных случаях соединения кристаллизуются в ромбической сингонии, симметрия несколько понижается при увеличении размера противоиона. Анализ длин связeй и валентных углов в анионе [FeCl5(H2O)]2– позволяет утверждать, что его геометрия, структурные параметры и степень искажения практически не зависят от природы противоиона.
Список литературы
Ackermann M., Brüning D., Lorenz T. et al. // New J. Phys. 2013. V. 15. P. 123001.
Kimura T., Goto T., Shintani H. et al. // Nature. 2003. V. 426. P. 55.
Fiebig M. // J. Phys. D. 2005. V. 38. P. R123.
Spaldin N.A., Fiebig M. // Science. 2005. V. 309. P. 391.
Cheong S.-W., Mostovoy M. // Nature Mater. 2007. V. 6. P. 13.
Kimura T., Lawes G., Goto T. et al. // Phys. Rev. B. 2005. V. 71. P. 224425.
Kimura T., Sekio Y., Nakamura H. et al. // Nature Mater. 2008. V. 7. P. 291.
Seki S., Kurumaji T., Ishiwata S. et al. // Phys. Rev. B. 2010. V. 82. P. 064424.
James B.D., Mrozinski J., Klak J. et al. // Z. Anorg. Allg. Chem. 2007. V. 633. P. 974.
Luter M.D., Wertz D.L. // J. Phys. Chem. 1981. V. 85. P. 3542.
Carlin R.L. Magnetochemistry. Berlin: Springer-Verlag, 1986. 320 p.
Zora J.A., Seddon K.R., Hitchcock P.B. et al. // Inorg. Chem. 1990. V. 29. P. 3302.
Shaviv R., Lowe C.B., Zora J.A. et al. // Inorg. Chim. Acta. 1992. V. 198–200. P. 613.
Shaviv R., Carlin R. L. // Inorg. Chem. 1992. V. 31. P. 710.
Wyrzykowski D., Warnke Z., Kruszynski R. et al. // Transition Met. Chem. 2006. V. 31. P. 765.
Lindqvist I. // Arkiv Kemi. Mineral. Geol. A. 1947. V. 24. P. 1.
Bellanca A. // Period. Mineral. 1948. V. 17. P. 59.
Figgis B.N., Raston C.L., Sharma R.P., White A.H. // Aust. J. Chem. 1978. V. 31. P. 2717.
Lacková D., Ondrejkovičová I., Koman M. // Acta Chim. Slovaca. 2013. V. 6. P. 129.
Sheldrik G.M. SHELX-86. Program for the Crystal Structure Determination. Cambridge (England): Univ. of Cambridge, 1986.
Sheldrick G.M. // Acta Crystallogr. 2008. A. V. 64. P. 112.
Sheldrick G.M. SHELXTL. Version 6.14. Structure Determination Software Suite. Madison (WI, USA): Brucker AXS, 2000.
Gabas M., Palacio F., Rodriguez-Carvajal J., Visser D. // J. Phys.: Condens. Matter. 1995. V. 7. P. 4725.
Greedan J.E., Hewitt D.C., Faggiani R., Brown I.D. // Acta Crystallogr. B. 1980. V. 36. P. 1927.
Søtofte I., Nielsen K. // Acta Chem. Scand. A. 1981. V. 35. P. 821.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


