Координационная химия, 2019, T. 45, № 7, стр. 399-403
Комплексы никеля(II) и цинка(II) с производными бензоилуксусного альдегида
М. А. Турсунов 1, *, К. Г. Авезов 1, Б. Б. Умаров 1
1 Бухарский государственный университет
Бухарa, Узбекистан
* E-mail: tursunovma@mail.ru
Поступила в редакцию 26.02.2018
После доработки 29.01.2019
Принята к публикации 11.02.2019
Аннотация
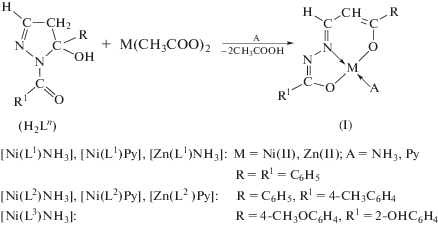
Синтезированы комплексы Ni(II) и Zn(II) состава [М(Ln)A] (n = 1–3, A = NH3, Py) на основе продуктов конденсации бензоилуксусного альдегида с гидразидами ароматических кислот (H2L1–H2L3). Полученные комплексы изучены методами элементного анализа, ИК- и ПМР-спектроскопии. Строение комплекса [Ni(L2)Py] определено методом РСА (СIF file CCDC № 1508698).
Производные ароилгидразонов с 1,3-дикарбонильными соединениями типа кетоальдегидов представляют большой интерес как источник потенциально прототропных кольчато-цепочечных равновесных форм [1–3]. Это обусловило выбор ароилгидразонов в качестве нуклеофилов в рассматриваемой работе. Мы синтезировали комплексные соединения [M(Ln)NH3] (M = Ni, Zn; n = 1–3) на основе H2L1 = бензоилгидразона, H2L2 = пара-метилбензоилгидразона и H2L3 = = орто-оксибензоилгидразона бензоилуксусного альдегида соответственно. Полученные соединения диамагнитны, растворимы в хлороформе, бензоле, пиридине и практически нерастворимы в воде. Данные ИК- и ПМР-спектров указывают на квадратное строение комплексов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали лиганды H2L1–H2L3, синтезированные согласно методикe [3, 4], ацетаты никеля(II), цинка(II), концентрированный аммиак (все “х. ч.”), пиридин (“ч. д. а.”), a также растворители EtOH, диэтиловый эфир (“х. ч.”, перегнанные).
Синтез комплекса [Ni(L1)NH3]. К раствору 1.33 г (0.005 моль) H2L1 в 20 мл EtOH постепенно добавляли горячий раствор 1.25 г (0.005 моль) ацетата никеля(II) в 15 мл концентрированного аммиака. Через 5–10 мин выпадали поликристаллы красного цвета, которые отфильтровывали, промывали водой, этиловым спиртом и высушивали в вакуум-эксикаторе над Р2О5 (“х. ч.”). Выход комплекса [Ni(L1)NH3] 1.23 г (86%).
Аналогично синтезировали комплексы [Zn(L1)NH3], [Ni(L2)NH3], [Ni(L3)NH3]. Аммиачные комплексы хорошо растворяются в органических растворителях и нерастворимы в воде.
При растворении комплекса [Ni(L1)NH3] в минимальном количестве Py с последующим высаливанием диэтиловым эфиром получен комплекс [Ni(L1)Py] [4, 5]. Выпавший осадок красного цвета отфильтровывали, промывали спиртом, эфиром и высушивали на воздухе. Выход комплекса [Ni(L1)Py] 0.66 г (74%).
Аналогично синтезировали комплексы [Ni(L2)Py] и [Zn(L2)Py].
Результаты элементного анализа и выходы полученных соединений Ni(II) и Zn(II) приведены в табл. 1.
Таблица 1.
Выходы и результаты элементного анализа комплексных соединений Ni(II) и Zn(II)
| Соединение | Брутто- формула |
Выход, % |
Тпл, °С |
Найдено/вычислено, % | |||
|---|---|---|---|---|---|---|---|
| М | С | Н | N | ||||
| [Ni(L1)NH3] | C16H15N3O2Ni | 86 | 158 | 17.21/17.26 | 56.54/56.52 | 4.41/4.45 | 12.39/12.36 |
| [Ni(L1)Py] | C21H17N3O2Ni | 74 | 166 | 14.56/14.60 | 62.69/62.73 | 4.23/4.26 | 10.48/10.45 |
| [Ni(L2)NH3] | C17H17N3O2Ni | 58 | 178 | 16.53/16.58 | 57.62/57.67 | 4.79/4.84 | 11.90/11.87 |
| [Ni(L2)Py] | C22H19N3O2Ni | 56 | 182 | 14.07/14.11 | 63.46/63.50 | 4.56/4.60 | 10.13/10.10 |
| [Ni(L3)NH3] | C17H17N3O4Ni | 76 | 193 | 15.15/15.20 | 52.83/52.89 | 4.39/4.44 | 10.93/10.89 |
| [Zn(L1)NH3] | C16H15N3O2Zn | 63 | 172 | 18.82/18.86 | 55.38/55.43 | 4.31/4.36 | 12.14/12.12 |
| [Zn(L2)Py] | C16H15N3O2Zn | 68 | 185 | 15.36/15.40 | 65.47/65.56 | 4.48/4.50 | 9.98/9.95 |
Перекристаллизацией [Ni(L2)Py] из смеси этанол–хлороформ (1 : 1) получили монокристаллы С22Н19N3O2Ni, пригодные для РСА.
РСА [Ni(L2)Py] проведен на автоматическом дифрактометре Xcalibur (CuKα-излучение, λ = = 1.54184 Å, графитовый монохроматор, ω-сканиравание, 2θmax = 75.9°). Структура расшифрована прямым методом и уточненa МНК в анизотропном приближении для неводородных атомов. Атомы водорода локализованы из карт электронной плотности разностного синтеза Фурье и уточнены в изотропном приближении.
Координаты атомов и другие параметры структуры NiL2 ⋅ Py депонированы в Кембриджском банке структурных данных (№ 1508698); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящей работе обсуждаются строение и свойства комплексных соединений, полученных на основе продуктов конденсации бензоилуксусного альдегида с гидразидами пара- и орто-замещенных ароматических кислот.
Взаимодействием водно-аммиачного раствора ацетатов металлов со спиртовыми растворами эквимолярного количества лигандов H2L синтезировали комплексы состава [М(Ln)A] (M2+ = Ni, Zn; n = 1–3; A = NH3, Py) (I) [1–3]. По результатам ИК- и ПМР-спектров комплексов с квадратным полиэдром приписано строение I (схема 1).
Схема 1.
На основании данных элементного анализа (табл. 1), ИК- и ПМР-спектроскопии, а также РСА комплекса [Ni(L2)Py] установлены состав и строение полученных комплексов.
В ИК-спектрах комплексов наблюдаются полосы поглощения в области 3375–3380, 3320–3330, 3240–3250 и 3150 см–1, которые следует отнести к симметричным и антисимметричным валентным колебаниям координированной молекулы NH3 [1, 6]. В ИК-спектре комплекса NiL1 ∙ Py появляется полоса около 1600 см–1, отнесенная к ν(C=N) Py, и отсутствует полоса выше 1640 см–1, отвечающая валентным колебаниям карбонильной группы. Обнаружены также полосы поглощения средней и сильной интенсивности в областях 1580–1585, 1530–1540, 1470–1480, 1420–1430, 1395–1400 см–1, обусловленных валентными и деформационными колебаниями сопряженной системы связей пяти- и шестичленного металлоциклов. Частота валентных колебаний связи С–О понижается на 15–25 см–1, в то же время значение частоты, характерной для связи С=N, повышается на 5–10 см–1, что свидетельствует о координации лиганда к металлу через атомы кислорода [7–9].
Параметры спектров ПМР растворов комплексов Ni(II) в ДМСО-d6 приведены в табл. 2. Для однозначного подтверждения сделанных выводов о квадратном строении комплексов Ni(II) и Zn(II) (по результатам ИК- и ПМР-спектроскопии), также были выращены монокристаллы NiL2 ∙ Py, полученные перекристаллизацией их из смеси EtOH–CHCl3. Основные кристаллографические данные и результаты уточнения структуры NiL2 ⋅ Py приведены в табл. 3.
Таблица 2.
Параметры спектров ПМР комплексов Ni(II) и Zn(II) в растворе ДМСО-d6
| Соединение | δ, м.д. | ||||
|---|---|---|---|---|---|
| сигналы протонов R |
H–C=N | –CH= | сигналы протонов R1 |
сигналы протонов NH3 или Py |
|
| [Ni(L1)NH3] | 7.29 м; 7.66 м | 5.95 | 5.86 | 7.29 м; 7.66 м | ** |
| [Ni(L1)Py] | 7.34 м; 7.66 м | 6.04 | 5.98 | 7.34 м; 7.66 м | 7.74 м; 8.08 м; 8.95 м |
| [Zn(L1)NH3] | 7.25 м; 7.72 м | 6.38 | 5.32 | 7.25 м; 7.72 м; 7.95 м | 1.75 |
| [Ni(L2)NH3] | 7.23 м; 7.69 м | 6.35 | 5.34 | 7.23 м; 7.70 м; 7.93 м | 1.77 |
| [Ni(L2)Py] | 7.34 м; 7.66 м | 6.04 | 5.98 | 7.34 м; 7.66 м | 7.74 м; 8.08 м; 8.95 м |
| [Zn(L2)Py] | 7.32 м; 7.64 м | 6.03 | 5.97 | 7.35 м; 7.67 м | 7.75 м; 8.09 м; 8.94 м |
| [Ni(L3)NH3] | 7.25 м; 7.48 м* | 6.34 | 5.28 | 7.25 м; 7.48 м | 1.86 |
Таблица 3.
Основные кристаллографические данные и параметры уточнения структуры [Ni(L2)Py]
| Параметр | Значение |
|---|---|
| М | 416.11 |
| Температура, K | 293 |
| Сингония | Триклинная |
| Пр. гр. | P1 |
| a, Å | 9.3151(9) |
| b, Å | 10.5675(11) |
| c, Å | 11.9266(7) |
| α, град | 112.030(7) |
| β, град | 92.227(6) |
| γ, град | 115.341(10) |
| V, Å3 | 955.33(17) |
| Z | 2 |
| ρ(выч.), г/см3 | 1.446 |
| μ, мм–1 | 1.649 |
| Размеры кристалла, мм | 0.5 × 0.4 × 0.3 |
| Область сканирования по θ, град | 4.1–75.9 |
| Область индексов h, k, l | −11 ≤ h ≤ 11, |
| –13 ≤ k ≤ 13, | |
| – 14 ≤ l ≤ 8 | |
| Собрано отражений | 6440 |
| Независимых отражений | 3836 |
| Rint | 0.036 |
| Отражений с I > 2σ(I) | 2607 |
| Число уточняемых параметров | 255 |
| GOOF (F 2) | 0.975 |
| R [F 2 > 2σ(F 2)], wR (F 2) | 0.045, 0.106 |
| S | 0.98 |
| Δρmin/Δρmax, e Å−3 | –0.24/0.33 |
Дважды депротонированный остаток лиганда Н2L2 координирован атомом Ni(II) через два атома кислорода и атом азота гидразонной части молекулы. Четвертое место в координационном квадрате занимает атом N донорной молекулы Py (рис. 1а).
Рис. 1.
Кристаллическая структура комплексного соединения [Ni(L2)Py] (а) и молекулярная упаковка ячейки (б).
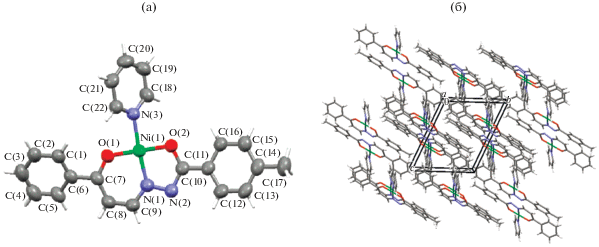
Длины связей Ni–O(1) 1.826(2), Ni–O(2) 1.835(2), Ni–N(1) 1.823(3), Ni–N(3) 1.926(3) Å в кристалле комплекса [Ni(L2)Py] близки к найденным в координационных полиэдрах кристаллов Ni(II) с бензоилгидразонами этилового эфира 5,5-диметил-2,4-диоксогексановой кислоты [4, 5, 10, 11], метилового эфира 5,5-диметил-2,4-диоксогексановой кислоты [12–20] и трифторацетилацетона [7, 8, 12, 16–20]. Большая разница между валентными углами O(1)NiN(1) (95.76(12)°) и N(1)NiO(2) (83.76(13)°) объясняется, на наш взгляд, наличием и размерами сопряженных пяти- и шестичленного металлоциклов вокруг иона-комплексообразователя, что согласуется с данными [8, 9, 14, 15, 17–20]. Атомы полиэдра NiO2N2, NiO(1)O(2)N(1)N(3), лежат в одной плоскости с точностью ±0.02 Å. Копланарные металлоциклы – пятичленный (NiO(2)C(10)N(2)N(1)) и шестичленный (NiO(1)C(7)C(8)C(9)N(1)) – сопряжены и плоские 0.003–0.022 Å.
Упаковка структурных единиц в кристалле молекулы NiL2 ⋅ Py показана на рис. 1б. Один из атомов водорода координированной молекулы пиридина участвует в водородных связях: внутримолекулярной (ВМВС) С(18)–H(18)∙·∙O(2) (С∙·∙О 2.937(4) Å), угол С(18)H(18)О(2) 102°, С(18)–Н(18) 0.93, Н(18)∙·∙О(2) 2.60 Å и межмолекулярной С(18)–H(18)∙·∙N(2) (С∙·∙N 3.437(4) Å); последняя приводит к образованию центросимметричного димера. Молекулы расположены по центрированному мотиву таким образом, что пяти- и шестичленные металлоциклы образуют друг с другом псевдостопки. В молекуле имеется еще одна ВМВС С(22)–H(22)∙·∙O(1) (С∙·∙О 2.861(3) Å), угол С(22)H(22)О(1) 104°, С(22)–Н(22) 0.93, Н(22)∙·∙О(1) 2.48 Å.
Список литературы
Пакальнис В.А., Зерова И.В., Якимович С.И., Алексеев В.В. // Химия гетероцикл. соед. 2013. № 3. С. 440.
Якимович С.И., Зерова И.В. // Журн. орган. химии. 1991. Т. 27. № 5. С. 959.
Умаров Б.Б., Тошев М.Т., Саидов С.О. и др. // Коорд. химия. 1992. Т. 18. № 9. С. 980.
Умаров Б.Б. Дис. … докт. хим. наук. Ташкент: ИУ АН РУз, 1996. 351 с.
Парпиев Н.А., Умаров Б.Б., Авезов К.Г. Производные перфторалькильных дикетонов и их комплексов. Ташкент: Dizayn-Press, 2013. 340 с.
Zelenin K.N., Yakimovich S.I. // Chem. Prop. Ital. Soc. Chem. 1998. V. 2. P. 207.
Тошев М.Т., Дустов Х.Б., Саидов С.О. и др. // Коорд. химия. 1992. Т. 18. № 12. С. 1184.
Тошев М.Т., Юсупов В.Г., Дустов Х.Б. Парпиев Н.А. Кристаллохимия комплексов металлов с гидразидами и гидразонами. Ташкент: Фан, 1994. 266 с.
Умаров Б.Б., Авезов К.Г., Абдурахмонов С.Ф. и др. Комплексные соединения Ni(II) и Cu(II) на основе бензоилгидразонов ароилтрифторацетилметанов // Тез. докл. III Mеждунар. конф. по молекулярной спектроскопии. Самарканд: СамГУ, 2006. С. 105.
Парпиев Н.А., Юсупов С.И., Якимович С.И., Шарипов Х.Т. Ацилгидразоны и их комплексы с переходными металлами. Ташкент: Фан, 1988. 161 с.
Умаров Б.Б., Авезов К.Г., Турсунов М.А. и др. // Коорд. химия. 2014. Т. 40. № 7. С. 415 (Umarov B.B., Avezov K.G., Tursunov M.A. et al. // Russ. J. Coord. Chem. 2014. V. 40. № 7. Р. 474. doi 10.1134/ S1070328414070094).
Agrawal A., Sharma K.M., Prasad R.N. // Pol. J. Chem. 2007. V. 81. № 12. P. 2081.
Авезов К.Г. Дис. … канд. хим. наук. Ташкент: НУУз, 2018. 120 с.
Tursunov M.A., Avezov K.G., Umarov B.B., Parpiev N.A. // Russ J. Coord. Chem. 2017. V. 43. № 2. P. 93. https://doi.org/10.1134/S1070328417020087
Гайбуллаев Х.С., Пумпор К.Б., Якимович С. и др. // Тез. докл. III Нац. конф. по применению рентгеновского, синхротронного излучений нейтронов и электронов “РСНЭ-2001”. М.: ИК РАН, 2001. С. 58.
Коган В.А., Зеленцов В.В., Ларин Г.М., Луков В.В. Комплексы переходных металлов с гидразонами. Физико-химические свойства и строение. М.: Наука, 1990. 112 с.
Умаров Б.Б., Турсунов М.А., Авезов К.Г. // Научный вестник БухГУ. 2014. № 1. С. 11.
Умаров Б.Б., Турсунов М.А., Минин В.В. Комплексы с производными кетоальдегидов и кетоэфиров. Ташкент: Нишон-ношир, 2016. 350 с.
Ревенко М.Д., Симонов Ю.А., Дука Г.Г. и др. // Журн. неорган. химии. 2009. Т. 54. № 5. С. 756 (Revenco M.D., Simonov Yu.A., Duca G.G. et al. // Russ. J. Inorg. Chem. 2009. V. 54. no. 5. P. 698. doi 10.1134/S0036023609050076).
Avezov K.G., Yakimovich S.I., Umarov B.B. et al. // Russ. J. Coord. Chem. 2011. V. 37. № 4. P. 275. https://doi.org/10.1134/S1070328411030018
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия