Координационная химия, 2021, T. 47, № 5, стр. 300-306
Комплексы Sb(V), Sn(IV) c редокс-активным O,N,O-донорным лигандом в электросинтезе симметричных дисульфидов
В. А. Лаврентьев 1, Е. В. Шинкарь 1, И. В. Смолянинов 1, Ю. И. Рябухин 1, Н. Т. Берберова 1, *
1 Астраханский государственный технический университет
Астрахань, Россия
* E-mail: berberova@astu.org
Поступила в редакцию 09.09.2020
После доработки 15.10.2020
Принята к публикации 16.10.2020
Аннотация
Исследованы реакции электрохимически генерированных форм комплексов сурьмы(V) и олова(IV), содержащих тридентантный O,N,O-донорный лиганд, с тиолами различного строения. В ряду комплексов непереходных металлов с N,N-бис-(2-гидрокси-ди-3,5-трет-бутилфенил)аминовым лигандом (CatH2–NH–CatH2): [Me2Sn(Cat-N-SQ)] (I), [Et2Sn(Cat-N-SQ)] (II), [Ph2Sn(Cat-N-SQ)] (III), [(с-C6H11)2Sb(Cat-N-Cat)] (IV), [Ph3Sb(Cat-NH-Cat)] (V) – определены наиболее активные, способные выступать в роли медиаторов окисления тиолов (гексантиола-1, циклогексантиола и 4-метокситиофенола) до симметричных дисульфидов. Анодная активация комплексов Sb(V), Sn(IV) протекает с участием органических лигандов и ведет к образованию интермедиатов, взаимодействующих с тиолами. В ходе медиаторного электросинтеза происходит регенерация исходной формы комплекса в растворе. Применение металлокомплексных медиаторов позволяет снизить анодное перенапряжение процесса окисления тиолов по сравнению с прямым электрохимическим синтезом. Выход полученных соединений зависит от строения комплекса, тиола и их соотношения. Наиболее высокую эффективность в электрокаталитических превращениях проявляет комплекс [Ph3Sb(Cat-NH-Cat)], который целесообразно применять для получения дисульфидов.
В химии металлоорганических соединений уделяется большое внимание органическим редокс-активным лигандам, координированным металлоцентром – атомом переходного или непереходного металла. Аналогичного типа комплексы металлов проявляют особые свойства: способность к редокс-изомерии, различным типам магнитных обменных взаимодействий и редокс-переходам по лигандному окружению. Лиганды переменной валентности применяются в качестве резервуаров для хранения/переноса электронов в химических превращениях, для формирования или разрыва связей [1–4]. Координация редокс-активных лигандов на металлоцентр открывает новые возможности для проведения реакций, требующих нескольких редокс-эквивалентов, или переноса атомов и функциональных групп.
Способность редокс-активных лигандов изменять степень окисления, находясь в координационной сфере металла, представляет особый интерес для химии различных производных непереходных элементов. Это связано с тем фактом, что подобные металлы, как правило, не обладают большим количеством различных окислительно-восстановительных состояний. Наличие редокс-активных лигандов в координационной сфере непереходного элемента существенно расширяет реакционные возможности комплексов за счет участия органических фрагментов в реакциях переноса электронов [5, 6]. Достаточно успешно металлокомплексы применяются в органическом электросинтезе в роли окислителей/восстановителей или медиаторов [7]. Данный подход, основанный на принципах “зеленой” химии, позволяет уменьшить энергозатраты, негативное влияние на окружающую среду и решить ряд экологических проблем [8]. Преимуществами медиаторного электросинтеза являются мягкие условия протекания химических реакций (25°С, 1 атм.), высокая селективность по целевому направлению, цикличность электродных процессов и снижение перенапряжения по сравнению с прямым электросинтезом [9].
Ранее мы показали эффективность применения комплексов переходных металлов – хрома(III), никеля(II), индия(III) с бидентатными O,O-, S,S-координированными лигандами в роли медиаторов окисления H2S с целью получения продуктов тиолирования циклоалканов, алкенов, аренов [9–11].
Известны примеры использования органических и неорганических медиаторов в реакциях окисления тиолов до дисульфидов, проводимых в полярных растворителях при комнатной температуре [12–15]. Интерес к синтезу дисульфидов обусловлен их применением в производстве ядохимикатов, присадок к маслам, одорантов, ароматизаторов и лекарственных препаратов (противовоспалительных, противоопухолевых, противоаллергенных) [16]. Комплексы непереходных металлов с редокс-активными лигандами не рассматривались ранее в качестве электромедиаторов окисления тиолов. Однако изученные ранее электрохимические свойства комплексов сурьмы(V) и олова(IV) c тридентатным O,N,O-донорным лигандом, находящимся в различных состояниях окисления, свидетельствуют о возможности генерирования стабильных редокс-форм [17, 18]. Перспективность использования комплексов с лигандами подобного типа подтверждают данные по их каталитической активности в реакциях трифторметилирования [19, 20].
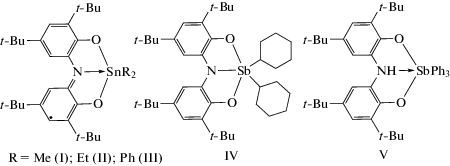
Цель настоящей работы – исследование новых медиаторов на основе комплексов сурьмы(V) и олова(IV) с N,N-бис-(2-гидрокси-ди-3,5-трет-бутилфенил)аминовым лигандом (CatH2–NH–CatH2) – [Me2Sn(Cat-N-SQ)] (I), [Et2Sn(Cat-N-SQ)] (II), [Ph2Sn(Cat-N-SQ)] (III), [(с-C6H11)2Sb(Cat-N-Cat)] (IV), [Ph3Sb(Cat-NH-Cat)] (V) – в реакциях окисления тиолов различного строения до симметричных дисульфидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Комплексы сурьмы(V), олова(IV) I–V синтезировали по известным методикам [17, 18, 21]. Коммерчески доступные гексантиол-1 (98%, Aldrich), циклогексантиол (97%, Alfa Aesar), 4-мет-окситиофенол (97%, Aldrich) и гексан (х. ч.) использовали без дополнительной очистки. Очистку хлористого метилена (х. ч.) проводили по известной методике [22] с последующим обезвоживанием над CaH2. Для электрохимических измерений использовали потенциостат IPC-Pro, Pt-анод (d = 2 мм) в CH2Cl2 в присутствии 0.1 М n-Bu4NClO4 (+99%), предварительно высушенного в вакууме 48 ч при 50°С. Электрод сравнения – насыщенный хлорсеребряный (Ag/AgCl/КСl) с водонепроницаемой диафрагмой. Электролиз смеси (тиол–комплекс) проводили на платиновом аноде (S = 70 мм2) в ячейке с неразделенным катодно-анодным пространством в дихлорметане с предварительной деаэрацией раствора аргоном (5 мин) при использовании потенциостата ПИ-50.1 в потенциостатическом режиме. Медиаторный электросинтез дисульфидов осуществляли при более положительном потенциале (на 0.2 В), чем значение потенциала окисления медиаторов: 0.63–0.85 В (I–IV) и 1.20 В (V). Рабочая концентрация комплексов составляла 0.001 моль/л. Мольное соотношение тиол/комплекс было равно 1 : 1; 2 : 1. Время электролиза варьировали от 1.5 до 3.0 ч.
Полученные дисульфиды после электролиза выделяли поэтапно: реакционную смесь концентрировали; фоновый электролит осаждали гексаном; разделяли серосодержащие соединения и комплексы методом колоночной хроматографии (адсорбент – силикагель, элюент – смесь этилацетат–гексан (1 : 1)). Раствор продуктов реакции и непрореагировавших тиолов подвергали электрохимическому анализу (метод циклической вольтамперометрии (ЦВА)). Оценку выхода по току полученных дисульфидов проводили на основании данных ЦВА. Синтезированные соединения идентифицировали методом хроматомасс-спектрометрии на спектрометре GCMS-QP2010 Ultra, Shimadzu с совмещенным пламенно-фотометрическим детектором. Газ-носитель – гелий, капиллярная колонка SPB – 1 SULFUR (30 м × 0.32 мм), адсорбент – силикагель, Тmax = 320°С. Результаты анализа серосодержащих соединений методом хроматомасс-спектрометрии представлены в табл. 1.
Таблица 1.
Данные масс-спектрометрического анализа синтезированных дисульфидов и исходных тиолов
| Соединение | m/z (I, %) |
|---|---|
| C6H13SH | 118 [M]+ (31), 84 (12), 69 (33), 56 (100), 47 (18), 41 (48) |
| (C6H13S)2 | 234 [M]+ (10), 208 (5), 192 (5), 150 (13), 117 (15), 85 (26), 69 (10), 43 (100) |
| С6Н11SH | 116 [M]+ (25), 83 (23), 67 (40), 55 (100), 43 (20) |
| (С6Н11S)2 | 230 [M]+ (14), 147 (16), 83 (100), 55 (27) |
| 4-MeOPhSH | 140 [M]+ (100), 125 (79), 97 (46), 77 (5), 69 (16), 53 (16), 45 (15) |
| (4-MeOPhS)2 | 278 [M]+ (31), 139 (100), 124 (15), 96 (25), 70 (14), 45 (5) |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Рассмотрено взаимодействие сериикомплексов сурьмы(V) и олова(IV): [Me2Sn(Cat-N-SQ)] (I), [Et2Sn(Cat-N-SQ)] (II), [Ph2Sn(Cat-N- SQ)] (III), [(с-C6H11)2Sb(Cat-N-Cat)] (IV), [Ph3Sb(Cat-NH-Cat)] (V) (схема 1 ) с тиолами в условиях их анодной активации.
Схема 1 .
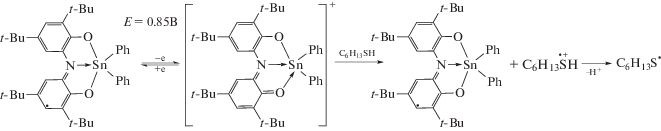
Исследуемые комплексы I–V отличаются состоянием окисления лиганда: дважды восстановленная парамагнитная (Cat–N–SQ), трианионная (Cat–N–Cat), дианионная (Cat–NH–Cat). Указанные редокс-формы лиганда при координации на атом металла способны к взаимопревращениям путем переноса электрона и протона. Методом ЦВА изучены электрохимические свойства комплексов на платиновом электроде. Значения анодных потенциалов соединений I–V коррелируют с опубликованными ранее результатами, полученными при использовании СУ-электрода [18]. Комплексам I–III свойственны две стадии окисления в анодной области: первый квазиобратимый пик наблюдается в диапазоне потенциалов 0.43–0.65 В и характеризует генерирование монокатионного комплекса, содержащего моноанионную форму лиганда; второй (необратимый) – свидетельствует о более глубоком окислении лиганда. Взаимодействие соединений I–III с гексантиолом-1 без использования электроактивации не приводит к образованию дисульфидов. Однако электролиз при контролируемом значении потенциала (0.63–0.85 В) ведет к формированию монокатионного комплекса, который реагирует с тиолом в растворе с последующей регенерацией медиатора (Med) и получением дигексилдисульфида (схема 2 ).
Схема 2.
Для соединений олова(IV) наибольшую эффективность продемонстрировал комплекс III с фенильными группами при атоме металла, что связано с более высокой стабильностью его окисленной формы, подтверждаемой данными ЦВА – значениями коэффициентов обратимости (Ic/Ia = 0.67 (I), 0.72 (II), 0.81(III)) для первой анодной стадии.
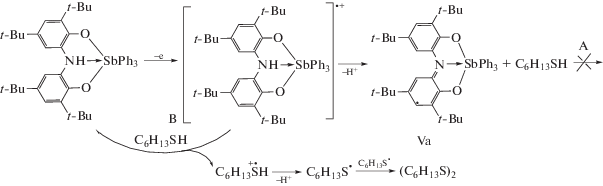
В случае комплекса IV на ЦВА фиксировали две квазиобратимые стадии окисления, приводящие к моно- и дикатионным формам комплекса ($Е_{{{\text{ра}}}}^{{\text{1}}}$ = 0.58 В; $Е_{{{\text{ра}}}}^{{\text{2}}}$ = 1.10 В). Электролиз соединения IV в присутствии гексантиола-1, независимо от величины накладываемого потенциала, не приводит к формированию соответствующего дисульфида. Это объясняется снижением концентрации Med в ходе электролиза, что обусловлено возможностью разрыва связи Sb–C в металлоорганическом фрагменте. Для соединения V на ЦВА наблюдали один необратимый пик окисления, отвечающий генерированию реакционноспособного катион-радикала в приэлектродной области. Как было показано ранее [18], результатом электрохимического окисления комплекса V является образование парамагнитного интермедиата, содержащего дианионную парамагнитную форму лиганда. С целью установления механизма взаимодействия соединения V с гексантиолом-1 предварительно генерировали монокатионный комплекс. При добавлении тиола не происходило восстановления комплекса до исходного состояния и образования дисульфида (схема 3, А).
Схема 3 .
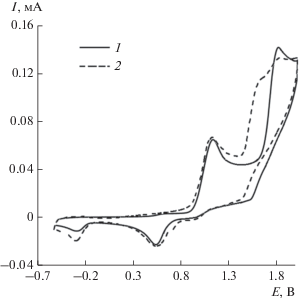
В отличие от данного направления реакции электролиз смеси комплекса V с гексантиолом-1 (мольное соотношение 1 : 1) при контролируемом потенциале 1.2 В приводил к формированию (C6H13S)2 (схема 3, B ). Этот факт подтверждается данными метода ЦВА: на вольтамперограмме первоначально наблюдали два анодных пика, отвечающих исходному комплексу и гексантиолу-1 при потенциале 1.80 В (рис. 1, 1). После электролиза фиксировали снижение интенсивности пика окисления тиола и появление нового пика продукта реакции – дигексилдисульфида при потенциале 1.58 В (рис. 1, 2). Полученные ЦВА кривые комплекса V до и после электролиза указывают на его стабильность.
Рис. 1.
ЦВА-кривые окисления эквимолярной смеси комплекса V с гексантиолом-1 (кривая 1); после электролиза при потенциале 1.20 В (1.5 ч) (кривая 2) (CH2Cl2, Pt‑анод, 0.1 М n-Bu4NClO4, c(V) = c(C6H13SH) = = 0.005 моль/л, Ag/AgCl/КСl, аргон).
Следовательно, соединения III, V можно использовать в качестве редокс-медиаторов в процессе окисления тиолов до дисульфидов с учетом различий в значениях их анодных потенциалов. Для соединений III, V проведен медиаторный электросинтнез дисульфидов на основе гексантиола-1, циклогексантиола и 4-метокситиофенола в потенциостатических условиях (Еэл = 0.85 (III), 1.20 В (V), Еэл = потенциал электролиза). В результате электролиза получены соответствующие симметричные дисульфиды с выходом по току 47–68% (табл. 2).
Таблица 2.
Выход симметричных дисульфидов, конверсия тиолов и анодное перенапряжение электросинтеза (ΔЕ) с применением комплексов III, V*
| Соединение | Выход R2S2, % | Конверсия RSH, % | ΔЕ, В |
|---|---|---|---|
| Гексантиол-1 | 59/68** | 60/72 | 1.05/0.71 |
| Циклогексантиол | 57/60 | 62/71 | 0.86/0.53 |
| 4-Метокситиофенол | 47/63 | 59/69 | 1.00/0.65 |
В случае комплекса V выход продуктов реакции превышает данный параметр, характеризующий активность комплекса III. Аналогичные закономерности прослеживаются для величины конверсии тиолов в дисульфиды. Анализ значений анодного перенапряжения при использовании медиаторов свидетельствует о снижении энергозатрат на проведение электросинтеза по сравнению с прямой анодной активацией тиолов. Несмотря на то, что выход дисульфидов в ходе электролиза (1.5 ч) при потенциале окисления тиолов (1.90 В) достигает более высоких значений (75–79%), эффективность медиаторного синтеза обусловлена уменьшением расхода электричества. Степень регенерации комплексов III, V для всех проведенных реакций составляла 93–95%. Показатель анодного перенапряжения электросинтеза (ΔЕ) для комплекса V является оптимальным, поскольку имеет более близкие значения (табл. 2) по сравнению с комплексом III, требуемые для редокс-медиаторов [23].
Далее было изучено влияние увеличения содержания тиола по отношению к Med (2 : 1) при различной продолжительности электросинтеза дисульфидов (рис. 2).
Рис. 2.
Диаграмма зависимости выхода по току различных дисульфидов от времени медиаторного электросинтеза в присутствии комплекса V (cMed = = 0.001 моль/л, соотношение Med : тиол = 1 : 2).
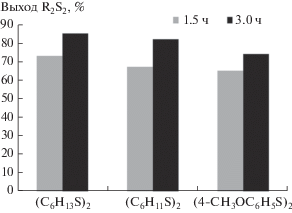
В процессе реакции (1.5 ч) наблюдали незначительное возрастание выхода дисульфида по сравнению с эквимолярным соотношением медиатор–тиол, что объясняется отсутствием выраженного каталитического эффекта. На основании полученных результатов по выходу симметричных дисульфидов отмечена более высокая реакционная способность алифатического тиола в отличие от циклогексантиола и 4-метокситиофенола. При увеличении времени электролиза в два раза не фиксировали пропорционального возрастания выхода дисульфидов, что связано с адсорбцией последних на платиновом аноде, способствующей снижению числа циклов регенерации Med на электроде. Следовательно, в данных условиях проведения реакции не рекомендуется создавать избыток тиола по отношению к комплексу. Возрастание продолжительности электросинтеза до 3 ч способствовало незначительному снижению (86–91%) степени регенерации комплекса V. Применение комплексов непереходных металлов в качестве медиаторов переноса электрона в реакциях тиолов показало, что возможность лиганда находиться в различных редокс-формах позволяет увеличивать реакционную способность соединений подобного типа. Oтметим, что исходные комплексы и их электрохимически генерированные формы остаются стабильными и не подвергаются деструкции в присутствии тиолов, несмотря на увлечение их содержания и продолжительности электросинтеза. В отличие от прямого электросинтеза симметричных дисульфидов на основе тиолов использование редокс-медиаторов имеет ряд преимуществ. Реакция протекает в растворе, поэтому снижается вероятность адсорбции тиолов на поверхности электрода. Кроме того, имеется возможность варьирования накладываемого электродного потенциала в зависимости от типа выбранного медиатора: органический, неорганический, металлокомплексный [24]. Для редокс-медиаторов характерна способность к циклической регенерации в растворе, позволяющая применять их многократно для синтеза дисульфидов в отличие от одноэлектронных окислителей – о-бензохинонов, о-иминобензохинонов [25].
Таким образом, впервые в настоящем исследовании предложено использовать комплексы непереходных металлов – сурьмы(V), олова(IV) с тридентатным O,N,O-донорным лигандом в качестве электромедиаторов окисления (цикло-)алкан-, арентиолов, до симметричных дисульфидов. Применение изученных медиаторов позволило снизить анодное перенапряжение электродного процесса по сравнению с прямой анодной активацией тиолов на 0.53–1.05 В. Диапазон потенциалов варьируется в зависимости от редокс-формы координированного лиганда и электрохимических свойств тиолов. Более высокую активность в медиаторном электросинтезе дисульфидов продемонстрировали комплексы Sn(IV), Sb(V), содержащие фенильные группы при атоме металла. Выход дисульфида, полученного на основе гексантиола-1, оказался наибольшим (84%) в случае применения комплексы сурьмы. Использование комплексов непереходных металлов с редокс-активными лигандами в роли медиаторов окисления тиолов оказалось целесообразным ввиду энергоэффективности данного экологически безопасного метода по сравнению с прямым электросинтезом дисульфидов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Van der Vlugt J.I. // Chem. Eur. J. 2019. V. 25. P. 2651.
Ершова И.В., Пискунов А.В.// Коорд. химия. 2020. Т. 46. № 3. С. 132 (Ershova I.V., Piskunov A.V. // Russ. J. Coord. Chem. 2020. V. 46. № 3. P. 154). https://doi.org/10.1134/S1070328420030021
Nikolaevskaya E.N., Druzhkov N.O., Syroeshkin M.A., Egorov M.P. // Coord. Chem. Rev. 2020. V. 417. P. 213353.
Ершова И.В., Пискунов А.В., Черкасов В.К. // Успехи химии. 2020. Т. 89. № 11. С. 1157.
Piskunov A.V., Ershova I.V., Fukin G.K., Shavyrin A.S. // Inorg. Chem. Comm. 2013. V. 38. P. 127.
Chegerev M.G., Piskunov A.V., Maleeva A.V. et al. // Eur. J. Inorg. Chem. 2016. № 23. P. 3813.
Будникова Ю.Г. Современный органический электросинтез. Принципы, методы исследования и практические приложения. Монография. М.: Изд‑во ИНФРА-М, 2016. 440 с.
Francke R., Little R.D. // Chem. Soc. Rev. 2014. V. 43. P. 2492.
Охлобыстин А.О., Охлобыстина А.В., Шинкарь Е.В. и др. // Докл. РАН. 2010. Т. 435. № 3. С. 1.
Берберова Н.Т., Шинкарь Е.В., Смолянинов И.В. и др. // Коорд. химия. 2017. Т. 43. № 9. С. 540 (Berberova N.T., Shinkar’ E.V., Smolyaninov I.V. et al. // Russ. J. Coord. Chem. 2017. V. 43. № 9. P. 578). https://doi.org/10.1134/S107032841707003X
Охлобыстин А.О., Смолянинов И.В., Охлобыстина А.В. и др. // Коорд. химия. 2013. Т. 39. № 1. С. 36 (Okhlobystin A.O., Smolyaninov I.V., Okhlobystina A.V et al. // Russ. J. Coord. Chem. 2013. V. 39. № 1. P. 33). https://doi.org/10.1134/S1070328413010077
Смолянинов И.В., Шинкарь Е.В., Кузьмин В.В., Берберова Н.Т. // Журн. общ. химии. 2019. Т. 89. № 4. С. 552.
Berberova N.T., Smolyaninov I.V., Shinkar’ E.V. et al. // Intern. J. Electrochem. Sci. 2019. V. 14. P. 531.
Sun X.-J., Yang S.-F., Wang Z.-T. et al. // ChemistrySelect. 2020. № 5. P. 4637.
Kashiwagi Y., Ohsawa A., Osa T. et al. // Chem. Lett. 1991. V. 20. P. 581.
Берберова Н.Т., Шинкарь Е.В., Смолянинов И.В. и др. Синтез и биологическая активность органических моно-, ди- и полисульфидов. Монография. Ростов-на-Дону: Изд-во ЮНЦ РАН, 2019. 268 с.
Пискунов А.В., Сухошкина О.Ю., Смолянинов И.В. // Журн. общ. химии. 2010. Т. 80. № 4. С. 629.
Смолянинов И.В., Поддельский А.И., Смолянинова С.А., Берберова Н.Т. // Коорд. химия. 2014. Т. 40. № 10. С. 608 (Smolyaninov I.V., Poddel’sky A.I., Smolyaninova S.A., Berberova N.T. // Russ. J. Coord. Chem. 2014. V. 40. № 10. P. 726). https://doi.org/10.1134/S1070328414090097
Jacquet J., Cheaib K., Ren Y. et al. // Chem. Eur. J. 2017. V. 23. P. 15030.
Jacquet J., Blanchard S., Derat E. et al. // Chem. Sci. 2016. V. 7. P. 2030.
Poddel’sky A.I., Somov N.N., Kurskii Yu.A. et al. // J. Organomet. Chem. 2008. V. 693. P. 3451.
Гордон А., Форд Р. Спутник химика. М.: Мир. 1976. 437 с.
Магдесиева Т.В., Бутин К.П. // Успехи химии. 2002. Т. 71. № 3. С. 255.
Wang F., Stahl S.S. // Acc. Chem. Res. 2020. V. 53. № 3. P. 561.
Бурмистрова Д.А., Смолянинов И.В., Берберова Н.Т. // Изв. АН. Сер. хим. 2020. № 5. С. 990.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия