Координационная химия, 2022, T. 48, № 5, стр. 296-301
Синтез и структурное разнообразие 1-(о-метоксифенил)-3,4-дифенилциклопентадиенильных комплексов гадолиния
Д. А. Бардонов 1, 2, К. А. Лысенко 3, И. Э. Нифантьев 1, 2, 3, Д. М. Ройтерштейн 1, 2, 4, *
1 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
2 Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Институт органической химии им. Н.Д. Зелинского РАН
Москва, Россия
* E-mail: roiter@yandex.ru
Поступила в редакцию 27.10.2021
После доработки 23.11.2021
Принята к публикации 23.11.2021
- EDN: VRJGME
- DOI: 10.31857/S0132344X22050012
Аннотация
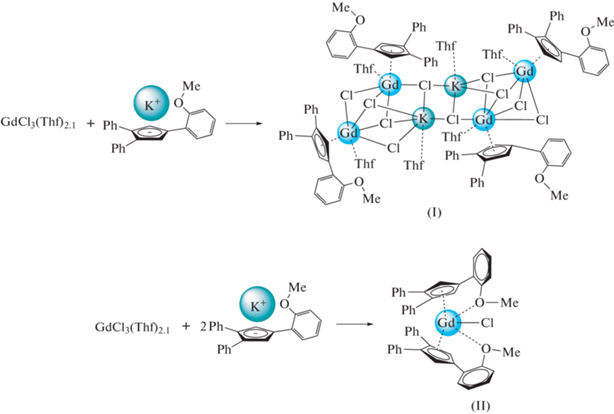
Взаимодействие 1-(о-метоксифенил)-3,4-дифенилциклопентадиенилкалия с тетрагидрофуранатом хлорида гадолиния в зависимости от стехиометрии приводит к образованию тетраядерного ат-комплекса [{[η5-(Ph2(o-CH3ОС6Н4)C5H2)Gd(Thf)]2(µ2-Cl)2(µ3-Cl)3K(Thf)}2] (I) и моноядерного [(Ph2(o-CH3ОС6Н4)C5H2)2GdCl] (II) (CIF files CCDC № 2116742 (I), 2116741 (II)). В комплексе I отсутствует координация атомом кислорода метоксигруппы катиона гадолиния, тогда как в случае комплекса II катион Gd3+ координирован атомами кислорода обеих метоксигрупп. Комплекс II кристаллизуется в хиральной пространственной группе P41212.
Циклопентадиенильные комплексы лантанидов играют важнейшую роль в металлоорганической химии 4f-элементов и являются первыми известными органическими производными лантанидов [1–4]. Востребованность циклопентадиенильных комплексов в химии РЗЭ обусловлена легкостью модификации циклопентадиенильного лиганда путем замещения атомов водорода пятичленного кольца на различные органические фрагменты. Наиболее изучены к настоящему времени комплексы лантанидов с незамещенными, алкил- и силилзамещенными циклопентадиенильными лигандами, арилциклопентадиенильные лиганды пока играют весьма скромную роль в химии РЗЭ, несмотря на очевидные перспективы таких лигандов, обусловленные многобразием возможностей их модификации путем введения заместителей в арильный фрагмент [5, 6]. Ранее мы показали, что использование ди-, три- и тетрафенилциклопентадиенильных лигандов позволяет получать разнообразные структурные типы моно-, бис-, и трис-циклопентадиенильных комплексов гадолиния, неодима и тербия [7–9]. Благодаря наличию совокупности невалентных взаимодействий с участием фенильных заместителей в циклопентадиенильных лигандах, реализовались различные структурные типы таких комплексов: от моноядерных и биядерных, до координационных полимеров [9].
Цель настоящей работы – выяснение координационных возможностей полиарилзамещенных циклопентадиенильных лигандов, содержащих метоксифенильные заместители в циклопентадиенильном лиганде. Ожидалось, что метоксигруппы, способные к координации с ионом РЗЭ, приведут к формированию принципиально новых комплексов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все синтетические манипуляции проводили в атмосфере предварительно очищенного аргона в среде безводных растворителей с использованием перчаточного бокса СПЕКС-ГБ2. Тетрагидрофуран предварительно высушивали над NaOH и перегоняли над калием/бензофеноном. Гексан перегоняли над калий-натриевой эвтектикой/бензофеноном. Толуол перегоняли над натрием/бензофеноном. GdCl3(THF)2.1 получали в соответствии с известной методикой [10]. Бензилкалий получали по модифицированной литературной методике [11]. 1-(о-Метоксифенил)-3,4-дифенилциклопентадиен получали по известной методике [12] и возгоняли в высоком вакууме. Элементный анализ выполняли на приборе Thermo Scientific FLASH 2000 CHNS/O Analyzer.
Синтез [{[η5-(Ph2(o-CH3ОС6Н4)C5H2)Gd(Thf)]2- (µ2-Cl)2(µ3-Cl)3K(Thf)}2](Thf)3 (I). Раствор бензилкалия (0.265 г, 2.04 ммоль) в 10 мл ТГФ медленно при перемешивании добавляли к раствору 1-(о-ме-т-оксифенил)-3,4-дифенилциклопентадиена (0.648 г, 2 ммоль) в 10 мл ТГФ. Реакционную смесь перемешивали в течение 15 мин, полученный раствор 1‑(о-метоксифенил)-3,4-дифенилциклопентадиенилкалия медленно прибавляли к перемешиваемой суспензии GdCl3(Thf)2.1 (0.830 г, 2 ммоль) в 10 мл ТГФ. Реакционную смесь перемешивали 12 ч, затем центрифугировали. Раствор концентрировали до объема 10 мл и аккуратно добавляли 20 мл гексана, избегая смешения слоев. Через 5 сут наблюдали образование кристаллического осадка I, который высушивали в динамическом вакууме. Выход I 1.200 г (92%).
Пригодные для РСА кристаллы получали в результате медленной диффузии гексана в раствор I в тетрагидрофуране.
Синтез [(Ph2(o-CH3ОС6Н4)C5H2)2GdCl] (II). Раствор бензилкалия (0.265 г, 2.04 ммоль) в 10 мл ТГФ медленно при перемешивании добавляли к раствору 1-(о-метоксифенил)-3,4-дифенилциклопентадиена (0.648 г, 2 ммоль) в 10 мл ТГФ. Реакционную смесь перемешивали в течение 15 мин, полученный раствор 1-(о-метоксифенил)-3,4-дифенилциклопентадиенилкалия медленно прибавляли к перемешиваемой суспензии GdCl3(Thf)2.1 (0.415 г, 1 ммоль) в 10 мл ТГФ. Реакционную смесь перемешивали 12 ч, затем центрифугировали. Раствор упаривали досуха, полученное вязкое масло растирали с гексаном. Осадок отделяли от раствора центрифугированием. К осадку добавляли 7 мл толуола, осадок хлорида калия отделяли центрифугированием. К раствору аккуратно добавляли 30 мл гексана, избегая смешения слоев. Через 7 сут наблюдали образование кристаллического осадка II, который высушивали в динамическом вакууме. Выход II 0.582 г (69%).
Пригодные для РСА кристаллы получали в результате медленной диффузии гексана в раствор II в толуоле.
РСА комплексов I, II был проведен на дифрактометре Bruker Quest D8 (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структуры расшифрованы прямым методом и уточнены МНК в анизотропном полноматричном приближении по $F_{{hkl}}^{2}$. Учет поглощения проведен полуэмпирически по эквивалентным отражениям. При уточнении разупорядоченных фрагментов использованы ограничения для параметров атомных смещений и позиционных параметров (DFIX и EADP). Атомы водорода во всех структурах рассчитаны и уточнены по модели наездника. Все расчеты проведены по комплексу программ SHELXL-2014/2017. Основные кристаллографические данные и параметры уточнения для соединений I, II приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для соединений I, II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто формула | C120H124Cl10O10K2Gd4, 3(C4H8O) | C48H38ClO2Gd |
| М | 3004.20 | 839.48 |
| T, K | 120 | 100 |
| Сингония | Триклинная | Тетрагональная |
| Пр. группа | $P\bar {1}$ | P41212 |
| Z (Z ') | 1(0.5) | 4(0.5) |
| a, Å | 12.0214(6) | 9.8421(2) |
| b, Å | 14.0206(7) | 9.8421(2) |
| c, Å | 19.7574(10) | 39.0260(12) |
| α, град | 74.5980(10) | 90 |
| β, град | 80.9890(10) | 90 |
| γ, град | 83.9800(10) | 90 |
| V, Å3 | 3163.8(3) | 3780.33(19) |
| ρ(выч.), г см−3 | 1.577 | 1.475 |
| μ, см−1 | 24.06 | 18.64 |
| F(000) | 1508 | 1692 |
| 2θmax, град (полнота) | 58 (0.999) |
60 (0.998) |
| Число измеренных отражений | 52 431 | 40 619 |
| Число независимых отражений | 16 804 | 5510 |
| Число отражений с I > 2σ(I) | 14 553 | 5152 |
| Количество уточняемых параметров | 732 | 237 |
| R1 | 0.0275 | 0.0307 |
| wR2 | 0.0731 | 0.0630 |
| GOОF | 1.008 | 1.022 |
| Остаточная электронная плотность (max/min), e Å−3 | 2.350/−1.201 | 0.636/−0.393 |
Координаты атомов и другие параметры структур депонированы в Кембриджском банке структурных данных (СCDC № 2116742 (I), 2116741 (II), deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие раствора калиевой соли 1-(о-метоксифенил)-3,4-дифенилциклопентадиена в тетрагидрофуране с суспензией тетрагидрофураната трихлорида гадолиния в зависимости от соотношения реагентов приводит к образованию моно-циклопентадиенильного ат-комплекса [{[η5- (Ph2(o-С6Н4OCH3)C5H2)Gd(Thf)]2(µ2-Cl)2(µ3-Cl)3K(Thf)}2] (I) или бис-циклопентадиенильного комплекса [(Ph2(o-С6Н4OCH3)C5H2)2GdCl] (II) (cхема 1).
Схема 1 .
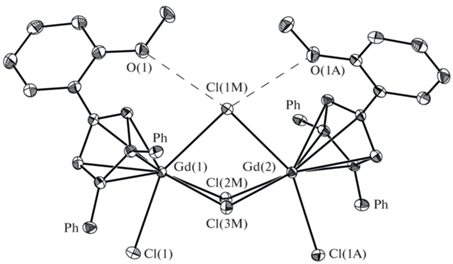
Строение полученных соединений установлено методом РСА. Тетраядерный комплекс I (рис. 1, табл. 2) состоит из двух фрагментов {[η5-(Ph2(o-С6Н4OCH3)C5H2)Gd(Thf)]2(µ2-Cl)2(µ3-Cl)3K(Thf)}, которые соединены через две связи K−Cl планарного фрагмента K2Cl2. Катион Gd3+ (КЧ 8) η5‑координирован циклопентадиенильным лигандом, молекулой ТГФ и четырьмя хлоридными лигандами, при этом один из катионов гадолиния в каждом из фрагментов окружен тремя µ2-хлоридными лигандами и одним µ3-хлоридным лигандом, тогда как второй катион окружен двумя µ2-хлоридными лигандами и двумя µ3-хлоридными лигандами. Два атома углерода фенильного кольца одного из двух арилциклопентадиенильных лигандов в каждом из фрагментов имеют короткие контакты (С…K 3.260(4)–3.396(3) Å) с катионом калия. В комплексе I метоксигруппа фенильного заместителя не принимает участия в координации с катионом гадолиния ни внутри-, ни межмолекулярно, что удивительно, принимая во внимание известную оксофильность лантанидов [13]. Вследствие этого строение I оказывается аналогичным строению комплекса с обычным трифенилциклопентадиенильным лигандом [{[η5- (Ph3C5H2)Gd(Thf)]2(µ2-Cl)2(µ3-Cl)3K(Thf)}2] (III) [9], не имеющим электронодонорных заместителей. При этом метоксифенильный фрагмент циклопентадиенильного лиганда расположен в пространстве аналогично фенильному заместителю в том же положении циклопентадиенильного кольца в комплексе III.
Рис. 1.
Общий вид комплекса I в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы углерода координированных молекул ТГФ и атомы водорода не показаны для упрощения рисунка.
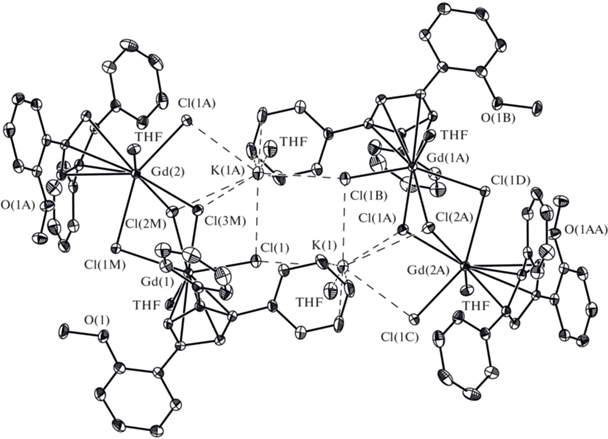
Таблица 2.
Основные структурные параметры комплексов I, II
| Параметр | I | II |
|---|---|---|
| Gd−CCp | 2.700(3)−2.781(3) | 2.662(4)−2.753(3) |
| Gd−Cl | 2.6392(6)−2.8750(6) | 2.600(1) |
| Gd−OTHF | 2.399(2)−2.402(2) | |
| Gd−OOMe | 2.617(3) | |
| K…CPh | 3.260(4)−3.396(3) |
Интересно, что если углы разворота фенильных заместителей в I и II близки (30.1°−37.8° и 28.4°−39.3°), то угол разворота для метоксифенила существенно превышает (30.6°−32.8°) таковой (18.1°−20.4°) для фенила в положении 1 комплекса III. Столь значительный разворот метоксифенильного заместителя несколько удивителен, учитывая, что планарное расположение не только выгодно с точки зрения сопряжения с циклопентадиенильным кольцом, но и с точки зрения возможного внутримолекулярного C−H….O контакта с водородом циклопентадиенильного лиганда (Cp). Анализ внутримолекулярных контактов позволяет предположить, что атом кислорода вовлечен во внутримолекулярный контакт с мостиковым хлоридным лигандом с расстояниями Сl(1m)…O(1) и Сl(1m)…O(1А) 3.170(2) и 3.220(2) Å соответственно (рис. 2). В пользу наличия подобного взаимодействия также может указывать величина углов ОСlGd (161°−162°), что согласуется с возможным переносом заряда с атома кислорода на разрыхляющую орбиталь связи Gd−Cl.
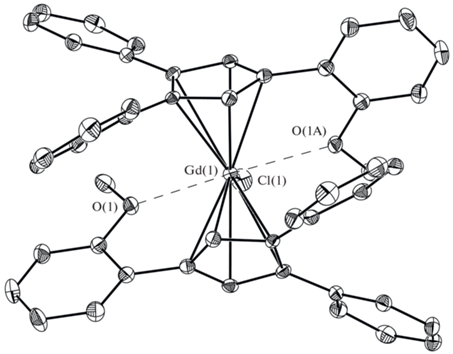
Комплекс II (рис. 3), относящийся к типу бис-циклопентадиенильных производных, построен принципиально иначе. Катион гадолиния в II η5‑координирован двумя циклопентадиенильными лигандами, хлорид-анионом и атомами кислорода обеих метоксигрупп. В комплексе II КЧ(Gd) равно 9. Молекула II кристаллизуется в хиральной пространственной группе P41212 и занимает частное положение – ось 2, проходящую по связи Gd−Cl. Кристаллизация в хиральной пространственной группе, в свою очередь, означает образование конгломерата – механической смеси энантиомеров, в которых хиральная конформация стабилизирована за счет связей Gd…O. Как и в случае комплекса I, углы разворота незамещенных фенильных циклов (25.2(2)° и 31.8(2)°) фактически не отличаются от таковых в I и III (см. выше). Угол разворота для метоксифенильного заместителя ожидаемо оказывается существенно больше (71.4(2)°) в результате взаимодействия Gd…O. Хотя расстояние Gd…O в II (2.617(2) Å) попадает в диапазон максимальных значений для связей Gd…O(Me)−Ph (среднее значение Gd…O ~2.55 Å), однако длина связи О−С в II (1.391(5) Å) существенно превышает таковую в I (1.362(3) Å).
Таким образом, на примере строения комплексов I и II обнаружено, что 1-(о-метоксифенил)-3,4-дифенилциклопентадиенильный лиганд демонстрирует принципиально разные способы координации с центральным ионом металла в зависимости от типа формирующегося комплекса (моно- или бис-циклопентадиенильного), причем в бис-циклопентадиенильном комплексе II обе метоксигруппы принимают участие в координации, что приводит к увеличению КЧ гадолиния до 9 и закономерному удлинению расстояний Gd−CCp.
Авторы сообщают, что у них нет конфликта интересов.
Список литературы
Wilkinson G., Birmingham J. M. // J. Am. Chem. Soc. 1954. V. 76. P. 6210.
Birmingham J.M., Wilkinson G. // J. Am. Chem. Soc. 1956. V. 78. P. 42.
Maginn R.E., Manastyrskyj S., Dubeck M. // J. Am. Chem. Soc. 1963. V. 85. P. 672.
Manastyrskyj S., Maginn R.E., Dubeck M. // Inorg. Chem. 1963. V. 2. P. 904.
Yang L., Ye J., Xu L. et al. // RSC Adv. 2012. V. 2. P. 11529.
Zhang X., Ye J., Xu L. et al. // J. Lumin. 2013. V. 139. P. 28.
Minyaev M.E., Vinogradov A.A., Roitershtein D.M. et al. // J. Organomet. Chem. 2016. V. 818. P. 128.
Roitershtein D.M., Minyaev M.E., Mikhaylyuk A.A. et al. // Russ. Chem. Bull. 2012. V. 61. P. 1726.
Roitershtein D.M., Puntus L.N., Vinogradov A.A. et al. // Inorg. Chem. 2018. V. 57. P. 10199.
Edelmann F.T., Poremba P. // Synthetic Methods of Organometallic and Inorganic Chemistry / Eds Edelmann F.T., Herrmann W.A. Stuttgart (Germany): Verlag, 1997. V. 6. P. 34.
Lochmann L., Trekoval J. // J. Organomet. Chem. 1987. V. 326. P. 1.
Hirsch S.S., Bailey W.J.J. // Org. Chem. 1978. V. 43. P. 4090.
Bünzli J.-C.G. // Acc. Chem. Res. 2006. V. 39. P. 53.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия