Кристаллография, 2020, T. 65, № 5, стр. 705-714
Нестехиометрия в неорганических фторидах. 3. Анионная нестехиометрия в MF2 (M = Ca, Sr, Ba)
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: sobolevb@yandex.ru
Поступила в редакцию 14.05.2019
После доработки 09.10.2019
Принята к публикации 10.10.2019
Аннотация
Анионная нестехиометрия во фторидах – замещение F1– на O2– – ухудшает качество оптических материалов. Начальной стадии анионной нестехиометрии посвящены два обзора: настоящий, который охватывает фториды MF2 (M = Ca, Sr, Ba), и последующий – RF3 (R – 16 редкоземельных элементов). Эти 19 фторидов родственны по их ведущему значению для фторидного материаловедения, составляя более 70% от 27 MFm, используемых для двухкомпонентных фторидных кристаллических материалов. Начальная стадия анионной нестехиометрии в MF2 единственная, в которой образуются оксофториды MF2 – 2xOx с низким содержанием кислорода. Частичное замещение F1– на O2– в структуре флюорита сопровождается термической стабилизацией структурного типа “вверх” по температуре с максимумом на кривых плавкости оксофторидной фазы, распадающейся при охлаждении. Других фтор-кислородсодержащих промежуточных фаз в изученных системах MF2–MO не обнаружено.
ОГЛАВЛЕНИЕ
Введение
1. Катионная и анионная нестехиометрия в неорганических фторидах
2. Анионная нестехиометрия в MF2 (M = Ca, Sr, Ba)
2.1. Бескислородные MF2
2.2. Пирогидролиз MF2 парами воды
2.3. Взаимодействие молекулярного O2 с расплавом CaF2
2.4. Cистемы MF2–MO и нестехиометрические фазы MF2 – 2xOx
2.5. Деструкция MF2 до MO при облучении электронами
Заключение
ВВЕДЕНИЕ
Сообщение продолжает обзоры по катионной нестехиометрии в неорганических фторидах [1, 2], дополняющие [3, 4], в которых изложены результаты исследований Института кристаллографии РАН (ИК РАН) до 2001 г. начальной стадии анионной нестехиометрии (НСАН) во фторидах посвящены два следующих обзора серии, различающиеся объектами. Первый – настоящий – рассматривает анионную нестехиометрию во фторидах щелочноземельных элементов (ЩЗЭ) – MF2 (M = Ca, Sr, Ba). Последующий анализирует НСАН в RF3 (R – 16 редкоземельных элементов – РЗЭ), где она искажает фазовые превращения в RF3. Семейства MF2 и RF3 родственны по значению для фторидного материаловедения, в сумме составляя более 70% от используемых 27 неорганических фторидов MFm для кристаллических двухкомпонентных фторидных материалов.
Катионная нестехиометрия во фторидах сыграла решающую роль в развитии материаловедения благодаря открытию лазеров. Поиск фторидных лазерных кристаллов инициировал получение новых многокомпонентных материалов. Первые оптические квантовые генераторы на них были созданы в середине 70-х годов. В этих генераторах кристаллическими матрицами были фториды ЩЗЭ, а активаторными ионами – в основном ионы РЗЭ – R3+.
Фторидная лазерная подпрограмма ИК РАН состояла из физико-химической и материаловедческой частей. Первая ставила целью изучение T–x-фазовых диаграмм систем MFm–RFn (m < n ≤ ≤ 4) как научной основы поиска новых фаз. Вскоре направления использования вышли за пределы интересов квантовой электроники [1, 4]. Опубликованы обзоры выполнения программы в ИК РАН [1] и Научном центре лазерных материалов и технологий ИОФ РАН [5].
Фториды щелочноземельных элементов – три наиболее изученных из 27 MFm. Освоено промышленное производство монокристаллов CaF2 и BaF2. Структурный тип флюорита является “рыхлым” (заполнение пространства у BaF2 в предположении несжимаемых ионов составляет ∼52%). Стремление к плотной упаковке делает тип CaF2 необычайно изоморфноемким по отношению к иновалентным катионам, в частности R3+. Их вхождение в структуру CaF2 – катионная нестехиометрия – сопровождается внедрением F1– в анионную подрешетку, не меняя ее качественного состава, но компенсируя разницу зарядов катионов. Одновременно взаимодействие высокозаряженных R3+ с анионной подрешеткой приводит к образованию кластеров структурных дефектов нанометрового размера. Кластеры концентрируют РЗЭ, создавая гетерогенный на нанометровом уровне нестехиометрический кристалл. Свойства наноструктурированного кристалла (НСК) [6] управляются составом. Изменения структурно чувствительных свойств (например, фтор-ионная проводимость), достигающие многих порядков величины, сделали кристаллы флюоритовых матриц с катионной нестехиометрией преобладающими фторидными материалами, расширяющими ассортимент кристаллических матриц для ионов РЗЭ в фотонике и оптике УФ- и среднего ИК-диапазона.
Трифториды редкоземельных элементов (RF3) составляют ∼60% от 27 MFm. Их участие как компонентов в образовании флюоритовых многокомпонентных нестехиометрических материалов привлекало к ним интерес. Несмотря на интенсивный синтез и исследования новых фторидных РЗЭ-содержащих материалов, к середине 80-х годов не существовало общепризнанной схемы фазовых превращений (плавления и полиморфизма) соединений RF3. С 1966 по 1976 г. получены четыре противоречивые схемы фазовых превращений в RF3 научными группами, авторитет которых был непререкаем, но результаты оказались несовместимыми. Фторидное материаловедение и высокотемпературная химия RF3 требовали поиска объективной причины разногласий.
Начальная стадия анионной нестехиометрии в трифторидах РЗЭ (или кислородное “загрязнение”) оказалась такой причиной. Четыре слова исчерпывающе характеризуют эту стадию.
Во фторидах ЩЗЭ начальная стадия анионной нестехиометрии является единственной, дающей продукт, в котором часть фтора замещается кислородом – оксофторид MF2 – 2xOx. За ним следует полное удаление фтора до образования оксида MO.
Во фторидах анионная примесь (кислород) – единственная, присутствующая в составе высоко летучего соединения – воды – в любых газовых атмосферах проведения реакций с фторидами. Рост концентрации структурно фиксированного (изоморфного) кислорода продолжается, пока есть внешние источники и не насыщен кислородом продукт НСАН – оксофторид. Управляет кислородным “загрязнением” начальная стадия взаимодействия фторида с источником кислорода, с которого начинается рассмотрение анионной нестехиометрии в данном сообщении для MF2.
Условия, при которых возникает “загрязнение” фторидов кислородом, трудно контролируемы. В отличие от примесей катионов борьба с анионной примесью – кислородом – остается актуальной по сей день.
Анионную нестехиометрию во фторидах из негативного явления, с которым всегда приходилось бороться химикам и технологам, нужно перевести в разряд креативных. Она создает новый класс фторидных нестехиометрических кристаллов сложного состава с новыми свойствами. Одна из задач этого и следующего сообщений – привлечь внимание к анионной нестехиометрии во фторидах как перспективному направлению, развитие которого началось параллельно с изучением катионной нестехиометрии в ИК РАН в 70-е годы прошлого столетия достаточно интенсивно, но в последующие годы замедлилось.
Настоящий и следующий обзоры являются первой попыткой объединения катионной нестехиометрии во фторидах (изученной для парных сочетаний 27 разновалентных катионов) [1, 3] с начальной стадией анионной нестехиометрии, изучаемой для пары анионов F1– и O2– в простых, но практически важных химических семействах соединений MF2 и RF3.
При большом количестве исследований в обсуждаемых областях химии и материаловедения фторидов дать полное цитирование не представляется возможным в объеме обзора. Будут упоминаться пионерские работы, обзоры с качественной библиографией и монографии, выложенные в Интернете.
Цели настоящего сообщения: обсудить соотношение катионной и анионной нестехиометрии в неорганических фторидах; обосновать выбор наиболее важных для фторидного материаловедения семейств фторидов ЩЗЭ и РЗЭ для анализа проявлений в них начальной стадии анионной нестехиометрии; рассмотреть анионную нестехиометрию – замещение F1– → O2– – в кристаллах фторидов ЩЗЭ – MF2.
1. КАТИОННАЯ И АНИОННАЯ НЕСТЕХИОМЕТРИЯ В НЕОРГАНИЧЕСКИХ ФТОРИДАХ
Подрешеток в ионном кристалле, в которых могут замещаться разнородные ионы, две: катионная и анионная. На эти два типа и делится нестехиометрия. В “чистом” виде (затрагивающем одну подрешетку) нестехиометрия возможна в бинарной системе как простейшей.
Катионная нестехиометрия в неорганических фторидах порождается изменениями качественного (элементного) состава катионной подрешетки путем взаимных гетеровалентных замещений Mm+ и Rn+ (m ≠ n). Она выражается в образовании фаз M1 – xRxFm(1 – x) + nx в хорошо изученных системах MFm–RFn (m < n ≤ 4) [1]. Разница зарядов компенсируется количественными (зависящими от m и n) изменениями анионной подрешетки – заселенностью ее позиций. Среди нестехиометрических фаз разного качественного состава в системах MFm–RFn преобладают два типа структур: CaF2 и LaF3 [3, 7, 8]. В обоих типах катионная нестехиометрия сопровождается количественными изменениями в анионной подрешетке, не меняя ее качественный состав.
Структурные исследования дефектного строения нестехиометрических фторидных кристаллов с катионной нестехиометрией в структурном типе флюорита установили в них сильные взаимодействия дефектов и их склонность к ассоциации в кластеры нанометровых размеров. Кластеры определяют особые физические свойства фторидных НСК [4, 6, 8]. Для фаз с высокими содержаниями второго компонента, не описываемых в приближении точечных дефектов, предложен термин “сильно нестехиометрических” (“grossly non-stoichiometric”) кристаллов [9].
Анионная нестехиометрия во фторидах предусматривает различие валентностей анионов при близости ионных радиусов. Для фторидов единственной такой парой являются изоэлектронные ионы F1– и O2– элементов VII и VI групп соответственно. Возможность и степень глубины анионной нестехиометрии определяются соотношением размеров F1– и O2– и типом структуры. В типе CaF2 ион F1– имеет по отношению к катиону координационное число (КЧ) 4. Ионный радиус F1– для этого КЧ равен 1.31 Å в системе “эффективных” ионных радиусов [10]. Ионный радиус O2– в структуре CaF2 для КЧ = 4 равен 1.38 Å.
Ион O2– в структурах типов LaF3 и β-YF3 имеет радиус 1.38 Å (КЧ = 4) и 1.34. Å (КЧ = 3). Размеры анионов F1– и O2– не близки. Различие, уменьшающееся в RF3, позволяет предполагать ограниченное изоморфное замещение F1– и O2– как в MF2, так и в RF3.
Для наблюдения анионной нестехиометрии в “чистом” виде нужна бинарная система, образованная компонентами с общим катионом и двумя разновалентными анионами, вступающими в изоморфные отношения.
Анионная нестехиометрия относит замещения F1– → O2– только к анионной подрешетке и ее качественному (элементному) составу. “Глубина” замещения определяется указанием принятых в литературе стадий: “начальной”, “промежуточной” и “конечной”. В полном сочетании они проявляются только в RF3.
Термин анионной нестехиометрии не отражает характера химической реакции замещения F1– → → O2–. Она может быть как реакцией гидролиза (MF2 + H2O ↔ MO + 2HF↑; RF3 + H2O ↔ ROF + + 2HF↑), так и окислением (MF2 + 1/2O2 ↔ MO + + F2↑; RF3 + 1/2O2 ↔ ROF + F2↑) с одинаковыми конечными твердыми продуктами – оксофторидами. Термин анионная нестехиометрия универсален по отношению к гетеровалентному изоморфизму F1– → O2–, в каких бы внешних условиях и в каком бы типе структуры он ни происходил. Для замещения “фтор–кислород” распространен другой термин: “пирогидролиз”, который формально относится к реакциям первого типа. “Пирогидролиз” водяным паром – частный случай анионной нестехиометрии.
Распространенность анионной нестехиометрии во фторидах столь же велика, сколь и катионной, несмотря на то, что в последней могут участвовать до 34 катионов [3], а элементный состав анионных замещений ограничен всего двумя элементами: F1– и O2–. В любой двухкомпонентной фазе, содержащей парную комбинацию из 27 (для кристаллов) или 34 (для кристаллов и стекол) фторидов, возможно замещение F1– → O2–, поскольку фтор присутствует во всех фазах. Заметим, что написание F1– → O2– не есть уравнение анионного замещения, разное для разных систем, а только указание на изменение качественного состава анионного мотива.
Катионная и анионная нестехиометрия во фторидах – связанные составом систем явления, которые могут переходить одно в другое и сосуществовать в области гомогенности одной фазы. Для их сравнения “сконструируем” схему из систем, в которых проявляются оба типа нестехиометрии в “чистом” виде. За базовые системы с катионной нестехиометрией возьмем изученные MF2–RF3 из фторидов ЩЗЭ и РЗЭ [3].
Как наиболее распространенные и практически важные для фторидного материаловедения компоненты этих систем (MF2 и RF3) выбраны как фторидные основы для изучения НСАН. В качестве источников кислорода в обменных реакциях с этими компонентами должны быть оксиды тех же элементов: MO и R2O3, образующие систему MO–MF2–RF3–R2O3.
На рис. 1 дана схема фазовых отношений в типовых координатах Т–х с катионной и анионной нестехиометрией.
Рис. 1.
Катионная и анионная нестехиометрия в системах MF2–RF3, MF2–MO и RF3–R2O3 (схематически). Фазовые поля: 1 – флюоритовая фаза M1 – xRxF2 + x, 2 – тисонитовая фаза R1 – yMyF3 – y, 3 – флюоритовая оксофторидная фаза MF2 – 2xOx, 4 – тисонитовая оксофторидная фаза RF3 – 2xOx.
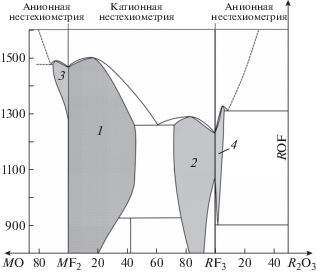
Системы MF2–RF3 располагаются в центре схемы и являются источниками фаз с катионной нестехиометрией. С двух сторон “фторид–фторидных” систем соседствуют “фторид–оксидные” системы (MO–MF2 и RF3–R2O3) – источники фаз с анионной нестехиометрией. Область температур на рис. 1 охватывает от 800 до 1550°С. Шкала составов дана в мольных процентах второго компонента.
Области гомогенности и структуры фаз на рис. 1 приближены к двум реальным системам: SrF2–GdF3 и GdF3–GdOF. Стронций расположен практически в середине ряда ЩЗЭ, а гадолиний – в середине ряда РЗЭ. Приведенные схематически фазовые отношения на рис. 1 представляют усредненную картину для массива из 45 систем MF2–RF3, трех систем MO–MF2 и 15 систем RF3–R2O3 (при парном участии только одноименных катионов).
Катионная нестехиометрия проявляется в “чистом” виде в системах MF2–RF3, где доминируют две области гомогенности, охватывающие в сумме >70% оси составов.
Катионные замещения в типе CaF2 образуют фазы M1 – xRxF2 + x по уравнению M2+ → R3+ + F1–, обозначенные на рис. 1 цифрой 1. Фазы относятся к сильно нестехиометрическим с областями гомогенности, достигающими 50 мол. % RF3 (при температурах эвтектик). Катионная нестехиометрия термически стабилизирует структурный тип CaF2 с образованием аномалий – максимумов на кривых плавкости в ∼70% систем MF2–RF3. При понижении температуры фазы 1 частично распадаются или упорядочиваются.
Катионная нестехиометрия в структурном типе LaF3 производит аналогичный эффект термической стабилизации “вверх” по температуре у тисонитовых фаз R1 – yMyF3 – y, образующихся по уравнению R3+ + F1– → M2+ + VF. Он наблюдается в ∼67% систем MF2–RF3. Тисонитовая фаза – твердый раствор на основе α-RF3 – 2 на рис. 1. Анионные вакансии стабилизируют тип LaF3 по ряду РЗЭ, формируя бертоллидные фазы R1 + yMyF3 – y в системах с RF3 без тисонитовых модификаций (на схеме не показаны). Катионная нестехиометрия стабилизирует структуру тисонита как “вверх”, так и “вниз” по температуре. Понижение температуры приводит к частичному или полному распаду фазы (в зависимости от R) с упорядочением или без него.
Анионная нестехиометрия в “чистом” виде проявляется в cистемах “фторид–оксид”: MF2–MO и RF3–R2O3. Начальная стадия стабилизирует тип CaF2 “вверх” по температуре в единственной изученной системе CaF2–CaO. Но оксофторид CaF2 – 2xOx распадается при охлаждении.
Продукт анионной нестехиометрии на основе MF2 образуется по уравнению (1 – х)MF2 + + xMO → MF2 – 2xOx. Оксофториды ЩЗЭ термически неустойчивы (3 на рис. 1). Для MF2 начальная стадия пирогидролиза является единственной, дающей продукт с одновременным присутствием изоморфных ионов фтора и кислорода. Максимальное содержание MO, зафиксированное в MF2 – 2xOx методом дифференциально-термического анализа (ДТА), около 5 мол. %.
На составе RF3 происходит переход от «чисто» катионной нестехиометрии в фазе R1 – yMyF3 – y к “чисто” анионной в фазе RF3 – 2xOx. Рост содержания R2O3 сопровождается процессами анионной нестехиометрии, зависящими от температуры, типа РЗЭ и валового состава. Начальный этап и структурный механизм зависимостей будут рассмотрены в следующем сообщении.
Продукты начальной стадии анионной нестехиометрии в RF3 образуются по реакции RF3 + + R2O3 → 3RF3 – 2xOx и cодержат 4–8 мол. % R2O3 (приближенно, так как области гомогенности ДТА определены неточно и не для всех РЗЭ). Фазы α-RF3 – 2xOx имеют структуру LaF3 и обозначены 4 на рис. 1.
Система RF3–R2O3 на рис. 1 приведена частично до состава ROF, образующегося по реакции RF3 + 1/2R2O3 → 2ROF. В нем 50 мол. % R2O3 (в пересчете на систему RF3–R2O3). Состав ROF имеет структуру CaF2 и является продуктом промежуточной стадии анионной нестехиометрии с близким к стехиометрическому (флюоритовому) отношением катион:анион = 1 : 2 (в фазах α-ROF). На рис. 1 он обозначен вертикалью ROF. При охлаждении α-ROF → β-ROF с искажениями флюорита (<610°С, низкотемпературная область на схеме не показана). Это промежуточная стадия, характеризующаяся “глубоким” замещением F1– → O2–, требует отдельного рассмотрения.
Как видно из рис. 1, НСАН оказывает на тип LaF3 сильное стабилизирующее действие “вверх” по температуре, несмотря на низкое (менее 8 мол. % R2O3) содержание кислорода в фазах α-RF3 ‒ 2xOx (4). На рис. 1 видно, что анионная стабилизация значительно превышает аналогичный эффект катионной стабилизации для нестехиометрии в фазах R1 – yMyF3 – y (2) с содержаниями иновалентной катионной примеси до 33 мол. % MF2.
Степень термической стабилизации оксофторидных фаз 0 < ΔTfus = Tfus-F–O – TfusRF3 (превышение температур плавления α-RF3 – 2xOx относительно бескислородных RF3) по ряду РЗЭ изменяется немонотонно. Это изменение рассмотрено в следующем обзоре.
Анионная нестехиометрия промежуточной стадии пирогидролиза RF3 (составы, примыкающие к ROF) требует отдельного обзора. Здесь отметим, что нестехиометрия оказывает чрезвычайно большой эффект термической стабилизации ее продуктов – ROF – “вверх” по температуре. Температура плавления для LaOF достигает 2000°С (единственная фаза с изученной термической стабильностью) [11]. Однако все ROF имеют полиморфные превращения ниже 610°С [12]. Неискаженная структура флюорита становится неустойчивой при “глубоком” замещении F1– → O2–. Область составов, обогащенная кислородом больше, чем ROF, здесь не рассматривается. Эта часть системы относится к анионной нестехиометрии промежуточной стадии с “глубоким” замещением F1– → O2–.
Выводы о взаимоотношении катионной нестехиометрии и НСАН во фторидах:
– катионная нестехиометрия широко распространена в системах MFm–RFn (m ≠ n), она наблюдается в фазах M1 – xRxFm(1 – x) + nx, большинство которых (в сумме ∼75%) кристаллизуется лишь в двух структурных типах: CaF2 и LaF3;
– к “чистому” типу фаз с катионной нестехиометрией относятся только фазы с качественными изменениями катионной подрешетки;
– анионная нестехиометрия в “чистом” виде проявляется в системе из компонентов с одним катионом и двумя анионами: F1– и O2–;
– отношение размеров F1– и O2– определяет ограниченный изоморфизм в рассматриваемых типах структур: флюорита и тисонита;
– распространенность анионной нестехиометрии во фторидах велика, как и катионной, несмотря на участие всего двух ионов – фтора и кислорода;
– фазы с катионной и анионной нестехиометрией переходят одна в другую при смыкании фаз α-R1 – yMyF3 – y и α-RF3 – 2xOx (тип LaF3) на составе RF3;
– начальная (и единственная) стадия анионной нестехиометрии в MF2 термически слабо стабилизирует тип CaF2 “вверх” по температуре;
– НСАН стабилизирует у RF3 тип LaF3 “вверх” по температуре, как и катионная нестехиометрия, но фазы α-RF3 – 2xOx распадаются при охлаждении;
– анионная нестехиометрия промежуточной стадии термически сильно стабилизирует тип CaF2 у оксофторида ROF (LaOF плавится при ∼2000°C).
2. АНИОННАЯ НЕСТЕХИОМЕТРИЯ В MF2 (M = Ca, Sr, Ba)
Предсказание анионной нестехиометрии во фторидах a priori невозможно, как и катионной. Единственный метод ее выявления – изучение фазовых диаграмм систем с замещением F1– → O2–. О первом различии систем с катионной и анионной нестехиометрией говорилось – это качественный химический состав.
Второе различие – температур плавления (ΔTfus) и упругостей паров (Δpvap) компонентов систем с катионной и анионной нестехиометрией. Небольшие ΔTfus и Δpvap для систем типа “фторид–фторид” (катионная нестехиометрия), они становятся очень большими для систем “фторид–оксид” (анионная нестехиометрия), затрудняя и даже исключая изучение их фазовых диаграмм в приближении конденсированных систем.
Для исследований НСАН во фторидах этой проблемы не существует: начальная cтадия захватывает самые низкоплавкие части систем “фторид–оксид”, как в случае у MF2 и RF3, рис. 1.
Для изучения НСАН в конденсированных системах стартовыми веществами должны быть бескислородные фториды. Полное удаление кислорода (как любой примеси) невозможно. Надо определить, какие содержания примеси кислорода в MF2 и RF3 допустимы, чтобы считать их номинально бескислородными, и для каких целей. Настоящие цели – высокотемпературные химические исследования систем и получение кристаллов с участием MF2 и RF3. Из выбранных для рассмотрения анионной нестехиометрии двух семейств фторидов MF2 и RF3 для кристаллов CaF2 и BaF2 разработка промышленной технологии роста кристаллов уже давно обеспечила производство бескислородных фторидов ЩЗЭ.
2.1. Бескислородные MF2
Фторидное материаловедение столкнулось с анионной нестехиометрией во фторидах ЩЗЭ в 50-х годах прошлого столетия, когда кристаллы CaF2 (флюорита) потребовались гражданскому и оборонному оптическому приборостроению. Важность направлений практического использования поставила вопрос о создании промышленного производства кристаллов фторидных оптических материалов.
Примесь кислорода во фторидах именовалась “загрязнением”. Очистка расплава CaF2 (позже BaF2) от кислорода стала основой организации производства прозрачных в коротковолновой области фундаментального поглощения кристаллов фторидов, делающего их незаменимыми оптическими конструкционными материалами. На поиски путей этой очистки в США было потрачено много лет [13]. Кислороду в технологии флюорита посвящено большое количество работ, рассмотрение которых не входит в задачи данного обзора. Основные технологии производства фторидных оптических кристаллов в разных странах и приемы очистки от кислорода, включая фторирующие атмосферы, рассмотрены в [14].
Промышленные кристаллы CaF2 и BaF2 [15] (ГОИ им. С.И. Вавилова, Санкт-Петербург), используемые в ИК РАН при изучении фторидных систем и получении материалов, содержали 0.01–0.03 мас. % кислорода (100–300 ppmw, метод вакуум-плавления). Такой чистоты достаточно для получения многокомпонентных нестехиометрических кристаллов, не рассеивающих свет и обладающих высоким пропусканием в УФ-области. Этот вывод неоднозначен, так как на стадиях обработки шихты и роста кристаллов иногда использовалось дополнительное фторирование, снижающее содержание кислорода.
Гораздо раньше с пирогидролизом минерала флюорита столкнулось производство плавиковой кислоты – важнейшего компонента современной как тонкой, так и многотоннажной химии.
2.2. Пирогидролиз MF2 парами воды
Реакция разложения нагретого минерала CaF2 с водяным паром при атмосферном давлении описана [16] в середине позапрошлого века:
В [16] также сообщается, что при обработке кислородом флюорит разлагается, выделяя очень активный газ (фтор?). Реакция приобрела практическое значение как основной метод получения плавиковой кислоты.
Кинетика пирогидролиза минерала и реактива CaF2 в твердой фазе при 1050–1250°С потоком пара (1.4 л/мин) различны [17]. Минерал гидролизуется медленнее и превращается в CaO при 1250°С за ∼5 ч.
Данные по анионной нестехиометрии во фторидах ЩЗЭ, не претендующие на полноту в связи с множеством работ, даны в табл. 1.
Таблица 1.
Условия анионной нестехиометрии в MF2 (M = Ca, Sr, Ba)
| MF2 | Температура, °С | Время, часы | Методы исследования | Реакция | Литература |
|---|---|---|---|---|---|
| CaF2 | 1250 | 5 | Кинетика 1050–1250°С, химанализ | CaF2 + H2O → CaO + 2HF↑ | [16, 17] |
| CaF2 | 1000 ± 25 | 7–94.7% | Кинетика при 1000°С, химанализ | CaF2 + H2O → CaO + 2HF↑ | [18] |
| CaF2 | 1) 1020; 2) 1150; 3) 1150 |
1) max OH1– 2) 216; 3) afl = const |
ИК-спектроскопия, рентгенофазовый анализ (РФА) | Три стадии начального этапа, подтвержденные анализом | [19] |
| CaF2 | 1100 | 12 | РФА | Растворимость CaO в CaF2 > 2400 ppm | [20] |
| CaF2 | Расплав 1454 ± 10 |
УФ-спектроскопия, анализ на кислород | F1– на O2– в CaF2 без участия H2O (механизм не известен) | [21] | |
| CaF2 | Эвтектика 1361 ± 5 |
ДТА, РФА, закалка | Растворимость CaO в CaF2 5 мол. % CaO при 1361°С | [22] | |
| СaF2 | >2 × 103 пА/см2 | Облучение электронами |
Электронный микроскоп | CaF2 → Ca0 + F2 → + H2O (O2) → CaO |
[23] |
| SrF2 | – | Распад SrF2 – 2xOx |
Визуальный | Фото на рис. 3 | |
| SrF2 | >2 × 103 пА/см2 | Облучение электронами |
Электронный микроскоп | SrF2 → Sr0 + F2 → + H2O (O2) → SrO |
[23] |
| BaF2 | 1000 × 25 | ∼40 | Гравиметрический + хим-анализ | BaF2 + H2O → BaO + 2HF↑ | [18] |
| BaF2 | >2 × 103 пА/см2 | Облучение электронами |
Электронный микроскоп | BaF2 → Ba(OH)2 → BaO | [23] |
Механизм взаимодействия кристалла CaF2 с парами воды на начальной стадии изучен [19] комплексом методов: ИК-спектроскопии, рентгенографии порошка, кинетики реакций и их энергий активации и др. Начальный этап замещения “фтор–кислород” делится на три переходящие друг в друга стадии, различающиеся по энергиям активации и продуктам, которые были идентифицированы. На первой стадии молекулы H2O диссоциируют на поверхности CaF2 на H+ и OH1–. Протон и решеточный фтор образуют HF, уходящий из сферы реакции. Гидроксил OH1– занимает вакантную позицию (VF) удаленного F1– c образованием изовалентного твердого раствора. Первая стадия изовалентного замещения F1– → → OH1– подтверждена ИК-спектрами.
На второй стадии каждая молекула H2O отдает O2–, вытесняющий 2F1– с образованием вакансии VF и выделением HF.
Третья стадия наступает при достижении равновесной концентрации VF. Дефекты коагулируют с образованием CaO, найденного рентгенофазовым анализом. Если механизм [19] верен, параметры элементарной ячейки при гидролизе CaF2 должны изменяться как при аддитивном окрашивании CaF2 с образованием VF. Изменения параметра решетки детектируются при температуре >1100°С. При 1150°С параметр достиг насыщения за 144 ч и составил а = 5.439 ± 0.004 Å. Он совпал с параметром решетки аддитивно окрашенного флюорита а = 5.438 ± 0.004 Å, подтверждая предложенный механизм.
Вывод из [19]: взаимодействие MF2 с парами H2O на начальном этапе – сложный процесс из трех стадий. В нем замещение F1– → OH1– переходит в 2F1– → O2– + VF. Реакции протекают на поверхности, и сравнение склонности фторидов ЩЗЭ к пирогидролизу не корректно без учета дисперсности.
Внимание к примесям кислорода и катионов в CaF2 возросло в связи с использованием его для микрофотолитографии. Это комплекс проблем, выходящих за рамки данного сообщения. История работ по получению и глубокой очистке от катионных и анионной примесей кристаллов CaF2 для микрофотолитографии изложена в [24]. Для большинства других областей применения CaF2 в такой дорогостоящей очистке нет необходимости.
2.3. Взаимодействие молекулярного O2 с расплавом CaF2
Реакция изучена [21] при росте кристалла методом Бриджмена в установке с контролем скорости потока и давления кислорода над расплавом. Получена линейная зависимость поглощения на длине волны 197 нм от содержания кислорода в интервале 5–150 ppm. Его минимальное содержание в кристалле 5 ppm (предел чувствительности), а максимальное (определенное анализом), введенное в расплав и кристалл, 145 ppm [21]. При росте кристалла кислород ведет себя как изоморфная примесь с эффективным коэффициентом распределения <1. Этот эксперимент говорит в пользу замещения F1– → O2– в CaF2 без участия H2O.
Термодинамический анализ [25] привел к выводу, что пирогидролиз фторидов при высоких температурах предпочтительнее окисления.
Вхождение кислорода в кристаллы фторидов ЩЗЭ обсуждалось в [26] на основе термодинамических данных реакций дефектообразования. Оценка парциальных давлений F2 (реакция окисления) и HF (реакция пирогидролиза) при 1000°С дала величины 10–15 и 10–3 атм. соответственно. Из этого следует предпочтительность пирогидролиза, однако реакции окисления, как отмечает автор, нельзя исключать. Им предложен механизм вхождения в кристалл гидроксил-иона с последующей диффузией и захватом кластером дефектов с выделением HF. Оценки [26] подтверждены в [27].
Кинетику проникновения молекулярного кислорода O2 в кристалл CaF2 (c 20 ppm кислорода) из воздуха при 1000°С изучили в [20]. Глубина проникновения (∼2 мм за 12 ч) лимитировалась диффузией. Кристалл CaF2 прозрачен от температуры диффузии до 725°С. При этой температуре на контакте с воздухом виден слой с 2000–2400 ppm кислорода из частиц CaO (рентгенофазовый анализ). Остальная часть кристалла прозрачна, что дает оценку растворимости CaO в CaF2 при 1000°С как ∼2400 ppmw.
Результат образования оксофторида стронция в недофторированном коммерческом реактиве “SrF2” показан на рис. 2.
Рис. 2.
Кристаллический блок SrF2 из недофторированного сплава с выделениями частиц SrO (слева) и диск из того же дофторированного реактива (справа).

В 70-е годы производство неорганических фторидов проводилось “мокрыми” методами (осаждение из водорастворимых солей плавиковой кислотой или бифторидом аммония), а удаление воды велось нагревом. Данные условия благоприятствовали неконтролируемому частичному замещению фтора на кислород. В результате использования таких реактивов для роста лазерных кристаллов получался брак: по данным [28, 29] содержание кислорода в кристаллах CaF2 > 50 ppm делает их непригодными для лазеров из-за оптических потерь на рассеяние от частиц CaO.
2.4. Cистемы MF2–MO и нестехиометрические фазы MF2 – 2xOx
Оксофториды MF2 – 2xOx образуются в этих системах на основе компонента MF2 по обменной реакции. Изучение полных фазовых диаграмм систем MF2–MO затруднено высокими температурами плавления MO. Изучают составы, прилегающие к MF2, представляющие в данном случае интерес.
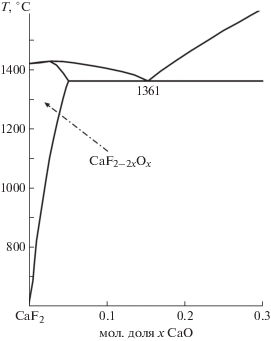
Согласно [30] система CaF2–CaO относится к простым эвтектическим. Температура плавления СаF2 (1360°С) сильно занижена. Растворимость CaO в CaF2 не найдена, нет данных по устойчивости CaF2 – 2xOx.
На этом прервем изложение ранних публикаций по системе CaF2–CaO, направив читателя к недавней работе [22] с хорошим обзором литературы. Методами ДТА и закалки в ней определена растворимость CaO в CaF2 (5 мол. % при эвтектике 1361 ± 5°С). Фаза CaF2 – 2xOx плавится конгруэнтно и распадается при охлаждении. Часть системы CaF2–CaO приведена на рис. 3.
2.5. Деструкция MF2 до MO при облучении электронами
Наличие частиц CaO (и MO в кристаллах других MF2) доказано рентгенофазовым анализом и другими методами. Поскольку размеры частиц малы, используется электронная микроскопия. В кристаллах CaF2 и BaF2 производства ГОИ им. С.И. Вавилова (содержание кислорода 0.025 и 0.012 мас. % соответственно, метод вакуум-плавления) с помощью дифракции электронов наблюдались частицы соответствующих оксидов [31, 32]. Появление частиц MO трактовалось как распад насыщенного кислородом при высоких температурах оксофторида MF2 – 2xOx. Весь кислород, найденный в форме MO, считался собственной исходной примесью расплава и кристалла.
Исследования взаимодействия высокоэнергетического электронного облучения (150 кэВ) с кристаллами MF2 в колонне электронного микроскопа [23] требуют пересмотра такой трактовки. Показано, что часть частиц MO – результат деструкции MF2 электронами. В продуктах появляется металл M0, реагирующий с кислородом и (или) остаточной атмосферной влагой в колонне микроскопа с образованием MO (или гидроксида в случае BaF2). Часть частиц MO, порожденная облучением MF2 электронами, не имеет отношения к содержанию кислорода в расплаве и кристалле. В цитируемой работе определен нижний предел энергии электронов, не вызывающий химических превращений MF2 (∼2 × 103 пА/см2). Полученные ранее оценки содержания кислорода в виде частиц MO в промышленных кристаллах CaF2 и BaF2 методами электронной микроскопии не корректны (завышены).
ЗАКЛЮЧЕНИЕ
Монокристаллы бескислородных CaF2 и BaF2 освоены промышленностью, их шихта и расплав успешно очищаются от кислорода разными твердыми и газообразными фторирующими агентами.
Начальный процесс взаимодействия CaF2 с влажным воздухом (950–1200°С) протекает в несколько последовательных переходящих одна в другую стадий, начинаясь с замещения F1– → OH1– и заканчиваясь: 2F1– → O2– + VF. Продукт начальной стадии – оксофторид – CaF2 – 2xOx – термически неустойчив и распадается на CaF2 и CaO. При температуре эвтектики (1361°С) растворимость CaO в CaF2 определена как 5 мол. %, а при 1000°С она существенно понижается.
Реакция нагретого MF2 с водяным паром (“пирогидролиз”) – способ изоморфного введения кислорода в кристаллы фторидов ЩЗЭ в форме оксофторида MF2 – 2xOx – твердого раствора на основе MF2. За начальной стадией пирогидролиза CaF2 до CaF2 – 2xOx следует его полное разложение до CaO. Реакция – промышленный способ производства плавиковой кислоты.
Взаимодействием молекулярного O2 с расплавом в кристалл CaF2 изоморфно введено до 145 ppm кислорода. Термодинамические оценки отдают предпочтение при высоких температурах “пирогидролизу” (выделение HF), но не исключают и окисления (выделение F2).
Изучение фазовых диаграмм систем MF2–MO ограничено высокими температурами плавления MO. Для системы CaF2–CaO определены растворимость CaO в CaF2 и конгруэнтный характер плавления CaF2 – 2xOx. Для MF2 начальная стадия анионной нестехиометрии, по-видимому, является единственной. Образующиеся MF2 – 2xOx имеют малые области гомогенности и при охлаждении распадаются. Изученность начальной стадии анионной нестехиометрии в MF2 следует признать недостаточной, особенно для SrF2 и BaF2.
Автор выражает благодарность Н.И. Сорокину и Д.Н. Каримову за обсуждение, Е.А. Кривандиой и З.И. Жмуровой за предоставленные кристаллы.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Соболев Б.П. // Кристаллография. 2012. Т. 57. № 3. С. 490.
Соболев Б.П., Сорокин Н.И. // Кристаллография. 2014. Т. 59. № 6. С. 889.
Sobolev B.P. The Rare Earth Trifluorides. Part 1. The High Temperature Chemistry of the Rare Earth Trifluorides. Institut d’Estudis Catalans. Barcelona. Spain. 2000. 520 p.
Sobolev B.P. The Rare Earth Trifluorides. Part 2. Introduction to Materials Science of Multicomponent Fluoride Crystals. Institut d’Estudis Catalans. Barcelona. Spain. 2001. 460 p.
Осико В., Щербаков И. // Фотоника. 2013. № 3(39). С. 14.
Соболев Б.П., Голубев А.М., Эрреро П. // Кристаллография. 2003. 48. № 1. С. 148.
Соболев Б.П., Ипполитов Е.Г., Жигарновский Б.М., Гарашина Л.С. // Изв. АН СССР. Неорган. материалы. 1965. Т. 1. № 3. С. 362.
Соболев Б.П. Дис. “Нестехиометрия в системах из фторидов щелочноземельных и редкоземельных элементов” … д-ра хим. наук. М.: Ин-т кристаллографии РАН, 1978.
Anderson J.S. // Problems of Nonstoichiometry / Ed. Rabenau. Amsterdam; London, North-Holland Publ. Company, 1970.
Shannon R.D. // Acta Cryst. A. 1976. V. 32. № 5. P. 75.
Осико В.В., Соболь А.А., Тимошечкин М.И. // Труды ФИАН. М.: Наука, 1972. Т. 60. С. 71.
Schinn D.B., Eick H.A. // Inorg. Chem. 1969. V. 8. № 2. P. 232.
Stockbarger D.S. // J. Opt. Soc. Am. 1949. V. 39. № 9. P. 31.
Sobolev B.P. // Crystallography Reports. 2002. V. 47. Suppl. 1. P. 63.
Степанов И.В., Феофилов П.П. // Рост кристаллов. М.: Изд-во АН СССР. 1957. С. 229.
Fremy M.E. // Annal. Chim. Physique. 1856. V. 47. 3 serie. P. 5.
Михайлов М.А. // Изв. Восточных филиалов АН СССР. 1957. № 9. С. 64.
Banks C.V., Burke K.E. et al. // Analyt. Chim. Acta. 1958. V. 19. P. 239.
Bontinck W. // Physica. 1958. V. 22. № 8. P. 650.
Phillips W.L., Hanlon J.E. // J. Am. Ceram. Soc. 1963. V. 46. № 9. P. 447.
Molchanov A., Friedrich J., Wehrhan G. et al. // J. Crystal Growth. 2005. V. 273. № 3–4. P. 629.
Kim D.-G., van Hoek C., Liebeske C. et al. // ISIJ International. 2012. V. 52. № 11. P. 1945.
Николайчик В.И., Соболев Б.П., Запорожец М.А., Авилов А.С. // Кристаллография. 2012. Т. 57. № 2. С. 348.
Mouhovski J.T. // Prog. Cryst. Growth Charact. Mater. 2007. V. 53. P. 79.
Поляченок О.Г. // Изв. АН СССР. Неорган. материалы. 1966. Т. 2. № 6. С. 958.
Catlow C.R.A. // J. Phys. Chem. Solid. 1977. V. 38. P. 1131.
Jacob K.T., Saji V.S., Waseda Y. // Int. J. Appl. Ceram. Technol. 2006. V. 3. № 4. P. 312.
Robinson M., Cripe D.M. // J. Appl. Phys. 1966. V. 37. № 5. P. 2072.
Robinson M., Hills G., Cripe D.M., U.S. patent 3, 649, 552, Mar. 4, 1972.
Будников П.П., Тресветский С.Г. // Докл. АН СССР. 1953. Т. 89. № 3. С. 479.
Максимов С.К., Авилов Ф.С., Соболев Б.П., Эрреро П. // Тез. докл. IX Рос. конф. по электронной микроскопии, Черноголовка 28–31 мая 2002. С. 162.
Максимов С.К., Авилов А.С., Соболев Б.П., Эрреро П. // Завод. лаб. Диагностика материалов. 2004. Т. 69. № 10. С. 24.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография