Кристаллография, 2021, T. 66, № 5, стр. 723-729
Влияние хлоридов одно- и двухвалентных металлов на олигомерный состав кристаллизационных растворов лизоцима и дальнейший рост кристаллов
М. А. Марченкова 1, 2, П. В. Конарев 1, 2, А. С. Бойкова 1, 2, *, К. Б. Ильина 1, 2, Ю. В. Писаревский 1, 2, М. В. Ковальчук 1, 2
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: boykova.irk@yandex.ru
Поступила в редакцию 03.09.2020
После доработки 23.10.2020
Принята к публикации 26.11.2020
Аннотация
Методом малоуглового рассеяния рентгеновских лучей исследовано влияние типа осадителя (LiCl, NaCl, KCl, NiCl2 и CuCl2) на образование олигомеров (димеров и октамеров) в кристаллизационных растворах лизоцима при двух концентрациях белка. Из этих же растворов выращены кристаллы для установления влияния олигомерного состава на рост кристаллов. На основе данных, полученных в настоящей и предыдущих работах, описывающих влияние концентрации осадителя, продемонстрирована обратно пропорциональная зависимость суммарного содержания октамеров и димеров от порядкового номера катиона, что согласуется с увеличением активности ионов в лиотропном ряду для Li+, Na+, K+ и увеличением ионных радиусов для Li+, Na+, K+ и для Ni2+, Cu2+. Показано, что уменьшение концентрации белка в кристаллизационном растворе ведет к уменьшению объемной доли октамеров при неизменяющейся объемной доли димеров и понижению вероятности появления кристаллов.
ВВЕДЕНИЕ
Изучение пространственной структуры белков, функционирующих в живых организмах, позволяет разобраться, каким образом биологические молекулы способны выполнять свои функции в природе.
На сегодняшний день около 90% пространственных структур макромолекул, депонированных в белковый банк данных (Protein Data Bank, PDB), определено методом рентгеноструктурного анализа (РСА). Однако ограничением данного метода является требование монокристалличности образца. Поэтому исследование основных механизмов кристаллизации биологических макромолекул представляет фундаментальный интерес как для развития кристаллографии, так и для оптимизации подбора условий кристаллизации и сокращения времени роста кристаллов.
В последние годы обозначился переход от классической схемы кристаллообразования к двухступенчатой, включающей в себя образование промежуточных кластеров-прекурсоров. Одними из первых предположения такого рода высказали сотрудники Института кристаллографии РАН профессор Н.Н. Шефталь в 1957 г. при анализе кристаллизации из газовой фазы и Р.О. Гриздейл в 1968 г. при анализе кристаллизации из растворов [1–3]. Активное развитие этого подхода началось в XXI веке. К настоящему времени имеются обширные данные по этой тематике [4–6]. Особое место занимает цикл работ, выполненный в ФНИЦ “Кристаллография и фотоника” РАН под руководством М.В. Ковальчука, в котором методами малоуглового рассеяния рентгеновских лучей (МУРР) и нейтронов (МУРН) впервые экспериментально обнаружены предкристаллизационные кластеры-прекурсоры в кристаллизационных растворах нескольких белков (лизоцим [7, 8], протеиназа [9], термолизин [10] и аминотрансфераза [11]) и кристаллизационных растворах неорганического соединения дигидрофосфата калия [12]. Для модельного белка лизоцима показано, что в условиях роста кристаллов лизоцима тетрагональной сингонии в растворе образуются олигомерные частицы белка – димеры и октамеры [7, 8], последние являются кластерами-прекурсорами кристалла. При добавлении к раствору лизоцима таких осадителей, как LiCl, NaCl, KCl, CoCl2, NiCl2 и CuCl2, приводящих к росту кристаллов тетрагональной сингонии, объемная доля октамеров увеличивается в следующем порядке: для одновалентных ионов: K+–Na+–Li+, для двухвалентных: Cu2+–Ni2+–Co2+ [13]. Наличие таких лиотропных рядов (или рядов Гофмейстера, которые располагают ионы по силе их воздействия на различные свойства, в случае белка – его растворимость и стабильность) обусловлено их влиянием на какие-либо параметры исследуемой системы [14].
В настоящей работе продолжено изучение структуры растворов лизоцима в условиях роста кристаллов тетрагональной сингонии при добавлении осадителей NaCl, KCl, LiCl, NiCl2 и CuCl2 в зависимости от концентрации белка, осадителя и температуры на станциях P12 EMBL BioSAXS (DESY, Гамбург, Германия) и BM29 BioSAXS (ESRF, Гренобль, Франция).
МАТЕРИАЛЫ И МЕТОДЫ
Материалы и подготовка образцов. Для приготовления образцов использовали белок лизоцим из куриного яйца производства Sigma-Aldrich (CAS № 12650-88-3). Для приготовления маточных растворов использовали следующие неорганические соли: NaCl (CAS № 7647-14-5, Helicon), KCl (CAS № 7447-40-7, abcr GmbH), LiCl (ТУ 6-09-3751-83, Лаверна Стройинжиниринг), CoCl2 (CAS № 7791-13-1, Alta Aesar), NiCl2 (CAS № 7791-20-0, Alta Aesar) и CuCl2 (CAS № 7447-39-4, Acros Organics). Все растворы были приготовлены с использованием ультрачистой воды Millipore (сопротивление воды 18 МОм·см). Белок и соли растворяли в 0.2 М натрий-ацетатном буфере, рН 4.5. Растворы солей фильтровали с помощью мембранных шприцевых фильтров Millex с размером пор 0.22 мкм, раствор белка центрифугировали в течение 10 мин с частотой 10 000 об./мин. Начальная концентрация в маточном растворе белка – 80 мг/мл, начальные концентрации всех солей в маточных растворах – 0.8 и 0.4 М.
Методика МУРР-измерений. Перед проведением измерений методом МУРР маточные растворы лизоцима и солей смешивали друг с другом в равных объемах. Эксперименты были проведены на станциях P12 EMBL BioSAXS источника синхротронного излучения PETRA III (DESY, Гамбург, Германия) и BM29 BioSAXS Европейского источника синхротронного излучения (Гренобль, Франция).
Описание эксперимента на станции P12 EMBL BioSAXS (DESY, Гамбург, Германия). Энергия составляла 10 кэВ (λ = 0.124 нм), в качестве детектора сигнала использовали двухкоординатный детектор PILATUS 6M, позволяющий проводить регистрацию относительно слабых сигналов рассеяния. Расстояние образец–детектор составляло 3.0 м, данные МУРР записывали в диапазоне величин вектора обратного рассеяния s = 0.02–7.0 нм–1, что соответствует разрешению 300–0.9 нм в реальном пространстве. Измерения проводили с использованием специализированной ячейки для образцов МУРР, состоящей из горизонтального термостатируемого в диапазоне от 278 до 323 K кварцевого капилляра со стенками толщиной 50 мкм и диаметром 1.7 мм, размещенного в специализированном корпусе из нержавеющей стали. Время экспозиции составляло 50 мс, было сделано 20 съемок для каждого измерения образца. Более детальное описание станции приведено в [15]. Объем образца в каждом измерении составлял 40 мкл. Измерения проводили при температуре 20°С.
Описание эксперимента на станции BM 29 BioSAXS (ESRF, Гренобль, Франция). Энергия составляла 12.4 кэВ, в качестве детектора сигнала использовали двухкоординатный детектор Pilatus 1M. Расстояние образец–детектор составляло 2.9 м. Исследуемые образцы помещали в специальную термостатируемую роботизированную систему в кюветы из полистирола объемом 200 мкл, нагрев которых осуществлялся одновременно. Первоначально образцы нагревали до 20°С, затем температуру понижали до 10°С. Далее раствор из кюветы с помощью робота помещали в проточный кварцевый капилляр диаметром 1.8 мм, который использовался при измерениях [16]. Исследуемый раствор равномерно продвигался по капилляру, при этом пучок попадал в одну и ту же точку на капилляре, но все время в новую часть образца. За время движения образца по капилляру было сделано 10 съемок. Время экспозиции каждого измерения составляло 1 с, сечение пучка на образце – 700 мкм2. Объем образца в каждом измерении составлял 50 мкл.
Методика обработки экспериментальных данных. Усреднение сигнала от буферного раствора, вычитание усредненного сигнала от буфера из экспериментальных данных рассеяния раствором белков и нормировку на концентрацию белка выполняли с помощью программы PRIMUS, входящей в программный пакет ATSAS [17, 18]. В результате получены экспериментальные кривые интенсивности I от модуля вектора рассеяния s (где s = $4\pi \sin \theta {\text{/}}\lambda $, 2θ – угол рассеяния, λ – длина волны) для растворов белка в различных условиях. Угловой диапазон составлял 0.03 < s < 5.0 нм–1. При сравнении последовательных кадров радиационного повреждения на исследуемых образцах не обнаружено. После первичной обработки экспериментальные кривые малоуглового рассеяния обрабатывали с помощью программы OLIGOMER [18] для определения объемных долей мономеров и олигомеров разного порядка. Расчет теоретических кривых олигомерных компонентов проводили с помощью программы CRYSOL [19]. В качестве мономерного компонента была взята кристаллографическая структура мономера лизоцима (PDB ID: 4WLD), а модели димера, тетрамера, гексамера и октамера получены по методике, описанной в [7]. Качество приближения оценивали с помощью минимизации невязки χ2 между экспериментальными данными и теоретическими модельными приближениями по формуле, приведенной в [13].
Кристаллизация. Маточные растворы, приготовленные для измерений методом МУРР на станции P12 EMBL BioSAXS (DESY, Гамбург, Германия), использовали также для кристаллизации (материалы и методы). Кристаллизацию осуществляли методом диффузии в парах в варианте сидячей капли [20] с помощью кристаллизационного робота Mosquito-LCP (EMBL, Гамбург, Германия), объем капли составлял 200 нл (100 нл маточного раствора белка + 100 нл маточного раствора осадителя). Рост кристаллов проводился в автоматизированной системе визуализации ROCK IMAGER при температуре 19°С. Система позволяет наблюдать рост кристаллов белков и фотографирует капли в течение длительного времени несколько раз (в “нулевой” день (сразу после загрузки кристаллизационного планшета) и далее в 1, 3, 7, 14, 28, 56 и 84 день). Осадители использовали те же (NaCl, KCl, LiCl, NiCl2 и CuCl2). Конечные концентрации в капле составляли для лизоцима 40 и 20 мг/мл, для осадителя – 0.4 М.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты моделирования данных МУРР и тенденции изменения объемной доли олигомеров. В серии экспериментов, выполненных на станциях малоуглового рассеяния P12 (EMBL, Гамбург) и BM 29 BioSAXS (ESRF, Гренобль), были проведены измерения растворов при концентрации лизоцима 20 и 40 мг/мл и концентрации осадителей 0.4 и 0.2 М при температуре 20°С. В качестве осадителей использовали неорганические соли – хлориды щелочных (NaCl, KCl и LiCl) и переходных металлов (NiCl2 и CuCl2). Для сравнения проведены измерения растворов лизоцима без осадителей. Экспериментальные и теоретические кривые, рассчитанные с помощью программы OLIGOMER, показаны на рис. 1.
Рис. 1.
Экспериментальные кривые МУРР от раствора лизоцима с добавлением осадителей LiCl (1), KCl (2), NaCl (3), NiCl2 (4) и CuCl2 (5) и теоретические приближения смесью олигомеров, рассчитанные программой OLIGOMER (черные линии) для концентрации осадителей и концентраций лизоцима соответственно: а – 0.4 М, 20 мг/мл, P12 (EMBL, Гамбург, Германия); б – 0.4 М, 40 мг/мг, P12 (EMBL, Гамбург, Германия); в – 0.43 М, 20 мг/мг, BM 29 BioSAXS (ESRF, Гренобль, Франция). Кривые смещены по вертикали для лучшей визуализации.
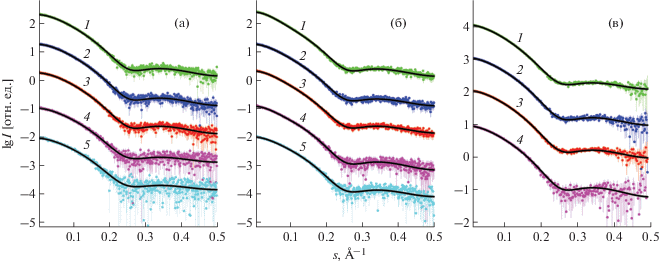
Каждая комбинация типа осадителя и концентрации белка была измерена несколько раз на станциях P12 EMBL BioSAXS (DESY) и BM 29 BioSAXS (ESRF); в табл. 1 приведены усредненные результаты обработки экспериментальных данных.
Таблица 1.
Средние значения объемных долей димеров (Д) и октамеров (О) (%) лизоцима в растворах с осадителями LiCl, NaCl, KCl, CuCl2 и NiCl2, полученные в экспериментах на станциях P12 EMBL BioSAXS (DESY, Hamburg) и BM 29 BioSAXS (ESRF, Grenoble)
| Сос, М | Сб, мг/мл | T, ºC | LiCl | NaCl | KCl | NiCl2 | CuCl2 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| О | Д | О | Д | О | Д | О | Д | О | Д | ||||
| DESY* | 0.4 | 40 | 20 | 6.70 | 17.75 | 5.15 | 16.25 | 4.65 | 14.65 | 5.55 | 8.85 | 4.05 | 6.4 |
| DESY* | 0.4 | 20 | 20 | 2.45 | 17.00 | 2.15 | 14.1 | 2.25 | 13.65 | 2.6 | 7.4 | 1.95 | 7.55 |
| ESRF** | 0.2 | 20 | 20 | 1.13 | 8.6 | 0.875 | 5.7 | 0.43 | 3.8 | 1.43 | 3.1 | 0.7 | 0.5 |
| ESRF [13] | 0.2 | 20 | 20 | 1.70 | 7.3 | 1.8 | 5.4 | 1.9 | 5.0 | 2.4 | 1.9 | 1.1 | 0 |
| ЕSRF [13] | 0.2 | 20 | 10 | 1.9 | 13.1 | 2.2 | 10.6 | 2.4 | 10.5 | 2.8 | 7.9 | 1.7 | 3.5 |
| ESRF [13] | 0.1 | 20 | 20 | 0.1 | 6.2 | 0.1 | 4.9 | 0.3 | 4.5 | 1.0 | 0 | 0 | 0 |
| ESRF [13] | 0.1 | 20 | 10 | 0.2 | 10.5 | 0.1 | 10.1 | 0.3 | 9.3 | 1.4 | 3.7 | 0 | 0.1 |
| ESRF *** | 0.43 | 20 | 20 | 2 | 12.6 | 1.86 | 10.3 | 2.27 | 9.7 | 2.46 | 9.83 | ||
Рассчитанные кривые МУРР от олигомерных смесей для растворов белка с осадителем хорошо совпадают с экспериментальными данными во всем угловом диапазоне, значения невязки χ2 не превышают 1.6, что свидетельствует о правильности предложенной модели обработки. Отметим, что данные, полученные в одном эксперименте при повторных измерениях, различаются незначительно (в некоторых случаях на величину погрешности обработки).
Исследования объемной доли олигомеров в кристаллизационных растворах лизоцима при одинаковых условиях (концентрация белка 20 мг/мл и концентрация осадителей 0.4 М), проведенные на разных источниках синхротронного излучения, показали, что усредненные по нескольким измерениям объемные доли олигомеров отличаются друг от друга в относительных пределах 1–15% (наибольшее различие в 20% с осадителем LiCl) для октамеров и 25–30% для димеров. Кроме того, при выполнении повторных экспериментов на одной и той же станции объемные доли димеров при определенных условиях могли различаться в абсолютных пределах на 1.2–1.5%, а для октамеров – в пределах 0.3–0.5%, с учетом данной неоднозначности, можно заключить, что результаты, представленные в табл. 3, измеренные при различных условиях, находятся в согласии друг с другом. Однако объемная доля тетрамеров и гексамеров во всех экспериментах равняется 0%. Разброс значений между экспериментами на разных станциях и между повторными экспериментами в одной серии могут быть вызваны следующими факторами: неизбежными различиями в протоколе приготовления (временной период между добавлением осадителя и фактическим измерением), разной степенью ослабления пучка во избежание радиационного повреждения образца, изначально разной интенсивностью падающего пучка, разной степенью “чистоты” буферного раствора и наличием “примесей”, стабильностью пучка на самих экспериментальных станциях и эффективностью заполнения образцов роботом.
Таблица 2.
Тенденция изменения объемной доли олигомеров в кристаллизационном растворе лизоцима с осадителями – хлоридами металлов
| Сос, М | Сб, мг/мл | T, °C | Изменение объемной доли октамеров в ряду от меньшего содержания к большему | Изменение объемной доли димеров в ряду от меньшего содержания к большему | Изменение объемной доли октамеров и димеров в ряду от меньшего содержания к большему | |
|---|---|---|---|---|---|---|
| DESY* | 0.4 | 40 | 20 | Cu2+ < K+ < Na+ < < Ni2+ < Li+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ |
| DESY* | 0.4 | 20 | 20 | Cu2+ < Na+ < K+ < < Li+ < Ni2+ | Ni2+ < Cu2+ < K+ < < Na+ < Li+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ |
| ESRF** | 0.2 | 20 | 20 | K+ < Cu2+ < Na+ < < Li+ < Ni2+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ | Cu2+ < Ni2+ ≈ K+ < < Na+ < Li+ |
| ESRF [13] | 0.2 | 20 | 20 | Cu2+ < Li+ < Na+ < < K+ < Ni2+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ |
| ЕSRF [13] | 0.2 | 20 | 10 | Cu2+ < Li+ < Na+ < < K+ < Ni2+ | Cu2+ < Ni2+ < K+ << Na+ < Li+ | Cu2+ < Ni2+ < K+ ≈ ≈ Na+ < Li+ |
| ESRF [13] | 0.1 | 20 | 20 | Cu2+ < Li+ = Na+ < < K+ < Ni2+ | Cu2+ = Ni2+ < K+ < < Na+ < Li+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ |
| ESRF [13] | 0.1 | 20 | 10 | Cu2+ < Li+ ≈ Na+ ≈ K+ < Ni2+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ | Cu2+ < Ni2+ < K+ < < Na+ < Li+ |
| ESRF *** | 0.43 | 20 | 20 | Na+ < Li+ < K+ < Ni2+ | K+ < Na+ < Ni2+ < Li+ | K+ < Na+ < Ni2+ < Li+ |
Таблица 3.
Объемная доля олигомерных фракций (димеров и октамеров), радиус инерции Rg и значение невязки χ2 для растворов лизоцима при концентрации белка 20 мг/мл и концентрации осадителей 0.43 М
| Осади-тель | 0 мин | 100 мин | 170 мин | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rg, Å | Д, % | О,% | χ2 | Rg, Å | Д, % | О,% | χ2 | Rg, Å | Д, % | О, % | χ2 | |
| NaCl | 18.6 | 10.1 | 1.9 | 0.98 | 18.5 | 10.3 | 1.8 | 0.91 | 18.6 | 10.6 | 1.9 | 0.87 |
| KCl [21] | 19.1 | 9.4 | 2.3 | 0.92 | 18.9 | 10.0 | 2.2 | 0.92 | 19.1 | 9.7 | 2.3 | 0.90 |
| LiCl | 18.9 | 12.0 | 2.1 | 1.06 | 18.8 | 12.8 | 2.0 | 1.18 | 18.8 | 13.0 | 2.0 | 1.13 |
| NiCl2 | 19.1 | 9.9 | 2.3 | 1.01 | 19.4 | 8.9 | 2.6 | 1.21 | 19.4 | 10.7 | 2.5 | 1.30 |
Октамеры в среднем демонстрируют более стабильное поведение (их объемные доли при сравнении с данными, полученными в различных сериях экспериментов на различных источниках, слабо меняются по сравнению с содержанием димеров), в то время как димеры, судя по всему, являются более нестабильными образованиями, и их содержание может значительно меняться в ходе проведения различных экспериментов.
Во всех случаях объемная доля октамеров максимальна для NiCl2 и минимальна для CuCl2. Исключение составляет LiCl (концентрация осадителя 0.4 M, белка 40 мг/мл), где объемная доля сильно повысилась в сравнении с условиями для NiCl2.
Зависимость объемной доли октамеров от порядкового номера Li, Na, K при комнатной температуре различается для разных измерений (табл. 2): для данных ESRF (строки 4–7) она прямо пропорциональна порядковому номеру элемента, для данных DESY (строки 1, 2) и ESRF (строка 3) – обратно пропорциональна.
Для димеров во всех измерениях (кроме строк 2 и 8) их объемная доля увеличивается при использовании разных осадителей в следующем порядке (от наименьшего к наибольшему): Cu2+, Ni2+, K+, Na+, Li+.
Объемная доля димеров и октамеров увеличивается для такой же, как в случае с димерами, последовательности ионов Cu2+, Ni2+, K+, Na+, Li+ или уменьшается в ряду Li+, Na+, K+, Ni2+, Cu2+, что согласуется с увеличением активности ионов в лиотропном ряду Гофмейстера для Li+, Na+, K+ и увеличением ионных радиусов для Li+, Na+, K+ и для Ni2+, Cu2+.
Временные измерения МУРР. Для условий кристаллизации, где концентрация белка составляла 20 мг/мл, а концентрация осадителей LiCl, NaCl, KCl, NiCl2 – 0.43 М, на станции BM29 (ESRF, Гренобль, Франция) было проведено исследование в промежутках времени 0* мин (*0 мин в данном случае означает фактически время начала измерения, а не смешивания; от смешивания раствора белка и раствора осадителя до начала измерений проходило ∼10–15 мин), 100 и 170 мин при температуре 20°С. Результаты обработки экспериментальных данных приведены в табл. 3.
С течением времени (от 0 до 170 мин) после смешения содержание октамеров и димеров в растворе изменяется незначительно. Это позволяет убрать вклад времени между добавлением осадителя к белку и фактическим измерением раствора из существенных факторов, влияющих на разброс значений содержания олигомеров между экспериментами.
Рост кристаллов в исследованных условиях. Рост кристаллов проводили из тех же маточных растворов, приготовленных для исследования методом МУРР на станции P12 (EMBL, Гамбург, Германия). Для каждого типа осадителя была поставлена кристаллизация в трех каплях. В подписях к рисункам указано, в скольких опытах образовались кристаллы лизоцима, также приведены средние объемные доли октамеров в растворах по данным МУРР.
В табл. 4 приведены фотографии кристаллов, выращенных в условиях с концентрацией белка 40 и 20 мг/мл. Фотографии сделаны по истечении 56 дней (исключение составляют фотографии кристалла с осадителями KCl и CuCl2, сделанные на 84 день). Все приведенные кристаллы выросли через день, кроме кристаллов в растворах с осадителями KCl и CuCl2 (концентрация белка 20 мг/мл), которые выросли спустя 84 дня.
Таблица 4.
Фотографии кристаллов лизоцима, выращенных из исследуемых растворов при температуре 20°С, концентрациях белка 40 и 20 мг/мл и осадителей 0.4 М
| Сб, мг/мл | LiCl | NaCl | KCl | NiCl2 | CuCl2 |
|---|---|---|---|---|---|
| 40 |  3/3, 6.70% |
 3/3, 5.15% |
 3/3, 4.65% |
 3/3, 5.55% |
 3/3, 4.05% |
| 20 |  2/3, 2.45% |
 3/3, 2.15% |
 1/3*, 2.25% |
 1/3, 2.6% |
 0/3*, 1.95% |
Примечание. Показана одна из трех капель на 56 день кристаллизации, указано, в скольких каплях из трех выросли кристаллы, приведены средние объемные доли октамеров в растворах по данным МУРР (табл. 1)
При концентрации лизоцима в капле 40 мг/мл кристаллы выросли во всех трех каплях при объемной доле октамеров в растворе от 4.05 до 6.70% (наибольшее значение наблюдалось при осадителе LiCl, наименьшее – при CuCl2). Уменьшение концентрации белка с 40 до 20 мг/мл, ведущее и к уменьшению объемной доли октамеров при неизменяющейся объемной доли димеров в растворе, уменьшает вероятность появления кристалла вплоть до полного отсутствия кристаллов в случае использования осадителя CuCl2 (1.95% октамеров). При использовании других осадителей наличие октамеров в растворе (при значении их средней объемной доли от 2.15% и больше) коррелирует с тем фактом, что в данных растворах наблюдался рост кристаллов лизоцима.
ЗАКЛЮЧЕНИЕ
Методом малоуглового рассеяния рентгеновского излучения на станциях P12 EMBL BioSAXS (DESY, Гамбург, Германия) и BM 29 BioSAXS (ESRF, Гренобль, Франция) определен олигомерный состав кристаллизационных растворов лизоцима с использованием разных осадителей NaCl, KCl, LiCl, NiCl2 и CuCl2. Для разных концентраций белка, осадителя и для разных температур показано, что в растворах присутствуют только димеры и октамеры, а также подтверждены выявленные ранее тенденции увеличения объемной доли октамеров при большем пересыщении [13].
Исследования объемной доли олигомеров в кристаллизационных растворах лизоцима при одинаковых условиях, проведенные на разных источниках синхротронного излучения, показали, что усредненные по нескольким измерениям объемные доли олигомеров отличаются друг от друга в относительных пределах 1–15% для октамеров и 25–30% для димеров. Однако зависимость суммарной объемной доли октамеров и димеров от порядкового номера катиона обратно пропорциональна порядковому номеру элемента: объемная доля димеров и октамеров уменьшается в ряду Li+, Na+, K+, Ni2+, Cu2+, что согласуется с увеличением активности ионов в лиотропном ряду Гофмейстера для Li+, Na+, K+ и увеличением ионных радиусов для Li+, Na+, K+ и для Ni2+, Cu2+.
Двукратное уменьшение концентрации белка в кристаллизационном растворе, ведущее и к уменьшению объемной доли октамеров при неизменяющейся объемной доли димеров, понижает вероятность появления кристалла вплоть до полного отсутствия кристаллов в случае использования осадителя CuCl2 (1.95% октамеров). При использовании других осадителей наличие октамеров в растворе (при значении их средней объемной доли от 2.15% и больше) коррелирует с тем фактом, что в данных растворах наблюдался рост кристаллов лизоцима. Таким образом, удалось показать, что образование предкристаллизационной олигомерной фазы на начальной стадии кристаллизации в растворе может являться одним из необходимых условий того, что в растворе вырастет белковый кристалл.
Экспериментальные данные МУРР были собраны на станции P12, управляемой EMBL в Гамбурге, на накопителе PETRA III (DESY, Гамбург, Германия) и на станции BM 29 (ESRF, Гренобль, Франция). Авторы выражают благодарность А.Ю. Грузинову и Cy Jeffries (P12) и Mark Tully (BM29) за помощь в проведении экспериментов.
Работа выполнена при частичной финансовой поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН, Российского фонда фундаментальных исследований (гранты № 18-32-20070 мол_а_вед, 19-29-12042 мк), НИЦ “Курчатовский институт” (приказ № 1360) и iNEXT [6938].
Список литературы
Асхабов А.М. // Записки Рос. минерал. о-ва. 2019. Т. 148. № 6. С. 1.
Шефталь Н.Н. // Успехи физ. наук. 1957. Т. 62. С. 191.
Гриздейл Р.О. // Теория и практика выращивания кристаллов. М: Металлургия, 1968. С. 176.
Асхабов А.М. // Зап. Рос. минерал. о-ва. 2016. Т. 145. № 5. С. 17.
Vekilov P.G. // Nanoscale. 2010. V. 2. P. 2346. https://doi.org/10.1039/C0NR00628A
Alexander E.S., Driessche V., Kellermeier M. et al. New Perspectives on mineral nucleation and growth. From solution precursors to solid materials. Springer, 2017. 380 p.
Kovalchuk M.V., Blagov A.E., Dyakova Y.A. et al. // Cryst. Growth Des. 2016. V. 16. P. 1792. https://doi.org/10.1021/acs.cgd.5b01662
Boikova A.S., Dyakova Y.A., Ilina K.B. et al. // Acta Cryst. D. 2017. V. 73. № 7. P. 591. https://doi.org/10.1107/S2059798317007422
Бойкова А.С., Дьякова Ю.А., Ильина К.Б. и др. // Кристаллография. 2018. Т. 63. № 6. С. 857. https://doi.org/10.1134/S0023476118060061
Kovalchuk M.V., Boikova A.S., Dyakova Y.A. et al. // J. Biomol. Struct. Dyn. 2019. V. 37. № 12. P. 3058. https://doi.org/10.1080/07391102.2018.1507839
Marchenkova M.A., Konarev P.V., Rakitina T.V. et al. // J. Biomol. Struct. Dyn. 2020. V. 38. P. 2939. https://doi.org/10.1080/07391102.2019.1649195
Ковальчук М.В., Алексеева О.А., Благов А.Е. и др. // Кристаллография. 2019. Т. 64. № 1. С. 10. https://doi.org/10.1134/S0023476119010156
Дьякова Ю.А., Бойкова А.С., Ильина К.Б. и др. // Кристаллография. 2019. Т. 64. № 1. С. 15. https://doi.org/10.1134/S0023476119010065
Sedlak E., Stagg L., Wittung-Stafshede P. // Arch. Biochem. Biophys. 2008. № 479. P. 69. https://doi.org/10.1016/j.abb.2008.08.013
Blanchet C.E., Spilotros A., Schwemmer F. et al. // J. Appl. Cryst. 2015. V. 48. № 2. P. 431. https://doi.org/10.1107/S160057671500254X
Pernot P., Round A., Barrett R. et al. // J. Synchrotron Rad. 2013. V. 20. P. 660. https://doi.org/10.1107/S0909049513010431
Franke D., Petoukhov M.V., Konarev P.V. et al. // J. Appl. Cryst. 2017. V. 50. P. 1212. https://doi.org/10.1107/S1600576717007786
Konarev P.V., Volkov V.V., Sokolova A.V. et al. // J. Appl. Cryst. 2003. V. 36. P. 1277. https://doi.org/10.1107/S0021889803012779
Svergun D.I., Barberato C., Koch M.H.J. // J. Appl. Cryst. 1995. V. 28. P. 768. https://doi.org/10.1107/S0021889895007047
Ковальчук М.В., Просеков П.А., Марченкова М.А. и др. // Кристаллография. 2014. Т. 59. № 5. С. 749. https://doi.org/10.7868/S0023476114050105
Kovalchuk M.V., Boikova A.S., Dyakova Y.A. et al. // Thin Solid Films. 2019. V. 677. P. 13. https://doi.org/10.1016/j.tsf.2019.02.051
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


