Кристаллография, 2021, T. 66, № 5, стр. 771-775
Влияние миссенс-мутации Ile222Thr в SsoIF2γ на сродство γ- и β-субъединиц aIF2
О. С. Никонов 1, *, О. В. Кравченко 1, Н. А. Невская 1, Е. А. Столбоушкина 1, М. Б. Гарбер 1, С. В. Никонов 1
1 Институт белка РАН
Пущино, Россия
* E-mail: alik@vega.protres.ru
Поступила в редакцию 08.09.2020
После доработки 16.12.2020
Принята к публикации 16.12.2020
Аннотация
Фактор инициации трансляции 2 эукариот (eIF2) и архей (аIF2) доставляет заряженную инициаторную тРНК (Met-tRNAiMet) на малую рибосомную субчастицу. Фактор e/аIF2 состоит из трех субъединиц (α, β, γ) и функционирует как гетеротримерный комплекс. Ранее было показано, что гомозиготная миссенс-мутация Ile222Thr в γ-субъединице человеческого IF2, нарушающая взаимодействие β- и γ-субъединиц, ведет к умственной отсталости и микроцефалии. В представленной работе показано, что аналогичная мутация в γ-субъединице фактора инициации трансляции 2 архей, который гомологичен эукариотическому белку, не изменяет ни конформацию этого белка, ни его сродство к aIF2β.
ВВЕДЕНИЕ
В эукариотах и археях фактор инициации трансляции 2 (e/aIF2) играет ключевую роль в инициации биосинтеза белка. В ГТФ-связанной форме он доставляет инициаторную метионил-тРНК на малую субчастицу рибосомы. Структурные перестройки, возникающие в 43S преинициаторном комплексе, состоящем из малой рибосомной субчастицы 40S, связанной с факторами инициации трансляции eIF1, eIF1A, eIF3, и тройным комплексом eIF2-Met-tRNAiMet-GTP, способствуют быстрому гидролизу ГТФ даже в отсутствие мРНК [1]. После узнавания старт-кодона и удаления неорганического фосфата (Pi) eIF2 переходит в ГДФ-связанную форму и диссоциирует из инициаторного комплекса [2, 3], оставляя инициаторную тРНК в Р-сайте малой рибосомной субчастицы и открывая возможности для дальнейших этапов биосинтеза белка.
Фактор инициации трансляции 2 состоит из трех субъединиц (α, β, γ) и функционирует как гетеротримерный комплекс. Центральную роль в формировании e/aIF2 играет γ-субъединица. Она взаимодействует как с α-, так и с β-субъединицами, тогда как α- и β-субъединицы не взаимодействуют друг с другом. Присутствие α-субъединицы необходимо для связывания инициаторной метионил-тРНК [4, 5]; β-субъединица в эукариотическом факторе при образовании инициаторного комплекса 43S взаимодействует с мРНК [6]. Дефекты в связывании γ- и β-субъединиц, обусловленные миссенс-мутацией Ile222Thr в человеческом IF2γ (HsaIF2γ), приводят к Х-хромосомному неврологическому заболеванию, характеризующемуся умственной отсталостью и микроцефалией [7]. В дрожжах аналогичная мутация ухудшает правильный выбор старт-кодона и функционирование SceIF2 in vivo, причем негативная роль указанной мутации может быть минимизирована суперэкспрессией гена белка eIF2β [7]. Структурное обоснование негативной роли миссенс-мутации в этих факторах в настоящее время невозможно, так как до сих пор не определена структура ни одного эукариотического фактора инициации трансляции 2 с атомным разрешением.
Ранее было показано, что in vitro аIF2 может функционально заменять eIF2 в связывании Met-tRNAiMet с эукариотической рибосомой и в сканировании матрицы [8]. В настоящее время известны кристаллические структуры γ-субъединиц из Pyrococcus abyssy (PabIF2γ) [9], Methanococcus jannaschii (MjaIF2γ) [10], Sulfolobus solfataricus (SsoIF2γ) [11, 13] и Pyrococcus furiosus (PfuIF2γ) [12]. Каждая γ-субъединица состоит из трех доменов, N-концевой домен (G-домен) представляет собой ГТФазу и отвечает за основные функции белка, в том числе за узнавание β-субъединицы [12–14]. G-домены структур aIF2 из разных организмов (за исключением лабильных переключателей) могут быть наложены друг на друга c r.m.s.d. < 0.65 Å [14]. Это предполагает наличие только незначительных локальных изменений в сайте узнавания β-субъединицы. Со стороны последней во всех известных структурах в узнавании γ-субъединицы участвует α-спираль [12–14]. В HsaIF2β участок 171–189 аминокислотной последовательности, соответствующий спирали α1 в структуре факторов из архей [15], скорее всего также имеет спиральную конформацию.
Тогда можем предположить, что миссенс-мутация будет иметь одинаковое влияние на целостность гетеротримера во всех e/аIF2. В настоящее время проверить это предположение возможно только для архей, так как только для них известны пространственные структуры IF2 или его субъединицы. Для исследования выбрали SsoIF2γ с мутацией Ile181Thr, которая является аналогом мутации Ile222Thr в HsaIF2γ. Полученная в работе структура мутантной формы Ile181Thr SsoIF2γ оказалась идентична структуре белка SsoIF2γ дикого типа (4rjl) [16]. Встраивание полученной структуры в структуру αβγ-гетеротримера [13] не выявило стерических или других препятствий для связывания β- и γ-субъединиц.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение Ile181Thr SsoIF2γ. Суперпродукцию и очистку мутантной формы Ile181Thr SsoIF2γ проводили так же, как и белка SsoIF2γ дикого типа [17]. Непосредственно перед кристаллизацией белок Ile181Thr SsoIF2γ смешивали с нуклеотидом GDPCP и проводили эксперименты по кристаллизации в условиях, описанных в [18] для мутантной формы Sso aIF2γ (∆37–47) с GDPCP.
Определение структуры мутантного белка. Дифракционные данные собраны в Институте белка РАН (Пущино, Россия) на генераторе с вращающимся анодом (Bruker AXS MICROSTAR) с CCD-детектором (Bruker PLATINUM 135). Данные обрабатывали с помощью программного комплекса PROTEUMplus (Bruker AXS). Стартовые фазы получены методом молекулярного замещения в программе Phaser [19], принадлежащей комплексу кристаллографических программ CCP4 [20]. В качестве стартовой модели использовали структуру белка SsoIF2γ дикого типа высокого разрешения в комплексе с GDPCP (PDB ID 4rjl) [16]. Полученную структуру уточняли при разрешении 2.1 Å с использованием программного комплекса PHENIX [21]. Ручную правку и модификацию модели осуществляли с помощью программного комплекса Coot [22]. Статистика сбора данных и кристаллографического уточнения представлена в табл. 1. Координаты и структурные факторы помещены в банк белковых данных.
Таблица 1.
Статистические характеристики дифракционного набора и кристаллографического уточнения Ile181Thr SsoIF2γ
| Статистика набора | |
| Пр. гр. | I23 |
| a = b = c, Å; α ≤ β ≤ γ, град | 186.59; 90.0 |
| Длина волны, Å | 1.54 |
| Пределы разрешения, Å | 26.39–2.1 (2.2–2.1) |
| Общее число отражений | 62755 (8124) |
| Число уникальных отражений | 18 403 (3357) |
| Полнота, % | 99.9 (100.0) |
| Rmerge, % | 10.8 (34.28) |
| Избыточность | 3.41 (2.42) |
| Среднее I/δ(I) | 8.02 (1.99) |
| Статистика уточнения | |
| Диапазон разрешения, Å | 26.38–2.10 (2.13–2.10) |
| Число молекул в асимметричной части | 1 |
| Число отражений | 62 736 (2594) |
| Размер тестовой выборки, % | 5 |
| Rwork, % | 18.2 (23.21) |
| Rfree, % | 20.6 (25.06) |
| Средний температурный фактор, Å2 | 24.3 |
| Среднеквадратичные отклонения | |
| Длины связей, Å | 0.005 |
| Валентные углы, град | 1.102 |
| Число остатков на карте Рамачандрана | |
| Наиболее предпочтительные районы, % | 97.8 |
| Дополнительно разрешенные районы, % | 2.2 |
| PDB ID | 6R8T |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящее время структура βγ-комплекса IF2 известна для двух архей: S. solfataricus [13, 14] и P. furiosus [12], что позволяет надежно выделить область межмолекулярного взаимодействия βγ. Фрагменты аминокислотных последовательностей a/eIF2γ и a/eIF2β, ответственные за формирование межмолекулярного взаимодействия βγ, представлены на рис. 1. Список доступных структур субъединиц aIF2 с литературными ссылками и PDB-кодами для каждой структуры приведены в табл. 2. Для исследования влияния миссенс-мутации в аIF2γ на сродство β- и γ-субъединиц в архейном IF2 выбрали структуру SsoIF2γ прежде всего потому, что гетеротример SsoIF2 определен с более высоким разрешением (2.15 Å), чем гетеродимер PfuIF2 (2.8 Å). Кроме того, в кристалле гетеродимера PfuIF2 N-конец β-субъединицы имеет плотный контакт с доменом II γ-субъединицы, что, по-видимому, искажает его спиральную конформацию, которая cохраняется в SsoIF2γ.
Рис. 1.
Сравнение аминокислотных последовательностей фрагментов aIF2 и eIF2 (табл. 2), ответственных за формирование области межмолекулярного взаимодействия βγ. Остатки, взаимодействующие в межмолекулярной области β- и γ-субъединиц SsoIF2, помечены звездочками; а – сравнение фрагмента последовательностей IF2γ архейных и эукариотичесих белков; б – сравнение аминокислотных последовательностей участка β-cубъединицы архейных и эукариотических белков, ответственного за связывание γ-субъединицы; на сером фоне показаны идентичные остатки, на черном – остатки, кардинально различающиеся в архейных и эукариотических последовательностях.

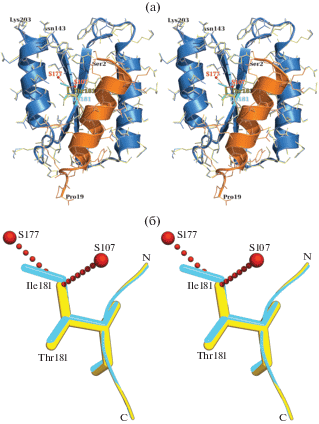
Кристаллическая структура мутантной формы Ile181Thr SsoIF2γ в комплексе с GDPCP (аналогом ГТФ) определена при разрешении 2.1 Å. Наложение этой структуры на структуру аналогичного комплекса белка дикого типа [16] показывает их полную идентичность (средняя квадратичная ошибка равна 0.184 Å для всех Сα-атомов). Фрагмент структуры, ответственный за контакт с β-субъединицей, показан на рис. 2. В месте точечной мутации боковая цепь треонина повторяет валиновую часть Ile181, положения атомов OG1 и CG1 совпадают в пределах ошибки измерения. В мутантной форме атом OG1 связан с двумя молекулами воды (S107 и S177), в структуре дикого типа вода вблизи CG1 отсутствует. Таким образом, единственное следствие миссенс-мутации в SsoIF2γ – появление полярного остатка на поверхности при полном сохранении конформации белка.
Рис. 2.
Наложение участков (Asn143-Lys203) структур SsoIF2γ дикого типа и мутантной формы Ile181Thr SsoIF2γ, определяющих связывание β-субъединицы: а – вторичная структура и аминокислотные остатки SsoIF2γ дикого типа показаны черным, аминокислотные остатки мутантной формы – белым. N-концевая α-спираль (Ser2-Pro19) SsoIF2β, участвующая в формировании βγ-комплекса, показана серым; б – положения атомов CG1 в изолейцине белка дикого типа и OG1 в треонине мутантной формы совпадают в пределах ошибки измерения (0.26 Å). В мутантной форме остаток Thr181 связан с двумя молекулами воды.
Остаток в положении 181 включен в область межмолекулярного взаимодействия βγ и может оказывать влияние на сродство комплекса. Замена γ-субъединицы дикого типа в структурах SsoIF2αβγ и PfuIF2βγ на мутантную форму Ile181Thr SsoIF2γ показывает, что место мутации в области межмолекулярного взаимодействия βγ как SsoIF2, так и PfuIF2 остается доступным растворителю. Обе молекулы воды, входящие в ближайшее окружение Thr181 в свободной мутантной форме SsoIF2γ, сохраняют свое положение при образовании βγ-гетеродимера, что позволяет этому остатку образовать все возможные для него водородные связи. Таким образом, анализ структурных данных показывает, что миссенс-мутация в SsoIF2 не создает стерических или каких-либо других ограничений, мешающих связыванию субъединиц. Это подтверждают проведенные биохимические эксперименты по связыванию мутантной формы Ile181Thr SsoIF2γ с SsoIF2β дикого типа (рис. 3). Обе субъединицы по-прежнему связываются друг с другом со сродством в соотношении 1 : 1.
Рис. 3.
Профиль элюции комплекса SsoIF2βγ и его компонентов, полученный с использованием гель-хроматографии и колонки Superdex 75 10/30. Тонкая черная пунктирная линия – SsoIF2γ дикого типа, тонкая серая пунктирная линия – Ile181Thr SsoIF2γ, черная пунктирная линия – SsoIF2β, черная сплошная линия – SsoIF2γβ, серая сплошная линия – Ile181Thr SsoIF2γβ.

Сравнение аминокислотных последовательностей архейных и эукариотических факторов инициации трансляции 2 (рис. 1) показывает, что некоторые остатки области межмолекулярного взаимодействия βγ, сохраняющие идентичность в археях, кардинально меняются в случае эукариот. Это остатки в позициях 167, 177, 187, 189, 194 и 197 (номенклатура SsoIF2γ). Возможно, именно замены в каких-то из этих положений при наличии миссенс-мутации влияют на сродство β- и γ-субъединиц в эукариотических IF2. Исследование влияния замен в этих положениях на сродство Ile181Thr SsoIF2γ и SsoIF2β SsoIF2 является целью дальнейшей работы.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 18-04-01331-а).
Список литературы
Algire M.A., Maag D., Lorsch J.R. // Mol. Cell. 2005. V. 20. P. 251. https://doi.org/10.1016/j.molcel.2005.09.008
Kap L.D., Lorsch J.R. // Annu. Rev. Biochem. 2004. V. 73. P. 657. https://doi.org/10.1146/annurev.biochem.73.030403.080419
Jackson R.J., Hellen C.U., Pestova T.V. // Nat. Rev. Mol. Cell. Biol. 2010. V. 11. P. 113. https://doi.org/10.1038/nrm2838
Pedulla N., Palermo R., Hasenohrl D. et al. // Nucl.c Acids Res. 2005. V. 33. P. 1804. https://doi.org/10.1093/nar/gki321
Yatime L., Schmitt E., Blanquet S., Mechulam Y. // J. Biol. Chem. 2004. V. 279. P. 15984. https://doi.org/10.1074/jbc.M311561200
Laurino J.P., Thompson G.M., Pacheco E., Castilho B.A. // Mol. Cell. Biol. 1999. V. 19. P. 173. https://doi.org/10.1128/MCB.19.1.173
Borck G., Shin B-S., Stiller B. et al. // Mol. Cell. 2012. V. 48. P. 641. https://doi.org/10.1016/j.molcel.2012.09.005
Dmitriev S.E., Stolboushkina E.A., Terenin I.M. et al. // J. Mol. Biol. 2011. V. 413. P. 106. https://doi.org/10.1016/j.jmb.2011.08.026
Schmitt E., Blanquet S., Mechulam Y. // EMBO J. 2002. V. 21. P. 1821. https://doi.org/10.1093/emboj/21.7.1821
Roll-Mecak A., Alone P., Cao C. et al. // J. Biol. Chem. 2004. V. 279. P. 10634. https://doi.org/10.1074/jbc.M310418200
Yatime L., Mechulam Y., Blanquet S., Schmitt E. // Structure. 2006. V. 14. P. 119. https://doi.org/10.1016/j.str.2005.09.020
Sokabe M., Yao M., Sakai N., Toya S., Tanaka I. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 13016. https://doi.org/10.1073/pnas.0604165103
Yatime L., Mechulam Y., Blanquet S., Schmit E. // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 18445. https://doi.org/10.1073/pnas.0706784104
Stolboushkina E., Nikonov S., Nikulin A. et al. // J. Mol. Biol. 2008. V. 382. P. 680. https://doi.org/10.1016/j.jmb.2008.07.039
Thompson G.M., Pacheco E., Melo E.O., Castilho B.A. // Biochem. J. 2000. V. 347. P. 703. https://doi.org/10.1042/bj3470703
Nikonov O., Kravchenko O., Arkhipova V. et al. // Biochimie. 2016. V. 121. P. 197. https://doi.org/10.1016/j.biochi.2015.11.029
Nikonov O., Stolboushkina E., Nikulin A. et al. // J. Mol. Biol. 2007. V. 373. P. 328. https://doi.org/10.1016/j.jmb.2007.07.048
Nikonov O., Stolboushkina E., Arkhipova V. et al. // Acta Cryst. D. 2014. V. 70. P. 658. https://doi.org/10.1107/S1399004713032240
Storoni L.C., McCoy A.J., Read R.J. // Acta Cryst. D. 2004. V. 60. P. 432. https://doi.org/10.1107/S0907444903028956
Collaborative Computational Project. Number 4 // Acta Cryst. D. 1994. V. 50. P. 760. https://doi.org/10.1107/S0907444994003112
Adams P.D., Grosse-Kunstleve R.W., Hung L.W. et al. // Acta Cryst. D. 2002. V. 58. P. 1948. https://doi.org/10.1107/S0907444902016657
Emsley P., Lohkamp B., Scott W., Cowtan K. // Acta Cryst. D. 2010. V. 66. P. 486. https://doi.org/10.1107/S0907444910007493
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


