Кристаллография, 2022, T. 67, № 3, стр. 488-496
Получение сложных гидросульфатов ряда K3H(SO4)2–Rb3H(SO4)2. Часть II. Фазовые равновесия в системе K2SO4–Rb2SO4–H2SO4–H2O
И. С. Тимаков 1, *, В. В. Гребенев 1, В. А. Коморников 1, О. Б. Зайнуллин 1, И. П. Макарова 1, Е. В. Селезнёва 1, И. И. Кузьмин 2
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Институт геохимии и аналитической химии им. В.И. Вернадского РАН
Москва, Россия
* E-mail: i.s.timakov@gmail.com
Поступила в редакцию 03.09.2021
После доработки 10.11.2021
Принята к публикации 17.11.2021
- EDN: XWIYVG
- DOI: 10.31857/S0023476122030225
Аннотация
Исследованы фазовые равновесия системы K2SO4–Rb2SO4–H2SO4–H2O в изотермических условиях (при 25°С). Определены концентрационные границы кристаллизации твердых растворов с общими формулами (KxRb$_{{1--x}}$)2SO4, (KxRb$_{{1--x}}$)3H(SO4)2, (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O, KxRb$_{{1--x}}$HSO4 и фазы K0.55Rb0.45HSO4. Выявлены зависимости равновесий насыщенных растворов от исходных условий приготовления. Определены условия получения крупных монокристаллов сложных кислых сульфатов калия–рубидия. Построена диаграмма фазовых равновесий системы.
ВВЕДЕНИЕ
Настоящая работа является продолжением исследований фазовых равновесий в сечении K3H(SO4)2–Rb3H(SO4)2–H2O четырехкомпонентной системы K2SO4–Rb2SO4–H2SO4–H2O [1]. Ранее была получена часть ряда твердых растворов (KxRb$_{{1--x}}$)3H(SO4)2 на основе структуры Rb3H(SO4)2. Эти кристаллы относятся к семейству соединений с общей формулой MmHn (AO4)$_{{(m + n)/2}}$ ⋅ yH2O (M = NH4, K, Rb, Cs; А = P, As, S, Se).
Первыми кристаллами этого семейства, привлекшими пристальное внимание исследователей, были CsHSO4 и CsHSeO4 [2]. Их отличительной особенностью являются структурные фазовые переходы (ФП) при повышенных температурах, приводящие к высокой протонной проводимости.
При ФП значения проводимости σ в кристаллах-суперпротониках возрастают скачкообразно и достигают величин, сопоставимых с проводимостью в расплаве. При этом само соединение по агрегатному состоянию остается твердым. Высокая протонная проводимость этих кристаллов обусловлена в первую очередь особенностями структуры и ее изменениями при повышении температуры [3, 4]. ФП в соединениях MmHn (AO4)$_{{(m + n)/2}}$ ⋅ yH2O, как правило, сопровождается повышением симметрии структуры и разупорядочением протонной подрешетки. Именно трансформация протонной подсистемы в кристаллах при изменении температуры является ключевым структурным фактором, определяющим наблюдаемые физические свойства.
Сочетание свойств высокой протонной проводимости (σ ≈ 10–3 Ом–1 см–1) в твердом агрегатном состоянии при умеренных (140–230°C) температурах привлекает внимание к указанному семейству кристаллов с точки зрения возможности использования их в качестве материалов для протон-обменных мембран топливных элементов [5, 6].
Отметим, что систематических исследований фазообразования и поиска новых соединений протонных проводников семейства MmHn (AO4)$_{{(m + n)/2}}$ ⋅ yH2O практически не проводится. Поэтому цель данной работы заключается в изучении фазовых равновесий в четырехкомпонентной системе K2SO4–Rb2SO4–H2SO4–H2O, исследовании фазообразования и определении условий получения не описанных в литературе сложных гидросульфатов рубидия–калия в виде крупных монокристаллов, пригодных для дальнейшего исследования их физико-химических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали Rb2SO4 (марки Ч, ТУ 6-09-04-198-83), H2SO4 (ОСЧ, ГОСТ 14262-78) и K2SO4 (ХЧ, ТУ 6-09-04-201-82). Все реактивы применяли без дополнительной очистки.
Метод исследования фазовых равновесий аналогичен методу, примененному в [1].
Изучение фазовых равновесий в системе K2SO4–Rb2SO4–H2SO4–H2O проводили методом одновременных параллельных кристаллизаций. Данное исследование проводили в специальном лабораторном термостате-шейкере WSB-18 (Witeg Labortechnik, Германия) с подвижным кассетным держателем (для обеспечения перемешивания в термостатируемых сосудах) и программируемым ПИД-регулятором температуры.
Готовили серию маточных растворов в одинаковых герметичных сосудах (кристаллизаторах) с переменным соотношением исходных сухих компонентов и минимальным количеством дистиллированной воды (∼5 мл). Затем при температуре, незначительно превышающей комнатную (50°С), проводили определение растворимости навесок компонентов посредством повторяющегося добавления воды малыми порциями (1–5 мл) до получения насыщенных растворов с минимальным содержанием осадка (не более 3–5 кристалликов соли) на дне сосуда.
Дополнительно контроль количества растворенной в насыщенном растворе соли осуществляли по содержанию сульфат-ионов весовым методом, описанным в [7].
После определения растворимости маточные растворы дополнительно выдерживали в течение двух суток при установленной температуре. Такая выдержка необходима для установления в кристаллизаторе динамического межфазного равновесия между насыщенным раствором и осадком. После указанной выдержки температуру кристаллизаторов снижали несколько суток по одинаковой программе до требуемого значения. Образовавшиеся при таком подходе кристаллы имели размеры 2–5 мм и легко отделялись от маточного раствора. Отбор кристаллов для рентгенофазового анализа проводили непосредственно из кристаллизатора с помощью пинцета с тефлоновыми наконечниками.
Элементный анализ кристаллов осуществляли с использованием рентгенофлюоресцентного энергодисперсионного спектрометра Orbis Micro-XRF (EDAX Inc., США) на свежих сколах монокристаллов в вакууме и на воздухе.
Для количественного определения соотношения калия к рубидию в исследуемых кристаллах применяли метод атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (АЭС-ИСП). Анализ проводили на АЭС-ИСП-спектрометре IRIS Intrepid II XDL Duo (Thermo Electron Corp., США) с CID-детектором. В качестве стандартных растворов при определении K и Rb использовали многоэлементный калибровочный стандарт ICP-MS 68B solution A (“High-Purity Standards”, США) с исходной концентрацией элементов 100 мг/л. Аналитические линии определяемых элементов выбирали на основании библиотеки программного обеспечения прибора. Использовали следующие аналитические линии: 766.491 нм (порядок спектра 44) при определении калия и 780.023 нм (порядок спектра 43) при определении рубидия. Пробоподготовка образцов для АЭС-ИСП-анализа включала в себя кислотное разложение при комнатной температуре: навески кристаллов массой 10 мг разводили до 50 мл 0.01%-ным раствором дважды перегнанной азотной кислоты, затем аликвоты разбавляли в 10 раз 0.01%-ной азотной кислотой.
Рентгенофазовый анализ (РФА) размолотых в порошок монокристаллических образцов выполняли при комнатной температуре на настольном рентгеновском дифрактометре Miniflex 600 (Rigaku, Япония) (CuKα-излучение, непрерывный режим съемки со скоростью 1.0–3.0 град/мин, величина шага 0.01°, в интервале углов 2θ 5°–75°, неподвижный образец, атмосфера окружающей среды).
РЕЗУЛЬТАТЫ
Результаты, изложенные ранее [1], однозначно указывали на необходимость определения фазовых равновесий в растворах с большим содержанием серной кислоты. Учитывая это, логичным было проведение полноценного исследования фазовых равновесий в широком интервале содержания серной кислоты с целью построения полноценной фазовой диаграммы системы K2SO4–Rb2SO4–H2SO4–H2O. Для этого в дополнение к сечению при 35.3 мол. % серной кислоты, описанному в [1], были построены сечения при 47.6, 56, 62 и 75 мол. % H2SO4 (без учета воды) по девять точек в каждом (с переменным соотношением K:Rb в растворе от 1:9 до 9:1 с шагом в 10%). Помимо этого, для упрощения построения фазовых полей в четырехкомпонентной системе K2SO4–Rb2SO4–H2SO4–H2O дополнительно исследовали образующие тройные системы K2SO4–H2SO4–H2O (в интервале 20–90 мол. % H2SO4, без учета воды) и Rb2SO4–H2SO4–H2O (в интервале 30–95 мол. % H2SO4, без учета воды).
Определение растворимости проводили при температуре 50°, кристаллизации осуществляли посредством программируемого снижения температуры до 25°.
Более наглядно концентрационные координаты указанных точек на плоскости составов K2SO4–Rb2SO4–H2SO4 (без учета воды) показаны на рис. 1.
Рис. 1.
Концентрационные координаты составов исходных маточных растворов на плоскости составов K2SO4–Rb2SO4–H2SO4 (в мол. %, без учета воды).

После проведения кристаллизаций в результате РФА равновесных кристаллов определены области кристаллизаций следующих фаз: непрерывные ряды твердых растворов (KxRb$_{{1--x}}$)2SO4 и (KxRb$_{{1--x}}$)3H(SO4)2; ограниченные ряды твердых растворов (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O, KxRb$_{{1--x}}$HSO4 со структурой KHSO4, RbxK$_{{1--x}}$HSO4 со структурой RbHSO4 и ограниченный ряд твердых растворов на основе структуры K0.55Rb0.45HSO4. Представленные фазы перечислены в порядке увеличения содержания серной кислоты в равновесных маточных растворах, из которых они кристаллизуются. На рис. 2 приведены порошковые дифрактограммы полученных кристаллов индивидуальных фаз и твердых растворов. Результаты, относящие к кристаллам фаз MHSO4, согласуются с известными структурными данными: кристалл KHSO4 является ромбическим (пр. гр. Pbca, a = 8.415, b = 9.796, c = 18.967 Å, Z = 16) [9]; RbHSO4 – моноклинным (пр. гр. P21/n, a = 14.350, b = 4.619, c = 14.393 Å, β = 118.03o, Z = 8) [10]. Кристалл K0.55Rb0.45HSO4 также является моноклинным (пр. гр. P21/c, a = 7.07, b = 14.10, c = 8.17 Å, β = = 103.9o, Z = 8) [11], при этом в упомянутой работе он выделен в отдельный, отличный от KHSO4 и RbHSO4, структурный тип. Анализ соотношений щелочных катионов в составе кристаллов, полученных при данном количестве серной кислоты, также указывает на два интервала изменений соотношения K:Rb, разделенных промежуточным значением, по-видимому, относящемуся к фазе K0.55Rb0.45HSO4, табл. 3. Кристаллы твердых растворов (KxRb$_{{1--x}}$)3H(SO4)2 и (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O получены впервые.
Рис. 2.
Рентгенофазовый анализ соединений, образующихся в системе K2SO4–Rb2SO4–H2SO4–H2O: 1 – RbHSO4, 2 – K0.55Rb0.45HSO4, 3 – KHSO4, 4 – (K,Rb)9H7(SO4)8 ⋅ H2O, 5 – (K,Rb)3H(SO4)2, 6 – (K,Rb)2SO4.

Фаза (KxRb$_{{1--x}}$)2SO4 является конгруэнтно растворимой при любых значениях параметра x. Для фазы (KxRb$_{{1--x}}$)3H(SO4)2 при изменении параметра x тип растворимости изменяется: при увеличении значения от 0 до 1 тип растворимости меняется с конгруэнтного (в случае Rb3H(SO4)2) на инконгруэнтный (в случае K3H(SO4)2). Фаза (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O инконгруэнтно растворима при всех рассмотренных значениях параметра x. Ограниченный ряд твердых растворов KxRb$_{{1--x}}$HSO4 со структурой KHSO4 и ограниченный ряд твердых растворов на основе структуры K0.55Rb0.45HSO4 инконгруэнтно растворимы, а ограниченный ряд твердых растворов RbxK$_{{1--x}}$HSO4 со структурой RbHSO4 – конгруэнтно. Дифрактограммы полученных фаз представлены на рис. 2.
Результаты установления фазовых равновесий, а также концентрационные координаты всех проведенных кристаллизаций в системе K2SO4–Rb2SO4–H2SO4–H2O изложены в табл. 1.
Таблица 1.
Концентрационные координаты исследованных точек и фазовые равновесия в системе K2SO4–Rb2SO4–H2SO4–H2O
| Кристал-лизация | Мольные % | Массовые % | Равновесная твердая фаза | ||||||
|---|---|---|---|---|---|---|---|---|---|
| K2SO4 | Rb2SO4 | H2SO4 | H2O | K2SO4 | Rb2SO4 | H2SO4 | H2O | ||
| 1–3 | 0.80–2.33 | 7.24–5.47 | 4.38–4.26 | 87.58–87.94 | 3.41–10.49 | 47.41–37.79 | 10.53–10.79 | 38.65–40.93 | (Rb,K)3H(SO4)2 |
| 4 | 2.85 | 4.31 | 3.91 | 88.92 | 13.69 | 31.69 | 10.56 | 44.05 | (Rb,K)3H(SO4)2 + (Rb,K)2SO4 |
| 5–9 | 3.03 –4.95 | 3.05 –0.55 | 3.32–3.02 | 90.59–91.48 | 16.01–29.22 | 24.71–5.01 | 9.88–10.02 | 49.40–55.75 | (Rb,K)2SO4 |
| 10–15 | 0.46–4.02 | 4.13–2.68 | 4.07–5.95 | 91.33–87.34 | 2.48–19.63 | 34.21–20.05 | 12.38–16.32 | 50.93–43.99 | (Rb,K)3H(SO4)2 + (Rb,K)9H7(SO4)8 ⋅ H2O |
| 16–18 | 5.71–8.72 | 2.45–0.97 | 7.24–8.59 | 84.60–81.72 | 25.65–37.14 | 16.85–6.32 | 18.29–20.59 | 39.22–35.94 | (Rb,K)3H(SO4)2 |
| 19–20 | 0.94–1.92 | 8.55–7.75 | 12.07–12.31 | 78.43–78.01 | 3.26–6.69 | 45.28–41.27 | 23.47–24.06 | 27.99 | RbxK$_{{1--x}}$HSO4 |
| 21–27 | 2.34–5.76 | 5.50–0.64 | 9.98–8.18 | 82.18–85.41 | 9.41–28.54 | 33.88–4.89 | 22.58–22.83 | 34.13–43.73 | (Rb,K)9H7(SO4)8 ⋅ H2O |
| 28–30 | 0.43–1.50 | 3.90–3.52 | 7.08–8.22 | 88.59–86.75 | 2.20–7.32 | 30.59–26.36 | 20.38–22.59 | 46.83–43.73 | RbxK$_{{1--x}}$HSO4 |
| 31 | 2.04 | 3.08 | 8.39 | 86.48 | 10.00 | 23.14 | 23.13 | 43.73 | RbxK$_{{1--x}}$HSO4 + K0.55Rb0.45HSO4 |
| 32–33 | 2.68–2.87 | 2.70–1.93 | 8.83–7.86 | 85.79–87.35 | 12.99–14.89 | 20.05–15.32 | 24.05–22.96 | 42.90–46.83 | K0.55Rb0.45HSO4 |
| 34–35 | 3.25–3.95 | 1.40–0.99 | 7.65–8.12 | 87.69–86.93 | 17.34–20.77 | 11.47–8.01 | 22.93–24.02 | 48.26–47.20 | (Rb,K)9H7(SO4)8 ⋅ H2O + K0.55Rb0.45HSO4 |
| 36 | 4.13 | 0.46 | 7.56 | 87.85 | 22.76 | 3.90 | 23.40 | 49.94 | (Rb,K)9H7(SO4)8 ⋅ H2O + KxRb$_{{1--x}}$HSO4 |
| 37–38 | 0.27–0.55 | 2.41–2.22 | 8.02–8.32 | 89.30–88.90 | 1.50–3.10 | 20.88–19.12 | 25.51–26.28 | 52.11–51.51 | RbxK$_{{1--x}}$HSO4 |
| 39–40 | 0.88–1.22 | 2.07–1.84 | 8.84–9.18 | 88.22–87.76 | 4.85–6.67 | 17.46–15.44 | 27.43–28.29 | 50.26–49.61 | RbxK$_{{1--x}}$HSO4 + K0.55Rb0.45HSO4 |
| 41–42 | 1.55–1.98 | 1.56–1.33 | 9.33–9.94 | 87.56–86.75 | 8.49–10.65 | 13.10–10.96 | 28.80–30.13 | 49.61–48.26 | K0.55Rb0.45HSO4 |
| 43–44 | 2.19–2.54 | 0.94–0.64 | 9.42–9.58 | 87.44–87.23 | 12.18–14.19 | 8.05–5.47 | 29.51–30.08 | 50.26 | K0.55Rb0.45HSO4 + KxRb$_{{1--x}}$HSO4 |
| 45 | 2.73 | 0.31 | 9.14 | 87.83 | 15.67 | 2.69 | 29.54 | 52.11 | KxRb$_{{1--x}}$HSO4 |
| 46–47 | 3.75–4.34 | 0.00 | 0.94–1.86 | 95.31–93.81 | 26.57–28.78 | 0.00 | 3.74–6.94 | 64.70 –64.29 | K2SO4 |
| 48–51 | 6.98–5.91 | 0.00 | 4.66–7.22 | 88.36–86.87 | 37.29–31.18 | 0.00 | 13.99–21.45 | 48.72–47.37 | K3H(SO4)3 |
| 52 | 5.14 | 0.00 | 7.71 | 87.16 | 27.81 | 0.00 | 23.47 | 48.72 | K9H7(SO4)8 ⋅ H2O |
| 53–54 | 4.61–3.19 | 0.00 | 8.57–9.58 | 86.81–87.23 | 25.08–18.15 | 0.00 | 26.21–30.63 | 48.72–51.22 | KHSO4 |
| 55–57 | 0.00 | 5.21–7.12 | 2.23–5.83 | 92.55–87.05 | 0.00 | 42.49–47.08 | 6.69–14.14 | 50.82–38.78 | Rb3H(SO4)2 |
| 58–63 | 0.00 | 7.41–2.84 | 7.41–8.53 | 85.18–88.63 | 0.00 | 46.69–23.79 | 17.14–26.21 | 36.17–50.00 | RbHSO4 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По результатам РФА равновесных твердых фаз в зависимости от составов исходных растворов можно построить диаграмму фазовых равновесий для рассматриваемой системы K2SO4–Rb2SO4–H2SO4–H2O, рис. 3.
Рис. 3.
Вид фазовой диаграммы системы K2SO4–Rb2SO4–H2SO4–H2O: а – развертка с указанием ключевых точек и линий (стрелками показаны направления изменения составов растворов при сокристаллизации на линиях моновариантного равновесия); б – изометрическая проекция фазовой диаграммы (показаны характерные габитусы кристаллов и размерность образцов).
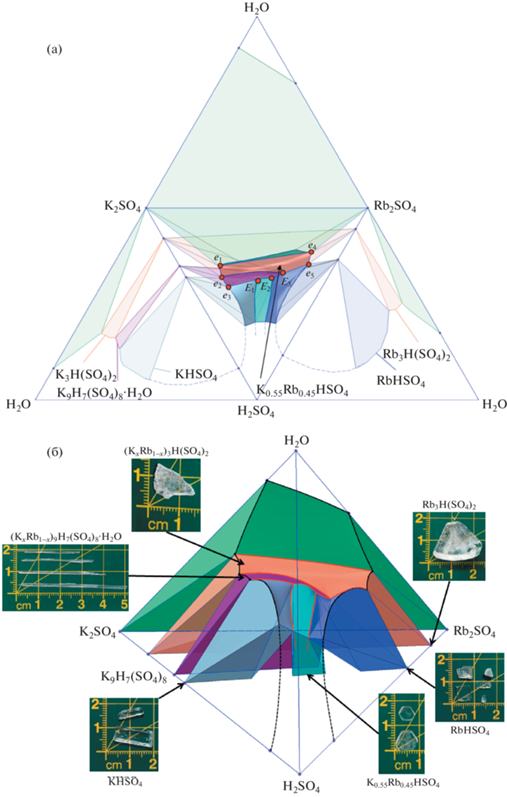
Данная диаграмма содержит восемь точек нонвариантного равновесия: три точки нонвариантных равновесий, обозначенные как eK1, eK2 и eK3, принадлежат образующей системе K2SO4–H2SO4–H2O; другие две точки, обозначенные как eRb1 и eRb2, – образующей системе Rb2SO4–H2SO4–H2O; и, наконец, оставшиеся три точки нонвариантных равновесий, обозначенные как E1, E2 и E3, принадлежат самой четырехкомпонентной системе K2SO4–Rb2SO4–H2SO4–H2O. Не менее важными для описания системы точками являются ωK2SO4 и ωRb2SO4, представляющие величины растворимости в воде исходных компонентов, а также точки ωKHSO4 и ωRbHSO4, описывающие растворимости соединений KHSO4 и RbHSO4 в 100%-ной серной кислоте.
Перечисленные точки соединены шестнадцатью линиями моновариантных равновесий – восемь из них относятся к тройным образующим системам и являются ветвями кристаллизаций фаз K2SO4, K3H(SO4)2, K9H7(SO4)8 ⋅ H2O, KHSO4, Rb2SO4, Rb3H(SO4)2, RbHSO4, а также непрерывного ряда твердых растворов (KxRb$_{{1--x}}$)2SO4. Еще восемь линий принадлежат четырехкомпонентной системе K2SO4–Rb2SO4–H2SO4–H2O и являются линиями совместных кристаллизаций соседствующих фаз. Данные линии разграничивают области (поверхности) кристаллизации следующих фаз: твердых растворов (KxRb$_{{1--x}}$)2SO4, (KxRb$_{{1--x}}$)3H(SO4)2, (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O; твердых растворов KxRb$_{{1--x}}$HSO4 со структурой KHSO4 и RbxK$_{{1--x}}$HSO4 со структурой RbHSO4, разделенных областью кристаллизации твердых растворов на основе двойного кислого сульфата состава K0.55Rb0.45HSO4. Более подробно перечисленные элементы диаграммы, их концентрационные координаты и соответствующие фазовые равновесия приведены в табл. 2.
Таблица 2.
Основные элементы системы K2SO4–Rb2SO4–H2SO4–H2O
| Точка | K2SO4, мол. % (мас. %) |
Rb2SO4, мол. % (мас. %) |
H2SO4, мол. % (мас. %) |
H2O, мол. % (мас. %) |
Равновесие |
|---|---|---|---|---|---|
| ωK2SO4 | 1.99 (16.4) | 98.1 (83.6) | K2SO4 ↔ L | ||
| ωRb2SO4 | 3.49 (34.9) | 96.51 (65.1) | Rb2SO4 ↔ L | ||
| ωKHSO4 | 10 (16)* | 90 (84)* | KHSO4 ↔ L | ||
| ωRbHSO4 | 15 (32)* | 85 (68)* | RbHSO4 ↔ L | ||
| eK1 | 6.41 (36.77) | 2.94 (9.49) | 90.66 (53.74) | K2SO4 + K3H(SO4)2 ↔ L | |
| eK2 | 6.15 (32.46) | 6.722 (20.0) | 87.133 (47.54) | K3H(SO4)2 + K9H7(SO4)8 ⋅ H2O ↔ L | |
| eK3 | 4.92 (26.60) | 8.16 (24.84) | 86.93 (48.56) | K9H7(SO4)8 ⋅ H2O+KHSO4 ↔ L | |
| eRb1 | 7.52 (50.52) | 3.77 (9.3) | 88.72 (40.18) | Rb2SO4 +Rb3H(SO4)2 ↔ L | |
| eRb2 | 7.41 (46.68) | 7.41 (17.15) | 85.18 (36.17) | Rb3H(SO4)2+RbHSO4 ↔ L | |
| Е1 | 2.33 (10.93) | 3.51 (25.3) | 8.39 (22.17) | 85.77 (41.6) | K0.55Rb0.45HSO4+(K$_{{1--x}}$Rbx)9H7(SO4)8 ⋅ H2O + + KxRb$_{{1--x}}$HSO4 ↔ L |
| Е2 | 3.86 (17.75) | 2.59 (18.25) | 9.27 (24.0) | 84.27 (40.0) | K0.55Rb0.45HSO4+(K$_{{1--x}}$Rbx)9H7(SO4)8 ⋅ H2O + + RbxK$_{{1--x}}$HSO4 ↔ L |
| Е3 | 2.25 (9.25) | 5.28 (33.30) | 9.58 (22.20) | 82.89 (35.24) | (KxRb$_{{1--x}}$)3H(SO4)2+(K$_{{1--x}}$Rbx)9H7(SO4)8 ⋅ H2O + + RbxK$_{{1--x}}$HSO4 ↔ L |
| Линия (ветвь) (со)кристаллизации | Наблюдаемое равновесие | ||||
| ωK2SO4–eK1 | K2SO4 ↔ L | ||||
| eK1–eK2 | K3H(SO4)2 ↔ L | ||||
| eK2–eK3 | K9H7(SO4)8 ⋅ H2O ↔ L | ||||
| eK3–ωKHSO4 | KHSO4 ↔ L | ||||
| ωRb2SO4–eRb1 | Rb2SO4 ↔ L | ||||
| eRb1–eRb2 | Rb3H(SO4)2 ↔ L | ||||
| eRb2–ωRbHSO4 | RbHSO4 ↔ L | ||||
| ωK2SO4–ωRb2SO4 | (KxRb$_{{1--x}}$)2SO4 ↔ L | ||||
| eK1–eRb1 | (KxRb$_{{1--x}}$)2SO4 + (KxRb$_{{1--x}}$)3H(SO4)2 ↔ L | ||||
| eK2–Е3 | (KxRb$_{{1--x}}$)3H(SO4)2 + (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O ↔ L | ||||
| Е3–eRb2 | (KxRb$_{{1--x}}$)3H(SO4)2 + RbxK$_{{1--x}}$HSO4 ↔ L | ||||
| eK3–Е1 | (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O + KxRb$_{{1--x}}$HSO4 ↔ L | ||||
| Е1–Е2 | (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O + K0.55Rb0.45HSO4 ↔ L | ||||
| Е2–Е3 | (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O + RbxK$_{{1--x}}$HSO4 ↔ L | ||||
| Е1–** | KxRb$_{{1--x}}$HSO4 + K0.55Rb0.45HSO4 ↔ L | ||||
| Е2–** | RbxK$_{{1--x}}$HSO4 + K0.55Rb0.45HSO4 ↔ L | ||||
| Область (поверхность) кристаллизации | Фаза | ||||
| ωK2SO4–eK1–ωRb2SO4–eRb1 | (KxRb$_{{1--x}}$)2SO4 | ||||
| eK1–eK2–Е3–eRb2–eRb1 | (KxRb$_{{1--x}}$)3H(SO4)2 | ||||
| eK2–eK3–Е1–Е2–Е3 | (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O | ||||
| eK3–ωKHSO4–Е1 | KxRb$_{{1--x}}$HSO4 | ||||
| Е2–Е3–eRb2–ωRbHSO4 | RbxK$_{{1--x}}$HSO4 | ||||
| **–Е1–Е2–** | K0.55Rb0.45HSO4 | ||||
Таблица 3.
Соотношение K : Rb в кристаллах твердых растворов по результатам элементного анализа
| Кристаллизация | Содержание K, ат. % | Содержание Rb, ат. % | Формула |
|---|---|---|---|
| 1 | 2.75 | 24.62 | (K0.9Rb0.1)3H(SO4)2 |
| 2 | 3.58 | 16.22 | (K0.18Rb0.82)3H(SO4)2 |
| 3 | 7.75 | 20.38 | (K0.28Rb0.72)3H(SO4)2 |
| 4 | 10.59 | 17.64 | (K0.38Rb0.62)3H(SO4)2 |
| 15 | 35.51 | 19.79 | (K0.64Rb0.36)3H(SO4)2 |
| 16 | 41.75 | 6.55 | (K0.86Rb0.14)3H(SO4)2 |
| 17 | 43.23 | 4.87 | (K0.90Rb0.10)3H(SO4)2 |
| 18 | 47.05 | 2.27 | (K0.95Rb0.05)3H(SO4)2 |
| 21 | 9.38 | 40.82 | (K0.19Rb0.81)9H7(SO4)8 ⋅ H2O |
| 22 | 11.29 | 41.96 | (K0.21Rb0.79)9H7(SO4)8 ⋅ H2O |
| 23 | 15.57 | 33.1 | (K0.32Rb0.68)9H7(SO4)8 ⋅ H2O |
| 24 | 21.04 | 25.43 | (K0.45Rb0.55)9H7(SO4)8 ⋅ H2O |
| 25 | 23.11 | 22.87 | (K0.5Rb0.5)9H7(SO4)8 ⋅ H2O |
| 26 | 27.61 | 16.54 | (K0.63Rb0.37)9H7(SO4)8 ⋅ H2O |
| 27 | 35.92 | 6.72 | (K0.84Rb0.16)9H7(SO4)8 ⋅ H2O |
| 37 | 2.16 | 35.14 | K0.06Rb0.94HSO4 |
| 38 | 4.66 | 34.27 | K0.12Rb0.88HSO4 |
| 39 | 8.53 | 32.3 | K0.21Rb0.79HSO4 |
| 40 | 13.44 | 25.89 | K0.34Rb0.66HSO4 |
| 41 | 18.02 | 20.25 | K0.47Rb0.53HSO4 |
| 42 | 24.11 | 14.86 | K0.62Rb0.38HSO4 |
| 43 | 26.93 | 11.76 | K0.70Rb0.30HSO4 |
| 44 | 36.13 | 4.54 | K0.89Rb0.11HSO4 |
| 45 | 39.53 | 1.96 | K0.95Rb0.05HSO4 |
Отдельного пояснения заслуживают некоторые элементы табл. 2. Значения концентрационных координат для точек ωKHSO4 и ωRbHSO4 установлены с меньшей точностью, нежели для остальных точек системы. Это связано с тем, что увеличение содержания серной кислоты в растворах приводит к образованию расплывающихся на воздухе осадков, что не позволило провести РФА. Поэтому значения ωKHSO4 и ωRbHSO4 определяли следующим образом: проводили синтез серии растворов K2SO4 и Rb2SO4 в серной кислоте при содержании последней 80, 85, 90 и 95 мол. %. Навеска K2SO4 полностью растворилась при содержании H2SO4 в 90 мол. %, а Rb2SO4 – при 95 мол. %. Эти значения использовали при построении диаграммы.
Определение ветви кристаллизации твердых растворов на основе K0.55Rb0.45HSO4 (образующая система K2SO4–Rb2SO4–H2SO4) также осложнено расплыванием осадков на воздухе. Поэтому координаты эвтонических точек для этой ветви кристаллизации не определяли, что отмечено в табл. 2.
Помимо определения областей существования твердых растворов (KxRb1‒x)3H(SO4)2, являвшихся первоначальной целью исследования, результаты исследования фазовых равновесий в системе K2SO4–Rb2SO4–H2SO4–H2O выявили еще одну интересную с точки зрения протонной проводимости систему твердых растворов – (KxRb$_{{1--x}}$)9H7 (SO4)8 ⋅ H2O. Их область кристаллизации оказалась довольно обширна по соотношению K2SO4 : Rb2SO4, табл. 3. Ранее [8, 12, 13] были исследованы и соединение K9H7(SO4)8 ⋅ H2O, и его твердый раствор с аммонием (Kx(NH4)$_{{1--x}}$)9H7 (SO4)8 ⋅ ⋅ H2O. Однако область кристаллизации и, соответственно, степень замещения катионов калия катионами аммония была значительно меньше, нежели в случае замещения калия рубидием. Сравнительный анализ структурных параметров и свойств рассматриваемых твердых растворов на основе кристалла K9H7(SO4)8 ⋅ H2O должны являться объектом отдельного исследования.
Твердые растворы на основе простых кислых сульфатов и фаза K0.55Rb0.45HSO4 также заслуживают отдельного разъяснения.
Из насыщенных растворов, содержащих более 12 мол. % (23 мас. %) серной кислоты (табл. 1), кристаллизуются твердые растворы со структурным типом простых кислых сульфатов – MHSO4.
При этом кристаллизуется не непрерывный ряд твердых растворов, как в случае (KxRb1‒x)3H (SO4)2, а три различные фазы. Это упомянутые твердые растворы KxRb$_{{1--x}}$HSO4 со структурой KHSO4 и RbxK$_{{1--x}}$HSO4 со структурой RbHSO4, разделенные областью кристаллизации твердого раствора со структурой двойного кислого сульфата K0.55Rb0.45HSO4.
Таким образом, более широкое исследование фазообразования и фазовых равновесий в системе K2SO4–Rb2SO4–H2SO4–H2O позволило достичь цели, заявленной в [1], а именно: определить концентрационные и температурные условия получения непрерывного ряда твердых растворов (KxRb1‒x)3H(SO4)2 (0 ≤ x ≤ 1).
ВЫВОДЫ
По результатам работы построена диаграмма фазовых равновесий для исследуемой четырехкомпонентной водно-солевой системы K2SO4–Rb2SO4–H2SO4–H2O в широком интервале содержания серной кислоты (рис. 3).
Определены концентрационные координаты ключевых точек и линий сокристаллизации соединений в системе K2SO4–Rb2SO4–H2SO4–H2O, а также определены области кристаллизации отдельных фаз системы и их характер растворимости.
В результате проведенных исследований впервые получены монокристаллы твердых растворов (KxRb$_{{1--x}}$)3H(SO4)2 и (KxRb$_{{1--x}}$)9H7(SO4)8 ⋅ H2O.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН. Исследования с использованием АЭС-ИСП проводили в рамках госзадания № 0137-2019-0018.
Список литературы
Коморников В.А., Гребенев В.В., Тимаков И.С. и др. // Кристаллография. 2019. Т. 64. № 3. С. 447. https://doi.org/10.1134/S0023476119060109
Баранов А.И., Шувалов Л.А., Щагина Н.М. // Письма в ЖЭТФ. 1982. Т. 36. № 11. С. 381.
Баранов А.И. // Кристаллография. 2003. Т. 48. № 6. С. 1081.
Иванов-Шиц А.К., Мурин И.В. Ионика твердого тела. В 2 т. СПб.: Изд-во СПбГУ, 2010. Т. 2.
Norby T. // Nature. 2001. V. 410. P. 877.
Fitzergerald R. // Physics Today. 2001. V. 54. P. 21.
Научный совет по аналитическим методам (НСАМ). Химико-аналитические методы. Инструкция № 3-Х. Сера. М. 1965.
Дмитричева Е.В., Макарова И.П., Гребенев В.В. и др. // Кристаллография. 2014. Т. 59. № 6. С. 966.
Swain D., Row T.N.G. // Inorgan. Chem. V. 47. № 19. P. 8613.
Nalini G., Row T.N.G. // Phase Trans. 2003. V. 76. № 11. P. 923. https://doi.org/10.1080/0141159031000155482
Mumme W.G. // Acta Cryst. B. 1973. 29. № 5. P. 1076. https://doi.org/10.1107/S0567740873003894
Makarova I.P., Grebenev V.V., Selezneva E.V. // Acta Cryst. B. 2014. V. 70. № 2. P. 218.
Selezneva E.V., Makarova I.P., Grebenev V.V. // Solid State Ionics. 2014. V. 268. P. 68.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


