Кристаллография, 2023, T. 68, № 2, стр. 262-267
Кристаллическая и молекулярная структура островного четырехъядерного комплекса диоксомолибдена (VI) [MoO2(L1)]4 (H2L1 = изоникотиноилгидразон ацетилацетона) с большими внутри- и межмолекулярными каналами
В. С. Сергиенко 1, *, В. Л. Абраменко 2, А. В. Чураков 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Луганский государственный университет им. Владимира Даля
Луганск, Россия
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 28.06.2022
После доработки 06.09.2022
Принята к публикации 08.09.2022
- EDN: BSNZIJ
- DOI: 10.31857/S0023476123020157
Аннотация
Проведены синтез и исследование строения методом рентгеноструктурного анализа сольватокомплекса [МоО2(L1)]4 диметилформамид (I). Основа структуры – лежащая на кристаллографической оси 2 четырехъядерная комплексная молекула [МоО2(L1)]4 (Ia). Каждый из двух независимых атомов молибдена имеет искаженную октаэдрическую координацию с двумя лигандами цис-О(оксо), двумя атомами N(L1) двух молекул Ia в транс-позициях к О(оксо) и двумя атомами О(L1) одной комплексной молекулы в цис-положениях к О(оксо) и в транс-позициях друг к другу. Каждый лиганд (L1)2– координирует два атома Мо тетрадентатным тридентатно-хелатным (2О, N) мостиковым (N) способом. Средние длины связей в Iа: Мо–О(оксо) 1.701, Мо–N(L1) 2.460 (м) и 2.214 (х), Мо–О(L1) 1.980 Å, валентный угол О(оксо)–МоО–(оксо) 105.6°. Упорядоченная молекула диметилформамида помещается в узком канале структуры. Сильно неупорядоченные (не локализованные) молекулы растворителей (метанол/диметилформамид/вода) заполняют широкие каналы структуры I.
ВВЕДЕНИЕ
Ацилгидразоны альдегидов и кетонов представляют интерес в координационной химии как амбидентные лигандные системы, существующие в растворах органических растворителей и в кристаллическом состоянии в виде прототропных таутомеров [1–3], что позволяет получать на их основе с кислотами Льюиса комплексы различного типа и строения [4–12].
Ранее были получены моноядерные комплексы диоксомолибдена (VI) с рядом ацилгидразонов β-дикарбонильных соединений общего состава [MoO2(L)]Solv. Их строение определено методами рентгеноструктурного анализа (РСА) и ИК-спектроскопии [13, 14]. Показано, что образование комплексов сопровождается депротонированием лигандов с замыканием пяти- и шестичленных металлоциклов. Молекулы комплексов в кристаллах объединены межмолекулярными водородными связями и образуют зигзагообразные цепочки.
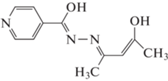
Продолжая синтез и исследование строения комплексных соединений диоксомолибдена (VI) с ацилгидразонами β-дикарбонильных соединений (H2Ln), получили в среде метанол–диметилформамид (ДМФА) (5:1) сольватированный комплекс, имеющий по данным РСА состав [MoO2(L1)]4 ДМФА (I) (H2L = изоникотиноилгидразон ацетилацетона) (схема 1). Не локализованные в процессе РСА сильно неупорядоченные молекулы растворителей (Solv) (ДМФА, метанола и, возможно, воды), вероятно, входят в структуру в неучтенном количестве. Выдерживание комплекса при 150°С в вакууме в течение 2 ч приводит к его полной десольватации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез H2L1 осуществляли конденсацией ацетилацетона и гидразида изоникотиновой кислоты в спирте [13].
Соединение I синтезировали методом лигандного обмена между ацетилацетонатом молибденила и H2L1 в спиртовой среде. К кипящему раствору 0.326 г (0.001 моль) МоО2(Асас)2 в 10 мл МеОН добавляли при перемешивании горячий раствор 0.219 г (0.001 моль) H2L1 в том же растворителе и 2 мл диметилформамида. Смесь кипятили с частичным упариванием в течение 10 мин и оставляли при комнатной температуре для кристаллизации. Из образовавшегося темно-красного раствора выпадали хорошо сформированные кристаллы I, которые отделяли на фильтре и сушили в токе аргона. При нагревании в вакууме при 150°С комплекс I десольватируется (с образованием несольватированной комплексной молекулы Ia) и плавится с разложением выше 300°С. Найдено: Мо 25.23, N 11.09, C 34.55, H 2.97 мас. %. Для десольватированного I C44H44Mo4N12O16 вычислено: Mo 25.13, N 11.01, C 34.61, Н 2.90 мас. %.
Элементный анализ проводили с помощью C,H,N-анализатора Carlo-Erba 1106. Содержание молибдена в комплексе определяли прокаливанием навески до массовой формы МоО3 [13].
РСА соединения I выполнен на монокристальном автоматическом дифрактометре Bruker D8 Venture при температуре 150 K (MoKα-излучение, графитовый монохроматор). Поправка на поглощение введена на основании измерений интенсивностей эквивалентных отражений [15]. Структура расшифрована прямым методом. Все атомы, кроме атомов водорода, уточнены полноматричным анизотропным МНК по F2 (SHELXTL [16]), в том числе одна упорядоченная молекула диметилформамида в узком канале (рис. 3). Все атомы водорода помещены в рассчитанные позиции и уточнены с использованием схемы “наездника”. В структуре имеются также широкие внутримолекулярные каналы, заполненные сильно неупорядоченными молекулами растворителей (ДМФА/метанол/вода), которые были удалены из окончательной модели уточнения с помощью процедуры SQUEEZE [17]. Установлено, что в ячейке кристалла (V = 1149.2 Å3) имеется свободное пространство (16.9% объема кристалла), разбитое на четыре области по 287 Å3 вокруг осей 2. Кристаллографические характеристики, данные эксперимента и результаты уточнения приведены в табл. 1. Структурные характеристики I депонированы в Кембриджский банк структурных данных (CCDC № 2181231).
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структуры кристалла I
| Брутто-формула | C50H58Mo4N14O18 |
|---|---|
| М | 1526.86 |
| Т, K | 150 |
| Размер кристалла, мм | 0.20 × 0.20 × 0.10 |
| Сингония, пр. гр., Z | Моноклинная, C2/c, 4 |
| a, b, c, Å | 38.710(2), 8.3739(3), 25.638(1) |
| β, град | 125.169(1) |
| V, Å3 | 6793.6(5) |
| ρвыч, г/см3 | 1.493 |
| μ, мм–1 | 0.793 |
| Дифрактометр | Bruker D8 Venture |
| Тип излучения; λ, Å | MoKα; 0.7107 |
| Тип сканирования | ω |
| F(000) | 3072 |
| θmin–θmax, град | 2.15–29.99 |
| Пределы h, k, l | –54 ≤ h ≤ 54, –11 ≤ k ≤ 11, –36 ≤ l ≤ 36 |
| Общее число отражений/Rint/число независимых отражений (I > 2σ(I)) | 36 092/0.0294/9886 |
| Количество переменных | 394 |
| R1/wR1 | 0.0431/0.0957 |
| S | 1.154 |
| Δρmin/Δρmax, э/Å3 | –0.814/1.096 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
По данным РСА основа структуры I – расположенная на кристаллографической поворотной двойной оси четырехъядерная комплексная молекула [МоО2(L1)]4 (Ia) (рис. 1). Независимая часть комплексной молекулы – [MoO2(L1)]2 – показана на рис. 2. Каждый из двух независимых атомов молибдена имеет искаженную октаэдрическую координацию с двумя лигандами цис-О(оксо), двумя атомами N(L1) двух молекул Ia в транс-позициях к О(оксо) и двумя атомами О(L1) одной комплексной молекулы в цис-положениях к О(оксо) и в транс-позициях друг к другу. Каждый лиганд (L1)2– координирует два атома Мо тетрадентатным тридентатно-хелатным {О(енол)2,N(азометин)} мостиковым [N(изоникотинил)] способом. При координации лиганда L1 c каждым из двух атомов молибдена замыкаются два сочлененных связью M–N металлоцикла: шестичленный MoOC3N и пятичленный MoN2CO. Средние длины связей в Iа: Мо–О(оксо) 1.701, Мо–N(L1) 2.338, Мо–О(L1) 1.980 Å, валентный угол О(оксо)–Мо–О(оксо) 105.6°. Сильно неупорядоченные (не локализованные в ходе РСА) молекулы растворителей (метанол/ДМФА/вода) заполняют широкие каналы в структуре I. Локализованная упорядоченная молекула ДМФА занимает узкий канал (рис. 3). Отметим неравноценность длин двух пар связей Mo–N(L1): мостиковые (м) Мо(1)–N(23A) 2.450(2) и Мо(2)–N(13) 2.469(2) Å в среднем на 0.246 Å длиннее хелатных (х) Мо(1)–N(11) 2.209(2) и Мо(2)–N(21) 2.219(2) Å. Более длинные связи Мо–N находятся в транс-положениях по отношению к более коротким связям Мо=О(оксо) 1.690(2) и 1.696(2) Å, а более короткие Мо–N – в транс-позициях по отношению к более длинным Мо=О(оксо) 1.708(2) и 1.709(2) Å. Также различаются длиной, хотя и в существенно меньшей степени, чем две пары связей Мо–N(м), Мо–N(х), две связи Мо–О(L1) в обоих полиэдрах МоО4N2 в зависимости от заместителей при атомах О(енол): Мо–О(а)(С(Ме)) (Мо(1)–О(13) 1.950(2) и Мо(2)–О(23) 1.941(2) Å) в среднем на 0.068 Å короче, чем Мо–О(б)(С(Ру) (Мо(1)–О(14) 2.013(2) и Мо(2)–О(24) 2.015(2) Å).
Рис. 3.
Упаковка структурных единиц – четырехъядерных молекул комплексов [МоО2(L1)]4 (Ia) – в кристалле I. Атомы водорода не показаны.

Аналогичным с молекулой Ia способом построены тетраядерные комплексные молекулы в структуре [МоО2(L2)]4⋅0.5МеСN (II) [18], [МоО2(L2)]4⋅ ⋅5СH2Cl2 (III) [19], [МоО2(L2)]4 (IV) [20] (комплексы II, III – в центрах инверсии, IV – на четверной оси); H2L2 = 2-оксидометоксибензальдегидизоникотингидразон, С14Н13N3O3. Лиганд (L2)2– в молекулах [МоО2(L2)]4 структур II–IV выполняет такую же, как в комплексе Ia, тетрадентатную тридентатно-хелатную (2О, N) мостиковую (N) функцию. В структурах II–IV, так же как и в Iа, неравноценны две пары связей Mo–N: мостиковые существенно длиннее хелатных. Две связи Мо–О(L1) в каждом из двух полиэдров МоО4N2 тоже различаются длиной, хотя и в значительно меньшей степени. Геометрические параметры комплексов I–IV приведены в табл. 2. Интервал средних расстояний в структуре I–IV: Mo=О(оксо) 1.686–1.703, Mo–N(Ln) 2.431–2.2.528 (м) и 2.214–2.238 (х), Мо–О(Ln) 1.909–1.945 (О(а)) и 2.005–2.014 Å (О(б)).
Таблица 2.
Средние геометрические параметры (Å) в тетраядерных комплексах соединений [MoO2(Ln)]4Solv (n = 1, 2; Solv = ДМФА, СH3OН, MeCN, CH2Cl2)
| Соединение | Мо=O(oкco) | Мо–О(Ln)цис | Мо–N(Ln)транс | Литература |
|---|---|---|---|---|
| [MoO2(L1)]4⋅xDMFA⋅yH2O (I) | 1.701 | 1.945 (фенол) 2.014 (енол) |
2.460 (м) 2.214 (х) |
Настоящая работа |
| [МоO2(L2)]4⋅0.5МеСN (II) | 1.696 | 1.932 (фенол) 2.007 (енол) |
2.528 (м) 2.237 (х) |
[18] |
| [МоO2(L2)]4⋅5CН2Cl2 (III) | 1.703 | 1.990 (фенол 2.009 (енол) |
2.439 (м) 2.237 (х) |
[19] |
| [МоO2(L2)]4 (IV) | 1.686 | 1.909 (фенол) 2.005 (енол) |
2.431 (м) 2.238 (х) |
[20] |
Известна также кристаллическая структура семи cоединений (V–XI), содержащих четырехъядерные комплексные анионы [MoO2(Ln)]$_{4}^{ - }$ (n = = 3, 4) иного строения, чем комплексы [MoO2(Ln)]4 (n = 1, 2) (I–IV). В двух соединениях (XPPh4)$_{4}^{ + }$[МоО2(L3)]4 7–mH2O ⋅ mC3OH (X = P, m = = 4 (V) и X = As, m =3 (VI) [21]), как и в пяти соединениях Кат$_{4}^{ + }$[MoO2(L4)]4 ⋅ mCH3O ⋅ nH2O [22], лиганды Ln (n = 3, 4) выполняют тетрадентатную (4О) бис(хелатно)-мостиковую (2О, 2О) функцию, замыкая по два пятичленных металлоцикла МоОС2О. Цис-диоксолиганды дополняют искаженную октаэдическую координацию атома металла МоО6. Расстояния Мо–O(Ln) в соединениях V–XI разбиваются на две группы: более короткие в цис-позициях к О(оксо) (транс друг к другу) и более длинные в транс-положениях к О(оксо). Средние длины связей в структурах V–XI: Mo=О(оксо) 1.703–1.722, Мо–О(Ln) 1.988–2.015 Å (цис к О(оксо)) и 2.000–2.206 Å (транс к О(оксо)).
Дискретные комплексные анионы [MoO2(Ln)]$_{4}^{ - }$ (n = 3, 4) в структурах V–XI, как и аналогичные комплексные молекулы в I–IV, – примерно квадратные металлоциклы [4 + 4]. Расстояния Мо…Мо близки к 12.8 Å соединений вольфрама (Vа, VIа), сходных с составом V, VI. Лиганд (L3)3––2,7-диоксо-3-оксо-3Н-ксантен-6-олат (С13Н5О5) отличается от лиганда (L4)3––2,7-диоксо-3-оксо-9-фенил-3Н-ксантен-6-олат (С19Н9О5) только замещением одного атома водорода (в позиции 9) фенильной группой. Кристаллы VII изоструктурны двум кристаллам соединений вольфрама близкого состава (VIIa, VIIb). Также изоструктурны друг другу кристаллы соединений молибдена VIII–X и близкие к ним по составу кристаллы трех комплексов вольфрама (VIIIa–Xa).
Интересно сопоставить строение и основные геометрические параметры исследованного в работе четырехъядерного соединения [MoO2(L1)]4 и одноядерного комплекса [MoO2(L1)]CH3OH, определенного при комнатной температуре (XIIа [23]) и 150 K (XIIб) [24]. Гидразоновое основание Шиффа – лиганд (L1)2– – в структуре моноядерного комплекса выполняет тридентатно-хелатную функцию (O2N), замыкая, как и в исследованном тетраядерном комплексе, два сочлененных связью Mo–N металлоцикла – шестичленный MoOC3N и пятичленный MoN2CO. Аналогичные с комплексом Ia связи металл–лиганд L1 в молекуле XII сопоставимы по длине: Mo–N 2.214 (Ia), 2.219 (XIIа), 2.216 (XIIб); Mo–О(a) 1.946, 1.959, 1.960; Mo–О(б) 2.014, 2.016, 2.009 Å. В структуре XII, как и в Ia, связи Мо–О(a) заметно короче (на 0.057, 0.049 Å в XIIа и XIIб соответственно), чем Mo–О(б).
ЗАКЛЮЧЕНИЕ
Строение одноядерного фрагмента четырехъядерной молекулы Ia сопоставимо по длинам связей металл–лиганд с моноядерной молекулой XII и отличается от последней функцией лиганда (L1)2– – тетрадентатной трис(хелатно)-мостиковой (О2N2) в [MoO2(L1)]4 и тридентатной трис(хелатно)-мостиковой (О2N) в [MoO2(L1)]. Отметим также, что замена двухзарядного лиганда – основания Шиффа L1 на L2 – не меняет строения четырехъядерной комплексной молекулы [MoO2(Ln)]4 (n = 1, 2) и основных межатомных расстояний.
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований.
Список литературы
Kargar H., Kia R., Froozandeh F. et al. // Acta Cryst. E. 2011. V. 67. P. o209. https://doi.org/org/10.1107/S160053681005275X
Kargar H., Kia R., Moghadamm M., Tahir M.N. // Acta Cryst. E. 2011. V. 67. P. o367. https://doi.org/org/10.1107/S1600536811000948
Paciorek P., Szklarzewicz J., Trzewik B. et al. // J. Org. Chem. 2021. V. 86. P. 1649. https://doi.org/10.1021/acs.joc.0c02451
Коган В.А., Зеленцов В.В., Ларин Г.М., Луков В.В. Комплексы переходных металлов с гидразонами. Физико-химические свойства и строение. М.: Наука, 1990. 112 с.
Гарновский А.Д., Васильченко И.С., Гарновский Д.А. Современные аспекты синтеза металлокомплексов. Основные лиганды и методы. Ростов-на-Дону: ЛаПО, 2000. 355 с.
Banße W., Ludwig E., Shilde U., Uhlemann E. // Z. Anorg. Allg. Chem. 1995. B. 621. № 8. S. 1275.
Nandy M., Shit S., Rizzoli C. et al. // Polyhedron. 2015. V. 88. P. 63. https://doi.org/org/10.1016/j.poly.2014.12.017
Bikas R., Darvishvand M., Kuncser V. et al. // Polyhedron. 2020. V. 190. P. 114751. https://doi.org/10.1016/j.poly.2020.114751
Hosseini-Monfared H., Bikas R., Sanchiz J. et al. // Polyhedron. 2013. V. 61. P. 45. https://doi.org/10.1016/j.poly.2013.05.033
Goorchibeygi S., Bikas R., Soleimani M. // J. Mol. Struct. 2022. V. 1250. Pt 1. P. 131774. https://doi.org/10.1016/j.molstruc.2021.131774
Бурлов А.С., Власенко В.Г., Чальцев Б.В. и др. // Координац. химия. 2021. Т. 47. № 7. С. 391. https://doi.org/10.31857/S0132344X2107001X
Hossain S.M., Lakma A., Pradhan R.N. // Dalton Trans. 2017. V. 46. № 37. P. 12612. https://doi.org/10.1039/c7dt02433a
Сергиенко В.С., Абраменко В.Л., Чураков А.В., Суражская М.Д. // Журн. неорган. химии. 2021. Т. 66. № 12. С. 1732. https://doi.org/10.31857/S0044457X21120151
Сергиенко В.С., Абраменко В.Л., Чураков А.В., Суражская М.Д. // Журн. общ. химии. 2022. Т. 92. № 6. С. 954. https://doi.org/10.31857/S0044460X22060142
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta. Cryst. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Spek A.T. // Acta Cryst. C. 2015. V. 71. P. 9.
Vrdoliak V., Mandaric M., Hrenar T. et al. // Cryst. Growth Design. 2019. V. 19. P. 3000. https://doi.org/10.1021./acs.cgd.9b00231
Vrdoliak V., Prugovecki B., Malkovic-Calogovic D. et al. // Cryst. Growth Design. 2013. V. 13. P. 3773. https://doi.org/10.1921/cg400782c
Vrdoliak V., Prugovecli B., Malkovic-Calogovic D. et al. // Cryst. Growth Design. 2010. V. 10. P.1373. https://doi.org/10.1021/cg901382h
Sutton A., Abrahams B.F., Hudson T.A., Robson R. // New. J. Chem. 2020. V. 44. P. 11437. https://doi.org/10.1039/d0nj02413a
McCormick L.J., Abrahams B.F., Boughton B.A. // Inorg. Chem. 2014. V. 53. P. 1721. https://doi.org/10.1021/ic402860r
Nandy M., Shit S., Rizzoli C. et al. // Polyhedron. 2015. V. 88. P. 63.
Сергиенко В.С., Абраменко В.Л., Чураков А.В., Суражская М.Д. // Журн. неорган. химии. 2021. Т. 66. № 12. С. 1732. https://doi.org/10.31857/S0044457X21120151
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография