Лесоведение, 2023, № 2, стр. 161-173
Пространственно-временная сопряженность многолетней динамики численности лесных насекомых-филлофагов на примере Краснотуранского бора
О. В. Тарасова a, *, П. А. Красноперова a
a Сибирский федеральный университет
660041 Красноярск, пр. Свободный, д. 76, Россия
* E-mail: olvitarasova2010@yandex.ru
Поступила в редакцию 03.06.2022
После доработки 31.08.2022
Принята к публикации 18.10.2022
- EDN: ARSUEQ
- DOI: 10.31857/S0024114823020109
Аннотация
Изучена сопряженность динамики численности различных видов лесных насекомых при неравноценных ландшафтных условиях на территории Краснотуранского бора (юг Красноярского края). Сопряженность популяционной динамики указывает на наличие экологического механизма, приводящего к согласованию временных рядов популяционной динамики различных видов в одном местообитании или одного вида в разных местообитаниях. Это означает, что по показателям сопряженности динамики насекомых можно косвенно оценить и влияние различных факторов, воздействующих на эти популяции. Для оценки пространственно-временной синхронизации динамики численности насекомых в различных ландшафтных условиях использованы данные учетов насекомых-филлофагов с 1979 по 2016 гг. Анализ данных многолетних учетов показывает, что даже на достаточно близких расстояниях характеристики динамики численности насекомых-филлофагов различаются как по абсолютным значениям, так и по фазам динамики, хотя периоды циклических колебаний филлофагов в различных урочищах близки. “Память” системы, выражающаяся в порядке авторегрессионной модели динамики численности, для изученных комплексов видов филлофагов достаточно велика: на текущее значение плотности популяций филлофагов оказывают значимое влияние плотности популяций даже за четыре года до учетов. Подобные значения “памяти” приводят к повышению запаса по устойчивости популяций и снижению рисков развития вспышек массового размножения. Близкие к 1 коэффициенты детерминации R2 для моделей динамики филлофагов в урочищах Краснотуранского бора указывают на слабое влияние модифицирующих (в частности, погодных) факторов на динамику численности популяций.
Изучение сопряженности динамики численности различных видов лесных насекомых важно при оценке влияния различных факторов на их популяционную динамику. Сопряженность популяционной динамики указывает на наличие экологического механизма, приводящего к согласованию временных рядов популяционной динамики различных видов в одном местообитании или одного вида в разных местообитаниях. Это означает, что по показателям сопряженности динамики насекомых можно косвенно оценить и влияние различных факторов, воздействующих на популяции.
Сопряженность и пространственно-временная синхронизация динамики численности изучались многими авторами в течение последних десятилетий (Henttonen et al., 1985; Miller, Epstein, 1986; Hanski, Woiwood, 1993; Haydon, Steen, 1997; Sutcliffe et al., 1997; Bascompte, Sole, 1998; Myers, 1998; Ranta et al., 1998; Bjornstad et al., 1999; Bjornstad, 2000; Liebhold, Kamata, 2000; Buonaccorsi et al., 2001; Peltonen et al., 2002; Choi et al., 2011; Kapeller et al., 2011; Haynes et al., 2012; Herrero et al., 2012; Schowalter, 2012; Van Rossum, Triest, 2012; Bone et al., 2013; Foster et al., 2013).
Показано, что степень сопряженности популяционной динамики одного вида в разных местообитаниях монотонно уменьшается с увеличением расстояния между этими местообитаниями. Если же уровень сопряженности динамики популяций не уменьшается при увеличении расстояния между местообитаниями, а расстояние между ними существенно превосходит радиус перемещения особей изучаемого вида, то следует говорить о его глобальной пространственной когерентности, связанной с реакцией популяции на воздействие мощного модифицирующего фактора (Liebhold et al., 2004).
Предполагается, что причиной синхронизации вспышек массового размножения насекомых может быть некоторый внешний фактор, воздействие которого приводит к одновременному развитию локальных вспышек. В частности, такими синхронизирующими факторами могут быть изменение активности Солнца (Чижевский, 1973), летние засухи на обширной территории (Кондаков, 1974, 2002) и др. Так как ритм солнечной активности определяет динамику воздействия солнечной радиации одновременно на всей планете, а вспышки численности различных видов насекомых все же не синхронизированы во времени и пространстве, то предполагается, что синхронизирующий фактор и есть сочетание ритма солнечной активности и локальных планетарных ритмов (Максимов, 1989). По мнению разных авторов, причиной сопряженности популяционной динамики одного вида в разных местообитаниях может быть эффект Морана, связанный с однородностью климатических условий на значительной территории и сходством реакции популяций на изменение погоды в различных местообитаниях (Moran, 1953; Чижевский, 1973; Baars, Van Dijk, 1984; Pollard, 1991; Maron, Harrison, 1997; Bjornstad et al., 1999; Volney, Fleming, 2000; Bjornstad, Bascompte, 2001; Williams, Liebhold, 1995).
Для количественной оценки сопряженности популяционной динамики отдельного вида в различных местообитаниях или нескольких видов в одном местообитании необходимы длительные (в течение нескольких десятков лет) наблюдения за данными видами насекомых на постоянных пробных площадях. К сожалению, такие полевые исследования проводятся достаточно редко, а для коротких временных рядов получить достоверные оценки сопряженности не представляется возможным (Дженкинс, Ваттс, 1971; Андерсон, 1976; Кендалл, Стьюарт, 1976; Марпл, 1990). Однако в настоящей работе для оценки пространственно-временной синхронизации динамики численности насекомых использованы данные учетов насекомых-филлофагов с 1979 по 2016 гг., что позволяет использовать стандартные статистические методы анализа временных рядов для оценки пространственной и популяционной сопряженности динамики комплекса видов лесных насекомых в близких местообитаниях.
ОБЪЕКТЫ И МЕТОДИКА
Популяционная динамика комплекса насекомых-филлофагов в различных ландшафтных структурах на территории Краснотуранского ленточного бора (юг Средней Сибири, 54°16.315′ N, 91°37.757′ E) изучалась в течение 1979–2016 гг. (Пальникова и др., 2002; Исаев и др., 2015; Isaev et al., 2017). Основная лесообразующая порода ленточного бора – сосна обыкновенная (Pinus sylvestris L.) На момент начала исследований возраст деревьев в насаждениях бора составлял 60–80 лет. Более 80% сосняков были представлены II–III классами бонитета (Пальникова и др., 2002). Местообитания в пределах Краснотуранского бора классифицировались по характеристикам ландшафта как урочища. На рис. 1 приведена пространственная структура урочищ на территории Краснотуранского бора, выполненная Д.М. Киреевым на основе оригинальной методики (Киреев, 1977). В табл. 1 приведены расстояния между пробными площадями в пределах урочищ.
Рис. 1.
Ландшафтная структура Краснотуранского бора (Пальникова и др., 2002). 1 – вершины и крутые прямые склоны сопок (“Вершина Сопки”); 2 – узкие плакоры (“Плакор”); 3 – пологие склоны; 4 – крутые склоны балок и логов (“Дюна”); 5 – вогнутые покатые и пологие склоны южной и западной экспозиций; 6 – пологонаклоненные террасовидные поверхности (“Терраса”); 7 – плоские пролювиальные днища (“Озеро”).

Таблица 1.
Расстояния (км) между пробными площадями в различных урочищах Краснотуранского бора
| Урочище | Урочище | ||||
|---|---|---|---|---|---|
| “Плакор” | “Вершина сопки” | “Дюна” | “Терраса” | “Озеро” | |
| “Плакор” | 0.00 | 1.6 | 1.2 | 1.8 | 2.9 |
| “Вершина сопки” | 0.00 | 2.3 | 2.1 | 3.8 | |
| “Дюна” | 0.00 | 1.0 | 3.9 | ||
| “Терраса” | 0.00 | 4.7 | |||
Комплекс видов насекомых-филлофагов в Краснотуранском бору типичен для сосновых лесов Сибири (Кондаков, Сорокопуд, 1982; Тарасова, 1982; Пальникова, 1987; Пальникова, 1998; Эпова, 1999; Яновский, 2003). Список изученных видов включает в себя пяденицу cосновую Bupalus piniarius L., пяденицу сосновую углокрылую Semiothisa liturata Сl. (Geometridae), cоснового шелкопряда Dendrolimus pini L. (Lasiocampidae) и два вида пилильщиков – гильпинию зеленоватую Gilpinia virens Kl. и пилильщика соснового бледноногого Microdiprion pallipes Fall. (Diprionidae).
В течение 1979–2016 гг. плотность популяций этих видов определялась в первой декаде августа методом околота на матерчатый полог. Ежегодные учеты численности филлофагов проводились в пяти типах урочищ: “Вершина сопки”, “Плакор”, “Дюны”, “Терраса”, “Озеро”. Данные учетов плотности популяций изученных видов в различных местообитаниях-рассмотрены в работе А.С. Исаева с соавторами (Исаев и др., 2015).
В табл. 2 приведены значения средних многолетних суммарной плотности (особей на дерево) популяций всех изученных видов, стандартные отклонения от средних значений, минимальные и максимальные значения плотностей и разница между максимальным и минимальным значениями плотностей в различных урочищах.
Таблица 2.
Значения статистических характеристик временных рядов динамики суммарной численности филлофагов в различных урочищах
| Статистические характеристики, особи/дерево–1 | Урочище | ||||
|---|---|---|---|---|---|
| “Плакор” | “Вершина сопки” | “Озеро” | “Дюна” | “Терраса” | |
| Среднее | 1.07 | 1.21 | 0.91 | 2.20 | 0.85 |
| Стандартное отклонение | 1.52 | 2.01 | 1.31 | 3.47 | 1.24 |
| Максимальное | 5.87 | 11.16 | 6.80 | 13.78 | 6.56 |
| Минимальное | 0.01 | 0.00 | 0.01 | 0.04 | 0.02 |
| Размах колебаний (макс–мин) | 5.86 | 11.16 | 6.79 | 13.74 | 6.54 |
Как видно из табл. 2, суммарная плотность популяций изученных видов филлофагов во всех местообитаниях в течение всего времени исследований была низка и не превышала 2.5 особей на дерево. Тем не менее такая низкая плотность филлофагов наблюдалась не всегда, и в 1976–1978 гг. на территории Краснотуранского бора в районе урочища “Плакор” происходила вспышка массового размножения сосновой пяденицы, в ходе которой были повреждены значительные массивы сосны обыкновенной (Пальникова и др., 2002). Далее в работе изучены сопряженные пространственно-временные характеристики рядов суммарных плотностей популяций исследуемых насекомых. Анализ рядов динамики отдельных видов был опубликован ранее (Soukhovolsky et al., 2022).
Расчет модельной динамики суммарных плотностей популяций филлофагов в урочищах
Расчет популяционной динамики насекомых-филлофагов выполнялся по следующей схеме:
– ряд динамики “ремонтировался”, и нулевые значения плотностей популяций заменялись значениями, в два раза меньшими минимальных значений плотности насекомых;
– для уменьшения разброса данных производился переход к логарифмической шкале (именно для этого выполнялась замена нулевых значений плотности);
– для уменьшения ошибок учетов численности насекомых производилась фильтрация высокочастотной составляющей ряда с использование фильтра Ганна (Хемминг, 1987):
(1)
$\begin{gathered} y(i) = 0.24\ln x(i - 1) + 0.52\ln x(i) + \\ + \,\,0.24\ln x(i + 1); \\ \end{gathered} $– для определения порядка k авторегрессии вычислялась парциальная автокорреляционная функция ПАКФ (Дженкинс, Ваттс, 1971). Значение порядка авторегрессии характеризуется максимальным значением ПАКФ, большим значений доверительного интервала ПАКФ;
– модель (2) рассматривалась как регрессионное уравнение с известными из данных учетов значениями {y(i)}, и стандартными методами находили неизвестные коэффициенты a0, …., ak;
– точность расчетов модельного уравнения динамики численности насекомых в урочище оценивалась по величине коэффициента детерминации R2, характеризующего долю дисперсии значений логарифмов численности насекомых, рассчитываемую AR-моделью, значимостью коэффициентов AR-модели, оцениваемую по t-критерию и F-критерию Фишера (Поллард, 1982);
– синхронность временного ряда трансформированных данных и модельного ряда оценивалась по величине кросс-корреляционной функции (ККФ) (Дженкинс, Ваттс, 1971). Для синхронных временных рядов максимальное значение ККФ (k = 0) близко к 1;
– цикличность колебаний временных рядов трансформированных данных оценивалась по спектру временного ряда (Бокс, Дженкинс, 1974; Кендалл, Стьюарт, 1976; Марпл, 1990);
– стабильность временного ряда суммарной динамики численности для данного урочища оценивалась по запасу устойчивости, вычисляемому по значениям коэффициентов a1, …, ak модели (2) для этого урочища (Гайдук и др., 2011). Чем больше значение запаса по устойчивости, тем выше устойчивость ряда динамики.
Расчеты выполнялись для всех временных рядов суммарных численностей насекомых в урочищах.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рассмотрим полный цикл расчетов для временного ряда динамики суммарной численности насекомых в урочище “Дюна”.
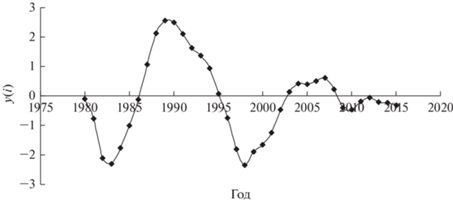
На рис. 2 приведена кривая популяционной динамики филлофагов в урочище “Дюна” после логарифмирования и высокочастотной фильтрации.
Рис. 2.
Динамика численности филлофагов в урочище “Дюна” после логарифмирования и высокочастотной фильтрации.
На следующем этапе расчетов определялся порядок k авторегрессии по виду ПАКФ (рис. 3).
Рис. 3.
Парциальная автокорреляционная функция временного ряда численности насекомых в урочище “Дюна”. 1 – ПАКФ; 2 – доверительный интервал стандартной ошибки ПАКФ.
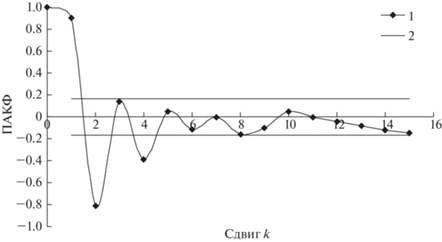
Как видно из рис. 3, порядок авторегрессии для анализируемого ряда равен 4. Это означает, что текущее значение трансформированного ряда зависит от четырех предыдущих значений и AR-модель можно записать в следующем виде:
(3)
$\begin{gathered} y(i) = {{a}_{0}} + {{a}_{1}}y(i - 1) + {{a}_{2}}y(i - 2) + \\ + \,\,{{a}_{3}}y(i - 3) + {{a}_{4}}y(i - 4). \\ \end{gathered} $Расчеты коэффициентов уравнения (3) производились с помощью статистического пакета Statistica 10. Результаты расчетов представлены в табл. 3.
Таблица 3.
Параметры AR-моделей рядов динамики филлофагов в различных урочищах Краснотуранского бора
| B | Std.Err. | t(26) | p-value | |
|---|---|---|---|---|
| “Дюна” | ||||
| a0 | 0.006 | 0.044 | 0.131 | 0.897 |
| y(i – 4) | –0.346 | 0.134 | –2.585 | 0.015 |
| y(i – 3) | 0.718 | 0.269 | 2.673 | 0.013 |
| y(i – 2) | –1.372 | 0.292 | –4.694 | 0.000 |
| y(i – 1) | 1.790 | 0.162 | 11.045 | 0.000 |
| adjR2 | 0.96 | |||
| F | 200.5 | |||
| η | 0.046 | |||
| “Плакор” | ||||
| a0 | –0.243 | 0.071 | –3.445 | 0.002 |
| y(i – 4) | –0.575 | 0.139 | –4.139 | 0.000 |
| y(i – 3) | 0.915 | 0.269 | 3.406 | 0.002 |
| y(i – 2) | –1.155 | 0.270 | –4.278 | 0.000 |
| y(i – 1) | 1.437 | 0.150 | 9.556 | 0.000 |
| adjR2 | 0.95 | |||
| F | 138.6 | |||
| η | 0.109 | |||
| “Вершина сопки” | ||||
| a0 | –0.180 | 0.076 | –2.384 | 0.024 |
| y(i – 4) | –0.591 | 0.141 | –4.207 | 0.000 |
| y(i – 3) | 1.177 | 0.277 | 4.246 | 0.000 |
| y(i – 2) | –1.637 | 0.283 | –5.775 | 0.000 |
| y(i – 1) | 1.753 | 0.150 | 11.653 | 0.000 |
| adjR2 | 0.94 | |||
| F | 112.3 | |||
| η | 0.07 | |||
| “Озеро” | ||||
| a0 | –0.270 | 0.122 | –2.215 | 0.035 |
| y(i – 2) | –1.325 | 0.336 | –3.944 | 0.001 |
| y(i – 1) | 1.685 | 0.184 | 9.156 | 0.000 |
| adjR2 | 0.905 | |||
| F | 75.3 | |||
| η | 0.111 | |||
| “Терраса” | ||||
| a0 | –0.146 | 0.073 | –1.994 | 0.056 |
| y(i – 4) | –0.291 | 0.121 | –2.410 | 0.023 |
| y(i – 3) | 0.936 | 0.264 | 3.550 | 0.001 |
| y(i – 2) | –1.808 | 0.306 | –5.903 | 0.000 |
| y(i – 1) | 1.979 | 0.171 | 11.544 | 0.000 |
| adjR2 | 0.94 | |||
| F | 120.0 | |||
| η | 0.102 | |||
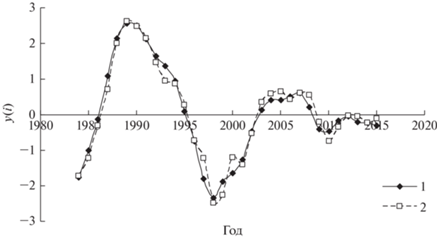
На рис. 4 сопоставлен трансформированный временной ряд общей плотности популяций филлофагов в урочище “Дюна” и модельный ряд, значения коэффициентов которого представлены в табл. 3.
Рис. 4.
Трансформированный временной ряд общей плотности популяций филлофагов в урочище “Дюна” (1) и модельный ряд (2).
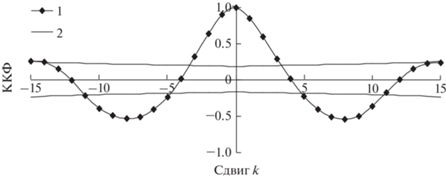
Как следует из табл. 3, предложенная модель позволяет учесть 96% дисперсии значений плотностей популяций в урочище “Дюна”. Для количественной оценки сопряженности временного ряда учетов и модельного ряда применялась кросс-корреляционная функция (ККФ). Для расчета кросс-корреляционной функции ${{\rho }_{{xy}}}(k)$ двух стационарных временных рядов {x} и {y} со средними значениями μх и μy и стандартными отклонениями σx и σy использовалось следующее выражение (Бокс, Дженкинс, 1974):
(4)
${{\rho }_{{xy}}}(k) = \frac{{E\left| {(x(t - k) - {{\mu }_{x}})(y(t) - {{\mu }_{y}})} \right|}}{{{{\sigma }_{x}}{{\sigma }_{y}}}},$Если сравниваемые временные ряды синхронны, то в этом случае максимумы и минимумы совпадают во времени; максимум взаимной корреляционной функции наблюдается при временном сдвиге k = 0 между рядами, и значение ρxy(0) → 1. Для рядов со сдвигом k по фазе максимум взаимной корреляционной функции и значение ρxy(k) → 1. Для несопряженных рядов ρxy(k) → 0 при любых значениях k.
Как показывает расчет кросс-корреляционной функции (ККФ), ряд данных и модельный ряд для урочища “Дюна” изменяются во времени синхронно (рис. 5).
Аналогично тому, как это было рассчитано для урочища “Дюна”, были выполнены расчеты и для других урочищ на территории Краснотуранского бора (табл. 3). Как следует из табл. 3, для всех популяций почти во всех урочищах (кроме урочища “Озеро”) характерны модели AR (4), согласно которым текущая плотность филлофагов зависит от плотностей популяций в предыдущие четыре года, а соответствующие коэффициенты этих моделей совпадают по знакам и близки по абсолютным значениям. Значения коэффициента аj в AR-модели характеризует восприимчивость текущей плотности популяции к изменениям плотностей в год (i – j): ${{a}_{j}} = \frac{{\partial y(i)}}{{\partial y(i - j)}}.$ Положительные значения коэффициентов AR-моделей можно трактовать как наличие положительных обратных связей между популяциями в разные годы. Так как все изученные виды характеризовались однолетним циклом генерации, то положительный коэффициент а1 описывает зависимость плотностей потомков от плотностей родительской популяции. Отрицательное значение коэффициента а2 можно трактовать как существования отрицательной обратной связи между популяциями в i-ом и (i – 2)-м годами. В качестве причины обратной связи можно говорить о влиянии паразитов, отрицательно воздействующих с лагом 2 года на изучаемые популяции. Ранее было показано, что влияние паразитов на изучаемые виды филлофагов достаточно сильно (Пальникова и др., 2002; Пальникова, Суховольский, 2016).
Для популяций филлофагов в Краснотуранском бору характерно наличие циклических колебаний численности, что подтверждается расчетами спектров плотностей популяций во всех урочищах бора (рис. 6).
Рис. 6.
Спектры временных рядов плотностей популяций филлофагов в различных урочищах Краснотуранского бора (1 – “Плакор”, 2 – “Вершина сопки”, 3 – “Озеро”, 4 – “Дюна”, 5 – “Терраса”).
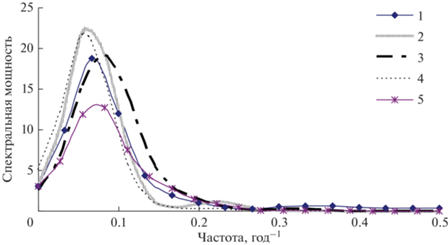
Как видно из рис. 6, периоды колебаний плотностей популяций (максимумы спектральной мощности) во всех урочищах близки (от 12 до 16 лет). Собственно говоря, циклические колебания с подобной периодичностью обычно наблюдаются для видов, дающих вспышки массового размножения (Исаев и др., 2001), однако плотность филлофагов в изученном местообитании за все время наблюдений была, как это следует из табл. 2, низка. Что может быть причиной таких колебаний: влияние модифицирующих факторов (погодных условий либо изменений солнечной активности (Чижевский, 1973)) или же регулирующих факторов? В качестве объяснения наблюдаемых колебаний можно указать, что для авторегрессионных рядов в общем случае характерны циклические колебания с характерными частотами, определяемыми коэффициентами авторегрессионных уравнений (Андерсон, 1976). Так как из табл. 3 видно, что коэффициенты AR-моделей насекомых во всех урочищах близки по значениям, это и приводит к близости значений циклических колебаний.
Коэффициенты детерминации для AR-моделей всех урочищ очень близки к 1, что указывает на следующее: предложенные AR-модели позволяют учитывать практически всю дисперсию наблюдаемых значений численности популяций. Из этого следует, что погодные факторы (по крайней мере, при низкой плотности популяций) не будут оказывать сильного влияния на динамику численности филлофагов.
В классической работе Морана (Moran, 1953) утверждается, что для близких по расположению местообитаний одного вида должны наблюдаться синхронные изменения плотностей популяций этого вида. Для оценки синхронности динамики популяций в разных урочищах были вычислены кросс-корреляционные функции (ККФ) временных рядов динамики филлофагов в разных урочищах. Для синхронных по динамике популяций максимум ККФ, близкий к 1, должен достигаться при сдвиге k = 0. Если ряды динамики сдвинуты по фазе, максимум ККФ будет достигаться при k ≠ 0. Расчеты парных ККФ для всех урочищ приведены в табл. 4, где выше главной диагонали рассмотрены максимальные значения ККФ(i, j) между рядами динамики урочищ m и l, а ниже главной диагонали – сдвиг во времени (в годах) между рядами динамики численности.
Таблица 4.
Синхронизация временной динамики численности филлофагов в различных урочищах
| Урочище | Урочище | ||||
|---|---|---|---|---|---|
| “Плакор” | “Вершина сопки” | “Озеро” | “Дюна” | “Терраса” | |
| “Плакор” | 1 | 0.831 | 0.747 | 0.823 | 0.857 |
| “Вершина сопки” | 0 | 1 | 0.865 | 0.937 | 0.787 |
| “Озеро” | –1 | 0 | 1 | 0.745 | 0.693 |
| “Дюна” | 0 | 0 | 0 | 1 | 0.770 |
| “Терраса” | –1 | –1 | 0 | –1 | 1 |
Как видно из данных табл. 4, для филлофагов в Краснотуранском бору полной синхронности динамики численности насекомых во всех урочищах бора не наблюдается. Возможно, эта десинхронизация динамики и привела к тому, что вспышка массового размножения мажоритарного вида в комплексе филлофагов – сосновой пяденицы в урочище “Плакор” не привела к возникновению очагов вспышки во всех урочищах. С другой стороны, если подобные эффекты десинхронизации характерны не только для изученных видов филлофагов в пределах достаточно ограниченной территории, но носят общий характер, то при проведении учетов численности насекомых-вредителей нельзя быть уверенным, что данные по плотности учитываемого вида на некоторой пробной площади могут давать информацию о плотностях популяций насекомых даже на достаточно близких расстояниях от пробной площади, на которой проводились расчеты.
Важным фактором динамики численности филлофагов в расположенных достаточно близко друг к другу урочищах Краснотуранского бора могут стать миграционные процессы. Если миграция существует, то текущая численность популяций филлофагов может зависеть не только от плотностей популяций в предыдущие годы, но и от плотности популяций в соседнем урочище в предыдущий год. Тогда для оценки влияния миграционных процессов в m-ом урочище следует рассмотреть AR-модель, в которую включена численность насекомых yl(i – 1) в урочище s:
(5)
$\begin{gathered} {{y}_{m}}(i) = {{a}_{{m0}}} + {{a}_{{m1}}}{{y}_{m}}(i - 1) + {{a}_{{2m}}}{{y}_{m}}(i - 2) + \\ + \,\,{{a}_{{3m}}}{{y}_{m}}(i - 3) + {{a}_{{4m}}}{{y}_{m}}(i - 4) + {{b}_{{1s}}}{{y}_{s}}(i - 1), \\ \end{gathered} $Расчеты по возможному влиянию на динамику численности филлофагов в урочище миграции из соседнего урочища были проведены для соседних урочищ “Дюна” и “Плакор”. В табл. 5 приведены расчеты коэффициентов уравнений (5) для этих урочищ.
Таблица 5.
Параметры уравнений (5) для динамики численностей филлофагов в урочище “Плакор” с учетом данных численностей популяций yD(i –1) в урочище “Дюна” и в урочище “Дюна” с учетом данных численностей популяций yР(i – 1) в урочище “Плакор”
| Переменные | Коэффи-циенты | Std.Err. | t(25) | p-value |
|---|---|---|---|---|
| “Плакор” | ||||
| a0 | –0.302 | 0.085 | –3.556 | 0.0015 |
| yD(i – 1) | 0.092 | 0.075 | 1.212 | 0.239 |
| y(i – 4) | –0.564 | 0.138 | –4.092 | 0.00039 |
| y(i – 3) | 0.873 | 0.268 | 3.253 | 0.00326 |
| y(i – 2) | –1.139 | 0.268 | –4.250 | 0.00026 |
| y(i – 1) | 1.379 | 0.156 | 8.822 | 0.000000 |
| adjR2 | 0.95 | |||
| F | 113.2 | |||
| “Дюна” | ||||
| a0 | –0.002 | 0.065 | –0.033 | 0.973 |
| yР(i – 1) | –0.010 | 0.061 | –0.170 | 0.866 |
| y(i – 4) | –0.356 | 0.148 | –2.408 | 0.023 |
| y(i – 3) | 0.726 | 0.277 | 2.616 | 0.015 |
| y(i – 2) | –1.369 | 0.298 | –4.590 | 0.0001 |
| y(i – 1) | 1.795 | 0.167 | 10.732 | 0.000000 |
| adjR2 | 0.96 | |||
| F | 154.6 | |||
Как видно из табл. 5, коэффициенты при переменной yD(i – 1) в модели динамики филлофаов в урочище “Плакор” и коэффициенты при переменной yР(i – 1) в модели динамики филлофаов в урочище “Дюна” незначимы при р = 0.05, а коэффициенты восприимчивости при переменных, характеризующих смежные урочища, отрицательны, хотя при наличии миграции из соседнего урочища они должны быть положительными. Следовательно, гипотезу о влиянии миграции из соседних урочищ на плотность популяций филлофагов в урочище следует отвергнуть. Таким образом, популяции филлофагов в отдельных урочищах следует рассматривать как независимо развивающиеся и пространственная корреляция между популяциями на территории Краснотуранского бора не проявляется.
Как видно из табл. 2, стандартное отклонение и максимумы значений плотностей популяций во всех урочищах Краснотуранского бора невелики и за все годы исследований не достигают значений, характерных для вспышек массового размножения, в частности, для вспышек массового размножения сосновой пяденицы (Пальникова и др., 2002). В связи с этим возникает вопрос о механизмах поддержания популяций филлофагов в стабильно-разреженном состоянии. С точки зрения теории автоматического управления поддержание стабильного состояния любой системы (в том числе и системы насекомых в лесу) связано с влиянием обратных связей (Дорф, Бишоп, 2004; Ким, 2007). При наличии сильных и быстрых отрицательных обратных связей система стремительно возвращается в норму после воздействия. Напротив, сильные и быстрые положительные обратные связи ведут к значительным отклонениям от нормы. При наличии как отрицательных, так и положительных обратных связей, как это характерно для насекомых в Краснотуранском бору, ситуация становится неясной и для оценки устойчивости системы необходимы комплексные показатели, учитывающие влияние как отрицательных, так и положительных обратных связей. В теории автоматического управления таким комплексным показателем является запас по устойчивости η (Гайдук и др., 2011). Чем больше запас по устойчивости системы, тем меньше вероятность “выбросов” ее характеристик (в данном случае подъемов и спадов численности в ходе массового размножения насекомых). Запас по устойчивости вычисляется по значениям коэффициентов AR-модели, характеризующих как положительные, так и отрицательные обратные связи (Гайдук, 2011). Значения запаса по устойчивости η для насекомых в каждом урочище приведены в табл. 3. Связь между величинами запаса по устойчивости и стандартного отклонения плотностей популяций в каждом урочище приведена на рис. 7.
Рис. 7.
Связь между размахом колебаний delta x многолетней динамики численности насекомых-филлофагов (см. табл. 2) и запасом по устойчивости η модельного ряда динамики популяций насекомых в урочище.
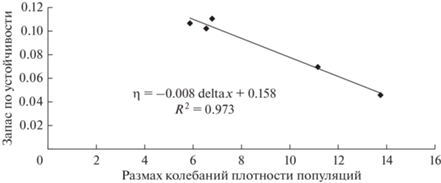
Как видно из рис. 7, между величинами delta x и η существует отрицательная линейная связь с очень высоким коэффициентом детерминации R2 = 0.973. Таким образом, коэффициенты AR‑модели, по которым вычисляется запас по устойчивости, определяют размах колебаний плотностей популяций. Чем больше размах колебаний плотности популяций, тем меньше запас по устойчивости, то есть величина запаса по устойчивости характеризует разброс величин плотности популяций в урочище. При увеличении размаха колебаний плотностей популяций на единицы запас по устойчивости снижается на 0.008, т.е. $\frac{{\partial \eta }}{{\partial {\text{(delta }}x{\text{)}}}} = - 0.008.$
ЗАКЛЮЧЕНИЕ
Анализ данных многолетних учетов показывает, что даже на достаточно близких расстояниях характеристики динамики численности насекомых-филлофагов различаются как по абсолютным значениям, так и по фазам динамики, хотя периоды L циклических колебаний филлофагов в различных урочищах близки. “Память” системы, выражающаяся в порядке авторегрессии для изученных комплексов видов филлофагов, достаточно велика: на текущее значение плотности популяций филлофагов указывает значимое влияние плотности популяций даже за четыре года до учетов. Подобные значения “памяти” приводят к повышению запаса по устойчивости популяций и снижению рисков развития вспышек массового размножения. Сравнение параметров порядка авторегрессий насекомых-филлофагов в Краснотуранском бору (k = 4) с параметрами порядка авторегрессий непарного и сибирского шелкопрядов (k = 2) показывает, что риски вспышек массового размножения выше для видов с малыми значениями параметров авторегрессии. Кроме того, близкие к 1 коэффициенты детерминации R2 для моделей динамики филлофагов в урочищах Краснотуранского бора указывают на слабое влияние модифицирующих (в частности, погодных) факторов на динамику численности популяций.
Список литературы
Андерсон Т. Статистический анализ временных рядов. М.: Мир, 1976. 755 с.
Бокс Дж., Дженкинс Г. Анализ временных рядов. Прогноз и управление. М.: Мир, 1974. Вып.1. 406 с.
Гайдук А.Р., Беляев В.Е., Пьявченко Т.А. Теория автоматического управления в примерах и задачах. СПб.: Лань, 2011. 464 с.
Дженкинс Г., Ваттс Д. Спектральный анализ и его приложения. М.: Мир, 1971. Вып. 1. 316 с.; Вып. 2. 287 с.
Дорф Р.К., Бишоп P.X. Современные системы управления. М.: Лаборатория базовых знаний, 2004. 832 с.
Исаев А.С., Хлебопрос Р.Г., Кондаков Ю.П., Недорезов Л.В., Киселев В.В., Суховольский В.Г. Популяционная динамика лесных насекомых М.: Наука, 2001. 374 с.
Исаев А.С., Пальникова Е.Н., Суховольский В.Г., Тарасова О.В. Динамика численности лесных насекомых-филлофагов: модели и прогнозы. М.: Товарищество научных изданий КМК, 2015. 276 с.
Кендалл М.Дж., Стьюарт А. Многомерный статистический анализ и временные ряды. М.: Наука, 1976. 736 с.
Ким Д.П. Теория автоматического управления. М.: Физматлит, 2007. Т. 1. 312 с.
Киреев Д.М. Методы изучения лесов по аэроснимкам. Новосибирск: Наука. Сибирское отделение, 1977. 213 с.
Кондаков Ю.П. Закономерности массовых размножений сибирского шелкопряда // Экология популяций лесных животных Сибири. Новосибирск: Наука, 1974. С. 206–265.
Кондаков Ю.П. Массовые размножения сибирского шелкопряда в лесах Красноярского края // Энтомологические исследования в Сибири. Вып. 2. Красноярск: КФ РЭО, 2002. С. 25–74.
Кондаков Ю.П., Сорокопуд Е.Н. Сосновая пяденица в ленточных борах Минусинской котловины // Насекомые лесостепных боров Сибири. Новосибирск: Наука, 1982. С. 34–56.
Максимов А.А. Природные циклы: Причины повторяемости экологических процессов. Л.: Наука, 1989. 236 с.
Марпл С.Л. Цифровой спектральный анализ и его приложения. М.: Мир, 1990. 584 с.
Пальникова Е.Н. Ландшафтно-экологические особенности очагов массового размножения сосновой пяденицы в борах юга Сибири // Экологическая оценка местообитаний лесных животных. Новосибирск: Наука, 1987. С. 96–106.
Пальникова Е.Н. Факторы динамики численности сосновой пяденицы // Лесоведение. 1998. № 4. С. 3–10.
Пальникова Е.Н., Свидерская И.В., Суховольский В.Г. Сосновая пяденица в лесах Сибири. Новосибирск: Наука, 2002. 252 с.
Пальникова Е.Н., Суховольский В.Г. Взаимодействие “фитофаг – энтомофаг” на разных фазах массового размножения лесных насекомых // Лесоведение. 2016. № 1. С. 15–24.
Поллард Дж. Справочник по вычислительным методами статистики. М.: Финансы и статистика, 1982. 344 с.
Тарасова О.В. Ландшафтно-экологическая специфика вредной лесной энтомофауны Минусинских ленточных боров // Насекомые лесостепных боров Сибири. Новосибирск: Наука, 1982. С. 18–34.
Хемминг Р.В. Цифровые фильтры. М.: Недра, 1987. 221 с.
Чижевский А.Л. Земное эхо солнечных бурь. М.: Мысль, 1973. 349 с.
Эпова В.И. Конспект фауны хвоегрызущих насекомых Байкальской Сибири. Новосибирск: Наука, 1999. 96 с.
Яновский В.М. Лесопатологическое районирование южной части Приенисейской Сибири. Красноярск: Институт леса им. В.Н.Сукачева СО РАН, 2003. 69 с.
Baars M.A., Van Dijk T.S. Population dynamics of two carabid beetles at a Dutch heatland // J. Animal Ecology. 1984. V. 53. P. 375–388.
Bascompte J., Sole R.V. Spatiotemporal patterns in nature // Trends in Ecology and Evolution. 1998. V. 13. P. 173-174.
Bjornstad O.N. Cycles and synchrony: two historical “experiments” and one experience // J. Animal Ecology. 2000. V. 69. P. 869–873.
Bjornstad O.N., Bascompte J. Synchrony and second order spatial correlation in host–parasitoid system // J. Animal Ecology. 2001. V. 70. P. 924–933.
Bjørnstad O.N., Ims R.A., Lambin X. Spatial population dynamics: analyzing patterns and processes of population synchrony // Trends in Ecology and Evolution. 1999. V. 14. № 11. P. 427–431.
Bone C., Wulder M.A., White J.C., Robertson C., Nelson T.A. A GIS-based risk rating of forest insect outbreaks using aerial overview surveys and the local Moran’s I statistic // Applied Geography. 2013. V. 40. P. 161–170.
Buonaccorsi J.P., Elkington J.S., Evans S.R., Liebhold A. Measuring and testing for spatial synchrony // Ecology. 2001. V. 82. P. 1668–1679.
Choi W.I., Ryoo M.I., Chung Y.-J., Park Y.-S. Geographical variation in the population dynamics of Thecodiplosis japonensis: causes and effects on spatial synchrony // Population Ecology. 2011. V. 53. № 3. P. 429–439.
Curran L.M., Webb C.O. Experimental test of the spatiotemporal scale of seeds predation in mast-fruiting Dipterocarpaceae // Ecological Monographs. 2000. V. 70. № 1. P. 129–148.
Foster J.R., Townsend P.A., Mladenoff D.J. Spatial dynamics of a gypsy moth defoliation outbreak and dependence on habitat characteristics // Landscape Ecology. 2013. V. 28. № 7. P. 1307–1320.
Hanski I., Woiwood I.P. Spatial synchrony in the dynamics of moth and aphid populations // J. Animal Ecology. 1993. V. 62. P. 656–668.
Haydon D., Steen H. The effect of large- and small-scale random events on the synchrony of metapopulation dynamics: a theoretical analysis // Proceedings of the Royal Society of London Series B-Biological Sciences. 1997. V. 264. P. 1375–1381.
Haynes K.J., Liebhold A.M., Johnson D.M. Elevational gradient in the cyclicity of a forest-defoliating insect // Population Ecology. 2012. V. 54. № 2. P. 239–250.
Henttonen H., McGuire D., Hansson L. Comparisons of amplitude and frequencies (spectral analyses) of density variations in long-term data sets of Clethrionomys species // Annales Zoologici Fennici. 1985. V. 22. P. 221–229.
Herrero A., Zamora R., Castro J., Hodar J.A. Limits of pine forest distribution at the treeline: herbivory matters // Plant Ecology. 2012. V. 213. № 3. P. 459–469.
Isaev A.S, Soukhovolsky V.G., Tarasova O.V., Palnikova E.N., Kovalev A.V. Forest Insect Population Dynamics, Outbreaks, and Global Warming Effects. N.Y.: Wiley, 2017. 298 p.
Kapeller S., Schroeder H., Schueler S. Modelling the spatial population dynamics of the green oak leaf roller (Tortrix viridana) using density dependent competitive interactions: Effects of herbivore mortality and varying host-plant quality // Ecological Modelling. 2011. V. 222. № 7. P. 1293–1302.
Liebhold A., Kamata N. Are population cycles and spatial synchrony universal characteristics of forest insect population? // Population Ecology. 2000. V. 42. P. 205–209.
Liebhold A., Koenig W., Bjornstad O.N. Spatial Synchrony in population dynamics // Annual Review of Ecology, Evolution, and Systematics. 2004. V. 35. P. 467–490.
Maron J.L., Harrison S. Spatial patterns formation in an insect host-parasitoid system // Science. 1997. V. 278. P. 1619–1621.
Miller W.E., Epstein M.E. Synchronous population fluctuations among moth species (Lepidiptera) // Environmental Entomology. 1986. V. 15. P. 443–447.
Moran P.A.P. The statistical analysis of the Canadian lynx cycle. II. Synchronization and meteorology // Australian J. Zoology. 1953. V. 1. P. 291–298.
Myers J.H. Synchrony in outbreaks of forest Lepidoptera: a possible example of the Moran effect // Ecology. 1998. V. 79. № 3. P. 1111–1117.
Peltonen V., Liebhold A., Bjornstad O.N., Williams D.W. Variation in spatial synchrony among forest insect species: roles of regional stochasticity and dispersal // Ecology. 2002. V. 83. P. 3120–3129.
Pollard E. Synchrony of population fluctuations: the dominant influence of widespread factors on local butterfly population // Oikos. 1991. V. 60. P. 7–10.
Ranta E., Kaitala V., Lundberg P. Population variability in space and time: the dynamics of synchronous populations // Oikos. 1998. V. 83. № 2. P. 376–382.
Schowalter T.D. Insect Responses to Major Landscape-Level Disturbance // Annual Review of Entomology. 2012. V. 57. P. 1-20.
Soukhovolsky V., Ovchinnikova T., Tarasova O., Ivanova Y., Kovalev A. Regulatory Processes in Populations of Forest Insects (a Case Study of Insect Species Damaging the Pine Pinus sylvestris L. in Forests of SIBERIA) // Diversity. 2022. V. 14 (10). P. 1038. https://doi.org/10.3390/d14121038
Sutcliffe O.L., Thomas C.D., Yates T.J., Greatorex-Devies J.N. Correlation extinctions, colonisations and population fluctuations in a highly connected ringlet butterfly metapopulation // Oecologia. 1997. V. 109. P. 235–241.
Van Rossum F., Triest L. Stepping-stone populations in linear landscape elements increase pollen dispersal between urban forest fragments // Plant Ecology and Evolution. 2012. V. 145. № 3. P.332-340.
Volney W.J.A., Fleming R.A. Climate change and impacts of boreal forest insects // Agriculture, Ecosystems and Environment. 2000. V. 82. P. 283–294.
Williams D.W., Liebhold A. Influence of weather on synchrony of gypsy moth (Lepidoptera: Lymantridae) outbreaks in New England // Environmental Entomology. 1995. V. 24. P. 987–995.
Дополнительные материалы отсутствуют.