Молекулярная биология, 2020, T. 54, № 4, стр. 653-666
In vitro и in silico определение взаимодействия артемизинина с сывороточным альбумином человекa
С. В. Гиносян a, *, О. В. Грабский a, С. Г. Тирацуян a, b
a Институт биомедицины и фармации Российско-Армянского университета
0051 Ереван, Армения
b Факультет биологии Ереванского государственного университета
0025 Ереван, Армения
* E-mail: siranush.ginosian@student.rau.am
Поступила в редакцию 05.12.2019
После доработки 13.02.2020
Принята к публикации 14.02.2020
Аннотация
Артемизинины ‒ вторичные метаболиты лекарственного растения Artemisia annua – обладают противовоспалительными, антиканцерогенными, иммуномодулирующими, антимикробными и другими свойствами. Однако фармакокинетика, фармакодинамика, точные молекулярные мишени артемизинина недостаточно известны. Изучено как in vitro, так и in silico взаимодействие артемизинина с сывороточным альбумином человека и проведено сравнение с дексаметазоном. Тушение флуоресцентной эмиссии сывороточного альбумина человека артемизинином при различных температурах происходило по одному механизму и указывало на статическую природу, что сходно с эффектом дексаметазона. Артемизинин и дексаметазон взаимодействуют с сайтом I связывания с лекарствами сывороточного альбумина человека. Нами впервые показано образование водородной связи с Arg218, который играет решающую роль в связывании лекарств с сайтом I. Дексаметазон образует водородные связи с боковой цепью Arg218 и Arg222 и основной цепью Val343. Аминокислоты субдоменов IIA и IIIA сывороточного альбумина человека совпадают для обоих соединений. Исследования электрофоретической подвижности ДНК клеток саркомы S-180 показывают, что артемизинин не взаимодействует непосредственно с ДНК. Итак, мы предполагаем, что сывороточный альбумин человека ‒ один из основных транспортеров артемизинина. При этом параметры взаимодействия артемизинина с сывороточным альбумином человека совпадают с таковыми для дексаметазона.
ВВЕДЕНИЕ
Артемизинин (АРТ) и его производные [1] принадлежат семейству сесквитерпеновых триоксановых лактонов и представляют собой вторичные метаболиты лекарственного растения Artemisia annua, которое традиционно используют в китайской медицине. АРТ обладает мощным противомалярийным, противовирусным, противогрибковым, противоопухолевым и др. действием [2, 3]. Он (C15H22O5) [4] содержит эндопероксидный мостик, необходимый для проявления его биологической активности (С-кольцо) [5], такой как антиоксидантная, противовоспалительная, иммуномодулирующая, антимикробная, антигельминтная и др. [6–10]. АРТ и его производные оказывают устойчивое ингибирующее действие на грибы; проявляют цитотоксическую активность in vitro и in vivo против раковых клеток [11]. В настоящее время АРТ рассматривают в качестве потенциальной альтернативы в лечении быстро прогрессирующих и высокоагрессивных форм рака без риска развития резистентности [12], а также в качестве сильнодействующих нейропротекторов [13].
АРТ обладают антибактериальными свойствами в отношении различных видов бактерий, в частности могут усиливать действие антибиотика метициллина в отношении резистентного золотистого стафилококка и бета-лактамов в отношении кишечной палочки [14, 15]. Одним из возможных вариантов противомалярийной активности может быть накопление и высвобождение свободных радикалов в результате разрушения эндопероксидного мостика внутриклеточным гем-эфирным железом (Fe) [16]. Однако до настоящего времени фармакокинетика, фармакодинамика, специфические молекулярные мишени и механизмы действия соединений семейства АРТ недостаточно изучены [5–7, 9].
Предварительно проведенный нами обратный виртуальный скрининг показал, что оптимальная мишень для АРТ ‒ лиганд-связывающий домен глюкокортикоидного рецептора (ГР) человека [17]. ГР представляет собой конститутивно экспрессируемый фактор транскрипции, контролирующий множество различных генных сетей [18, 19]. Кетостероидные рецепторы, включая ГР человека, активируют эндогенный гормон кортизол или экзогенные глюкокортикоиды, такие как дексаметазон (ДЕКСА), и играют жизненно важную роль в регуляции метаболизма и гомеостаза [20, 21], межклеточной коммуникации, необходимой для координации развития, роста, воспаления и иммунитета [22, 23]. Таким образом, глюкокортикоиды и их синтетические производные, такие как ДЕКСА, – одни из наиболее используемых лекарств при лечении астмы, ревматоидного артрита, аутоиммунных заболеваний, лейкемии и т.д. благодаря их сильной иммуносупрессивной, противовоспалительной и апоптотической активности. Однако использование стероидов, таких как ДЕКСА, может привести к серьезным побочным эффектам [24]. Поэтому исследуют новые терапевтические агенты, которые могут заменить стероиды, и будут использоваться в качестве противовоспалительных препаратов без побочных эффектов. Эти агенты могут быть селективными агонистами или модуляторами ГР [21].
Большинство ксеногенных факторов, включая лекарственные средства, нативные и синтетические глюкокортикоиды [25] и АРТ [26], достигают тканей-мишеней, связываясь с сывороточным альбумином человека (САЧ), который участвует в абсорбции, распределении, метаболизме и экскреции лекарств. САЧ оказывает существенное влияние на фармакокинетику и фармакодинамику многих лекарственных препаратов [27]. Всасывание АРТ после приема внутрь длится 0.5‒2 часа, достигая максимальной концентрации в плазме в интервале 1‒3 часа после приема. Ферменты цитохрома P-450 CYP3A4 и CYP2A6 участвуют в метаболизме АРТ и его производных. Они также участвуют в конверсии производных АРТ в дигидроартемизинин [28].
САЧ представляет собой одноцепочечный гликозилированный полипептид, который содержит 585 аминокислотных остатков, с молекулярной массой 66 500 Да. Он образует структуру в форме сердца, состоящую из трех гомологичных α-спиральных доменов (I, II и III), каждый из которых подразделяется на два субдомена (A и B) [29]. Анализ кристаллической структуры показал, что существуют два больших и структурно селективных сайта связывания с лекарствами – сайт I (Sudlow I) и сайт II (Sudlow II), которые расположены соответственно в субдомене IIA и IIIA [30].
В данной статье для изучения взаимодействия АРТ и ДЕКСА с САЧ мы использовали различные методы, такие как УФ- и флуоресцентная спектроскопии [27, 31], молекулярная динамика (МД) [32] и молекулярный докинг [33]. Эндогенные или экзогенные глюкокортикоиды, такие как ДЕКСА, активируют ГР. Поскольку мы предполагаем, что АРТ может быть потенциальным лигандом, мы провели сравнительный анализ взаимодействия этих двух лигандов с САЧ для сравнения их фармакокинетики. Цель данной работы ‒ in vitrо и in silico определение молекулярных механизмов взаимодействия и связывания АРТ с САЧ, ДНК и сравнительный анализ с ДЕКСА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и растворы. Стандартные растворы АРТ, САЧ и триптофана (Trp) готовили с использованием: АРТ (≥98%) фирмы “Toronto Research Chemicals” (Торонто, Канада); САЧ, свободный от жирных кислот (<0.005%), “Sigma Chemical Co.” (Сент-Луис, США); Trp и Трис (≥99%) от “Sigma Chemical Co.” (Сент-Луис, США). Буферный раствор Трис-HCl (0.050 М, рН 7.40) доводили до рН 7.40 добавлением 36% HCl. Исходный раствор АРТ (1.0 × 10–2 М) готовили в этаноле, а САЧ (2.5 × 10–4 М) ‒ в Трис-HCl (рН 7.40). Концентрацию САЧ определяли спектральным поглощением при длине волны λ = 280 нм, используя коэффициент молярного поглощения ε = 36600 М–1 см–1. Все исходные растворы хранили в темноте при 4°С. В экспериментах использовали дистиллированную воду.
Спектральные методы. УФ-видимая спектроскопия. УФ-спектры всех растворов САЧ в отсутствие/присутствии АРТ в физиологических условиях (pH 7.4) регистрировали на спектрофотометре Unicam UV-1601 (Shimadzu, Япония) с 10-миллиметровыми кварцевыми ячейками в диапазоне длин волн от 200 до 350 нм при комнатной температуре. Стандартные растворы САЧ и АРТ использовали в качестве контроля. Флуоресцентный спектр растворов САЧ в отсутствие/присутствии АРТ в физиологических условиях (pH 7.4) регистрировали на флуоресцентном спектрофотометре Varian Cary Eclipse с 10 мм кварцевыми ячейками с шириной щели 10/10 нм. Спектры флуоресцентной эмиссии измеряли в диапазоне от 300 до 500 нм с интервалом 0.2 нм при длине волны возбуждения λex = 280 нм при трех разных температурах (298, 304 и 310 K). Ширина спектральных полос возбуждения и излучения равна 5 нм. Температуру образца поддерживали рециркуляцией воды на протяжении всего эксперимента.
Методами порядковой статистики проводили анализ спектрофотометрических данных. При нормальном распределении данных применяли методы параметрической статистики, в том числе порядковую статистику и непарный t-тест Стьюдента. Вычисления проводили с применением программы Microsoft Office Excel 2007. Статистически значимой величиной принята p < 0.05. Опыты проводили 4‒6 раз сериями по 2‒3 раза.
Флуоресцентная спектроскопия. Константу связывания Kb и количество сайтов связывания n определяли построением кривой двойной логарифмической регрессии данных флуоресцентной эмиссии по уравнению (1) [34, 35]:
где F0 и F ‒ интенсивности флуоресценции САЧ в отсутствие и в присутствии АРТ, [Q] ‒ концентрация АРТ, Kb ‒ константа связывания, а n ‒ число сайтов связывания.Энтальпия ΔH, энтропия ΔS и изменения свободной энергии Гиббса ΔG рассчитаны с использованием уравнений Вант-Гоффа, которые использовали для характеристики силы связывания САЧ с АРТ [31]:
(2)
${\text{ln}}{{K}_{{\text{b}}}} = - \left( {\frac{{{\Delta }H}}{R}} \right)\left( {\frac{1}{T}} \right) + \frac{{{\Delta }S}}{R},$Эффективность переноса энергии для одиночной донорно-акцепторной системы рассчитывают по уравнению (4) [36]:
где F0 и F ‒ интенсивности флуоресценции САЧ в отсутствие и присутствии АРТ соответственно. R0, так называемая длина Фёрстера, представляет собой функцию взаимной ориентации САЧ и АРТ и степени перекрывания спектра возбуждения АРТ спектра эмиссии САЧ.R0 ‒ это критическое расстояние, при котором эффективность переноса энергии составляет 50%, значение которой рассчитывают согласно уравнению 5 [36]:
(5)
$R_{0}^{6} = 8.79 \times {{10}^{{ - 25}}}{{k}^{2}}{{n}^{{ - 4}}}\Phi J\left( {\lambda } \right),$(6)
$J = \frac{{{\Sigma }F\left( {\lambda } \right)\varepsilon \left( {\lambda } \right){{{\lambda }}^{4}}{\Delta \lambda }}}{{{\Sigma }F\left( {\lambda } \right){\Delta \lambda }}},$Электрофоретическая подвижность ДНК. Эксперименты с линией мышей с саркомой S-180 проведены в лаборатории токсикологии и молекулярной систематики Института физиологии им. Л.А. Орбели НАН РА. Все процедуры выполняли в соответствии с правилами Института по уходу за животными и этическими нормами IACUC по обезглавливанию неанестезированных мышей и крыс. Ткань саркомы удаляли у мышей, а ДНК извлекали из клеток методом [37]. ДНК выделяли из небольшого объема клеток линии саркомы S-180 с использованием китов peqGOLD MicroSpin Tissue DNA Kit (PeqLab Biotechnologie GmbH Erlangen, Германия). Целостность ДНК оценивали по стандарту электрофоретической подвижности ДНК в 0.8% агарозном геле [37]. АРТ растворяли в 10 мл диметилсульфоксида до конечной концентрации 1, 5, 10, 25, 50 и 100 мкМ и затем добавляли к экстрагированной ДНК.
Молекулярное моделирование. Симуляция МД и кластерный анализ САЧ. Трехмерная структура САЧ с миристиновой кислотой и R(+) энантиомером варфарина получена из банка данных RCSB Protein Data Bank [38, 39] (PDB ID: 1H9Z). Лиганды, молекулы воды и ионы удаляли, а затем добавляли недостающие аминокислотные остатки САЧ с использованием программного пакета Modeller [40]. Симуляцию МД проводили с использованием пакета программ GROMACS [32]. Использовали силовое поле Amber99SB-ILDN [41] и модель воды TIP3P [42]. Для увеличения временного шага до 4 фс применяли “виртуальные сайты”. Далее проводили минимизацию энергии и симуляцию МД в явной воде (explicit water) при постоянной температуре (300 К). Заряд системы нейтрализовали путем случайной замены молекул воды ионами Na и Cl. При моделировании использовали периодические граничные условия (Periodic boundary conditions). Particle-Mesh Ewald (PME) использовали для расчета электростатики со значением “cut-off” 1.0 Å. Четыре независимых запуска симуляции МД со случайными начальными скоростями проводили параллельно (400 нс каждое), что в итоге составило 1.6 мкс. Чтобы получить наиболее встречаемую конформацию САЧ, проводили кластерный анализ с использованием метода Gromos RMSD [43]. Этот метод, разработанный в исследовании [43], основан на расчете количества соседей для каждой точки, в которой RMSD меньше заданного предела “cut-off”. Для кластерного анализа выбрано значение “cut-off” 0.26 в соответствии с 3 критериями, описанными в работе [44]. Моделирование МД проводили на ЦКП МГУ им. М.В. Ломоносова [45].
Подготовка лиганда. 3D структуры АРТ [CID: 68827] и ДЕКСА [CID: 5743] взяты в банке данных PubChem [46]. Топологию лигандов для моделирования МД генерировали с использованием программного обеспечения АCPYPE [47], которое совместимо с General Amber Force Field [48].
Слепой докинг несколькими программами. Центроидная конформация САЧ получена для последующего молекулярного докинга после симуляции МД и кластерного анализа. Докинг АРТ и ДЕКСА с САЧ проводили с использованием Autodock Vina [49], rDock [50], Ledock [51], FlexAID [52]. Первые три пакета программ выбраны исходя из их точности [33], а FlexAID ‒ из-за его устойчивости к структурной изменчивости [52].
Весь объем пространства белка исследован с использованием размеров бокса 94 × 54 × 92 Å для Autodock Vina. Нами использованы следующие значения глубин поиска (exhaustiveness): 8, 16, 32, 64, 128, 256, 512, 1024, 2048 и 4096. В программе rDock установлен радиус, равный 50 Å, чтобы покрыть всю поверхность белка. Для программы LeDock также задан размер бокса для покрытия всей поверхности белка со следующими значениями: xmin = –10, xmax = 11; ymin = –20, ymax = = 21; zmin = –42, zmax = 43. В случае программы FlexAID мы использовали проверенные и оптимальные настройки по умолчанию, предложенные создателями программы [52]. В случае докинга моделирование выполняли 10 раз, а количество мод связывания составляло 20 для каждой программы. Получено 200 конформаций лиганда для каждой программы, всего сгенерировано 800 конформаций. Большое количество конформаций необходимо для получения хорошей выборки и дальнейшего кластерного анализа.
Анализ результатов докинга: конформации и траектории. Координаты центра масс экстрагировали, а затем размеры данных уменьшали с использованием анализа главных компонент по первым двум компонентам [53]. Позже проводили кластерный анализ данных координат центра масс с использованием алгоритма DBSCAN, основанного на плотности пространственной кластеризации для приложений с шумами [54], известного алгоритма кластеризации данных, который обычно используют в интеллектуальном анализе данных и машинном обучении. Этот алгоритм имеет два важных параметра: эпсилон и минимальное количество точек. Параметр эпсилон можно определить как радиус окрестности вокруг определенной точки x, а параметр минимальное количество точек ‒ как минимальное количество соседних точек в пределах определенного радиуса [54]. Минимальное количество точек выбрали равным 5 как для АРТ, так и для ДЕКСА. По графику kNN определяли оптимальное значение эпсилона, равное 2.0 для АРТ (рис. S1 , см. Приложение) и 4.0 для ДЕКСА (рис. S2 , см. Приложение).
Методология слепого докинга основана на исследовании в работе [55], в котором используют библиотеки pandas [56] и scikit-learn [57] и программу OpenBabel [58]. После этого извлекали центроидные конформации из общих для всех программ кластеров. Позже эти конформации использовали в качестве основы для локального докинга, который осуществляли с помощью Autodock Vina [49]. Анализ гидрофобных взаимодействий и водородных связей проводили с использованием программы Ligplot+ [59]. Визуализация конформаций докинга выполнена с помощью программы Pymol (DeLano W.L. (2002) The PyMOL molecular graphics system. http://www.pymol.org).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
УФ-видимая спектроскопия
Измерены УФ-спектры поглощения САЧ с АРТ (рис. 1а). Как видно на рисунке, САЧ имеет два пика поглощения: сильное поглощение при λ = 212 нм и слабое при 280 нм. Первая полоса отражает конформацию САЧ, а вторая ‒ переход π → π* ароматических аминокислот, в частности триптофана [31]. При добавлении АРТ интенсивность полосы поглощения около 212 нм падала с небольшим красным смещением. Интенсивность полосы около 280 нм также уменьшалась, что указывает на изменение конформации САЧ и наличие α-спирали в результате образования комплекса AРT–САЧ. Это указывает на взаимодействие АРТ с САЧ. Информация о конформационных изменениях САЧ до/после добавления АРТ получена измерением интенсивности флуоресценции.
Рис. 1.
а ‒ УФ-спектры САЧ (1) 1.5 × 10–6 М (контроль); (2) САЧ + АРТ (12 × 10–6 моль л–1 (1 : 1); (3) АРТ (2 × × 10–6 моль л–1), рН 7.4, 298 К. б ‒ Спектры флуоресцентной эмиссии САЧ (1.0 × 10–6 М) и АРТ, λex = 289 нМ, 298 К. 0‒6 ‒ Концентрации АРТ 10–5× 0, 2, 4, 6, 8, 10, 12 моль л–1. в ‒ Модифицированные графики Штерна–Фольмера для тушения САЧ артемизинином при 298 К (R = 0.9995); 304 К (R = 0.9975); 310 К (R = 0.9965). г ‒ Графики Вант-Гоффа для взаимодействия САЧ с АРТ, рН 7.4 (буфер Трис-HCl, [САЧ] = 1.5 × 10–6 моль л–1).
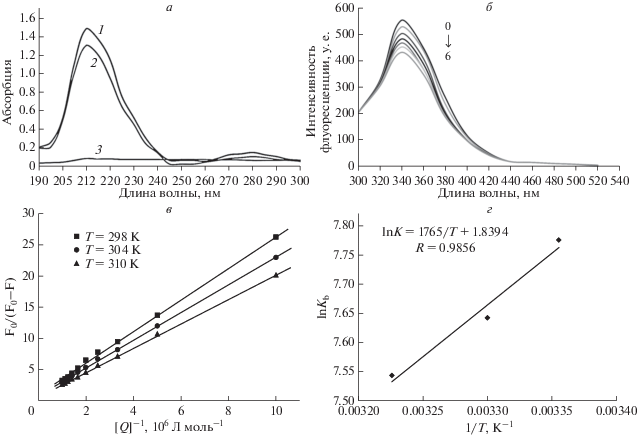
САЧ обладает флуоресцентными свойствами и интенсивно излучает свет при возбуждении, а три аминокислотных остатка, триптофан, тирозин и фенилаланин, ответственны за флуоресценцию [31, 60]. Этот белок содержит только один остаток Trp214 в большой гидрофобной полости субдомена IIA, который представляет основной флуоресцирующий компонент, а его вклад составляет ≈ 90% от общей флуоресценции белка [29, 61]. САЧ генерировал видимую полосу флуоресцентной эмиссии при 337 нм, которая уменьшалась и постепенно затухала с увеличением концентрации АРТ без значительного сдвига (рис. 1б). При этом АРТ не флуоресцирует даже при максимальной концентрации. Следовательно, такое уменьшение интенсивности может быть связано с тушением флуоресценции САЧ с помощью АРТ в результате образования комплекса. Чтобы выяснить механизм тушения, мы проанализировали данные флуоресценции при различных температурах с помощью уравнения Штерна–Фольмера, (уравнение (7)) [31]:
(7)
$\frac{{{{F}_{0}}}}{F} = 1 + {{k}_{{\text{q}}}}{{\tau }_{0}}\left[ Q \right] = 1 + {{K}_{{{\text{SV}}}}}\left[ Q \right],$(8)
$~\frac{{{{F}_{0}}}}{{{{F}_{0}} - F}} = \frac{1}{{{{f}_{{\text{a}}}}{{K}_{{\text{a}}}}}}\frac{1}{{\left[ Q \right]}} + \frac{1}{{{{f}_{{\text{a}}}}}},$Как видно на рис. 1в, в диапазоне исследуемых концентраций результаты согласуются с уравнением Штерна–Фольмера, а график показывает линейную зависимость. Это говорит о том, что в присутствии АРТ тушение флуоресценции САЧ происходит по одному механизму. А тот факт, что при повышении температуры скорость тушения падает, свидетельствует о статической природе тушения [31]. Наши результаты согласуются с результатами работы [62] относительно взаимодействия других противомалярийных препаратов, таких как пиперахин и его метаболиты, с САЧ, где тушение флуоресценции также имеет статический характер.
Константы связывания и количество сайтов связывания
Значения константы связывания Kb получены из графика lg[(F0 – F)/F] – lg[Q] на основе уравнения 1. Значения ΔH и ΔS получены из определения величины углового коэффициента и точки пересечения линейного графика lnKb против 1/T (уравнение (2)). Величина ΔG рассчитана по уравнению (3) (рис. 1г).
Значения ΔH, ΔS и ΔG приведены в табл. 1. Отрицательный знак ΔG указывает на то, что все процессы связывания происходят спонтанно. Положительное значение ΔS часто свидетельствует о наличии гидрофобного взаимодействия лекарственного средства с белком [63]. Наши данные согласуются с результатами исследований [26].
Таблица 1.
Константы тушения KSV, kq, связывания Kb и термодинамические параметры взаимодействия САЧ-AРT и САЧ-ДЕКСА при pH 7.40
| Система | Температура, K | KSV × 10–4, л моль−1 | kq × 1012, л моль−1 с−1 | Константа связывания, Kb × 10–4 л моль–1 | Количество сайтов связы- вания, n | ΔH, кДж моль–1 | ΔS, Дж моль −1 K−1 | ΔG, кДж моль−1 |
|---|---|---|---|---|---|---|---|---|
| САЧ + АРТ | 298 303 310 |
2.38 2.08 1.89 |
2.38 2.08 1.89 |
2.381 ± 0.004 2.083 ± 0.003 1.887 ± 0.003 |
0.09621 1.0043 1.004 |
–14.67 ± 0.012 | 15.29 ± 0.164 | –19.32 ± 0.107 |
| САЧ + + ДЕКСАa | 298 308 |
1.83 1.46 |
1.83 1.46 |
1.70 ± 0.003 0.71 ± 0.002 |
0.996 1.059 |
–61.7 ± 3 | –126.4 ± 1 | –24.0 ± 3 |
a Использованы экспериментальные данные для ДЕКСА из работы [64].
В комплексе САЧ-АРТ преобладают гидрофобные взаимодействия, тогда как в случае САЧ-ДЕКСА превалируют водородные связи и взаимодействия Ван-дер-Ваальса, поскольку ΔH < 0 и ΔS < 0 [63]. Следует отметить, что значения KSV, kq и ΔG САЧ-АРТ близки к таковым для САЧ-пиперахина и его метаболитов. САЧ-АРТ и САЧ с одним из производных пиперахина имеют почти одинаковую величину ΔG (–19.32 и –19.29 кДж моль–1) [62].
Перенос энергии от САЧ к AРT
Оценку взаимодействий, измерение расстояния между АРТ (акцептор) и молекулой флуорофора САЧ (донор) проводили с помощью теории резонанса переноса энергии Ферстера (FRET) [65]. Перенос энергии контролируется квантовым выходом флуоресценции донора (E), относительной ориентацией переходных диполей донора и акцептора k2, интегралом перекрывания спектра флуоресценции донора и спектра поглощения акцептора J и расстоянием r между ними. Перекрывание спектров флуоресценции САЧ и спектров поглощения АРТ приведено на рис. 2а.
Рис. 2.
а ‒ Спектральное перекрывание флуоресцентной эмиссии САЧ (1.0 × 10–6 М) (прямая линия) и спектра поглощения АРТ (1.0 × 10–6 М) (пунктирная линия). б ‒ Спектры флуоресцентной эмиссии Trp (1) и Trp-АРТ (2). Перекрывание спектра излучения Trp (прямая линия) и поглощения АРТ (пунктирная линия) pH 7.40, T = 298 К.
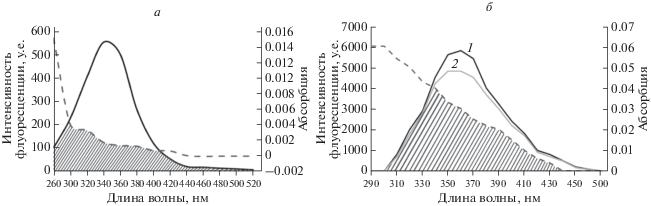
Значения J, E, R0 и r рассчитаны на основании уравнений (4)‒(6). Перенос энергии в спектрах может зависеть от расстояния между остатком триптофана и АРТ, связанного с САЧ. Интеграл спектрального перекрывания, рассчитанный по графику на рис. 2а, равен 2.5216 × 10–15 см3/моль–1. Значение R0 равно 1.98 нм, а r ‒ 1.89 нм. Для системы ДЕКСА-САЧ R0 = 2.53 нм и r = 2.87 нм [64]. Расстояние между САЧ (донор) и АРТ (акцептор) намного меньше значения критерия для безизлучательного переноса энергии [66]. Это соответствует правилу 0.5R0 < r0 < 1.5R0 [67], что позволяет предположить, что перенос энергии от САЧ к АРТ происходит с высокой вероятностью, а расстояние, полученное с помощью FRET, рассчитано с высокой точностью. Среднее расстояние между донором и акцептором составляет 2–8 нм, что указывает на то, что перенос энергии от САЧ к ДЕКСА, а также САЧ‒АРТ происходил с высокой вероятностью. Более высокое значение R0, полученное для системы ДЕКСА‒САЧ, указывает на более эффективный FRET [64], по сравнению с комплексом АРТ‒САЧ.
Влияние АРТ на интенсивность флуоресценции Trp в H2O при 293 K представлено на рис. 2б. Флуоресценцию Trp характеризует максимальная эмиссия при λem = 356 нм. Спектральные характеристики 2D-спектров флуоресценции аминокислот регистрируют при следующих условиях: λex/λem = 280/357 нм диапазоны для Trp. Ультрафиолетовый спектр поглощения Trp характеризуется коротковолновым диапазоном при 220 нм и длинноволновым диапазоном при 260–290 нм, который состоит из двух перекрывающихся переходов. Спектр флуоресценции Trp в водном растворе характеризуется широкой бесструктурной полосой излучения с максимумом 357 нм и шириной 60 нм при λex = 280 нм, которая уменьшается и постепенно затухает с увеличением концентрации АРТ без значительного сдвига (рис. 2б). Измерения переноса энергии рассчитаны согласно уравнению (4).
Для системы АРТ-Trp J = 3.6 × 10–16 см3/моль–1, R0 равно 2.07 нм, а r0 – 2.05 нм. Расстояние между Trp (донор) и АРТ (акцептор) намного меньше [66] значения критерия для безизлучательного переноса энергии (1.035 < 2.05 < 3.105).
Взаимодействие АРТ с ДНК линии клеток саркомы S-180
АРТ при взаимодействии с ГР может быть импортирован в ядро, и крайне важно оценить возможность непосредственного взаимодействия АРТ с ДНК. Исследование прямого взаимодействия ДНК линии клеток саркомы S-180 с АРТ проводили путем измерением электрофоретической подвижности ДНК [68] (рис. 3). Протестированы различные концентрации и время совместной инкубации.
Рис. 3.
Электрофоретическая подвижность ДНК клеток S-180 после инкубации в течение 30 мин (а) и 48 ч (б). 1 ‒ маркер; 2 ‒ ДНК; 3‒8 ‒ ДНК с АРТ: 1, 5, 10, 25, 50 и 100 мкМ АРТ соответственно.
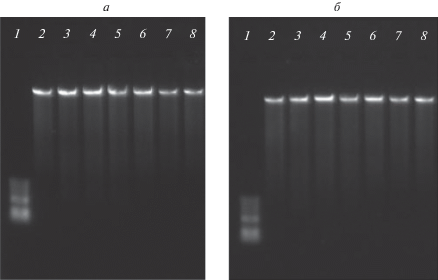
Как видно на рис. 3, при инкубации от 0 до 48 час в пределах концентраций АРТ 1‒100 мкмоль не происходит изменения электрофоретической подвижности ДНК. Таким образом, можно сделать вывод, что нет прямого взаимодействия между АРТ и ДНК. Существуют противоречивые данные о взаимодействии АРТ с ДНК. В работе [69] обнаружено непосредственное взаимодействие АРТ с ДНК, что приводит к повреждению ДНК. Наши результаты согласуются с данными, которые показывают отсутствие прямого взаимодействия [5, 11].
Молекулярный докинг САЧ с АРТ и ДЕКСА
Мы провели симуляцию МД САЧ после добавления первых двух недостающих аминокислот. Затем мы провели кластерный анализ и получили 36 кластеров, где первый кластер составлял 43.25% от общего числа конформаций (рис. 4). Распределение кластеров во времени показывает, что первый кластер содержит конформации, встречающиеся во всех запусках симуляции МД (рис. S3 , см. Приложение). Таким образом, можно сделать вывод, что эти конформации САЧ не случайны.
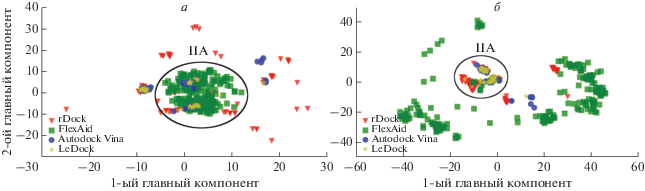
Мы использовали для дальнейших исследований центроидную конформацию первого кластера САЧ. Чтобы изучить механизм взаимодействия АРТ с ней, проводили симуляцию докинга. Затем проводили анализ главных компонентов (рис. 5а) и кластерный анализ с использованием алгоритма DBSCAN. В результате кластерного анализа определены 6 участков связывания из 800 конформаций АРТ (рис. S4 , см. Приложение). Результаты всех 4-х программ докинга совпадают в кластере I (58.2% всех конформаций докинга), который может быть потенциальным сайтом связывания для АРТ с САЧ. Этот сайт соответствует домену II субдомена A или сайту I связывания с лекарствами, что согласуется с экспериментальными данными [26]. Противомалярийный препарат пиперахин и его метаболиты [62] также связываются с сайтом I.
Рис. 5.
Анализ главных компонентов по результатам многократного запуска докинга АРТ (а) и ДЕКСА (б) с центроидной конформацией САЧ.
После определения сайта связывания АРТ на САЧ (IIA) мы провели локальный докинг с использованием программы AutoDock Vina [49] (рис. 6). Эту программу выбрали в связи с лучшей оценочной функцией, которая основана на эмпирической свободной энергии, и ее часто используют в исследованиях [33]. Энергия связи наилучшей конформации составляет –8.4 ккал/моль, что указывает на довольно сильное взаимодействие.
Рис. 6.
Докинг АРТ с центроидной конформацией первого кластера САЧ (слева). Анализ гидрофобных взаимодействий и водородных связей АРТ с САЧ (справа).
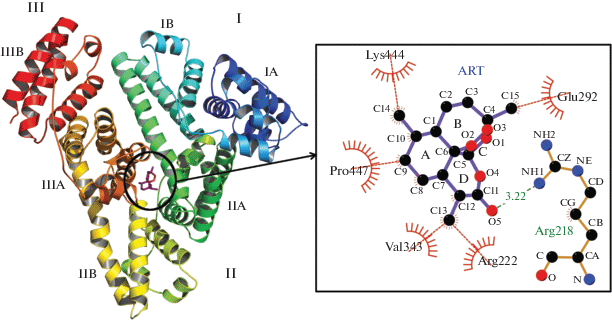
Атомы кольца D АРТ участвуют в образовании водородной связи. Группа NH1 боковой цепи Arg218 образует водородную связь с карбоксилом С11 АРТ на расстоянии 3.22 Å. Остатки Glu292, Lys444, Pro447, Val343, Arg222 вовлечены в гидрофобные взаимодействия с АРТ: Glu292 с C15 (кольцо B) АРТ, Lys444 с C14 (A), Pro447 с С9 (А), Val343 с C13 (D) и Arg222 с C13 (D). АРТ не образует водородных связей с Trp214, что подтверждают результаты флуоресценции. Сравнение результатов наших работ с данными работы [62] показывает, что пиперахин и его метаболиты также не образуют водородную связь с Trp214. Показано, что пиперахин и его метаболиты, а также АРТ взаимодействуют с Arg222, и некоторые метаболиты пиперахина (M1, M4 и M5) также взаимодействуют с Arg218 [62].
Биологическая активность АРТ в основном связана с эндопероксидным мостиком [70], поэтому они должны сохранять эндопероксидный мостик для воздействия на мишень при транспортировке альбумином. Наши результаты не показывают вовлеченность О–О связи во взаимодействии с САЧ, что важно для фармакокинетики и фармакодинамики АРТ.
Поскольку мы рассматриваем АРТ в качестве нового лиганда для ГР человека, необходим сравнительный анализ взаимодействия АРТ и ДЕКСА с САЧ. Как и в случае с АРТ, мы провели многократную симуляцию докинга ДЕКСА с центроидной конформацией САЧ, анализ главных компонент (рис. 7а), кластерный анализ и, наконец, локальный докинг ДЕКСА с центроидной конформацией САЧ. В результате получено 10 кластеров (рис. S5 , см. Приложение). Только I-ый кластер совпадал для всех 4 программ по докингу, что составляло 68.8% от всех конформаций ДЕКСА. Этот кластер соответствует сайту связывания АРТ (рис. 7а) с субдоменом IIA (сайт I), что согласуется с экспериментальными данными [64].
Рис. 7.
а ‒ Локальный докинг САЧ с ART (зеленый) и ДЕКСА (пурпурный). б ‒ Локальный докинг ДЕКСА с центроидной конформацией САЧ (слева). Анализ гидрофобных взаимодействий и водородных связей ДЕКСА с САЧ (справа).
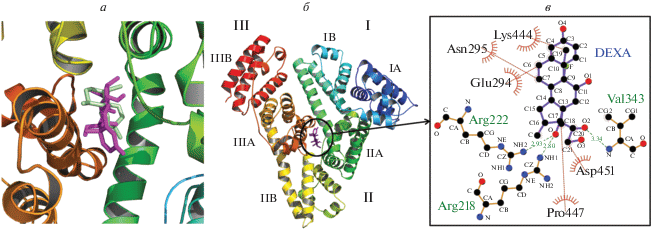
Затем с данным сайтом провели локальный докинг с использованием Autodock Vina [49] (рис. 7б). Согласно результатам докинга аффинность связывания ДЕКСА с САЧ равна –9.3 ккал/моль, что превышает таковую для АРТ. Это может быть связано с тем, что ДЕКСА образует 3 водородные связи с САЧ и гидрофобными взаимодействиями (рис. 7б). Полученные результаты согласуются с исследованиями in vitro [64].
Группа NH1 боковой цепи Arg218 образовывала водородную связь с карбоксилом C17 ДЕКСА на расстоянии 2.80 Å. Группа NH2 боковой цепи Arg222 образовывала водородную связь с карбоксилом C17 ДЕКСА на расстоянии 2,93 Å. N-группа основной цепи Val343 образовывала водородную связь с карбоксилом C20 ДЕКСА на расстоянии 3.34 Å. Остатки Lys444, Glu294, Asn295, Asp451, Pro447 были вовлечены в гидрофобные взаимодействия с ДЕКСА: Lys444 с C19 ДЕКСА, Glu294 с C6, Asn295 с C7, Asp451 с C21 и Pro447 с C18 ДЕКСА. Известно, что Arg222 и Arg257 взаимодействуют с карбонилом лактона варфарина, тем самым стабилизируя и ориентируя его в участке сайта I связывания с лекарствами [71].
Таким образом, и АРТ, и ДЕКСА позиционируются в гидрофобной полости САЧ в субдомене IIA, взаимодействуя главным образом с одними и теми же аминокислотами. При этом, как ART, так и ДЕКСА образуют 1 водородную связь с группой NH1 боковой цепи Arg218. Известно, что Arg218 играет критическую роль в связывании тироксина [72 ] , варфарина, билирубина и холестерина [73 ] .
ЗАКЛЮЧЕНИЕ
Проведенные нами спектральные исследования показали уменьшение пика поглощения САЧ при λ = 280 нм в присутствии АРТ, что указывает на взаимодействие между ними. АРТ также способствует тушению флуоресцентной эмиссии САЧ при λ = 337 нм, коррелирующему с концентрацией АРТ, который не обладает флуоресценцией даже при максимальной концентрации. Следовательно, такое снижение интенсивности эмиссии белка может быть связано с тушением флуоресценции САЧ посредством АРТ в результате образования комплекса. В то же время наблюдали лишь незначительное смещение эмиссии флуоресценции САЧ в коротковолновую область, что указывает на то, что тушение не затрагивает локальную диэлектрическую среду САЧ в области триптофана. Наши данные совпадают с результатами других исследований [26]. В пределах исследуемого диапазона концентраций АРТ результаты согласуются с уравнением Штерна–Фольмера, так как график показывает линейную зависимость. Это говорит о том, что в присутствии АРТ тушение флуоресцентной эмиссии САЧ происходит по одному механизму. Тушение флуоресценции САЧ с помощью АРТ при различных температурах, во-первых, линейное, а во-вторых, по мере повышения температуры скорость затухания уменьшается, что указывает на его статическую природу. Проводили докинг-анализ для исследования механизма взаимодействия АРТ с САЧ.
Чтобы выяснить моды связывания АРТ с САЧ и проанализировать гидрофобные взаимодействия и водородные связи, проводили молекулярный докинг. Показано, что ART взаимодействует с одним сайтом САЧ – сайтом I. Он образует водородные связи с Arg218, в то время как с Trp214 водородных связей нет, что подтверждают результаты флуоресценции. Мы установили образование водородной связи с Arg218, который играет решающую роль в связывании лекарств, таких как тироксин [72 ] , варфарин, билирубин и холестерин [73 ] c сайтом I. Исследования специфичности связывания и модификации этого аргинина могут быть полезны для терапевтических методов лечения, которые направлены на предотвращение опосредованных побочных реакций у пациентов [73 ] . Наши результаты не показывают участия О–О связи АРТ во взаимодействии с САЧ, что важно для фармакокинетики и фармакодинамики АРТ. Мы показали, что ДЕКСА образует три водородные связи с Arg218 (боковая цепь), Arg222 (боковая цепь) и Val343 (основная цепь), а АРТ образует водородную связь с Arg218 (боковая цепь). Следует отметить, что многие аминокислоты субдоменов IIA и IIIA САЧ совпадают при взаимодействии как с АРТ, так и с ДЕКСА. Аффинность связывания ДЕКСА с САЧ выше, чем АРТ.
Ранее проведенный нами докинг-анализ АРТ с мономером лиганд-связывающего домена ГР человека показал, что основное распределение АРТ находится на интерфейсе, образованном спиралями H3–H7–H10/H11 лиганд-связывающего кармана, [17]. Взаимодействие лигандов, например ДЕКСА, с данным сайтом приводит к активации ГР [19]. Данный сайт содержит аминокислоты, которые участвуют в связывании глюкокортикоидов, сильной димеризации ГР и играют важную роль в распознавании лигандов и трансактивации [18, 19]. Наши эксперименты показывают, что прямого взаимодействия АРТ с ДНК клеток саркомы S-180 нет, что указывает на отсутствие генотоксичности и согласуется с обзорными работами [5, 11].
Итак, мы предполагаем, что один из основных транспортеров АРТ ‒ САЧ. При этом взаимодействие АРТ с САЧ и его характеристики, такие как тушение флуоресценцентной эмиссии, энергетические параметры и результаты молекулярного докинга, совпадают с параметрами ДЕКСА, а также противомалярийного препарата пиперахина и его метаболитов.
Авторы благодарны Лаборатории токсинологии и молекулярной систематики Института физиологии им. Л.А. Орбели НАН РА.
Работа выполнена с использованием оборудования Центра коллективного пользования сверхвысокопроизводительными вычислительными ресурсами МГУ им. М.В. Ломоносова.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Krishna S., Bustamante L., Haynes R.K., Staines H.M. (2008) Artemisinins: their growing importance in medicine. Trends Pharmacol. Sci. 29, 520–527. https://doi.org/10.1016/j.tips.2008.07.004
Ali M., Abbasi B.H., Ahmad N., Khan H., Ali G.S. (2017) Strategies to enhance biologically active-secondary metabolites in cell cultures of Artemisia – current trends. Crit. Rev. Biotechnol. 37, 833–851. https://doi.org/10.1080/07388551.2016.1261082
Yao W., Wang F., Wang H. (2016) Immunomodulation of artemisinin and its derivatives. Sci. Bull. 61, 1399–1406. https://doi.org/10.1007/s11434-016-1105-z
Lisgarten J.N., Potter B.S., Bantuzeko C., Palmer R.A. (1998) Structure, absolute configuration, and conformation of the antimalarial compound, artemisinin. J. Chem. Crystallogr. 28, 539–543. https://doi.org/10.1023/A:1023244122450
O’Neill P.M., Barton V.E., Ward S.A. (2010) The molecular mechanism of action of artemisinin—the debate continues. Molecules. 15, 1705–1721. https://doi.org/10.3390/molecules15031705
Ho W.E., Peh H.Y., Chan T.K., Wong W.F. (2014) Artemisinins: Pharmacological actions beyond anti-malarial. Pharmacol. Ther. 142, 126–139. https://doi.org/10.1016/j.pharmthera.2013.12.001
Kim W.S., Choi W.J., Lee S., Kim W.J., Lee D.C., Sohn U.D., Shin H.S., Kim W. (2014) Anti-inflammatory, antioxidant and antimicrobial effects of artemisinin extracts from Artemisia annua L. Korean J. Physiol. Pharmacol. 19, 21. https://doi.org/10.4196/kjpp.2015.19.1.21
Bhaw-Luximon A., Jhurry D. (2017) Artemisinin and its derivatives in cancer therapy: status of progress, mechanism of action, and future perspectives. Cancer Chemother. Pharmacol. 79, 451–466. https://doi.org/10.1007/s00280-017-3251-7
Dai Y.F., Zhou W.W., Meng J., Du X.L., Sui Y.P., Dai L., Wang P.Q., Huo H.R., Sui F. (2017) The pharmacological activities and mechanisms of artemisinin and its derivatives: a systematic review. Med. Chem. Res. 26, 867–880. https://doi.org/10.1007/s00044-016-1778-5
Tu Y. (2011) The discovery of artemisinin (qinghaosu) and gifts from Chinese medicine. Nat. Med. 17, 1217–1220. https://doi.org/10.1038/nm.2471
Crespo-Ortiz M.P., Wei M.Q. (2012) Antitumor activity of artemisinin and its derivatives: from a well-known antimalarial agent to a potential anticancer drug. J. Biomed. Biotechnol. 2012, 1–18. https://doi.org/10.1155/2012/247597
Das A.K. (2015) Anticancer effect of antimalarial artemisinin compounds. Ann. Med. Health Sci. Res. 5, 93. https://doi.org/10.4103/2141-9248.153609
Shi Z., Chen Y., Lu C., Dong L.M., Lv J.W., Tuo Q.H., Qin L., Cheng S.W., Bu L.L., Lin N., Zhu X.X., Liao D.F., Liu X.M. (2018) Resolving neuroinflammation, the therapeutic potential of the anti-malaria drug family of artemisinin. Pharmacol. Res. 136, 172–180. https://doi.org/10.1016/j.phrs.2018.09.002
Appalasamy S., Lo K.Y., Ch’ng S.J., Nornadia K., Othman A.S., Chan L.K. (2014) Antimicrobial activity of artemisinin and precursor derived from in vitro plantlets of Artemisia annua L. BioMed Res. Int. 2014, 1–6. https://doi.org/10.1155/2014/215872
Li B., Yao Q., Pan X.C., Wang N., Zhang R., Li J., Ding G., Liu X., Wu C., Ran D., Zheng J., Zhou H. (2011) Artesunate enhances the antibacterial effect of β-lactam antibiotics against Escherichia coli by increasing antibiotic accumulation via inhibition of the multidrug efflux pump system AcrAB-TolC. J. Antimicrob. Chemother. 66, 769–777. https://doi.org/10.1093/jac/dkr017
Krungkrai J., Krungkrai S.R. (2016) Antimalarial qinghaosu/artemisinin: the therapy worthy of a Nobel prize. Asian Pac. J. Trop. Biomed. 6, 371–375. https://doi.org/10.1016/j.apjtb.2016.03.010
Ginosyan S.V., Grabski H.V., Tiratsuyan S.G. (2017) Insights on glucocorticoid receptor modulation through binding of artemisinin. Biol. J. Armen. 69, 104–109.
Weikum E.R., Knuesel M.T., Ortlund E.A., Yamamoto K.R. (2017) Glucocorticoid receptor control of transcription: precision and plasticity via allostery. Nat. Rev. Mol. Cell Biol. 18, 159–174. https://doi.org/10.1038/nrm.2016.152
Bledsoe R.K., Montana V.G., Stanley T.B., Delves C.J., Apolito C.J., McKee D.D., Consler T.G., Parks D.J., Stewart E.L., Willson T.M., Lambert M.H., Moore J.T., Pearce K.H., Xu H.E. (2002) Crystal structure of the glucocorticoid receptor ligand binding domain reveals a novel mode of receptor dimerization and coactivator recognition. Cell. 110, 93–105. https://doi.org/10.1016/S0092-8674(02)00817-6
Ratman D., Mylka V., Bougarne N., Pawlak M., Caron S., Hennuyer N., Paumelle R., Cauwer L.D., Thommis J., Rider M.H., Libert C., Lievens S., Tavernier J., Staels B., Bosscher K.D. (2016) Chromatin recruitment of activated AMPK drives fasting response genes co-controlled by GR and PPARα. Nucleic. Acids. Res. 44, 10539–10553. https://doi.org/10.1093/nar/gkw742
Sundahl N., Bridelance J., Libert C., Bosscher K.D., Beck I.M. (2015) Selective glucocorticoid receptor modulation: New directions with non-steroidal scaffolds. Pharmacol. Ther. 152, 28–41. https://doi.org/10.1016/j.pharmthera.2015.05.001
Cruz-Topete D., Cidlowski J.A. (2015) One hormone, two actions: anti- and pro-inflammatory effects of glucocorticoids. Neuroimmunomodulation. 22, 20–32. https://doi.org/10.1159/000362724
Presman D.M., Hager G.L. (2017) More than meets the dimer: what is the quaternary structure of the glucocorticoid receptor? Transcription. 8, 32–39. https://doi.org/10.1080/21541264.2016.1249045
Conaway H.H., Henning P., Lie A., Tuckermann J., Lerner U.H. (2016) Activation of dimeric glucocorticoid receptors in osteoclast progenitors potentiates RANKL induced mature osteoclast bone resorbing activity. Bone. 93, 43–54. https://doi.org/10.1016/j.bone.2016.08.024
Yasseen Z.J., El-Ghossain M.O. (2016) Studies on binding of widely used drugs with human serum albumin at different temperatures and PHs. J. Biomed. Sci. 5. https://doi.org/10.4172/2254-609X.100033
Chen R., Jiang H., Pu H. (2013) Interaction of artemisinin and its derivatives with human serum albumin studied using spectroscopies and molecular modeling methods. Mol. Biol. Rep. 40, 4791–4804. https://doi.org/10.1007/s11033-013-2575-6
Marković O.S., Cvijetić I.N., Zlatović M.V., Opse-nica I.M., Konstantinović J.M., Jovanović N.V.T., Šolaja B.A., Verbić T.Ž. (2018) Human serum albumin binding of certain antimalarials. Spectrochim. Acta A Mol. Biomol. Spectrosc. 192, 128–139. https://doi.org/10.1016/j.saa.2017.10.061
Hananta L., Astuti I., Sadewa A.H., Alice J., Hutagalung J. (2018) The prevalence of CYP2B6 gene polymorphisms in malaria-endemic population of timor in East Nusa Tenggara Indonesia. Osong Public Health Res. Perspect. 9, 192–196. https://doi.org/10.24171/j.phrp.2018.9.4.08
Maciążek-Jurczyk M., Szkudlarek A., Chudzik M., Pożycka J., Sułkowska A. (2018) Alteration of human serum albumin binding properties induced by modifications: a review. Spectrochim. Acta A Mol. Biomol. Spectrosc. 188, 675–683. https://doi.org/10.1016/j.saa.2017.05.023
Sudlow G., Birkett D.J., Wade D.N. (1976) Further characterization of specific drug binding sites on human serum albumin. Mol. Pharmacol. 12, 1052–1061
Lakowicz J.R. (2006) Principles of Fluorescence Spectroscopy. Springer US, Boston, MA.
Lemkul J. (2019) From proteins to perturbed hamiltonians: a suite of tutorials for the GROMACS-2018 molecular simulation package [Article v1.0]. Living J. Comput. Mol. Sci. 1. https://doi.org/10.33011/livecoms.1.1.5068
Pagadala N.S., Syed K., Tuszynski J. (2017) Software for molecular docking: a review. Biophys. Rev. 9, 91–102. https://doi.org/10.1007/s12551-016-0247-1
Zhao H., Ge M., Zhang Z., Wang W., Wu G. (2006) Spectroscopic studies on the interaction between riboflavin and albumins. Spectrochim. Acta A Mol. Biomol. Spectrosc. 65, 811–817. https://doi.org/10.1016/j.saa.2005.12.038
Lissi E., Calderón C., Campos A. (2013) Evaluation of the number of binding sites in proteins from their intrinsic fluorescence: limitations and pitfalls. Photochem. Photobiol. 89, 1413–1416. https://doi.org/10.1111/php.12112
Mahammed A., Gray H.B., Weaver J.J., Sorasaenee K., Gross Z. (2004) Amphiphilic corroles bind tightly to human serum albumin. Bioconjug. Chem. 15, 738–746. https://doi.org/10.1021/bc034179p
Wang Y.Q., Su J., Wu F., Lu P., Yuan L.F., Yuan W.E., Sheng J., Jin T. (2012) Biscarbamate cross-linked polyethylenimine derivative with low molecular weight, low cytotoxicity, and high efficiency for gene delivery. Int. J. Nanomedicine. 7, 693–704. https://doi.org/10.2147/IJN.S27849
Berman H.M. (2000) The Protein Data Bank. Nucleic Acids Res. 28, 235–242. https://doi.org/10.1093/nar/28.1.235
Petitpas I., Bhattacharya A.A., Twine S., East M., Curry S. (2001) Crystal structure analysis of warfarin binding to human serum albumin anatomy of drug site I. J. Biol. Chem. 276, 22804–22809. https://doi.org/10.1074/jbc.M100575200
Webb B., Sali A. (2014) Comparative protein structure modeling using MODELLER. Curr. Protoc. Bioinformatics. 47, 5.6.1-5.6.32. https://doi.org/10.1002/0471250953.bi0506s47
Lindorff-Larsen K., Piana S., Palmo K., Maragakis P., Klepeis J.L., Dror R.O., Shaw D.E. (2010) Improved side-chain torsion potentials for the Amber ff99SB protein force field. Proteins. 78, 1950–1958. https://doi.org/10.1002/prot.22711
Jorgensen W.L., Chandrasekhar J., Madura J.D., Impey R.W., Klein M.L. (1983) Comparison of simple potential functions for simulating liquid water. J. Chem. Phys. 79, 926–935. https://doi.org/10.1063/1.445869
Daura X., Gademann K., Jaun B., Seebach D., Van Gunsteren W.F., Mark A.E. (1999) Peptide folding: when simulation meets experiment. Angew. Chem. Int. Ed. 38, 236–240. https://doi.org/10.1002/(SICI)1521-3773(19990115)38:1/ 2<236::AID-ANIE236>3.0.CO;2-M
Offutt T.L., Swift R.V., Amaro R.E. (2016) Enhancing virtual screening performance of protein kinases with molecular dynamics simulations. J. Chem. Inf. Model. 56, 1923–1935. https://doi.org/10.1021/acs.jcim.6b00261
Sadovnichy V., Tikhonravov A., Voevodin V., Opana-senko V. (2017) “Lomonosov”: supercomputing at Moscow State University. In: Contemp. High Perform. Comput. Chapman and Hall/CRC. 283–307.
Bolton E.E., Wang Y., Thiessen P.A., Bryant S.H. (2008) PubChem: integrated platform of small molecules and biological activities. In: Annual Reports in Computational Chemistry. Elsevier. 4, 217–241.
Da Silva A.W.S., Vranken W.F. (2012) ACPYPE – Antechamber python parser interface. BMC Res. Notes. 5, 367. https://doi.org/10.1186/1756-0500-5-367
Wang J., Wolf R.M., Caldwell J.W., Kollman P.A., Case D.A. (2004) Development and testing of a general amber force field. J. Comput. Chem. 25, 1157–1174. https://doi.org/10.1002/jcc.20035
Trott O., Olson A.J. (2010) AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading. J. Comput. Chem. 31, 455–461. https://doi.org/10.1002/jcc.21334
Ruiz-Carmona S., Alvarez-Garcia D., Foloppe N., Garmendia-Doval A.B., Juhos S., Schmidtke P., Barril X., Hubbard R.E., Morley S.D. (2014) rDock: a fast, versatile and open source program for docking ligands to proteins and nucleic acids. PLoS Comput. Biol. 10, e1003571. https://doi.org/10.1371/journal.pcbi.1003571
Wang Z., Sun H., Yao X., Li D., Xu L., Li Y., Tian S., Hou T. (2016) Comprehensive evaluation of ten docking programs on a diverse set of protein–ligand complexes: the prediction accuracy of sampling power and scoring power. Phys. Chem. Chem. Phys. 18, 12964–12975. https://doi.org/10.1039/C6CP01555G
Gaudreault F., Najmanovich R.J. (2015) FlexAID: Revisiting Docking on Non-Native-Complex Structures. J. Chem. Inf. Model. 55, 1323–1336. https://doi.org/10.1021/acs.jcim.5b00078
Hotelling H. (1933) Analysis of a complex of statistical variables into principal components. J. Educ. Psychol. 24, 417–441. https://doi.org/10.1037/h0071325
Rehman S.U., Asghar S., Fong S., Sarasvady S. (2014) DBSCAN: past, present and future. IEEE. 232–238.
Grabski H., Tiratsuyan S. (2018) Mechanistic insights of the attenuation of quorum-sensing-dependent virulence factors of Pseudomonas aeruginosa: molecular modeling of the interaction of taxifolin with transcriptional regulator LasR. bioRxiv, 500157.
McKinney W. (2011) pandas: a foundational Python library for data analysis and statistics. Python High Perform. Sci. Comput. 14.
Pedregosa F., Varoquaux G., Gramfort A., Michel V., Thirion B., Grisel O., Blondel M., Prettenhofer P., Weiss R., Dubourg V., Vanderplas J., Passos A., Cournapeau D., Brucher M., Perrot M., Duchesnay E. (2011) Scikit-learn: machine learning in Python. J. Mach. Learn. Res. 12, 2825–2830.
O’Boyle N.M., Banck M., James C.A., Morley C., Vandermeersch T., Hutchison G.R. (2011) Open Babel: an open chemical toolbox. J. Cheminform. 3. https://doi.org/10.1186/1758-2946-3-33
Wallace A.C., Laskowski R.A., Thornton J.M. (1995) LIGPLOT: a program to generate schematic diagrams of protein-ligand interactions. Protein Eng. Des. Sel. 8, 127–134. https://doi.org/10.1093/protein/8.2.127
Peters T. (1996) All about Albumin: Biochemistry, Genetics, and Medical Applications. Academic Press, San Diego.
Fanali G., Di Masi A., Trezza V., Marino M., Fasano M., Ascenzi P. (2012) Human serum albumin: from bench to bedside. Mol. Aspects Med. 33, 209–290. https://doi.org/10.1016/j.mam.2011.12.002
Ma R., Guo D.X., Li H.F., Liu H.X., Zhang Y.R., Ji J.B., Xing J., Wang S.Q. (2019) Spectroscopic methodologies and molecular docking studies on the interaction of antimalarial drug piperaquine and its metabolites with human serum albumin. Spectrochim. Acta A Mol. Biomol. Spectrosc. 222, 117158. https://doi.org/10.1016/j.saa.2019.117158
Ross P.D., Subramanian S. (1981) Thermodynamics of protein association reactions: forces contributing to stability. Biochemistry. 20, 3096–3102. https://doi.org/10.1021/bi00514a017
Naik P.N., Chimatadar S.A., Nandibewoor S.T. (2010) Interaction between a potent corticosteroid drug – dexamethasone with bovine serum albumin and human serum albumin: a fluorescence quenching and fourier transformation infrared spectroscopy study. J. Photochem. Photobiol. B, Biol. 100, 147–159. https://doi.org/10.1016/j.jphotobiol.2010.05.014
Förster T. (1948) Energy transfer and fluorescence between molecules. Ann Phys. 437, 55–75.
Valeur B., Brochon J.C. (2001) New Trends in Fluorescence Spectroscopy: Applications to Chemical and Life Sciences. Springer, Berlin, Heidelberg.
Foresman J.B., Frisch A. (1996) Exploring Chemistry with Electronic Structure Methods. Sec. Ed. Pittsburgh, PA: Gaussian, Inc.
Wang Y.Q., Su J., Wu F., Lu P., Yuan L.F., Yuan W.E., Sheng J., Jin T. (2012) Biscarbamate cross-linked polyethylenimine derivative with low molecular weight, low cytotoxicity, and high efficiency for gene delivery. Int. J. Nanomedicine. 7, 693–704. https://doi.org/10.2147/IJN.S27849
Cai H.H., Yang P.H., Chen J., Liang Z.H., Chen Q., Cai J. (2009) Visual characterization and quantitative measurement of artemisinin-induced DNA breakage. Electrochim. Acta. 54, 3651–3656. https://doi.org/10.1016/j.electacta.2009.01.042
Navaratnam V., Mansor S.M., Sit N.W., Grace J., Li Q., Olliaro P. (2000) Pharmacokinetics of artemisinin-type compounds. Clin. Pharmacokinet. 39, 255–270. https://doi.org/10.2165/00003088-200039040-00002
Kimzey M.J., Yassine H.N., Riepel B.M., Tsaprailis G., Monks T.J., Lau S.S. (2011) New site(s) of methylglyoxal-modified human serum albumin, identified by multiple reaction monitoring, alter warfarin binding and prostaglandin metabolism. Chem. Biol. Interact. 192, 122–128. https://doi.org/10.1016/j.cbi.2010.09.032
Mimoto M.S., Karaca A., Scherberg N., Dumitrescu A.M., Refetoff S. (2018) Homozygous mutation in human serum albumin and its implication on thyroid tests. Thyroid. 28, 811–814. https://doi.org/10.1089/thy.2017.0564
Ha J.S., Ha C.E., Chao J.T., Petersen C.E., Theriault A., Bhagavan N.V. (2003) Human serum albumin and its structural variants mediate cholesterol efflux from cultured endothelial cells. Biochim. Biophys. Acta (BBA) – Mol. Cell. Res. 1640, 119–128. https://doi.org/10.1016/S0167-4889(03)00027-2
Дополнительные материалы
- скачать ESM.docx
- Supporting Material. Figure S1 - Figure S5.
Инструменты
Молекулярная биология