Молекулярная биология, 2022, T. 56, № 1, стр. 118-125
Cтруктурный анализ 5'-фланкирующей области гена, кодирующего альфа-фетопротеин человека
C. Zhang a, *, H. J. Zhao a, J. Wang a, W. Y. Zhou a, T. J. Zhang a, C. B. Zhang a, **
a National Center for Clinical Laboratories, Beijing Hospital, National Center of Gerontology;
Institute of Geriatric Medicine, Chinese Academy of Medical Sciences
Beijing, P.R. China
* E-mail: zc_mdy@163.com
** E-mail: cbzhang@nccl.org.cn
Поступила в редакцию 07.01.2021
После доработки 14.04.2021
Принята к публикации 18.05.2021
- EDN: NALKBU
- DOI: 10.31857/S0026898422010128
Аннотация
Альфа-фетопротеин (AFP) – фактор роста и сигнальная молекула, которая способствует развитию гепатоклеточной карциномы (НСС). Однако механизм “пробуждения” AFP в ходе прогрессии НСС не установлен. Структура 5'-фланкирующей регуляторной области гена AFP изучена с использованием двойных люциферазных репортерных векторов с фрагментами этой области. Репортерные конструкции вводили в линии клеток гепатомы НерG2 и PLC. Регуляторные 5'-фланкирующие последовательности –1871…–1004 п.н. AFP стимулировали транскрипцию гена, тогда как влияние последовательности –1004…–667 п.н. было слабым. Фрагмент, расположенный между положениями –667 и –448 п.н., ингибировал транскрипционную активность гена AFP, тогда как фрагмент –448…–287 п.н. усиливал экспрессию AFP. Действие прилегающей промоторной последовательности было слабым. Картированы множественные сайты связывания факторов транскрипции.
ВВЕДЕНИЕ
Ген альфа-фетопротеина (AFP) человека, состоящий из 14 экзонов и 15 интронов, локализован в хромосоме 4. Зрелая мРНК AFP имеет длину 2039 н. и кодирует 609 аминокислотных остатков, включая 19 N-концевых, образующих сигнальный пептид. Белок AFP, входящий в семейство альбуминов, модифицирован аминосахарами [1, 2]. В это семейство входят альбумин, белок, связывающий витамин D, и альфа-глобулин [3]. Структура белков этого семейства поддерживается дисульфидными связями, образованными остатками цистеина. Белок сворачивается с образованием U-образного домена.
AFP экспрессируется в фетальном периоде и способствует росту и развитию плода. Ген AFP реактивируется в ходе доброкачественной регенерации печени у взрослых или при развитии гепатоклеточной карциномы (НСС). С начала 1970-х AFP используется в качестве диагностического маркера первичной НСС. Механизмы реэкспрессии AFP понятны не полностью, а изучению регуляторной области гена AFP посвящено ограниченное число исследований. Ранее установили, что регуляторные элементы гена AFP мыши локализованы в вышележащем участке (–1.0…–7.6 т.п.н.), а 5'‑фланкирующая область –3.8 т.п.н. регуляторной области способна значительно усиливать транскрипционную активность гена AFP, независимо от ее локализации [4]. Энхансеры гена AFP человека расположены в области –4.0…–3.3 т.п.н., что примерно совпадает с их локализацией в гене мыши, а их активность также не зависит от характера локализации. Однако сайленсер гена AFP человека находится во фрагменте –1.8 т.п.н. 5'-фланкирующей области, тогда как промотор найден в положении –1.0 т.п.н. вышележащей области [5].
Учитывая, что большая часть результатов изучения AFP опубликована в 1980-х, мы сфокусировались на изучении участка гена AFP, расположенного в области –1.8 т.п.н. Путем конструирования репортерных генов люциферазы с разными фрагментами регуляторной области определена локализация сайленсера и промотора в гене AFP, что создает структурные основы для исследований аномальной экспрессии гена AFP в клетках гепатомы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные культуры. Клетки HepG2 и PLC/PRF/5 хранили в жидком азоте. Клетки оттаивали, культивировали в среде DMEM (High Glucose) фирмы “Gibco”, содержащей 10% фетальной сыворотки крупного рогатого скота. Клетки инкубировали при 37°C в присутствии 5% CO2.
Конструирование плазмид. Плазмиды PLuc1-4, содержащие фрагменты 5'-фланкирующей области гена AFP разной длины (1871, 1567, 1004, 677, 448, 287 и 215 п.н.), сконструированы путем встраивания этих фрагментов по сайтам KpnI и MluI. Матрицей для амплификации фрагментов 5'-фланкирующей области гена AFP человека служила геномная ДНК человека. Сначала амплифицировали самый длинный фрагмент (1871 п.н.), а затем использовали его в качестве матрицы для амплификации остальных фрагментов. Последовательность олигонуклеотидов, использованных для анализа плазмидных конструкций, приведены в табл. S1 (см. Приложение на сайте http://www.molecbio.ru/downloads/2022/1/supp_Zhang_rus.pdf) .
ПЦР-амплификацию фрагментов гена AFP проводили в следующих условиях.
Предварительная денатурация – 94°C, 2 мин. Затем 30 циклов:
Все плазмиды, использованные в опытах по трансфекции, получали, используя набор для крупномасштабной очистки (“Tiangen Biotech”, КНР), в соответствии с инструкциями производителя. Клетки трансфицировали плазмидами, используя липофектамин 3000 (“Thermo Fischer”, Waltham, США), согласно рекомендациям производителя. В качестве контроля использовали плазмиду pGL3-Basic .
Предсказание сайтов связывания факторов транскрипции. Программы Genomatix MatInspector (https://www.genomatix.de/index.html) и JASPAR (http://jaspar.genereg.net/) использовали для предсказания сайтов связывания факторов транскрипции.
Трансфекция плазмид. Плазмидно-липосомный комплекс готовили в следующей дозировке (в расчете на ячейку шестилуночного планшета): 1 мкл липофектамина добавляли в 100 мкл среды Opti-MEM™ и тщательно перемешивали в течение 5 мин. Затем 4 мкг плазмиды добавляли в 100 мкл Opti-MEM™ и инкубировали при комнатной температуре в течение 5 мин. Эти две смеси объединяли, аккуратно перемешивали и инкубировали в течение 20 мин при комнатной температуре. Затем плазмидно-липосомный комплекс добавляли по каплям в бессывороточную среду DMEM. После инкубации в течение 4–6 ч при 37°С заменяли культуральную среду. Через 24 ч после трансфекции определяли активность люциферазы.
Анализ люциферазной активности. Активность репортерного гена люциферазы определяли согласно [6], используя Dual Luciferase Assay System (“Promega”, США). Активность люциферазы светлячка нормировали по активности люциферазы Renilla. В качестве отрицательного контроля использовали вектор pGL3-Basic.
Статистический анализ. Результаты представляли как средние значения ± SD, вычисленные из результатов по меньшей мере трех независимых экспериментов. Статистическую значимости определяли с использованием t-теста Стъюдента. Значения р < 0.05 считали статистически значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
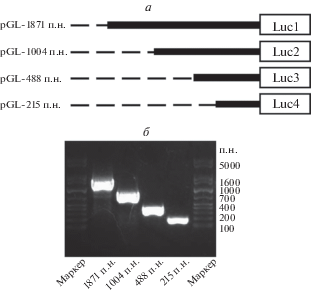
Конструирование плазмид с укороченной 5'-фланкирующей областью гена AFP
На основании сообщений о регуляторной последовательности 5'-фланкирующей области AFP, сконструированы укороченные варианты (pluc1-1871 п.н., pluc2-1004 п.н., pluc3-488 п.н. и pluc4-215 п.н.) (рис. 1а). Условия проведения ПЦР на колониях, электрофореза в агарозном геле, секвенирования и других экспериментов были оптимизированы для подтверждения успешного конструирования укороченных вариантов 5'-фланкирующей области гена AFP (рис. 1б).
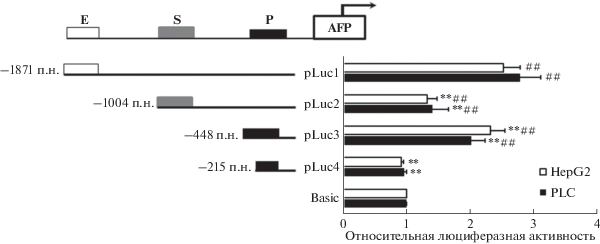
Анализ транскрипционной активности фрагментов 5'-фланкирующей области гена AFP
Плазмидами (pLuc1–4), содержащими фрагменты 5'-фланкирующей области гена AFP, трансфицировали клетки линий HepG2 и PLC и через 24 ч определяли люциферазную активость (рис. 2). Значительное повышение люциферазной активности плазмиды pLuc1 по сравнению с контролем (pL3-Basic) указывает на то, что эта последовательность может способствовать транскрипции гена AFP. Люциферазная активность pLuc2 была значительно ниже, чем у pLuc1, что указывает на ингибирование транскрипции областью –1871…–1004 п.н. Однако люциферазная активность pLuc3 значительно превышала активность pLuc2, т.е. область –1004…–448 п.н. может содержать последовательности, подавляющие транскрипцию. Делеция области –448…–215 п.н. приводила к заметному снижению люциферазной активности, т.е. эта часть последовательности может способствовать транскрипции. Плазмида pLuc4 обеспечивала почти такую же активность люциферазы, как и контрольная pGL-Basic, т.е. 215 п.н. вышележащей последовательности гена AFP могут вносить небольшой вклад в активацию транскрипции или индуцирующие и ингибирующие эффекты могут действовать антагонистически. Нами проведен ПЦР-анализ содержания мРНК люциферазы светлячка и получены такие же результаты (рис. S1 , см. Приложение на сайте http://www.molecbio.ru/downloads/2022/1/supp_ Zhang_rus.pdf). Следовало проанализировать сайты связывания факторов транскрипции в разных последовательностях и детализировать специфические сайты регуляции транскрипции в 5'‑фланкирующей области гена AFP.
Рис. 2.
Анализ люциферазной активности, обеспечиваемой 5'-укороченными фрагментами гена AFP в трансфицированных клетках HepG2 и PLC. Трансфекция плазмид, содержащих регуляторные последовательности разной длины, в клетки HepG2 и PLC приводила к изменению люциферазной активности. Приведены репрезентативные результаты экспериментов, проведенных по меньшей мере в трех повторах: *p < 0.05, **р < 0.01 по сравнению с контролем.
Анализ сайтов связывания факторов транскрипции в 5'-фланкирующей области гена AFP
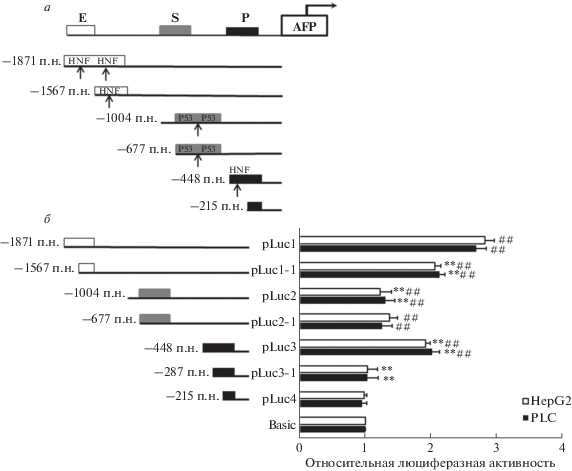
В начале 1990-х показали, что уровень экспрессии AFP контролируется двумя взаимоисключающими транс-действующими факторами: ядерным фактором гепатоцитов 1 (HNF-1) и P53. HNF1 повышает уровень экспрессии AFP, тогда как P53 ингибирует экспрессию. Ингибирующее действие усиливалось после ацетилирования Р53 гистонацетилазой р300 [7]. Анализ сайтов связывания факторов транскрипции в 5'-фланкирующей области AFP (1871 п.н.) выявил четыре сайта связывания NF1 в положении между –1871 и –1004 п.н. Эти данные, а также результаты, представленные на рис. 2, свидетельствуют о том, что четыре обнаруженных сайта связывания могут играть значимую роль в транскрипции гена. Два сайта связывания P53 найдены между положениями –677 и –448 п.н. Транскрипционная активность, как показано на рис. 2, значительно возрастает при делеции участка ‒1004…–448 п.н., что может быть ассоциировано с ингибирующим действием P53. Главная роль последовательности –1004…–677 п.н. нуждается в дополнительной верификации. В участке –448…–215 п.н. идентифицирован только один сайт связывания HNF1. Для проверки возможной роли этих сайтов в изменении транскрипционной активности сконструированы две плазмиды, содержащие сайты связывания HNF1 на границе.
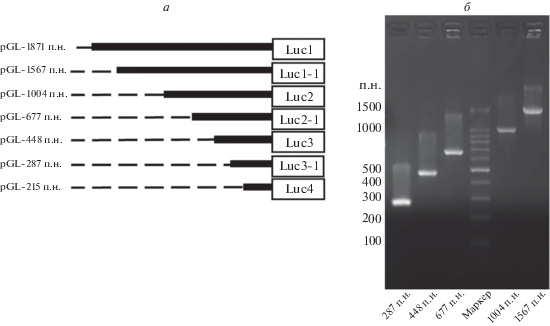
Конструирование плазмид с укороченной 5'-областью AFP на основе анализа сайтов связывания факторов транскрипции
Взяв за основу результаты анализа сайтов связывания факторов транскрипции, сконструировали дополнительные варианты плазмид с укороченными фрагментами 5'-области гена AFP (pLuc1-1, pLuc2-1 и pLuc3-1) из исходных плазмид pLuc1–4 (рис. 4а). Правильность конструкций подтвердили с помощью ПЦР, электрофореза в агарозном геле (рис. 4б) и секвенирования.
Рис. 4.
Конструирование плазмид с репортерным геном люциферазы, содержащих 5'-укороченные фрагменты гена AFP, на основе результатов анализа сайтов связывания факторов транскрипции. а – Схема 5 '-фланкирующей области гена AFP; б – Электрофореграмма продуктов ПЦР-амплификации 5'-укороченных фрагментов гена AFP в агарозном геле.
Картирование промоторного и сайленсерного элементов в 5'-фланкирующем субрегионе гена AFР
После предварительной верификации и предсказания сайтов связывания факторов транскрипции (рис. 2 и 3) и построили схему 5 '‑фланкирующей области гена AFP (рис. 5а). Сконструированными плазмидами трансфицировали клетки HepG2 и PLC. Люциферазную активность определяли через 24 ч после трансфекции. Показано, что люциферазная активность варианта, содержащего фрагмент 1567 п.н., полученный в результате делеции двух сайтов связывания HNF1, была значительно ниже, чем активность варианта размером 1871 п.н., что указывает на вклад этих двух сайтов в промоторную активность. Люциферазная активность варианта 1004 п.н. была значительно ниже, чем активность варианта 1567 п.н., что свидетельствует о том, что сайты связывания HNF1 в этой области также могут играть роль в транскрипции гена AFP. Люциферазна активность варианта 677 п.н. практически не отличается от активности варианта 1004 п.н. Люциферазная активность области размером 4486 п.н. значительно превышала активность вариантов 677 и 1004 п.н., что свидетельствует об ингибирующем действии сайтов связывания Р53 на транскрипцию гена AFP. Варианты размером 287 и 215 п.н. не вызывали значительного изменения люциферазной активности по сравнению с контролем, тогда как удаление фрагмента –448…–287 п.н. снижало люциферазную активность. Эти данные свидетельствуют о том, что сайты связывания HNF1 в области между –287 и –448 п.н. могут играть роль в транскрипции гена, тогда как вклад фрагмента 287 п.н. минимален. Можно также предположить, что эта последовательность может быть мишенью других ингибиторов. Плазмиды pLuc1, pLuc 1-1, pLuc2, pLuc 2-1 и pLuc3 обеспечивали значительно более высокую люциферазную активность, чем pGL3-Basic. Встроенные в них последовательности содержат регуляторные элементы, способствующие транскрипции гена AFP или одновременно ингибирующие и активирующие элементы, причем последние проявляют доминирующее действие (рис. 5б). Мы провели ПЦР-анализ содержания мРНК люциферазы и получили такие же результаты (рис. S2 , см. Приложение на сайте http://www.molecbio.ru/ downloads/2022/1/supp_Zhang_rus.pdf).
Рис. 5.
Анализ люциферазной активности, обеспечиваемой различными 5'-укороченными фрагментами гена AFP человека в трансфицированных клетках HepG2 и PLC. а – Паттерны распределения HNF1 и P53; б – изменение люциферазной активности после трансфекции клеток HepG2 и PLC плазмидами, содержащими регуляторные последовательности разной длины. *р < 0.05, **р < 0.01 по сравнению с контролем. Опыты проводили в трех повторностях.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
AFP входит в суперсемейство альбуминов, которое включает AFP, сывороточный альбумин, белок, связывающий витамин D, и альфа-альбумин [8]. Изучение регуляторных участков гена AFP проведено в прошлом столетии. Поиск по ключевым словам “AFP gene expression” и “AFP transcriptional regulation” в базе данных PubMed не находит ссылок на работы последнего десятилетия. К настоящему времени в регуляторных областях генов AFP мыши и крысы выявлены три дальних энхансера, промотор и сайленсер, однако известно несколько работ, посвященных гену AFP человека [9]. Хотя общая структура регуляторной области гена AFP у этих видов имеет значительное сходство, точная локализация и детальная структура этих элементов у мыши, крысы и человека имеют некоторые различия [10]. Экспрессия AFP характеризуется высокой тканевой специфичностью и строгой временной регуляцией. Во взрослой печени AFP почти не экспрессируется или экспрессируется на очень низком уровне [11]. Показано также, что в разных линиях клеток гепатомы с высоким, средним и низким уровнем экспрессии AFP AT-мотив-связывающий фактор 1 подтипа А (ATBF1) может ингибировать экспрессию гена AFP, подавляя активность энхансеров, а подтип В ATBF1 играет как активирующую, так и ингибирующую роль [12].
Удаление фрагмента –677…–448 п.н. из плазмиды, содержащей регуляторную последовательность транскрипции AFP, приводило к значительному повышению люциферазной активности, что свидетельствует об увеличении транскрипционной активности гена AFP. Анализ сайтов связывания факторов транскрипции выявил два сайта связывания Р53 в этой области. Ранее обнаружили, что делеция Р53 связана с повышением экспрессии AFP, тогда как ингибирование AFP устраняется путем РНК-интерференции Р53 в клетках гепатомы [13]. Это согласуется с уже известными и новыми данными. HNF-1 – это активатор транскрипции гена AFP. Нами обнаружено значительное снижение активности люциферазы после удаления сайтов связывания HNF. Однако следует отметить, что сайты связывания HNF выявлены в области –287…–215 п.н., но транскрипционная активность остается практически неизменной. В этом участке обнаружены два сайта связывания NF-1. Поскольку NF-1 является мощным ингибитором активности промотора AFP, конкуренция между NF-1 и HNF-1 может быть ключом к регуляции транскрипционной активности [14]. Таким образом, изменение баланса этих транс-действующих факторов может строго регулировать активность промотора гена AFP в ходе развития печени и в канцерогенезе.
Примерно у 60–70% пациентов с НСС обнаружен аномальный уровень AFP в сыворотке, а ранее показали важную роль реэкспрессии AFP в развитии НСС [6, 15]. Хотя высказываются предположения, что реэкспрессия AFP может быть связана с активацией прогениторных клеток печени и с ослаблением ингибирующего действия фактора транскрипции Р53. Однако механизм реэкспрессии AFP не установлен. Изучение функции AFP показало, что этот белок может способствовать пролиферации опухолевых клеток и ингибировать апоптоз, участвуя в избегании иммунного контроля, активации PI3K/Akt и интерференции с сигнальным путем каспазы-3 [16, 17]. Таким образом, изучение структуры регуляторной области гена AFP позволит понять основы реэкспрессии AFP и разработать подходы к терапии НСС. Хотя показано, что в области –4.0…–3.3 т.п.н. находятся определенные энхансеры гена AFP, сайты связывания факторов транскрипции локализованы преимущественно в области –1.8 т.п.н. Считалось, что между этими двумя участками расположена нефункциональная область размером 1.5 т.п.н., поэтому наше исследование было сфокусировано на области –1.8 т.п.н. В дальнейшем мы объединили области –4.0…–3.3 и –1.8 т.п.н. с целью более детального и всестороннего изучения регуляторных последовательностей гена AFP.
Мы признательны Wenting Hou за помощь в редактировании статьи.
Выполнение работы получил поддержку National Natural Science Foundation of China (No. 82003809) Beijing Hospital Nova Project (BJ-2020-087), Beijing Hospital Doctoral Scholars Foundation (BJ-2019-148).
В работе не использовали животных и людей в качестве объекта исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Morinaga T., Sakai M., Wegmann T.G., Tamaoki T. (1983) Primary structures of human alpha-fetoprotein and its mRNA. Proc. Natl. Acad. Sci. USA. 80, 4604–4608.
Sakai M., Morinaga T., Urano Y., Watanabe K., Wegmann T.G., Tamaoki T. (1985) The human alpha-fetoprotein gene. Sequence organization and the 5' flanking region. J. Biol. Chem. 260, 5055–5060.
Dimitris K., Fern E., Paul R., Michael B., Robert S., Tilghman S.M. (1981) The evolution of α-fetoprotein and albumin. J. Biol. Chem. 256, 1960–1967.
Roseline G., Robert I., Tilghman S.M. (1986) Multiple regulatory elements in the intergenic region between the alpha-fetoprotein and albumin genes. Mol. Cell. Biol. 6, 477–487.
Nakabayashi H., Hashimoto T., Miyao Y., Tjong K.K., Chan J., Tamaoki T. (1991) A position-dependent silencer plays a major role in repressing alpha-fetoprotein expression in human hepatoma. Mol. Cell. Biol. 11, 5885–5893.
Zhang C., Chen X., Liu H., Li H., Jiang W., Hou W., McNutt M.A., Lu F., Li G. (2015) Alpha fetoprotein mediates HBx induced carcinogenesis in the hepatocyte cytoplasm. Int. J. Cancer. 137, 1818–1829.
Lee K.C., Crowe A.J., Barton M.C. (1999) p53-mediated repression of alpha-fetoprotein gene expression by specific DNA binding. Mol. Cell. Biol. 19, 1279–1288.
Терентьев А.А, Молдогазиева Т.Е. (2006) Структурно-функциональное картирование альфа-фетопротеина. Биохимия. 71(2), 152–172
Lienard P., Mees C., Dreze P.L., Dieu M., Dierick J.F., Raes M., Szpirer J., Szpirer C. (2006) Regulation of the alpha-fetoprotein promoter: Ku binding and DNA spatial conformation. Biochimie. 88, 1409–1417.
Miyake K., Takahashi M., Dohda T., Kaneoka H., Sato Y., Inayoshi Y., Kamihira M., Iijima S. (2005) Transcriptional regulation of the alpha-fetoprotein gene by SWI/SNF chromatin remodeling complex. Cytotechnology. 49, 143–151.
Zhang H., Cao D., Zhou L., Zhang Y., Guo X., Li H., Chen Y., Spear B.T., Wu J.W., Xie, Z., Zhang W.J. (2015) ZBTB20 is a sequence-specific transcriptional repressor of alpha-fetoprotein gene. Sci Rep. 5, 11979.
Ninomiya T., Mihara K., Fushimi K., Hayashi Y., Hashimoto-Tamaoki T., Tamaoki T. (2002) Regulation of the alpha-fetoprotein gene by the isoforms of ATBF1 transcription factor in human hepatoma. Hepatology. 35, 82–87.
Wilkinson D.S., Ogden S.K., Stratton S.A., Piechan J.L., Nguyen T.T., Smulian G.A., Barton M.C. (2005) A direct intersection between p53 and transforming growth factor beta pathways targets chromatin modification and transcription repression of the alpha-fetoprotein gene. Mol. Cell. Biol. 25, 1200–1212.
Bois-Joyeux B., Danan J.L. (1994) Members of the CAAT/enhancer-binding protein, hepatocyte nuclear factor-1 and nuclear factor-1 families can differentially modulate the activities of the rat alpha-fetoprotein promoter and enhancer. Biochem. J. 301(Pt 1), 49–55.
Zhang C., Liu P., Zhang C. (2020) Hepatitis B virus X protein upregulates alpha-fetoprotein to promote hepatocellular carcinoma by targeting miR-1236 and miR-329. J. Cell. Biochem. 121, 2489–2499.
Li M., Li H., Li C., Zhou S., Guo L., Liu H., Jiang W., Liu X., Li P., McNutt M.A., Li G. (2009) Alpha fetoprotein is a novel protein-binding partner for caspase-3 and blocks the apoptotic signaling pathway in human hepatoma cells. Int. J. Cancer. 124, 2845–2854.
Li M., Li H., Li C., Wang S., Jiang W., Liu Z., Zhou S., Liu X., McNutt M.A., Li G. (2011) Alpha-fetoprotein: a new member of intracellular signal molecules in regulation of the PI3K/AKT signaling in human hepatoma cell lines. Int. J. Cancer. 128, 524–532.
Дополнительные материалы
- скачать ESM.docx
- Table 1S. Sequences of oligonucleotides used for qRT-PCR and plasmid constructs assays.
Supplementary Figure 1. PCR analysis of luciferase mRNA conferred by different 5’-truncated fragments of human AFP gene in transfected HepG2 and PLC cells.
Supplementary Figure 2. PCR analysis of luciferase mRNA conferred by different 5’-truncated fragments of human AFP gene in transfected HepG2 and PLC cells.
Инструменты
Молекулярная биология