Молекулярная биология, 2022, T. 56, № 5, стр. 848-859
Получение “усиленных” естественных киллерных клеток с нокаутом генов CISH и B2M и оценка их цитотоксичности на культурах первичной глиобластомы
Г. М. Юсубалиева a, b, Э. Б. Дашинимаев c, А. А. Горчаков d, С. В. Кулемзин d, О. А. Бровкина a, А. А. Калинкин a, А. Г. Винокуров a, М. В. Ширманова e, А. В. Таранин d, В. П. Баклаушев a, b, *
a Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства России
115682 Москва, Россия
b Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
c Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117437 Москва, Россия
d Институт молекулярной и клеточной биологии Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
e Приволжский национальный исследовательский медицинский университет
603005 Н. Новгород, Россия
* E-mail: Baklaushev.vp@fnkc-fmba.ru
Поступила в редакцию 14.11.2021
После доработки 30.03.2022
Принята к публикации 30.03.2022
- EDN: TGXRSF
- DOI: 10.31857/S0026898422050159
Аннотация
В экспериментальном исследовании с помощью системы CRISPR/Cas9 на основе линии естественных киллерных клеток человека YT и созданной ранее линии YT-VAV1+, сверхэкспрессирующей белок VAV1, поддерживающий цитотоксичность, получены две “усиленные” линии клеток с нокаутом гена белка CIS, негативного регулятора цитотоксичности NK-клеток, понижающего чувствительность этих клеток к IL-15. Получены также линии с нокаутом гена β2-микроглобулина, обеспечивающего экспонирование MHC класса I на мембране NK-клеток. Эффективность нокаута определяли методом ПЦР в реальном времени; отсутствие β2-микроглобулина подтверждали с помощью проточной цитометрии со специфическими антителами. Цитотоксичность линий клеток с нокаутом CISH–/– или B2M–/– тестировали на первичных монослойных культурах клеток мультиформной глиобластомы человека. Цитотоксичность полученных линий оценивали с помощью клеточного анализатора, регистрирующего клеточный индекс на основе импеданса клеток. Показано, что YT-CISH–/– эффективнее, чем YT дикого типа элиминируют клетки первичной глиобластомы в условиях эксперимента in vitro с клеточным монослоем. Цитотоксичность линий YT-VAV1+-CISH–/– и YT-VAV1+B2M–/– в отношении клеток глиобластомы была наиболее выраженной, но не отличалась значимо от исходно повышенной цитотоксичности линии YT-VAV1+. Полученные линии NK-подобных клеток могут служить прототипом для создания аллогенных и аутологичных “усиленных” NK- и CAR-NK-клеток для иммунотерапии мультиформной глиобластомы.
ВВЕДЕНИЕ
Естественные киллерные клетки (NK) ‒ это лимфоциты, способные уничтожать инфицированные вирусом или трансформированные клетки путем прямой цитотоксической атаки. NK-клетки служат первой линией системы врожденной иммунной защиты, они находятся в периферическом кровотоке и лимфоидных структурах. Рассматривается возможность использования NK-клеток при проведении адоптивной иммунотерапии солидных опухолей [1]. Изучается возможность применения как нативных аутологичных и аллогенных NK-клеток из пуповинной крови, так и подвергнутых генно-инженерным модификациям (CAR-NK), нацеленным на различные опухоль-специфические антигены [2].
Главную проблему для адоптивной иммунотерапии любых солидных опухолей представляет их иммуносупрессивное микроокружение, инактивирующее любые цитотоксические противоопухолевые клетки, включая NK [3‒5]. Попытки усилить цитотоксичность NK-клеток заключаются, например, в модификации генов сигнальных путей, участвующих в прямой или опосредованной цитокинами активации NK-клеток [6‒10]. Одной из потенциальных мишеней для опосредованной цитокинами активации NK-клеток считается CIS ‒ SH2-содержащий индуцируемый цитокинами белок, кодируемый геном CISH. СIS снижает восприимчивость NK-клеток к IL-15 и таким образом является мощной контрольной точкой инактивации их цитотоксичности. Делеция гена CISH многократно уменьшает порог чувствительности NK-клеток к IL-15, вследствие чего эти клетки могут активироваться на фоне очень низкой концентрации IL-15 в тканях, что приводит к значительному усилению их противоопухолевой цитотоксичности [11]. В экспериментальных исследованиях показано, что NK-клетки с нокаутом CISH эффективно элиминируют солидные опухолевые очаги, включая множественные отдаленные метастазы.
Еще один подход к увеличению противоопухолевой активности NK-клеток ‒ повышение экспрессии белков, усиливающих цитотоксичность. Один из таких белков ‒VAV1 ‒ входит в семейство факторов обмена гуаниновых нуклеотидов (GEF). Ранее нами было показано, что NK-клетки, сверхэкспрессирующие VAV1, проявляют значимо бóльшую цитотоксическую активность в отношении различных опухолевых мишеней [12].
Одним из возможных ограничений на пути к широкому клиническому применению аллогенных NK-клеток может быть их элиминация Т-лимфоцитами хозяина в результате реакции хозяин против трансплантата [13]. Чтобы исключить возможность этого процесса мы предлагаем получить и исследовать NK-клеточные линии, лишенные HLA. Известно, что молекулы HLA-I экспонируются на мембране иммунных клеток в виде гетеродимерного мембранного комплекса, состоящего из кодируемой MHC тяжелой цепи класса I, легкой цепи β2-микроглобулина (B2M) и короткого пептида длиной 8–10 аминокислотных остатков. Делеция гена B2M приводит к тому, что структура HLA-I нарушается и становится нефункциональной. Таким образом, с помощью нокаута B2M можно создать универсальные NK-клетки, не экспонирующие HLA-I.
Цель нашей работы состояла в том, чтобы объединить модификации NK-клеток путем нокаута гена CISH в полученных ранее сверхэкспрессирующих VAV1 NK-клетках, а также нокаута B2M в VAV1+ NK-клетках и оценить цитотоксические свойства полученных клеточных линий на опухолевом монослое клеток мультиформной глиобластомы человека.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные линии и их культивирование. Создание биобанка первичных линий мультиформной глиобластомы одобрено Локальным этическим комитетом ФНКЦ ФМБА России (Протокол № 16 от 30 сентября 2017, дополнение Протокол № 10 от 6 октября 2020). Забор биоматериала проводили в соответствии с Хельсинкской декларацией и более поздними поправками к ней [14]. В исследование включены пациенты с супратенториальной глиомой, подтвержденной МРТ и гистологически верифицированной как мультиформная глиобластома. Все пациенты дали письменное информированное согласие на участие в исследовании. Образцы интраоперационного материала собраны в период с 2018 по 2020 годы, диагностику опухолей проводили в соответствии с четвертым изданием классификации опухолей центральной нервной системы Всемирной организации здравоохранения [15]. Все доноры биоматериала прошли тестирование на гемотрансмиссивные инфекции.
Опухолевую ткань глиобластомы собирали во время хирургического вмешательства в условиях операционной в стерильные пробирки с раствором для хранения тканей Macs Tissue Storage Solution (“Milteny Biotech”, США). Опухолевую ткань промывали в стерильных условиях в PBS (фосфатно-солевой буфер, “ThermoFisher Scientific”, США) с добавлением антибиотика-антимикотика (×100) (“ThermoFisher Scientific”), измельчали с помощью скальпеля, а затем подвергали ферментативной диссоциации смесью коллагеназы типа I (“Sigma-Aldrich”, США), диспазы (“Sigma-Aldrich”) и ДНКазы I (“Sigma Aldrich”) в PBS (“ThermoFisher Scientific”). Ферментативную диссоциацию проводили в инкубаторе (37°C, 5% CO2) при постоянном покачивании (30 мин–1 ч). Клетки центрифугировали при 300 g в течение 5 мин при 4°C, ресуспендировали в DMEM с добавлением 10% фетальной сыворотки крупного рогатого скота (FBS, “ThermoFisher Scientific”) и высевали в матрас (25 см2). В дальнейших экспериментах in vitro использовали пять перевиваемых линий, полученных из первичной культуры глиомы, прошедших более 20 пассажей и сохранивших экспрессию маркеров глиобластомы.
Клеточные линии YT и NK92 любезно предоставлены А.В. Филатовым (лаборатория иммунохимии, Институт иммунологии, Москва). Клетки YT культивировали в среде Iscove׳s Modified Dulbecco’s Medium (IMDM, “Gibco”, США) с добавлением 10% FBS, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина в CO2-инкубаторе в атмосфере 5% CO2 при 37°С.
Создание VAV1-сверхэкспрессирующей линии NK-клеток человека. Ранее нами был сконструирован лентивирусный вектор, содержащий кассету c Vav1-IRES-copGFP под конститутивным промотором EF1a. С использованием этого вектора получены лентивирусные частицы, проведена трансдукция линии YT и получена линия YT-VAV1+, обладающая более выраженной цитотоксичностью в отношении метастазирующих карцином и некоторых других опухолей [12].
Конструирование векторов для нокаута B2M и СISH в YT-клетках дикого типа и YT-VAV1+. Для конструирования протоспейсеров в качестве гидовых РНК использовали последовательности, описанные ранее для B2M [16] и CISH [11] (табл. 1). Последовательности вариабельных участков гидовых РНК для B2M длиной 20 нуклеотидов, выбранные согласно программам онлайн ресурсов BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi) и CHOPCHOP (http://chopchop.cbu.uib.no/), комплементарны последовательностям нуклеотидов в первом экзоне гена B2M. Точки разрыва при использовании обеих гидовых РНК создают делецию 32 нуклеотидов, что позволяет вызвать сдвиг рамки считывания и нокаут гена (рис. 1).
Таблица 1.
Гидовые РНК, использованные для нокаута генов B2M и CISH
| Гидовая РНК | Нуклеотидная последовательность |
|---|---|
| gRNA_B2M1 | CGCGAGCACAGCTAAGGCCA |
| gRNA_B2M2 | GCTACTCTCTCTTTCTGGCC |
| gRNA_CISH3 | TCGGGCCTCGCTGGCCGTAA |
| gRNA_CISH4 | CAGACTCACCAGATTCCCGA |
Рис. 1.
Положение гидовых РНК для нокаута гена B2M на последовательности первого экзона гена B2M (подчеркнуто). Старт-кодон рамки считывания белоккодирующей последовательности выделен зеленым. Точки разрезания геномной ДНК выделены красным цветом, ожидаемая делеция находится между двумя красными участками.

Последовательности вариабельных участков гидовой РНК для гена CISH (20 нуклеотидов), выбранные согласно программам онлайн-ресурса CRISPR.tefor.net, комплементарны последовательностям нуклеотидов во втором и третьем экзонах гена CISH. Точки разрыва, полученные при использовании обеих гидовых РНК, создают делецию 259 нуклеотидов, включающую короткий интрон между экзонами 2 и 3. При этом пропадают также небольшие участки белоккодирующей последовательности, что в итоге приводит к делеции 29 нуклеотидов в обеих известных изоформах мРНК гена CISH и к сдвигу рамки считывания с последующим нокаутом (рис. 2).
Рис. 2.
Положение гидовых РНК для нокаута гена CISH на последовательности второго и третьего экзонов гена CISH (подчеркнуто). Стоп-кодон рамки считывания белоккодирующей последовательности выделен синим цветом. Точки разрезания геномной ДНК показаны красным, ожидаемая делеция находится между двумя красными участками.

Последовательности гидовых РНК были клонированы в плазмидный вектор pU6-gRNA для экспрессии под U6-промотором. Этот вектор любезно предоставлен Б. Скрябиным (университет г. Мюнстера, Германия). Работоспособность полученных конструкций pU6-gRNA_B2M1, pU6-gRNA_B2M2, pU6-gRNA_CISH-3 и pU6-gRNA_ CISH-4 оценили на клеточной линии иммортализованных фибробластов кожи человека 1608hT-Cas9 с конститутивной экспрессией белка spCas9. Данная клеточная линия приобретена в клеточном банке ИБР РАН (Москва, Россия). С этой целью клетки 1608hT-Cas9 трансфицировали плазмидами (по 5 мкг каждой) при помощи электропорации на приборе Bio-Rad Gene Pulser Xcell по следующей программе: три прямоугольных импульса амплитудой 255 В с шириной 5 мс, расстояние между пульсами 0.1 с в буфере для электропорации Gene Pulser Electroporation Buffer (“Bio-Rad”, #1652677). Через 7 дней из клеток стандартным методом выделяли геномную ДНК с использованием очистки смесью фенол–хлороформ. Возникающие делеции на данном этапе анализировали с помощью стандартного T7E1-анализа (с использованием T7-эндонуклеазы 1) после проведения ПЦР с праймерами, фланкирующими таргетные области делеции генов B2M и CISH (табл. 2).
Таблица 2.
Нуклеотидные последовательности праймеров, фланкирующих таргетные области делеции генов B2M и CISH
| Праймер | Нуклеотидная последовательность | Тотж, °С | Ампликон, размер, п.н. |
|---|---|---|---|
| B2M-F | CCTTCTTAAACATCACGAGAC | 62.3 | 183 |
| B2M-R | GAGGGTAGGAGAGACTCA | 62.2 | |
| CISH-F | GAGGATCTGCTGTGCATA | 62.7 | 137 |
| CISH-R | GTGCTGTCACGTACTAAG | 61.2 |
Продукты ПЦР перед обработкой T7E1 подвергали процедуре переотжига (реаннилинг) при 95°С, а затем охлаждали до 25°С с образованием гетеродуплексов исследуемых фрагментов ДНК. В протоколе использовали нуклеазу T7E1 (“New England Biolabs”, Великобритания). На одну реакцию объемом 20 мкл добавляли 1 ед. акт. фермента. Смесь гетеродуплексов и нуклеазы перемешивали и инкубировали при 37°С в течение 30 мин. Далее с помощью гель-электрофореза без предварительной очистки продуктов определяли присутствие делеции в клетках.
Для нокаута генов B2M и CISH в линии NK-клеток YT проведена котрансфекция клеток плазмидами pU6-gRNA_B2M1, pU6-gRNA_B2M2 и pU6-gRNA_CISH-3, pU6-gRNA_CISH-4 и плазмидой pCas9-IRES2-EGFP, экспрессирующей под CMV-промотором spCas9 и ген флуоресцентного белка EGFP через IRES2-переход (соотношение плазмид 5/5/10 мкг соответственно). Плазмида pCas9-IRES2-EGFP синтезирована в компании “Евроген” (карта плазмиды pCas9-IRES2-EGFP представлена в Дополнительных материалах, см. на сайте http://www.molecbio.ru/downloads/2022/5/ supp_Yusubalieva_rus.pdf). Трансфекция проведена при помощи электропорации на приборе Bio-Rad Gene Pulser Xcell. Параметры электропорации: три прямоугольных импульса амплитудой 220 В с шириной 5 мс, расстояние между пульсами 0.1 с, буфер для электропорации Gene Pulser Electroporation Buffer (“Bio-Rad”, #1652677). После электропорации клетки помещали в полную ростовую среду (RPMI1540, 10% FBS, 3300 ME/мл IL-2, 50 Ед./мл пенициллина, 50 мкг/мл стрептомицина) на 3 суток. Эффективность трансфекции и выживаемость клеток оценивали с использованием проточной цитометрии c функцией сортинга Bio-Rad S3.
NK-клеточные линии. На основе библиотечной линии YT дикого типа (YTwt) и линии YT-VAV1+, сверхэкспрессирующей белок VAV1 [12], нами получены четыре модифицированные NK-клеточные линии с повышенной цитотоксичностью (табл. 3).
Таблица 3.
Характеристика модифицированных NK-клеточных линий
| Исходная линия | Модифицированная линия | Вид модификации |
|---|---|---|
| YTwt (wild type) | YT CISH–/– | Нокаут гена CISH |
| YTwt | YT B2M–/– | Нокаут гена B2M |
| YT VAV1+ | YT VAV1+CISH–/– | Сверхэкспрессия белка VAV1 в комбинации с нокаутом гена CISH |
| YT VAV1+ | YT VAV1+B2M–/– | Сверхэкспрессия белка VAV1 в комбинации с нокаутом гена B2M |
Иммуноцитохимические методы. В культивируемых клетках первичной глиобластомы с помощью проточной цитометрии и конфокальной микроскопии оценивали экспрессию фибриллярного кислого белка (GFAP), нестина (Ne), Cх43, CD133, CD44, CD70.
Клетки глиомы выращивали в чашках Петри диаметром 30 мм до образования монослоя. Готовые клетки после удаления среды и промывки PBS фиксировали 4%-ным параформальдегидом (10 мин, +4°С). После трехкратной промывки в PBS блокировали неспецифическое связывание (инкубация при комнатной температуре с 5%-ной сывороткой козы в течение 30 мин). Затем в чашки Петри с клетками последовательно вносили коктейли первичных антител (анти-Ne/GFAP, IgG мыши; + анти-CD133/Ki67, IgG кролика) в концентрации 1‒5 мкг/мл, инкубировали в течение 1 ч при +37°C, промывали 3 раза и вносили коктейль вторичных антител (антимышиные антитела козы Alexa Fluor 488, антикроличьи антитела козы Alexa Fluor 633, “Invitrogen”, 1 мкг/мл). После инкубации в течение 1 ч при 37°C и трехкратной промывки ядра клеток окрашивали Hoechst (“Invitrogen”) по протоколу изготовителя, препараты заключали в 50%-ный забуференный глицерин и микроскопировали (конфокальный микроскоп Nicon А1, Япония).
Исследуемые белки выявляли методом проточной цитометрии с использованием первично меченных антител. При анализе клеток глиомы экспрессию маркеров стволовости оценивали с помощью антител: CD133-PE, CD44-PE, CD70-APC-Vio770. Для прижизненной окраски суспензии YT-клеток после нокаута B2M и CISH использовали антитела фирмы “Biolegend” против β2-микроглобулина (#316304, clone 2M2) конъюгированные с красителем PE, и антитела к CIS (D4C10, #8431, “Cell Signaling Technology”, США) соответственно. Окрашивание проводили по стандартному протоколу с инкубацией в течение 30 мин в минимальном объеме раствора первично меченных антител (5 мкг/мл) в DPBS (“ПанЭко”, Россия) с последующей трехкратной отмывкой в DPBS, с осаждением центрифугированием на каждом этапе. Окрашенные клетки анализировали с помощью проточного цитометра MACSQuant (“Miltenyi Biotec”). Результаты обрабатывали с использованием программного обеспечения FlowJo (“Tree Star”).
Анализ цитотоксичности в реальном времени. Платформа RTCA iCelligenece (ACEA “Biosciences, Inc.”, США) позволяет проводить динамическое исследование пролиферации и цитотоксической активности. Метод основан на измерении импеданса клеточного монослоя с помощью золотых микроэлектродов. Адгезионные клетки (клетки первичной глиобластомы) действуют как изолятор на поверхности электрода, увеличивая импеданс. Чем выше скорость пролиферации и адгезии клеток, тем круче кривая роста импеданса. На основании этих параметров определяют клеточный индекс (CI), характеризующий уровень пролиферации или клеточной гибели.
Все эксперименты проводили при 37°С в атмосфере с 5% СО2. E-планшеты (культуральные планшеты для системы iCELLigence), содержащие 200 мкл культуральной среды в каждой лунке, уравновешивали до 37°C в течение 30 мин и устанавливали нулевой уровень CI. С помощью реагента TripLE Express (“ThermoFisher”) клетки первичной глиобластомы снимали с матраса, отмывали в среде PRMI и подсчитывали. По 103 клеток ресуспендировали в 200 мкл среды RPMI c 3%-ной аллогенной сывороткой человека группы AB(IV) (“Inc. Innovance”, США) и вносили в лунки планшета iCelligence. Планшет устанавливали в анализатор и оставляли в инкубаторе на 24‒48 ч до выхода кривой клеточного индекса на плато.
Важно отметить, что клетки первичной глиобластомы имеют различные индексы пролиферации вследствие выраженной генетической гетерогенности. На первых пассажах почти все первичные культуры содержат несколько различных клонов с разными уровнями плоидности. Поэтому для получения воспроизводимых результатов мы анализировали цитотоксичность модифицированных киллерных клеток на пяти независимо полученных культурах, прошедших не менее 20 пассажей и сохраняющих стабильную экспрессию маркеров глиобластомы и высокую пролиферативную активность.
В качестве контроля использовали лунки с глиомными клетками без последующего внесения клеток-эффекторов, лунки с внесенными клетками-эффекторами без клеток мишеней и лунки со средой для культивирования без клеток. Все исследования проводили в двух повторах. Клетки-эффекторы вносили в соотношении мишень: эффектор 1 : 1 и регистрировали динамику клеточного индекса в течение 144 ч. Среду в лунках с клетками глиомы перед внесением клеток-эффекторов заменяли на свежую, вносили клетки-эффекторы в среде RPMI c 3%-ной аллогенной сывороткой человека.
Статистический анализ выполнен в программе Prism software (GraphPad version 8.0) с помощью однофакторного дисперсионного анализа (one-way ANOVA). Данные представлены как среднее ± ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Создание и иммунофенотипирование первичных перевиваемых культур глиобластомы
На первом этапе была создана коллекция из 20 первичных перевиваемых культур глиобластомы человека, полученных из образцов интраоперационно удаленного биоматериала от пациентов, оперированных в нейрохирургических отделениях Федерального научно-клинического центра ФМБА России и Приволжского исследовательского медицинского университета Минздрава России. При гистологическом исследовании образцов интраоперационного материала наблюдалась картина ядерной атипии, клеточного полиморфизма, выраженной митотической активности, тромбозы сосудов, микроваскулярная пролиферация, некротические участки (рис. 3а, б).
Рис. 3.
Гистологический анализ и иммунофенотипирование перевиваемых линий первичной мультиформной глиобластомы. а, б – Парафиновые срезы образцов интраоперационного материала, окрашенные гематоксилином-эозином, увеличение ×50 (а) и ×200 (б). в‒д ‒ Иммунофлуоресценция первичных культур глиобластомы. в ‒ Ne, CD133, увеличение ×1000. г ‒ GFAP, Ki67, увеличение ×200. д ‒ Ne, Ki67. Масштабная линейка ‒ 100 мкм. Вторичные антимышиные антитела козы (Alexa Fluor 488) и антикроличьи антитела козы (Alexa Fluor 633). е‒и ‒ Результаты проточной цитометрии CD70 (е), CD44 (ж), CD133 (з), Ki67(и). Ne – нестин.
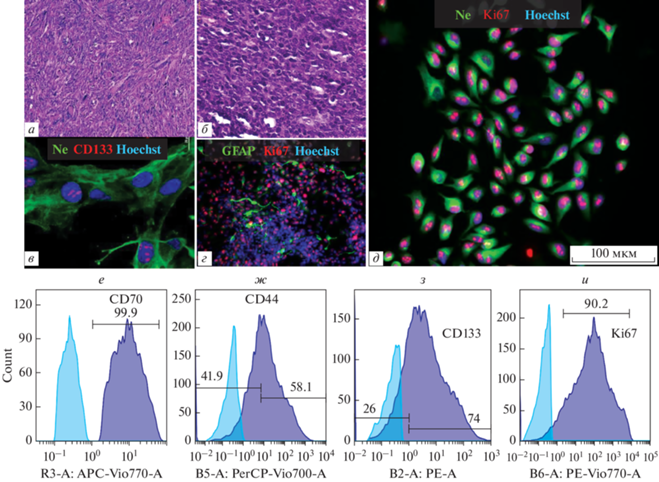
Из операционного биоматериала, содержащего жизнеспособные глиомные клетки IV степени злокачественности, в 100% случаев удавалось получить перевиваемые первичные культуры, пассируемые не менее 3‒5 раз и хорошо переносящие криоконсервацию. Полученные нами линеаризованные глиомные клетки сохраняли в процессе многократного пассирования гомогенную морфологию, высокую пролиферативную активность по маркеру пролиферации Ki67 и были положительными по основным маркерам глиальных опухолей: GFAP, Ne и маркерам стволовости, таким как CD133, CD44, CD70, CD15 (рис. 3в‒и).
Получение нокаутных линий YTwt-CISH–/–, YTwt-B2M–/–, YT-VAV+-CISH–/–, YT-VAV+-B2M–/–
Предварительная проверка функциональности подобранных гидовых РНК для нокаута генов B2M и CISH, проведенная на клеточной линии иммортализованных фибробластов кожи человека 1608hT-Cas9, конститутивно экспрессирующих белок spCas9, показала, что трансфекция конструкциями, содержащими последовательности гидовых РНК, приводит к образованию делеций в таргетных генах (рис. 4а).
Рис. 4.
Получение линий YT-VAV1+ и YTwt с нокаутом генов B2M и CISH. а ‒ T7E1-анализ эффективности гидовых РНК для получения делеций генов В2М и CISH в линии клеток 1608hT-Cas9. Появление дополнительных полос в дорожке T7E1 указывает на присутствие значимых мутаций (делеций), что подтверждает эффективность гидовых РНК. б ‒ Сортинг клеток YT после трансфекции плазмидой pCas9-IRES2-EGFP. в ‒ Иммуноцитохимическое исследование клеток YT дикого типа ((YTwt) и YT с нокаутом гена B2M (YT-B2M–/–) методом проточной цитометрии с антителами к B2M. г ‒ Т7Е1-анализ клонов YT с нокаутом гена CISH.
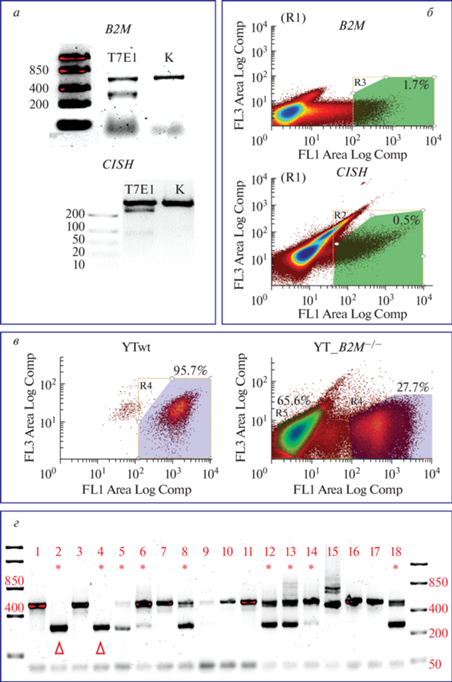
При получении линии клеток YT с нокаутом B2M мы сначала провели сортинг клеток, эффективно экспрессирующих EGFP после трансфекции плазмидой pCas9-IRES2-EGFP. В результате отобрали клетки (1.7%) с наиболее интенсивной зеленой флуоресценцией (рис. 4б). Далее эти клетки наращивали и окрашивали антителами к B2M. С помощью проточной цитометрии показано, что эффективность нокаута B2M в полученном клеточном препарате составляет 65.6% (рис. 4в). На последнем этапе с помощью флуоресцентного клеточного сортинга отобрано по 40 × 104 клеток с нулевым сигналом окрашивания на B2M в линиях YT-VAV1+ и YTwt. Клетки были размножены и криоконсервированы.
В предварительных параллельных экспериментах при помощи прижизненного иммуноцитохимического окрашивания на CIS обнаружено, что экспрессия мембранного белка CIS (в отличие от B2M), не является облигатной, в каждый момент времени примерно 70% клеток остаются CIS-негативными. Таким образом, сортинг мутантных клеток по окрашиванию на CIS теряет смысл. Поэтому мы использовали стратегию, в которой клонирование полученной трансфицированной популяции проводили методом предельного разведения, с последующим анализом единичных клонов.
После котрансфекции YT-клеток плазмидами pU6-CISH-3, pU6-CISH-4 и плазмидой pCas9-IRES2-EGFP, экспрессирующей под CMV-промотором spCas9 и ген флуоресцентного белка EGFP через IRES2-переход, с помощью проточного цитофлуориметра c функцией сортинга Bio-Rad S3 проанализировали экспрессию флуоресцентного маркера EGFP и отобрали порядка 20 000 клеток с интенсивным зеленым сигналом (0.5% от общей популяции, рис. 4б), которые затем подвергли клональной селекции. В результате получено 18 клонов, из которых лишь два (№ 2 и № 4) признаны гомозиготными мутантными линиями клеток YT с нокаутом гена CISH (рис. 4г) Эффективность нокаута CISH в полученных клонах в итоге составила примерно 30% (11 аллелей из 36). Для подтверждения возникновения делеции проведен более детальный анализ данного локуса при помощи секвенирования по Сэнгеру.
Применяя стратегию, аналогичную описанной, мы получили также линии клеток YT, несущих трансген VAV1, с нокаутом генов B2M и CISH (YT-VAV1+CISH–/– и YT-VAV1+-B2M–/–).
Изучение цитоксической активности NK-клеток с нокаутом генов B2M и CISH на культурах первичной глиобластомы
Сравнительный анализ цитотоксичности полученных NK-клеток показал, что как сама линия YT-VAV1+, так и все ее производные обладают гораздо более высокой цитотоксической активностью, чем YT дикого типа, клетки который практически не проявляли цитотоксичности в отношении глиобластомы. Эти данные хорошо согласуются с полученными ранее результатами, согласно которым YT-VAV1+ обладает более высокой цитотоксичностью в отношении различных типов злокачественных опухолевых клеток [12]. Нокаут В2M, который должен сопровождаться нарушением экспонирования MHC на мембране NK-клеток, не повлиял существенно на цитотоксическую активность полученных линий.
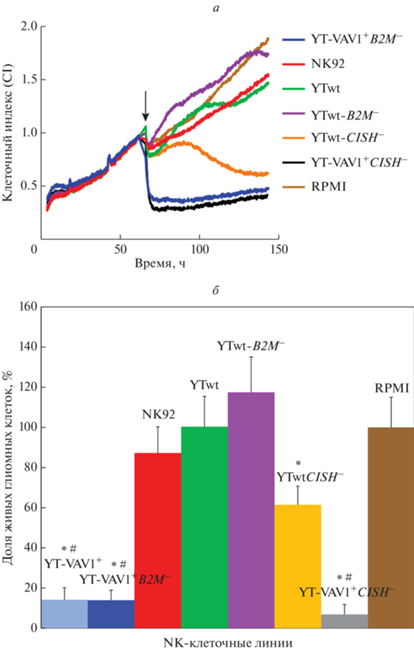
В связи с тем, что линия YTwt почти не проявляла цитотоксичности в отношении исследованных глиомных линий, для исключения влияния индивидуальных особенностей линии YT в качестве дополнительного контроля цитотоксичности линейных NK-клеток в отношении мультиформной глиобластомы мы применили еще одну линию ‒ NK92, полученную из NK-клеточной лимфомы человека. В проведенной серии экспериментов ни одна из немодифицированных линий NK-клеток, как и линий с нокаутом гена B2M YTwt, не проявляла цитотоксичности по отношению к клеткам глиобластомы. Модифицированные YTwt-CISH–/–, YT-VAV1+CISH–/–, как и YT-VAV1+-B2M–/– показали выраженную цитотоксичность. Наибольший видимый цитотоксический эффект, сопровождающийся почти 100%-ной гибелью опухолевого монослоя и приближением значения импеданса к его значениям в бесклеточной среде через 100 ч после коинкубации, наблюдали при применении YT-VAV1+-CISH–/– (рис. 5а). Статистический анализ данных всех серий экспериментов показал, что цитотоксичность “нокаутированной” линии YTwt-CISH–/– была значимо ниже, чем у клеток исходной линии YTwt (p < 0.05 при сравнении с использованием параметрических методов). Цитотоксичность YT-VAV1+-B2M–/– не отличалась от цитотоксичности исходной линии YT-VAV1+. Цитотоксичность YT-VAV1+-CISH–/–, хотя и имела тенденцию к повышению по сравнению с цитотоксичностью исходной линии YT-VAV1+, однако не отличалась статистически значимо от цитотоксичности материнской линии, как показывает анализ интегральных данных (рис. 5б).
Рис. 5.
Цитотоксичность линий NK-клеток YTwt и YT-VAV1+ с нокаутом генов В2М и CISH в отношении монослойных культур клеток мультиформной глиобластомы человека. а ‒ Кривые клеточного индекса, рассчитанного на основе импеданса в анализаторе RTCA iCelligence. По оси ординат отложены значения клеточного индекса, нормированные по значению на момент добавления NK-клеток; по оси абсцисс ‒ время. Момент внесения NK-клеток отмечен стрелкой. б ‒ Результирующие показатели цитотоксичности в пяти экспериментах на независимо полученных линиях мультиформной глиобластомы через 100 ч после начала эксперимента (30 ч после внесения NK-клеток) по сравнению с контролем. Цветовые обозначения линий NK-клеток такие же, как на панели а. * p < 0.05 при сравнении с YTwt; # p < 0.05 при сравнении с NK92.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Применение CAR-T-клеточной терапии серьезно ограничивается необходимостью использования аутологичных клеток для производства трансгенного продукта. Аллогенные Т-клетки с интактным Т-клеточным рецептором могут атаковать организм реципиента, вызывая реакцию трансплантат-против-хозяина. Существуют пилотные работы, в которых нокаут Т-клеточного рецептора делает Т-клетки пригодными к использованию в аллогенном формате, однако этот подход не получил широкого распространения из-за технических сложностей (необходимо обязательно избавляться от немодифицированных клеток в окончательном продукте). В то же время, NK-клетки не экспрессируют Т-клеточный рецептор и практически не вызывают реакции трансплантат-против-хозяина при аллогенном использовании. В связи с этим для производства CAR-NK-клеточных продуктов можно применять пуповинные NK-клетки без дополнительных модификаций [17]. Пока не вполне понятно, насколько долгим может быть персистенция аллогенных NK-клеток в организме пациента, однако мы предполагаем, что Т‑клетки реципиента могут со временем элиминировать NK-клетки донора. Один из вариантов решения проблемы иммунного ответа на аллогенные клетки – нокаут гена B2M, нарушающего функционирование мембранного комплекса MHC-I, как в случае аллогенных CAR-Т-клеток [16]. MHC-негативные NK-клетки должны стать неуязвимыми для Т-клеток реципиента, что, вероятнее всего, увеличит время их персистенции в организме пациента и повысит эффективность терапии, однако этот подход нуждается в дальнейшем изучении.
В связи с низкой эффективностью иммунотерапии немодифицированными лимфоцитами и NK-клетками, сегодняшние тренды клеточной иммунотерапии солидных опухолей предполагают не только создание CAR-NK, но и разработку подходов к модификации NK-клеток, повышению их цитотоксической активности, в частности, путем воздействия на ингибиторный белок CIS [11, 18]. В исследованиях, проведенных ранее на мышах, показано, что делеция гена Cish делает NK-клетки гиперчувствительными к IL-15, о чем свидетельствует усиленная пролиферация, выживаемость, продукция IFN-γ и повышенная цитотоксичность по отношению к солидным опухолям. Один из молекулярных механизмов активации клеток с нокаутом Cis – усиление передачи сигналов JAK-STAT, поскольку Cis взаимодействует с тирозинкиназой JAK1, ингибируя ее ферментативную активность и направляя JAK на протеасомную деградацию [18]. Очень убедительны данные экспериментов in vivo, проведенных Delconte и соавт., которые показали, что мыши с нокаутом гена Cish устойчивы к формированию метастазов меланомы, рака предстательной и молочной железы [11]. Новизна нашего исследования заключалась в попытке комбинирования нокаута ингибитора иммунных контрольных точек CIS в NK-клетках человека, сверхэкспрессирующих другой белок, ассоциированный с повышенной цитотоксичностью ‒ VAV1 [12].
Для решения задачи по созданию универсальных “усиленных” киллерных клеток, обладающих высокой цитотоксичностью по отношению к опухолевым клеткам, была выбрана иммортализованная перевиваемая линия YT с NK-подобным фенотипом, поскольку эти клетки, обладающие способностью к перфорин-опосредованному лизису мишеней, не зависят от присутствия IL-2 в среде при культивировании и не экспрессируют Fc-рецепторы [19‒21]. Вместе с тем, важно отметить, что линейные иммортализованные клетки YT могут отличаться от нормальных NK-клеток, поэтому модификации этой линии, выполненные нами, это лишь модельная система для исследования влияния сверхэкспрессии VAV1 и нокаута генов B2M и CISH на функции NK-клеток.
В данном исследовании нами показано, что нокаут B2M в линии YT, сверхэкспрессирующей VAV1, не влияет на цитотоксическую активность этих клеток в отношении клеток мультиформной глиобластомы, а нокаут белка CIS статистически значимо увеличивает цитотоксичность YT дикого типа, но не влияет существенно на цитотоксические свойства модифицированных клеток YT-VAV1+. Отсутствие значимого усиления цитотоксичности YT-VAV1+ после нокаута в них CIS можно объяснить с помощью двух гипотез: во-первых, сверхэкспрессия VAV1+ может вызывать настолько мощную активацию цитотоксичности NK-клеток и их дегрануляцию, что повышение их чувствительности к IL-15 просто незаметно на этом фоне. Во-вторых, IL-2-независимая линия YT-VAV1+ может быть в высокой степени и IL-15-независимой, поэтому нокаут CIS никак не влияет на ее цитотоксичность. Вместе с тем, для изучения молекулярных механизмов, задействованных в активации цитотоксичности линии YT-VAV1+CISH–, требуются дальнейшие исследования, с применением ингибиторов сигнальных путей активации NK-клеток. Кроме того, следует иметь в виду, что цитотоксичность созданных нами линий может существенно варьировать при переходе на 3D модель солидных опухолей ‒ опухолевые сфероиды, а также при постановке экспериментов in vivo.
ЗАКЛЮЧЕНИЕ
На основе NK-подобной клеточной линии YT и ее модифицированного варианта YT-VAV1+, сверхэкспрессирующего белок VAV1, активирующий цитотоксические свойства, с помощью системы CRISPR/Cas9 созданы линии YT-B2M–/–, YT-VAV1-B2M–/– и YT-CISH–/–, YT-VAV+CISH–/– с нокаутом генов B2M и CISH соответственно. В экспериментах на монослойных культурах первичной глиобластомы показано, что нокаут B2M не влияет на цитотоксические свойства YT и YT-VAV+, а нокаут CISH статистически значимо повышает цитотоксичность YT и не влияет на цитотоксичность YT-VAV1+. Полученные линии могут стать платформой для создания универсальных усиленных CAR-NK-клеток для эффективной иммунотерапии мультиформной глиобластомы человека.
Коллектив авторов благодарит Центр высокоточного редактирования генома и генетических технологий для биомедицины, Российский национальный исследовательский медицинский университет имени Н.И. Пирогова за помощь в работе с генетическими конструкциями системы CRISPR/Cas9.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 21-74-20110) и Российского фонда фундаментальных исследований (грант № 18-29-01022).
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. У всех пациентов получено письменное информированное согласие.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Myers J.A., Miller J.S. (2021) Exploring the NK cell platform for cancer immunotherapy. Nat. Rev. Clin. Oncol. 18(2), 85‒100. https://doi.org/10.1038/s41571-020-0426-7
Rezvani K., Rouce R., Liu E., Shpall E. (2017) Engineering natural killer cells for cancer immunotherapy. Mol. Ther. 25(8), 1769‒1781. https://doi.org/10.1016/j.ymthe.2017.06.012
Mamessier E., Sylvain A., Thibult M.L., Houvenaeghel G., Jacquemier J., Castellano R., Gonçalves A., André P., Romagné F., Thibault G., Viens P., Birnbaum D., Bertucci F., Moretta A., Olive D. (2011) Human breast cancer cells enhance self tolerance by promoting evasion from NK cell antitumor immunity. J. Clin. Invest. 121(9), 3609‒3622. https://doi.org/10.1172/JCI45816
Pasero C., Gravis G., Guerin M., Granjeaud S., Thomassin-Piana J., Rocchi P., Paciencia-Gros M., Poizat F., Bentobji M., Azario-Cheillan F., Walz J., Salem N., Brunelle S., Moretta A., Olive D. (2016) Inherent and tumor-driven immune tolerance in the prostate microenvironment impairs natural killer cell antitumor activity. Cancer Res. 76(8), 2153‒2165. https://doi.org/10.1158/0008-5472.CAN-15-1965
Suen W.C., Lee W.Y., Leung K.T., Pan X.H., Li G. (2018) Natural killer cell-based cancer immunotherapy: a review on 10 years completed clinical trials. Cancer Invest. 36(8), 431‒457. https://doi.org/10.1080/07357907.2018.1515315
Igarashi T., Wynberg J., Srinivasan R., Becknell B., McCoy J.P. Jr, Takahashi Y., Suffredini D.A., Linehan W.M., Caligiuri M.A., Childs R.W. (2004) Enhanced cytotoxicity of allogeneic NK cells with killer immunoglobulin-like receptor ligand incompatibility against melanoma and renal cell carcinoma cells. Blood. 104(1), 170‒177. https://doi.org/10.1182/blood-2003-12-4438
Carlsten M., Childs R.W. (2015) Genetic manipulation of NK cells for cancer immunotherapy: techniques and clinical implications. Front. Immunol. 6, 266. https://doi.org/10.3389/fimmu.2015.00266
Yang L., Shen M., Xu L.J., Yang X., Tsai Y., Keng P.C., Chen Y., Lee S.O. (2017) Enhancing NK cell-mediated cytotoxicity to cisplatin-resistant lung cancer cells via MEK/Erk signaling inhibition. Sci. Rep. 7(1), 7958. https://doi.org/10.1038/s41598-017-08483-z
Freund-Brown J., Chirino L., Kambayashi T. (2018) Strategies to enhance NK cell function for the treatment of tumors and infections. Crit. Rev. Immunol. 38(2), 105‒130. https://doi.org/10.1615/CritRevImmunol.2018025248
Nayyar G., Chu Y., Cairo M.S. (2019) Overcoming resistance to natural killer cell based immunotherapies for solid tumors. Front. Oncol. 9, 51. https://doi.org/10.3389/fonc.2019.00051
Delconte R.B., Kolesnik T.B., Dagley L.F., Rautela J., Shi W., Putz E.M., Stannard K., Zhang J.-G., Teh C., Firth M., Ushiki T., Andoniou C.E., Degli-Esposti M.A., Sharp P.P., Sanvitale C.E., Infusini G., Liau N.P.D., Linossi E.M., Burns C.J., Carotta S., Gray D.H.D., Seillet C., Hutchinson D.S., Belz G.T., Webb A.I., Alexander W.S., Li S.S., Bullock A.N., Babon J.J., Smyth M.J., Nicholson S.E., Huntington N.D. (2016) CIS is a potent checkpoint in NK cell-mediated tumor immunity. Nat. Immunol. 17(7), 816‒824. https://doi.org/10.1038/ni.3470
Smagina A.S., Kulemzin S.V., Yusubalieva G.M., Kedrova A.G., Sanzharov A.E., Ivanov Y.V., Matvienko D.A., Kalsin V.A., Gorchakov A.A., Baklaushev V.P., Taranin A.V. (2021) VAV1-overexpressing YT cells display improved cytotoxicity against malignant cells. Biotechnol. Appl. Biochem. 68(4), 849‒855. https://doi.org/10.1002/bab.2001
Paul S., Lal G. (2017) The molecular mechanism of natural killer cells function and its importance in cancer immunotherapy. Front. Immunol. 8, 1124. https://doi.org/10.3389/fimmu.2017.01124
(2013) World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA. 310(20), 2191‒2194.
Louis D.N., Ohgaki H., Wiestler O.D., Cavenee W.K., Burger P.C., Jouvet A., Scheithauer B.W., Kleihues P. (2007) The 2007 WHO classification of tumors of the central nervous system. Acta Neuropathol. 114(2), 97‒109.
Ren J., Zhang X., Liu X., Fang C., Jiang S., June C.H., Zhao Y. (2017) A versatile system for rapid multiplex genome-edited CAR T cell generation. Oncotarget. 8(10), 17002‒17011. https://doi.org/10.18632/oncotarget.15218
Daher M., Rezvani K. (2021) Outlook for new CAR-based therapies with a focus on CAR NK cells: what lies beyond CAR-engineered T cells in the race against cancer. Cancer Discov. 11(1), 45‒58. https://doi.org/10.1158/2159-8290.CD-20-0556
Daher M., Basar R., Gokdemir E., Baran N., Rezvani K. (2021) Targeting a cytokine checkpoint enhances the fitness of armored cord blood CAR-NK cells. Blood. 137(5), 624‒636. https://doi.org/10.1182/blood.2020007748
Yodoi J., Teshigawara K., Nikaido T., Fukui K., Noma T., Honjo T., Takigawa M., Sasaki M., Minato N., Tsudo M. (1985) TCGF (IL 2)-receptor inducing factor(s). I. Regulation of IL 2 receptor on a natural killer-like cell line (YT cells). J. Immunol. 134(3), 1623‒1630.
Deaglio S., Zubiaur M., Gregorini A., Bottarel F., Ausiello C.M., Dianzani U., Sancho J., Malavasi F. (2002) Human CD38 and CD16 are functionally dependent and physically associated in natural killer cells. Blood. 99(7), 2490‒2498. https://doi.org/10.1182/blood.v99.7.2490
Edsparr K., Speetjens F.M., Mulder-Stapel A., Goldfarb R.H., Basse P.H., Lennernäs B., Kuppen P.J.K., Albertsson P. (2010) Effects of IL-2 on MMP expression in freshly isolated human NK cells and the IL-2-independent NK cell line YT. J. Immunother. 33(5), 475‒481. https://doi.org/10.1097/CJI.0b013e3181d372a0
Дополнительные материалы
- скачать ESM.docx
- Приложение1. Рис.1-Рис.3
Инструменты
Молекулярная биология


