Российские нанотехнологии, 2020, T. 15, № 4, стр. 493-504
ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ СВОЙСТВ ГЕМОСТАТИЧЕСКИХ МАТЕРИАЛОВ НА ОСНОВЕ ХИТОЗАНА И НАНОФИБРИЛЛ ХИТИНА
Е. Н. Маевская 1, *, Е. Н. Дресвянина 2, 3, А. С. Шабунин 1, 4, И. П. Добровольская 1, 3, М. Б. Панеях 4, 5, А. М. Федюк 4, 5, П. Л. Сущинский 4, 5, Г. П. Смирнов 2, В. Е. Юдин 1, 3, Е. В. Зиновьев 5, 6
1 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет промышленных технологий и дизайна
Санкт-Петербург, Россия
3 Институт высокомолекулярных соединений РАН
Санкт-Петербург, Россия
4 Национальный медицинский исследовательский центр детской травматологии и ортопедии им. Г.И. Турнера
Санкт-Петербург, Россия
5 Санкт-Петербургский государственный педиатрический медицинский университет
Санкт-Петербург, Россия
6 Научно-исследовательский институт скорой помощи им. И.И. Джанелидзе
Санкт-Петербург, Россия
* E-mail: ma.eka@yandex.ru
Поступила в редакцию 20.06.2020
После доработки 26.07.2020
Принята к публикации 26.07.2020
Аннотация
Одними из перспективных полимеров для создания гемостатических материалов являются природный полимер хитин и его производный хитозан. Методом мокрого формования получены композиционные нити с различным соотношением нанофибрилл хитина. Исследование механических характеристик композиционных нитей показало, что введение малого количества нанофибрилл хитина, около 0.5 мас. %, сопровождается упрочнением нитей, а использование больших концентраций приводит к увеличению устойчивости нитей к воздействию влажной среды. Нетканый материал, полученный из композиционных нитей, показал сравнимую эффективность с коммерческими гемостатическими препаратами Surgicel и Tachocomb. В экспериментах in vivo проведена оценка взаимодействия разработанных материалов с живым организмом. Волокна из хитозана продемонстрировали биоинертный характер. На 91-е сутки наблюдалось образование плотной соединительнотканной капсулы вокруг имплантированного волокна, что свидетельствует о низкой скорости его резорбции в субфасции. Гистологическое исследование взаимодействия разработанных материалов с тканями живого организма показало в области имплантации наличие многочисленных гигантских многоядерных клеток.
ВВЕДЕНИЕ
Неконтролируемые кровотечения остаются одной из главных причин смертности в процессе хирургических операций, сопровождаясь большим количеством осложнений и побочных эффектов [1]. Ввиду различной природы возникающих кровотечений существует большое разнообразие методов их остановки. Так, одними из самых простых и используемых в первую очередь являются механические способы остановки кровотечений, включающие в себя прямое давление на рану, использование хирургических нитей, зажимов и скоб. Они используются в самых простых случаях, когда кровотечение легко идентифицируется, а место повреждения может быть быстро запечатано [2].
Термические методы включают в себя использование лазеров, гемостатических скальпелей и других инструментов для коагуляции тканевых белков и эритроцитов, механической закупорки поврежденного сосуда и стимулирования его вазоконстрикции [3]. Имеются сведения о высокой эффективности подобных методов [4], однако их применение сопряжено со значительными рисками, такими как развитие некроза [5] и вероятность возникновения повторного кровотечения [6]. Один из возможных способов не допустить развития кровотечения – инъекционное введение эпинефрина, витамина К, транексамовой кислоты и прочих веществ, способствующих свертыванию крови, связано с их непосредственным участием в каскаде реакций, приводящих к гемостазу. Показано, что их предварительное введение уменьшает риск возникновения кровотечений во время операций [7], а также снижает вероятность повторных кровотечений [8]. Однако данный метод используется лишь для предотвращения возникновения кровотечения, либо для его остановки в комбинации с другими способами.
Самым распространенным и широко используемым методом остановки кровотечений остается использование поверхностных гемостатических материалов ввиду удобства их применения и большого разнообразия. Кровеостанавливающие материалы выпускают в различных формах, таких как пленки, губки, гидрогели, гранулы, порошки, волокна, спреи, а также создаваемые на их основе тканые и нетканые материалы. Каждая форма имеет свои преимущества и ограничения, обеспечивая высокую эффективность при использовании в конкретных случаях. Так, гемостатический агент в виде порошка обеспечивает большую площадь контакта действующего вещества с кровью, демонстрируя наибольшую эффективность и удобство применения в сравнении с другими формами при небольших диффузных кровотечениях [9], когда сложно идентифицировать место повреждения. В то же время использование тканых и нетканых материалов, а также губок и марлей сопряжено с возможностью оказания дополнительного давления на рану, что особенно актуально для крупных локализованных кровотечений.
Идеальный гемостатический материал для использования при внутриполостных операциях должен, в первую очередь, быстро останавливать массивные кровотечения из крупных сосудов и паренхиматозных органов и не допускать возникновения повторных кровотечений, а также обладать стабильностью, биосовместимостью и биорезорбируемостью, не оказывать отрицательного влияния на прилежащие ткани и организм в целом, быть удобным для использования и недорогим [10, 11]. Очевидно, изготовить материал, обладающий всеми перечисленными характеристиками, невозможно, в связи с чем возникает необходимость выбирать наиболее подходящий агент в зависимости от ситуации. На это влияет тип кровотечения, особенности организма пациента, а также такие факторы, как доступность, стоимость и удобство использования материала для хирурга [12, 13].
Одними из наиболее часто используемых средств являются гемостатические материалы на основе желатина и крахмала, действие которых обусловлено хорошей впитывающей и набухающей способностями. В результате впитывания жидкой фазы крови происходит концентрация высокомолекулярных факторов крови, способствуя быстрому достижению гемостаза [14]. Другим популярным гемостатическим агентом является окисленная целлюлоза, механизм действия которой связан с разложением полимера и понижением локального рН среды, провоцирующими лизис эритроцитов и превращение гемоглобина в кислый гематин [15]. Большая группа кровеостанавливающих средств изготавливается непосредственно на основе факторов свертывания крови и коллагена, принимающих активное участие в процессе гемостаза. Их использование приводит к быстрому формированию кровяного сгустка, обеспечивая высокую скорость остановки кровотечения.
Тип ткани, на которой проводится операция, является одним из наиболее существенных факторов при выборе кровеостанавливающего препарата. Например, гемостатический воск подходит только для остановки костных кровотечений [16], а материалы на основе желатина или крахмала не рекомендуется использовать вблизи нервов ввиду их возможного сдавливания в результате сильного набухания полимеров [17, 18]. В то же время в отличие от изделий на основе окисленной целлюлозы [5] их можно применять одновременно с факторами свертывания крови, например тромбином, для ускорения остановки серьезных кровотечений. Белки, участвующие в каскаде реакций свертывания крови, безусловно, являются одними из наиболее эффективных способов обеспечить быстрый гемостаз, однако необходимо учитывать их высокую стоимость [19] и возможные побочные аллергические реакции [20]. Таким образом, ввиду наличия большого числа ограничений у существующих гемостатических материалов разработка новых средств с использованием других полимеров для их изготовления является актуальной задачей современной медицины.
Одним из наиболее перспективных полимеров для создания материалов медицинского профиля является хитозан – линейный полисахарид, получаемый из хитина при его деацетилировании [21]. Основными свойствами, определяющими широкое использование хитозана для создания материалов медицинского назначения, являются его биосовместимость, способность к биорезорбции, бактерицидные свойства, а также отсутствие цитотоксичности [22]. Ведутся активные разработки раневых покрытий на его основе [23], противоожоговых препаратов [24], систем доставки лекарств [25], костных имплантатов [26], хирургических шовных нитей [27], а также гемостатических материалов [28]. Так, существующие коммерческие гемостатические материалы на основе хитозана, такие как Celox, HemCon и QuikClot, демонстрируют высокую эффективность в остановке кровотечений [29]. Также большим преимуществом хитозана является возможность изготовления из него различных форм препаратов – гидрогели, пленки, волокна, тканевые и нетканые покрытия.
Ввиду близкой природы хитозана и хитина их совместное использование может стать эффективным способом усилить биомедицинские свойства изготавливаемых на их основе изделий. Было показано, что введение небольшого количества нанофибрилл хитина (НФХ) положительно сказывается на клеточной адгезии [30], а также сопровождается увеличением механических характеристик материалов [31]. Целью данной работы является изучение влияния НФХ на механические свойства композиционных нитей на основе хитозана, а также на кровеостанавливающие эффекты изготавливаемых на их основе нетканых материалов и их биосовместимость.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проводили с использованием хитозана фирмы Biolog Heppe (Германия) со средневязкостной молекулярной массой 164 кДа и степенью деацетилирования 92%. Нанофибриллы хитина поставлялись компанией SRL Mavi Sud (Италия) в виде водной суспензии с концентрацией 20 мг/мл, с длиной нанофибрилл 600 нм и диаметром 25 нм.
Для изготовления растворов смесь хитозана и предварительно диспергированной суспензии НФХ растворяли в 2 мас. % водном растворе уксусной кислоты. Формование композиционных нитей осуществляли по мокрому способу [32]. Раствор подавали через фильеру в осадительную ванну, состоящую из смеси 10%-ного водного раствора NaOH и этанола в соотношении 1:1, в результате чего происходила коагуляция полимера. Полученные нити промывали дистиллированной водой и просушивали при температуре 40°С. Суммарная концентрация полимеров в растворе при этом составляла 4 мас. % ввиду оптимальной вязкости раствора с точки зрения его прохождения через фильеру [33]; концентрация НФХ варьировалась от 0.1 до 50% от массы хитозана. Также были изготовлены нити без НФХ (0%). Для получения монофиламентных нитей использовали фильеру с одним отверстием диаметром 0.6 мм, скорость подачи раствора составляла 0.2 мл/мин. Для изготовления полифиламентных нитей применяли фильеру со 100 отверстиями диаметром 0.1 мм, скорость подачи была 0.3 мл/мин. Регулированием скорости первого ролика варьировали фильерную вытяжку волокна от 0 до 100%; отношение скоростей роликов друг относительно друга определяло пластификационную вытяжку, составляющую 20%.
Для определения механических свойств нитей они предварительно были выдержаны не менее суток при нормальных климатических условиях: относительной влажности 66% и температуре 20 ± 2°С. Механические свойства нитей определяли с помощью разрывной машины Instron 5943, базовая длина нити составляла 100 мм, скорость нагружения волокна – 10 мм/мин.
Ввиду планируемого использования материала в контакте с организмом человека, где такие условия, как температура и влажность, отличаются от нормальных, более того, зависят от ткани, в которую помещен материал, было проведено исследование влияния влажности среды на механические характеристики композиционных нитей. Для этого нити были помещены в эксикаторы с относительным давлением водяного пара (Р/Р0) в диапазоне от 0.10 до 0.98; относительную влажность воздуха в эксикаторах создавали с помощью насыщенных растворов солей. Эксикаторы были термостатированы при температуре 25 ± ± 1°С. Предварительно нити термостатировали в сушильной камере при температуре 80°С до достижения постоянной массы; содержание влаги контролировали гравиметрическим методом. Образцы находились в эксикаторах до установления сорбционного равновесия (3–7 нед), после чего определяли их механические свойства.
Для определения оптимальной концентрации НФХ с точки зрения кровеостанавливающих свойств материала были изготовлены композиционные губки с содержанием НФХ от 0 до 50%. Общая концентрация композиций хитозан/НФХ в растворе составляла 3%. Растворы замораживали при температуре –20°С, затем подвергали лиофильной сушке при температуре –2°С и давлении 1.6 Па на установке Freeze Dry System (США). Для перевода губок в основную, не растворимую в воде форму, их обрабатывали 10%-ным водным раствором NaOH в течение 10 мин, после чего промывали дистиллированной водой.
Перед изготовлением нетканых материалов полифиламентные нити гофрировали и нарезали. Штапельная длина полученных волокон составляла 80 мм, общая масса была 20 г. Методом иглопробивания на установке кафедры технологии и проектирования текстильных изделий Санкт-Петербургского университета промышленных технологий и дизайна были получены нетканые материалы.
Для исследования эффективности полученных кровеостанавливающих материалов были проведены их испытания in vivo. Исследование проводили на базе лаборатории экспериментальной хирургии Санкт-Петербургского государственного педиатрического медицинского университета при согласовании действий с локальным этическим комитетом. В качестве лабораторных животных были использованы крысы-самцы линии Wistar-Kyoto массой 230–250 г. Все эксперименты проводили при общей анестезии и в соответствии с правилами проведения работ с использованием экспериментальных животных (принципы Европейской конвенции, Страсбург, 1986 г., и Хельсинкской декларации Всемирной медицинской ассоциации о гуманном обращении с животными, 1996 г.).
Испытания кровеостанавливающих свойств материалов проводили в два этапа. В первой фазе экспериментов были использованы губки без содержания НФХ и с концентрациями НФХ 0.5, 5, 50% при моделировании артериального кровотечения. Для этого у крыс выбривали внутреннюю поверхность бедра, после чего их фиксировали на операционном столе; с помощью хирургических инструментов обеспечивали доступ к бедренной артерии. После рассечения сосуда испытываемый образец размером 7 × 7 × 4 мм3 немедленно прикладывали к месту повреждения и засекали время до полной остановки кровотечения. В качестве контрольной группы выступало время кровотечения без использования гемостатических препаратов.
Второй этап состоял из испытаний нетканых материалов, изготовленных без добавления НФХ и с их содержанием 0.5%. Данная концентрация была выбрана благодаря продемонстрированным результатам в предыдущих экспериментах. Эксперимент был разделен на две группы: моделирование артериального и венозного кровотечений. Аналогичным способом обеспечивали доступ к сосудисто-нервному пучку, после чего в зависимости от группы эксперимента перерезали либо бедренную артерию, либо бедренную вену. В качестве группы сравнения были выбраны два коммерчески доступных гемостатических материала с различными механизмами действия: Surgicel Nu-Knit (Ethicon, США), изготовленный из окисленной целлюлозы, и Tachocomb (Takeda Austria GmbH, Австрия), состоящий из фибриногена и тромбина.
Для определения возможных причин различного кровеостанавливающего действия нетканых материалов были проведены измерения их ζ-потенциала с помощью прибора SurPASSTM 3 (Anton Paar, Австрия) по методу, описанному в [34]. Образцы размером 20 × 10 мм2 помещали друг напротив друга на расстоянии 100 мкм, расчет ζ-потенциала осуществляли при изменении давления жидкости в капилляре в диапазоне от 200 до 600 мбар. Изменение рН среды происходило в диапазоне от 5 до 9 за счет добавления 0.05 моль/л раствора КОН в 0.001 моль/л раствор KCl при температуре 23°С.
Исследование взаимодействия материалов с организмом проводили при имплантации нитей хитозана (0% НФХ) и композиционных нитей с содержанием НФХ 0.5% субфасциально в проекции m. latissimus dorsi на сроки в 14 и 91 сут. После истечения срока эксперимента нити извлекали из организма животных вместе с участком прилежащей ткани для последующего гистологического исследования с целью изучить тканевой ответ на чужеродный объект, который наблюдался с помощью светового микроскопа Leica DM750 (Германия).
Ввиду планируемого использования получаемых гемостатических материалов для остановки внутренних кровотечений с возможностью оставить материал в организме без проведения повторных операций по его удалению была проведена имплантация готовых образцов у лабораторных животных. Материалы были помещены субфасциально в проекции m. latissimus dorsi на срок 14 сут. В качестве контрольной группы использовали материалы Surgicel Nu-Knit и Tachocomb. По истечении срока эксперимента были взяты биоптаты, включающие в себя участок ткани вместе с исследуемым образцом, для последующего гистологического исследования.
Обработку полученных данных осуществляли с помощью пакета программ MS Excel и Origin (OriginLab Corporation, США), статистический анализ проводили с помощью языка R (R Foundation for Statistical Computing, Вена, Австрия). Для сравнения независимых выборок использовали тесты Краскела–Уоллиса и Манна–Уитни, статистически значимыми различиями считались результаты с параметром p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены зависимости механических характеристик композиционных нитей от содержания в них НФХ.
Рис. 1.
Зависимость разрывного напряжения (σ, МПа), модуля Юнга (Е, ГПа) и относительной деформации (ε, %) волокон от концентрации НФХ.
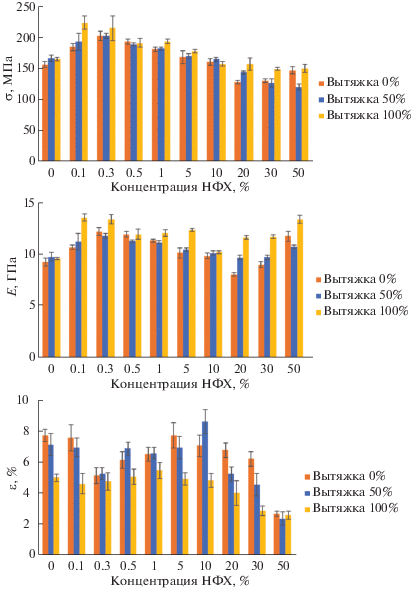
Видно, что введение небольших концентраций НФХ (от 0.1 до 1%) сопровождается ростом разрывного напряжения и модуля Юнга нитей. Это можно объяснить следующим образом. Когда раствор полимера проходит через фильеру, происходит ориентация макромолекул хитозана в направлении потока, которая усиливается при последующей вытяжке нити в пластификационной ванне. Введение малых концентраций НФХ способствует дополнительной ориентации макромолекул хитозана вдоль нанофибрилл, что приводит к повышению прочности и модуля упругости нити. В то же время дальнейшее увеличение концентрации НФХ в растворе выше перколяционного порога, который для НФХ по данным [32] составляет ~1.5 мас. %, приводит к образованию плотной сетки из НФХ, препятствующей ориентации макромолекул хитозана и, соответственно, снижению молекулярной подвижности хитозана [35]. Это, в свою очередь, приводит к снижению деформационно-прочностных характеристик композиционной нити.
При введении НФХ в количестве 20% и более наблюдается увеличение разрывного напряжения и модуля Юнга и снижение относительной деформации композиционных нитей. Это может быть обусловлено формированием новой структуры композиционной нити и повышенной жесткостью хитиновой сетки.
Отметим, что увеличение вытяжки нити вне зависимости от количества введенных в хитозан НФХ приводит не только к увеличению ее прочности, но и одновременно с этим к снижению ее деформации до разрыва (охрупчиванию). Для соблюдения баланса между этими характеристиками в дальнейшем формование волокон проводили с вытяжкой 50%.
На рис. 2 представлены зависимости отношения разрывного напряжения и деформации до разрыва влажных нитей к соответствующим характеристикам абсолютно сухих нитей (σ/σ(0) и ε/ε(0) соответственно) для различных концентраций НФХ от относительного давления водяного пара в эксикаторах. Видно, что увеличение концентрации НФХ приводит к увеличению относительной прочности нитей за счет меньшего поглощения влаги. Наиболее сильное сопротивление воздействию влажности среды наблюдается у нитей с 50%-ным содержанием НФХ, у которых наблюдается минимальная прочность при относительном давлении водяного пара вплоть до 84%. Дальнейшее повышение относительного давления приводит к снижению механических характеристик для всех материалов независимо от содержания наполнителя. Следует отметить, что концентрация НФХ 0.5% выделяется из-за низкой потери прочности нитей, в то время как другие концентрации НФХ (5 и 30%) незначительно отличаются друг от друга и от хитозана без добавления НФХ. При этом с точки зрения деформационных характеристик введение в растворы хитозана больших количеств НФХ не снижает зависимость этих характеристик от влияния влаги, исключением является 5%-ная концентрация НФХ.
Рис. 2.
Зависимости относительного разрывного напряжения σ/σ(0) и деформации до разрыва ε/ε(0) от давления водяного пара в эксикаторах.

В [35, 36] было показано, что добавление НФХ в растворы хитозана приводит к снижению сорбционных характеристик материала за счет увеличения упорядоченности структуры композиционных материалов, формирования более плотной упаковки макромолекул хитозана в адсорбционном слое на поверхности НФХ. Этим в определенной степени можно объяснить снижение влияния влажной среды на прочностные свойства композитных хитозановых нитей с высокой концентрацией НФХ.
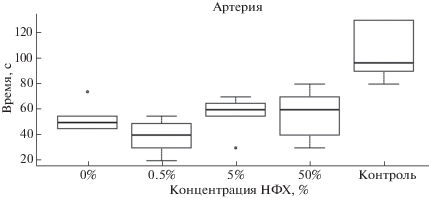
Первый этап испытания гемостатических свойств материалов заключался в измерении скорости остановки артериального кровотечения губками с различным содержанием НФХ (рис. 3). Все материалы продемонстрировали наличие гемостатических свойств ввиду меньшего времени остановки кровотечения в сравнении с контрольной группой (без применения кровеостанавливающих препаратов). Наименьшее время было достигнуто при использовании хитозановой губки с 0.5%-ным содержанием НФХ. В связи с этим, а также с учетом результатов предыдущих испытаний нетканый материал (рис. 4) был изготовлен из композиционных хитозановых нитей, содержащих 0.5% НФХ.
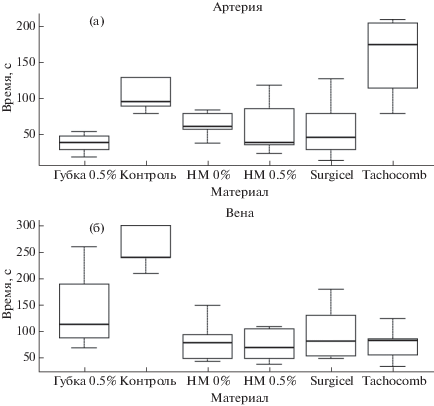
Испытания разработанных нетканых материалов (группы “НМ” на графике рис. 5) проводили в сравнении с хитозановой губкой, наполненной 0.5% НФХ, а также двумя коммерчески доступными гемостатическими агентами с различными механизмами действия (Surgicel Nu-Knit и Tachocomb). Группа “Контроль” на рис. 5 означает, что при остановке кровотечения у лабораторных животных не использовались какие-либо материалы. Анализ результатов эксперимента, представленных на рис. 5 (“Артерия”), показывает, что при моделировании артериального кровотечения только нетканый материал с добавлением 0.5% НФХ сравнился по эффективности с губкой той же концентрации. Однако при остановке кровотечения из бедренной вены все материалы продемонстрировали лучший результат, чем при использовании губки (рис. 5 “Вена”). В обоих случаях нетканый материал с добавлением 0.5% НФХ оказался сравнимым по скорости достижения гемостаза с коммерческими агентами, а в случае кровотечения из артерии даже оказался эффективнее, чем Tachocomb. Столь низкая скорость действия материала Tachocomb может быть объяснена его составом, в который входят человеческий фибриноген и тромбин, в то время как испытания проводили на крысах. Также заметим, что инструкция к материалу Surgicel Nu-Knit не предусматривает его использование для остановки артериальных кровотечений – в этом случае нетканые материалы на основе хитозана могут стать его перспективной заменой.
Рис. 5.
Время остановки кровотечения различными материалами при артериальном (а) и венозном (б) кровотечении.
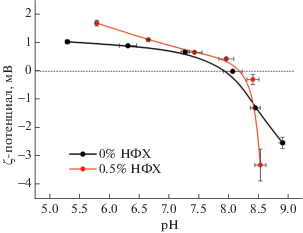
Важными свойствами гемостатического материала являются величина и знак заряда на его поверхности. Поэтому было проведено исследование величины поверхностного заряда нетканых материалов на основе волокон из хитозана и композиционных волокон, содержащих в качестве наполнителя НФХ. Зависимости ζ-потенциала материалов от рН среды приведены на рис. 6. Видно, что оба вида волокон характеризуются положительным поверхностным зарядом. Введение НФХ в небольшом количестве, 0.5 мас. %, приводит к повышению ζ-потенциала поверхности композиционного волокна.
Известно, что хитозан обладает полиэлектролитными свойствами, в растворах слабых кислот аминогруппа NH2 переходит в положительно заряженную NH3+, а гидроксильные и аминогруппы хитозана образуют внутри- и межмолекулярные водородные связи. В [32] с использованием метода молекулярной динамики показано, что при введении НФХ в раствор хитозана происходит ориентация макромолекул хитозана на поверхности наночастиц. При этом, кроме описанных выше водородных связей, возможно взаимодействие аминогрупп хитозана с карбонильной С=О группой хитина. Можно предположить, что упорядоченность макромолекул хитозана в композиционной нити, в частности их взаимная ориентация, а также ориентация относительно НФХ, будут влиять на количество водородных связей и, как следствие, на величину поверхностного заряда волокна. Распрямленная конформация макромолекул будет снижать вероятность образования внутримолекулярных связей хитозана, тем самым повышать свободный поверхностный заряд нити. Действительно, как следует из данных, приведенных на рис. 6, введение небольшого количества НФХ, 0.5 мас. %, увеличивает величину ζ-потенциала. Кроме того, в пользу большей упорядоченности заряженных групп композиционных нитей и, как следствие, более узкого распределения величины зарядов свидетельствует резкое падение потенциала при достижении pH среды изоэлектрической точки для хитозанового волокна с добавкой 0.5% НФХ (рис. 6).
При гистологическом исследовании имплантированных нитей на 14-е сутки вокруг изучаемых образцов определялась нешироким слоем воспалительная инфильтрация, представленная лимфоцитами, макрофагами с примесью немногочисленных нейтрофильных и эозинофильных лейкоцитов. Слабее всего было выражено воспаление при добавлении 0.5% НФХ (рис. 7а); в случае использования нитей без добавления НФХ в составе инфильтратов наблюдались немногочисленные, сгруппированные тучные клетки (рис. 8а). На 91-е сутки в исследованных образцах отмечалось формирование тонкой грубоволокнистой капсулы вокруг инородных тел. Ни в одной из групп гигантских многоядерных клеток не было обнаружено.
Рис. 7.
Гистологические микрофотографии волокон хитозана с добавлением 0.5% НФХ, увеличение ×200: а – 14 сут; б – 91-е сутки.
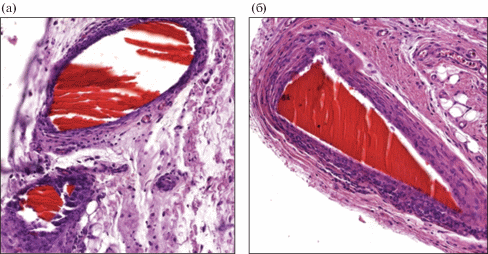
Рис. 8.
Гистологические микрофотографии волокон хитозана, увеличение ×200: а – 14 сут; б – 91-е сутки.
Полученные в ходе гистологического исследования данные свидетельствуют о биоинертности композиционных нитей. На 14-е сутки имплантации материалов вокруг них наблюдалось слабое воспаление, которое уменьшалось при более длительном нахождении в организме; при этом введение НФХ слабо сказывалось на реакции прилежащих тканей. Образование плотной соединительнотканной капсулы вокруг всех имлантированных материалов к 91-м суткам свидетельствует об отсутствии процессов резорбции хитозановых волокон вне зависимости от наличия НФХ в их составе.
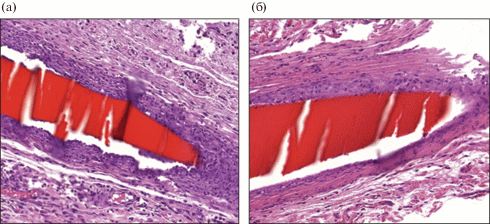
Спустя 14 сут после имплантации нетканых гемостатических материалов были взяты биоптаты и проведено их гистологическое исследование. Микроскопическое исследование нетканого хитозанового материала (рис. 9) выявило наличие крупной макрофагальной гранулемы, окружающей элементарные волокна нетканого материала (на фотографии окрашены красным цветом), в составе которой выявляются многочисленные гигантские многоядерные клетки типа инородных тел. Похожая ситуация наблюдается при исследовании нетканого материала с добавлением 0.5% НФХ (рис. 10): среди ярко окрашенных элементарных нитей материала отмечается формирование крупной гранулемы с многочисленными гигантскими клетками инородных тел, а также с мелкими очагами инфильтрации нейтрофильными лейкоцитами. Столь сильные отличия в сравнении с результатами имплантации нитей могут быть объяснены крупной пористой структурой нетканых материалов, состоящих из большого количества элементарных волокон.
Рис. 9.
Микрофотография гистологического исследования нетканого материала на основе хитозана, увеличение ×200. Стрелками показаны гигантские многоядерные клетки в гранулеме.

Рис. 10.
Микрофотография гистологического исследования нетканого материала на основе хитозана с добавлением 0.5% НФХ, увеличение ×200. Стрелками показаны гигантские многоядерные клетки в гранулеме.

Контрольная группа гемостатических материалов Surgicel Nu-Knit и Tachocomb отмечается быстрой биорезорбцией, на 14-е сутки остались лишь небольшие следы их присутствия в организме (рис. 11). В случае обоих материалов наблюдается присутствие единичных гигантских многоядерных клеток типа инородных тел, а также лимфомакрофагальная инфильтрация, выраженная слабее у материала Surgicel. Также данный образец отличается небольшим очагом склероза, который выражен гораздо сильнее и представлен в виде грубоволокнистой соединительной ткани в случае использования материала Tachocomb.
Рис. 11.
Микрофотографии гистологического исследования материалов Surgicel (а) и Tachocomb (б), увеличение ×50.

Таким образом, сравнительные исследования in vivo резорбции нетканых материалов на основе композиционных хитозановых нитей, содержащих НФХ, и гемостатических материалов Surgicel Nu-Knit и Tachocomb показали существенно меньшую скорость резорбции материалов на основе хитозана по сравнению с коммерческими гемостатиками.
ЗАКЛЮЧЕНИЕ
Испытания композиционных нитей продемонстрировали существенное влияние различных концентраций введенных в хитозан НФХ на их физико-механические свойства. Упрочнение нитей наблюдается при использовании малых концентраций НФХ (до 5%), тогда как введение большого количества НФХ приводит к снижению разрывного напряжения нитей и деформации до разрыва. Наилучшие результаты продемонстрировали нити с 0.5%-ным содержанием НФХ. Это может быть связано с дополнительной ориентацией макромолекул хитозана вдоль нанофибрилл при их малом количестве, что приводит к упрочнению получаемых нитей. В то же время использование больших концентраций НФХ приводит к образованию жесткой “хитиновой сетки”, напротив, препятствующей образованию ориентированной структуры нитей. С другой стороны, использование больших концентраций НФХ сопровождается большей устойчивостью нитей к действию влажной среды. Это может быть объяснено меньшими сорбционными способностями хитина в сравнении с хитозаном и большей гидрофильностью хитозана.
Для оценки кровеостанавливающих свойств материалов и их взаимодействия с организмом были проведены испытания in vivo. Было измерено время остановки артериального кровотечения при использовании различных концентраций НФХ. Наиболее выраженным гемостатическим эффектом обладали губки с 0.5%-ным содержанием НФХ, ввиду чего данная концентрация была использована для изготовления нетканого материала, который оказался сравнимым с коммерческими кровеостанавливающими препаратами Surgicel Nu-Knit и Tachocomb при моделировании артериального и венозного кровотечений. Измерение ζ-потенциала нетканых материалов на основе хитозановых, а также композиционных нитей, содержащих 0.5% НФХ, показало наличие большего положительного заряда при pH < 8 на поверхности нетканого материала из композиционных нитей. Можно предположить, что взаимодействие положительного заряда поверхности материала с отрицательно заряженными клетками крови способствует повышению гемостатического потенциала нетканого материала на основе хитозановых нитей, содержащих НФХ.
Для оценки долгосрочного взаимодействия разработанных материалов с живым организмом была проведена имплантация хитозановых волокон субфасциально в проекции m. latissimus dorsi. Волокна продемонстрировали биоинертный характер и отсутствие воспалительной реакции вне зависимости от наличия или отсутствия в них НФХ. Следует отметить на 91-е сутки наблюдения образование плотной соединительнотканной капсулы вокруг имплантированного волокна, что свидетельствует о низкой скорости резорбции хитозановых волокон в субфасции. Гистологическое исследование взаимодействия разработанных нетканых материалов с тканями живого организма показало в области имплантации наличие многочисленных гигантских многоядерных клеток, что может быть связано с их крупной пористой структурой, ввиду чего требуется проведение дальнейших исследований. Также планируется провести сравнение эффективности полученных материалов с существующими коммерческими препаратами на основе хитозана, такими как Celox.
Авторы выражают благодарность Pierfrancesco Morganti за предоставленные нанофибриллы хитина для проведения исследования.
Работа выполнена при поддержке Российского фонда фундаментальных исследований, грант № 18-29-17011 мк.
Список литературы
Ersoy G., Kaynak M.F., Yilmaz O. et al. // Adv. Therapy. 2007. V. 24. № 3. P. 485.
Samudrala S. // AORN J. 2008. V. 88. № 3. P. S2.
Jensen D.M., Machicado G.A. // Techniques in Gastrointestinal Endoscopy. 2005. V. 7. № 3. P. 124.
Kichler A., Jang S. // Clinical Endoscopy. 2019. V. 52. № 5. P. 401.
Howe N., Cherpelis B. // J. American Academy of Dermatology. 2013. V. 69. № 5. P. 659.e1.
Ghassemi K.A., Jensen D.M. // Expert Review of Gastroenterology Hepatology. 2016. V. 10. № 5. P. 615.
Alizadeh F., Fakoor A., Haghdani S. // J. Pediatric Urology. 2016. V. 12 № 3. P. 160.e1.
Lo C.-C., Hsu P.-I., Lo G.-H. et al. // Gastrointestinal Endoscopy. 2006. V. 63. № 6. P. 767.
Paternò V.A., Bisin A., Addis A. // BMC Surgery. 2020, PREPRINT (Version 1).
Johnson D., Bates S., Nukalo S. et al. // Annals of Medicine and Surgery. 2014. V. 3. № 2. P. 21.
Sun X., Tang Z., Pan M. et al. // Carbohydrate Polymers. 2017. V. 177. P. 135.
Achneck H.E., Sileshi B., Jamiolkowski R.M. et al. // Annals of Surgery. 2010. V. 251. № 2. P. 217.
Ren D., Yi H., Wang W., Ma X. // Carbohydrate Res. 2005. V. 340. № 15. P. 2403.
Murat F.-J.L., Ereth M.H., Dong Y. et al. // J. Urology. 2004. V. 172. № 3. P. 1119.
Achneck H.E., Sileshi B., Jamiolkowski R.M. et al. // Annals of Surgery. 2010. V. 251. № 2. P. 217.
Baird S.M., Teh B.M., Lim K.K.M., Campbell M.C. // Laryngoscope. 2018. V. 128. № 2. P. 369.
Larson P.O. // J. Dermatologic Surgery and Oncology. 1988. V. 14. № 6. P. 623.
Lewis K.M., Atlee H., Mannone A. et al. // J. Surgical Res. 2015. V. 193. № 2. P. 825.
Lee S., Pham A.M., Pryor S.G. et al. // Arch. Facial Plastic Surgery. 2009. V. 11. № 1. P. 29.
Vadasz Z., Toubi E. // Seminars in Thrombosis and Hemostasis. 2018. V. 44. № 07. P. 669.
Ravi Kumar M.N.V. // Reactive and Functional Polymers. 2000. V. 46. № 1. P. 1.
Qin Y. // J. Appl. Polym. Sci. 2008. V. 107. № 2. P. 993.
Ueno H., Mori T., Fujinaga T. // Adv. Drug Delivery Rev. 2001. V. 52. № 2. P. 105.
Boucard N., Viton C., Agay D. et al. // Biomaterials. 2007. V. 28. № 24. P. 3478.
Dodane V., Vilivalam V.D. // Pharmaceutical Science Technology Today. 1998. V. 1. № 6. P. 246.
Kim I.-Y., Seo S.-J., Moon H.-S. et al. // Biotechnol. Adv. 2008. V. 26. № 1. P. 1.
East G.C., Qin Y. // J. Appl. Polym. Sci. 1993. V. 50. № 10. P. 1773.
Hu Z., Zhang D.-Y., Lu S.-T. et al. // Marine Drugs. 2018. V. 16. № 8. P. 273.
Kozen B.G., Kircher S.J., Henao J. et al. // Acad. Emerg. Med. 2008. V. 15. P. 74.
Zubillaga V., Salaberria A.M., Palomares T. et al. // Biomacromolecules. 2018. V. 19. № 7. P. 3000.
Torres F.G., Troncoso O.P., Pisani A. et al. // Int. J. Mol. Sci. 2019. V. 20. № 20. P. 5092.
Yudin V.E., Dobrovolskaya I.P., Neelov I.M. et al. // Carbohydrate Polymers. 2014. V. 108. P. 176.
Dresvyanina E., Yudenko A., Yevlampieva N. et al. // Vlakna a Textil. 2018. V. 25. № 2. P. 27.
Smirnova N.V., Kolbe K.A., Dresvyanina E.N. et al. // Materials. 2019. V. 12. № 11. P. 1874.
Smotrina T.V., Dresvyanina E.N., Grebennikov S.F. et al. // Polymer. 2020. V. 189. P. 122.
Дресвянина Е.Н., Гребенников С.Ф., Добровольская И.П. и др. // Высокомол. cоединения. А. 2020. Т. 62. № 3. С. 181.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии