Нефтехимия, 2020, T. 60, № 2, стр. 214-224
Каталитические материалы на основе гидроталькитоподобных гидроксидоВ Al, Mg, Ni, Co. Влияние соотношения никель : кобальт на результаты кислородной и углекислотной конверсии метана в синтез-газ
А. Г. Дедов 1, 2, 4, А. С. Локтев 1, 2, 4, *, **, В. П. Данилов 2, О. Н. Краснобаева 2, Т. А. Носова 2, И. Е. Мухин 1, А. Е. Баранчиков 2, Х. Э. Ёров 3, М. А. Быков 3, И. И. Моисеев 1, 2, 4
1 Российский государственный университет нефти и газа (Научно- исследовательский университет)
имени И.М. Губкина
119991 Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова
119991 Москва, Россия
4 Институт нефтехимического синтеза имени А.В. Топчиева РАН
119991 Москва, Россия
* E-mail: al57@rambler.ru
** E-mail: genchem@gubkin.ru
Поступила в редакцию 07.10.2019
Принята к публикации 14.10.2019
Аннотация
Катализаторы кислородной и углекислотной конверсии метана получены на основе гидроксосолей [AlMg2NixCoy(OH)6.08][(NO3) ⋅ nH2O], где x, y = 0; 0.005, 0.01, 0.02; 0.03, 0.035, 0.04, имеющих гидроталькитоподобную структуру, с суммарным содержанием Ni и/или Co не более 2 мас. %. Показано, что Ni−Co-катализаторы с x = 0.03–0.035, y = 0.005–0.01 позволяют достигнуть выхода синтез-газа 97–99% в обоих процессах. Даже при незначительном содержании кобальта катализаторы практически не образуют углеродных нанотрубок и других углеродных отложений.
Получение синтез-газа (СГ) из природного газа – важная высокозатратная стадия переработки газового сырья в продукты нефтехимии. Содержащийся в СГ водород рассматривают и как экологически чистое топливо [1–6]. Перспективные процессы получения СГ кислородной конверсией метана (ККМ) и углекислотной конверсией метана (УКМ) выступают ближайшими конкурентами действующему процессу паровой конверсии метана. К достоинствам ККМ можно отнести соотношение H2/CO = 2 в получаемом СГ, позволяющее синтезировать метанол и углеводороды по Фишеру–Тропшу, и экзотермичность. Процесс УКМ (H2/CO = 1) привлекает возрастающее внимание как способ утилизации основного парникового газа – диоксида углерода. Кроме того, для проведения данного процесса возможно использование возобновляемого сырья – биогаза [7].
Известны эффективные катализаторы получения синтез-газа – нанесенные на оксидные носители никель, кобальт, металлы платиновой группы и их различные комбинации [1–6]. Использование металлов платиновой группы сдерживается их высокой стоимостью. Катализаторы на основе никеля, значительно более активны при сравнительно невысоких температурах, чем кобальтовые, склонны к потере активности за счет блокировки активных центров поверхностным углеродом или за счет взаимодействия никеля с носителем, ведущим к образованию неактивных соединений. Допирование никельсодержащих катализаторов платиновыми металлами уменьшает зауглероживание катализаторов, а подбор оптимального носителя способствует стабилизации никелевых активных центров [1–6]. Добавки кобальта также позволяют уменьшить зауглероживание катализатора [8].
Одной из причин дезактивации никелевых катализаторов, нанесенных на оксид алюминия, принято считать образование шпинели NiAl2O4 [1–4]. Однако при использовании смешанных алюмомагниевых носителей никель не дезактивируется [9–11] и характеристики полученных катализаторов часто превосходят характеристики контактов, содержащих платиновые металлы. Считается, что восстановление шпинели NiAl2O4 способствует образованию стабильных и активных никелевых частиц [9], а оксид магния способствует равномерному диспергированию никеля за счет ингибирования образования шпинели NiAl2O4 и формирования твердого раствора NiO–MgO [11].
Эффективным носителем никелевых и кобальтовых катализаторов ККМ и УКМ оказались оксидные системы на основе слоистого материала – Al–Mg-гидроталькита [12–26]. Высокие показатели: степень конверсии реагентов, селективность, стабильность образования синтез-газа и устойчивость к зауглероживанию связывают с формированием наноразмерных частиц никеля, присутствием оксида магния и алюмомагниевой шпинели. Добавление кобальта в никельсодержащие контакты в ряде случаев уменьшает зауглероживание катализаторов. Большинство описанных катализаторов этого типа содержит значительное количество никеля и/или кобальта и, в целом, не свободны от зауглероживания. Известные катализаторы УКМ на основе алюмомагниевых гидроталькитов, содержащие менее 5 мас. % никеля, обеспечивают конверсии метана и СО2 менее 90% при заметном зауглероживании [15]. Введение лантана в 2% никелевый катализатор позволяло достигнуть конверсии метана и СО2 около 90%, но не устраняло формирование углеродных нановолокон и нанотрубок [23, 24].
Нами разработаны катализаторы, получаемые термолизом имеющих гидроталькитоподобную структуру гидроксосолей общей формулы [AlMg2NixCoy(OH)6.08][(NO3) ⋅ nH2O], где x = 0, 0.02, 0.04; y = 0, 0.02, 0.04, суммарно содержащие не более 2 мас. % Ni и/или Co [27]. Ni-содержащие катализаторы позволили достичь выхода синтез-газа 90% в кислородной и 97% в углекислотной конверсии метана. При этом в ходе УКМ образуется лишь незначительное количество углеродных нанотрубок, а совместное содержание никеля и кобальта в составе катализатора полностью предотвращает их образование в углекислотной конверсии метана. В то же время катализатор, содержащий по 1 мас. % никеля и кобальта был менее активен в УКМ; а катализатор, содержащий только 2 мас. % кобальта показал неудовлетворительные результаты [27].
Катализатор, содержащий 2% Ni после кратковременного разогрева до 950°С в потоке метан-кислородной смеси (CH4/O2 = 2; скорость подачи 12 л/г катализатора в ч), продолжает стабильно работать в реакции ККМ при 900°С на протяжении 50 ч, демонстрируя высокий (более 90%) выход синтез-газа [28]. На микрофотографиях катализатора после ККМ отсутствуют признаки зауглероживания.
Тот же катализатор в реакции УКМ стабильно работал на протяжении 60 ч, показывая высокий (более 95%) выход синтез-газа. На микрофотографиях поверхности катализатора после УКМ фиксируются фрагментарные скопления частиц никеля или его оксида, а также связанные с ними незначительные углеродные отложения. Рентгенограммы катализатора после ККМ и УКМ идентичны и позволяли зафиксировать лишь образование фаз MgO и шпинелей, содержащих наряду с алюминием магний или никель.
Вероятной причиной стабильности катализатора в ККМ и УКМ служат малые размеры формируемых никелевых частиц, не дающих рефлексов на рентгенограммах. Такой эффект наблюдали в УКМ на содержащих 10% никеля алюмомагниевых гидроталькитных катализаторах. При размерах частиц никеля менее 15 нм закоксовывание катализатора прекращается [17].
В связи с тем, что смешанный никель-кобальтовый катализатор не подвергался зауглероживанию в реакции УКМ, а также с учетом литературных данных, указывающих на активность в ККМ и УКМ содержащих кобальт катализаторов на основе алюмомагниевых гидроталькитов, представляло интерес изучить влияние на протекание реакций ККМ и УКМ соотношения никель: кобальт в алюмомагниевых катализаторах на основе алюмомагниевого гидроталькита.
Цель работы:
• синтез и исследование катализаторов кислородной и углекислотной конверсии метана на основе никель-кобальтовых алюмомагниевых гидроксосолей гидроталькитоподобной структуры, суммарно содержащих 2 мас. % смеси никеля и кобальта при варьировании их соотношения,
• определение влияния соотношения никель: кобальт в синтезированных катализаторах на результаты ККМ и УКМ,
• сопоставление результатов ККМ и УКМ с ранее полученными результатами [27].
Использование подобных катализаторов ККМ и УКМ с варьируемым соотношением никеля и кобальта при их суммарном содержании, не превышающем 2 мас. %, ранее не описано.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Предшественники катализаторов: никель-кобальтовые алюмомагниевые гидроксосоли, синтезировали по следующей методике: к раствору, содержащему нитраты алюминия, магния, кобальта и никеля в заданных количествах, при 60°С и перемешивании по каплям добавляли раствор, содержащий гидроксид и карбонат калия в мольном соотношении 2 : 1, до изменения рН от 1 до 10. Полученный осадок отмывали водой до отсутствия ионов калия (по реакции с тетрафенилборатом). Для установления фазового и химического состава синтезированных гидроксосолей использовали методы химического и рентгенофазового анализа (дифрактометр ДРОН-2.0, Cu-Kα-излучение), а для контроля условий их образования – рН-метрическое титрование растворов на прецизионном цифровом рН-метре ОР-208 РАДЕЛИКС (Венгрия). Методики определения элементов приведены в [29]. Получены четыре однофазных образца гидроталькитоподобных гидроксосолей, которые, по данным химического и рентгенофазового (РФА) анализов имеют следующие составы:
1. [AlMg2Ni0.01Co0.03(OH)6.08][(NO3) ⋅ nH2O]
2. [AlMg2Ni0.03Co0.01(OH)6.08][(NO3) ⋅ nH2O]
3. [AlMg2Ni0.005Co0.035(OH)6.08][(NO3) ⋅ nH2O]
4. [AlMg2Ni0.035Co0.005(OH)6.08][(NO3) ⋅ nH2O]
Синтезированные гидроксосоли нагревали от 20 до 400°С со скоростью 100 град/ч, затем выдерживали 2 ч при 400°С и 2 ч при 500°С.
Каталитические свойства образцов в ККМ и УКМ исследовали в обогреваемом кварцевом реакторе проточного типа с карманом для термопары. Конец термопары располагали в центре слоя катализатора. Порошки прекурсоров катализаторов таблетировали, измельчали и отбирали фракцию с размером гранул 0.5–1 мм. Катализатор (0.2 г, высота слоя 1 мм) размещали на подложке из кварцевого волокна. При проведении ККМ свободный объем реактора заполняли кварцевой крошкой. В реактор подавали неразбавленные инертным газом смеси CH4 с O2 или CO2 (ОАО “Московский газоперерабатывающий завод”, чистота 99.9%) в соотношении CH4/O2 = 2; CH4/CO2 = 1 со скоростью соответственно 11–12 и 15–16 л (г катализатора ч)–1 и разогревали катализатор до заданной температуры. После проведения анализа приводили температуру к заданным значениям. Состав продуктов анализировали методом ГЖХ по известной методике [5, 8].
Фазовый состав катализаторов после ККМ и УКМ изучали методом рентгенофазового анализа (РФА) порошков на дифрактометре Rigaku MiniFlex 600 (Япония), детектор с графитовым монохроматором и медным антикатодом, CuKα излучение, λ = 1.54187 Å, использовали базу международного центра дифракционных данных (International Center for Diffraction Data – ICDD).
Морфологию катализаторов после использования в ККМ и УКМ изучали при помощи растрового электронного микроскопа (РЭМ) Carl Zeiss NVision 40 при увеличении до 200 000× с использованием детекторов вторичных (SE или InLens; ускоряющее напряжение 7 кВ) и обратно рассеянных (ESB; ускоряющее напряжение 1 кВ) электронов.
Синтезированные и использованные в катализе ККМ и УКМ материалы сложнооксидной структуры, полученные термолизом соответствующих гидроксосолей, характеризуются следующим мольным соотношением содержащихся в них ионов металлов:
1. Al : Mg : Ni : Co = 1 : 2 : 0.01 : 0.03 (далее обозначен Ni0.01Co0.03ГТ);
2. Al : Mg : Ni : Co = 1 : 2 : 0.03 : 0.01 (далее обозначен Ni0.03Co0.01ГТ);
3. Al : Mg : Ni : Co = 1 : 2 : 0.005 : 0.035 (далее обозначен Ni0.005Co0.035ГТ);
4. Al : Mg : Ni : Co = 1 : 2 : 0.035 : 0.005 (далее обозначен Ni0.035Co0.005ГТ).
Для сравнения использованы результаты ранее проведенных экспериментов по ККМ и УКМ, в которых материалы, полученные по аналогичной методике, имели следующее мольное соотношение содержащихся в них ионов металлов [27]:
Al : Mg : Ni = 1 : 2 : 0.04 (далее обозначен NiГТ);
Al : Mg : Ni : Co = 1 : 2 : 0.02 : 0.02 (далее обозначен Ni0.02Co0.02ГТ);
Al : Mg : Co = 1 : 2 : 0.04 (далее обозначен CoГТ).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
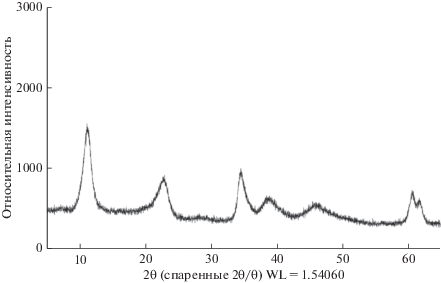
Определенные методом рентгенофазового анализа (рис. 1) межплоскостные расстояния у исходных гидроксосолей d = 1.49 (113); 1.51(110); 1.98 (018); 2.33 (015) 2.59 (009); 3.88(006); 7.76 (003) Å характерны для классического гидроталькитоподобного соединения, кристаллизующегося в гексагональной сингонии с параметрами элементарной ячейки: C = 23.28 Å, а = 3.02 Å.
Рис 1.
Пример дифрактограммы порошка синтезированного образца гидроксосоли № 1 – [AlMg2Ni0.01Co0.03(OH)6.08][(NO3) ⋅ nH2O]; образцы №№ 2–4 изоморфны образцу № 1.
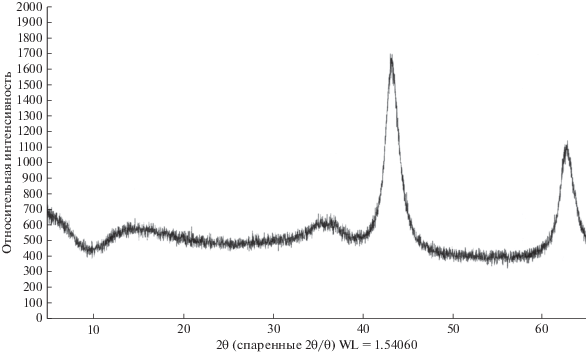
После прокаливания при 500°С по данным РФА (рис. 2) все образцы представляют собой смесь плохо окристаллизованных и аморфных фаз, предположительно, Al2O3, MgO, NiO, CoO, Co2O3. Последние три оксида затруднительно надежно обнаружить рентгенографически из-за их малого содержания в образцах.
Рис. 2.
Пример дифрактограммы порошка прокаленного образца гидроксосоли № 1 – [AlMg2Ni0.01Co0.03(OH)6.08][(NO3) ⋅ nH2O]; образцы №№ 2–4 изоморфны образцу № 1.
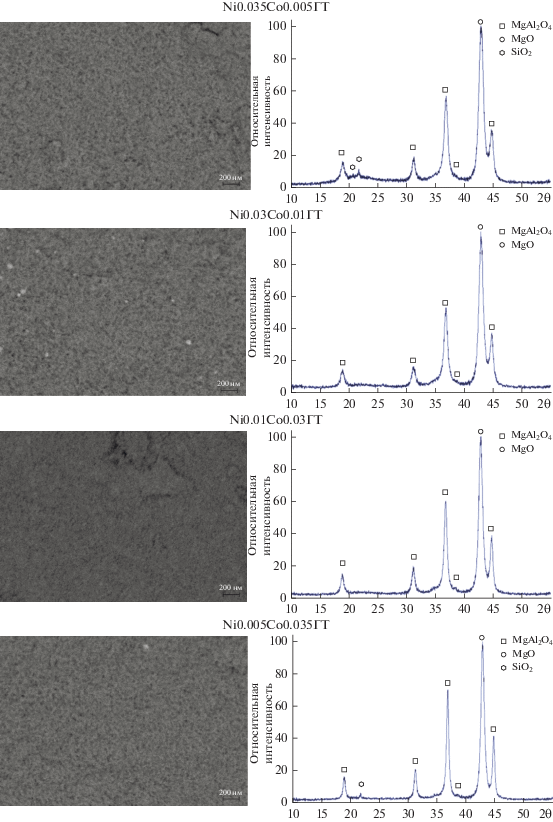
В табл. 1 приведены результаты по ККМ на синтезированных катализаторах Ni0.035Co0.005ГТ, Ni0.03Co0.01ГТ, Ni0.01Co0.03ГТ, Ni0.005Co0.035ГТ (опыты 5–14, 20–29). Для сравнения в таблицу включены результаты ранее проведенных экспериментов на катализаторах NiГТ, Ni0.02Co0.02ГТ, CoГТ [27] (опыты 1–4, 15–19, 30–34). Катализаторы расположены по мере уменьшения содержания никеля и возрастания содержания кобальта.
Таблица 1.
Результаты ККМ
| № опыта | T, °C | Конверсия CH4,% | Выход, % | |||
|---|---|---|---|---|---|---|
| CO | H2 | CO2 | С2+ | |||
| NiГТ* | ||||||
| 1 | 950 | 34 | 7 | 14 | 16 | 9 |
| 2 | 950 | 90 | 90 | 90 | Cледы | 0 |
| 3 | 920 | 89 | 89 | 89 | Cледы | 0 |
| 4 | 900 | 89 | 89 | 89 | Cледы | 0 |
| Ni0.035Co0.005ГТ | ||||||
| 5 | 900 | 86 | 80 | 71 | 6 | 0 |
| 6 | 920 | 99 | 96 | 95 | 1 | 0 |
| 7 | 950 | 100 | 98 | 98 | Cледы | 0 |
| 8 | 900 | 99 | 95 | 95 | Cледы | 0 |
| 9 | 850 | 96 | 93 | 91 | 1 | 0 |
| Ni0.03Co0.01ГТ | ||||||
| 10 | 900 | 77 | 70 | 60 | 6 | 0 |
| 11 | 920 | 97 | 95 | 93 | Cледы | 0 |
| 12 | 950 | 99 | 98 | 99 | 0 | 0 |
| 13 | 900 | 99 | 97 | 94 | Cледы | 0 |
| 14 | 850 | 97 | 95 | 89 | 1 | 0 |
| Ni0.02Co0.02ГТ* | ||||||
| 15 | 950 | 36 | 7 | 15 | 16 | 8 |
| 16 | 920 | 32 | 6 | 14 | 18 | 6 |
| 17 | 900 | 28 | 5 | 12 | 17 | 5 |
| 18 | 850 | 23 | 3 | 6 | 17 | 4 |
| 19 | 800 | 23 | 3 | 6 | 17 | 3 |
| Ni0.01Co0.03ГТ | ||||||
| 20 | 900 | 33 | 0 | 5 | 27 | 6 |
| 21 | 920 | 23 | 0 | 8 | 20 | 3 |
| 22 | 950 | 37 | 2 | 17 | 30 | 2 |
| 23 | 900 | 37 | 1 | 13 | 32 | 3 |
| 24 | 850 | 31 | 0 | 4 | 27 | 4 |
| Ni0.005Co0.035ГТ | ||||||
| 25 | 900 | 34 | 2 | 9 | 26 | 4 |
| 26 | 920 | 34 | 1 | 12 | 29 | 3 |
| 27 | 950 | 38 | 5 | 17 | 28 | 1 |
| 28 | 900 | 36 | 3 | 14 | 29 | 2 |
| 29 | 850 | 35 | 1 | 8 | 30 | 3 |
| CoГТ* | ||||||
| 30 | 950 | 33 | 5 | 13 | 19 | 8 |
| 31 | 920 | 32 | 3 | 10 | 20 | 7 |
| 32 | 900 | 30 | 2 | 8 | 21 | 6 |
| 33 | 850 | 25 | 2 | 6 | 19 | 4 |
| 34 | 800 | 25 | 2 | 6 | 21 | 2 |
* Данные работы авторов [27].
Соотношение никеля и кобальта в составе катализатора существенно влияет на результаты ККМ (табл. 1). Не содержавший кобальта катализатор NiГТ (опыты 1–4), разогретый в течение часа в метан-кислородной смеси до 950°С, первоначально не показал высокого выхода синтез-газа (опыт 1). Но после выдержки при 950°С (опыт 2) конверсия метана и выход синтез-газа возросли до 89–90% и существенно не снижались даже с понижением температуры в слое катализатора (опыты 3, 4). Не содержавший никеля катализатор CoГТ и содержавший эквимолярные количества никеля и кобальта Ni0.02Co0.02ГТ (опыты 30–34 и 15–19, табл. 1) были малоактивны в ККМ даже при продолжительном контакте с метан-кислородной смесью при 950°С (опыты 15 и 30, табл. 1) [27]. Конверсия метана и выход СГ были невысокими и заметно уменьшались со снижением температуры. Это указывало на неэффективность в ККМ кобальтсодержащих катализаторов на основе алюмомагниевого гидроталькита, содержащих 2 мас. % Co или по 1 мас. % Co и Ni [27].
В то же время синтезированный в настоящей работе катализатор Ni0.035Co0.005ГТ, содержащий 1.75% Ni и 0.25% Co (был разогрет в течение часа в метан-кислородной смеси до 900°С), уже при этой температуре показал высокие значения конверсии метана (86%), выхода водорода (71%) и CO (80%) (опыт 5 табл. 1). С ростом температуры (опыты 6, 7 табл. 1) конверсия метана, выход водорода и CO возрастали и при 950°С достигли значений, близких к 100%. Последующее снижение температуры (опыты 8 и 9 табл. 1) привело к уменьшению достигнутых показателей, однако даже при 850°С сохранялись высокие значения: конверсия метана (96%), выход водорода (91%) и CO (93%). Таким образом, введение небольшого количества кобальта (Ni/Co = 7) при суммарном содержании никеля и кобальта 2 мас. % положительно влияет на результаты ККМ.
Катализатор Ni0.03Co0.01ГТ, содержащий 1.5% Ni и 0.5% Co (Ni/Co = 3), в аналогичных условиях показал близкие результаты (опыты 10–14 табл. 1). Видно, что увеличение содержания кобальта с 0.25 до 0.5 мас. % с одновременным уменьшением содержания никеля с 1.75 до 1.5 мас. % не приводит к ухудшению результатов ККМ.
Но надо отметить, что дальнейший рост содержания кобальта при одновременном уменьшении содержания никеля значительно ухудшает результаты ККМ. Катализаторы, содержащие по 1 мас. % кобальта и никеля, (Ni0.02Co0.02ГТ, опыты 15–19 табл. 1), 1.5% кобальта и 0.5% никеля (Ni0.01Co0.03ГТ, опыты 20–24 табл. 1) и 1.75% кобальта и 0.25% никеля (Ni0.005Co0.035ГТ, опыты 25–29 табл. 1), так же, как и не содержавший никеля CoГТ, показали низкое значение конверсии метана и выхода синтез-газа.
Исследования катализаторов с варьируемым соотношением никель/кобальт после ККМ методами РЭМ и РФА показали (рис. 3), что их текстура и фазовый состав примерно одинаковы: слоистая структура с эпизодическими вкраплениями на поверхности частиц, содержащих никель или кобальт, вероятно, в форме оксидов. Фиксировали образование фаз MgO и шпинелей, содержащих наряду с алюминием магний и, возможно, никель и кобальт. Фаза диоксида кремния принадлежит частицам подложки – кварцевого волокна. Отсутствие на порошкограммах рефлексов металлических никеля, кобальта и их оксидов может быть связано с малыми размерами частиц и процедурой охлаждения катализаторов в смеси с высоким содержанием кислорода. Возможно также вхождение никеля и кобальта в структуру шпинелей, изоморфных алюмомагниевой.
Таким образом, наблюдавшиеся отличия в каталитических свойствах, видимо, определяются присутствием неоптимального избыточного по отношению к никелю количества кобальта, ухудшающего результаты ККМ, возможно, из-за высокой окислительной активности оксидов кобальта в присутствии кислорода, подаваемого в реактор наряду с метаном.
В табл. 2 приведены результаты УКМ на синтезированных катализаторах Ni0.035Co0.005ГТ, Ni0.03Co0.01ГТ, Ni0.01Co0.03ГТ, Ni0.005Co0.035ГТ (опыты 6–17, 24–34). Для сравнения в таблицу включены результаты ранее проведенных экспериментов по УКМ на катализаторах NiГТ, Ni0.02Co0.02ГТ, CoГТ [27] (опыты 1–5, 18–23, 35–38). Катализаторы расположены по мере уменьшения содержания никеля и возрастания содержания кобальта.
Таблица 2.
Результаты УКМ
| № опыта | T, °C | Конверсия, % | Выход, % | ||
|---|---|---|---|---|---|
| CH4 | CO2 | CO | H2 | ||
| NiГТ* | |||||
| 1 | 850 | 1 | 11 | 5 | 1 |
| 2 | 900 | 93 | 93 | 92 | 93 |
| 3 | 920 | 94 | 94 | 94 | 94 |
| 4 | 950 | 95 | 99 | 97 | 95 |
| 5 | 850 | 89 | 89 | 89 | 89 |
| Ni0.035Co0.005ГТ | |||||
| 6 | 900 (30 мин) | 14 | 31 | 15 | 17 |
| 7 | 900 (50 мин) | 94 | 97 | 92 | 92 |
| 8 | 920 | 95 | 97 | 95 | 96 |
| 9 | 950 | 96 | 98 | 97 | 99 |
| 10 | 900 | 93 | 96 | 94 | 95 |
| 11 | 850 | 90 | 93 | 90 | 85 |
| Ni0.03Co0.01ГТ | |||||
| 12 | 900 (50 мин) | 80 | 84 | 68 | 47 |
| 13 | 920 | 97 | 97 | 96 | 97 |
| 14 | 900 | 93 | 97 | 92 | 91 |
| 15 | 920 | 96 | 98 | 97 | 99 |
| 16 | 950 | 96 | 98 | 97 | 99 |
| 17 | 850 | 90 | 93 | 91 | 88 |
| Ni0.02Co0.02ГТ* | |||||
| 18 | 800 | 6 | 14 | 3 | Cледы |
| 19 | 850 | 6 | 18 | 3 | 2 |
| 20 | 900 | 14 | 30 | 12 | 6 |
| 21 | 920 | 28 | 45 | 28 | 18 |
| 22 | 950 | 81 | 85 | 83 | 81 |
| 23 | 850 | 79 | 83 | 81 | 79 |
| Ni0.01Co0.03ГТ | |||||
| 24 | 900 | 1 | 7 | 0 | 2 |
| 25 | 920 | 8 | 18 | 3 | 9 |
| 26 | 950 | 14 | 29 | 11 | 16 |
| 27 | 900 | 11 | 24 | 6 | 13 |
| 28 | 850 | 10 | 20 | 1 | 7 |
| Ni0.005Co0.035ГТ | |||||
| 29 | 900 | 3 | 10 | 0 | 3 |
| 30 | 920 | 9 | 22 | 4 | 9 |
| 31 | 950 | 20 | 37 | 16 | 15 |
| 32 | 920 | 28 | 45 | 28 | 18 |
| 33 | 900 | 9 | 25 | 3 | 8 |
| 34 | 850 | 4 | 10 | 0 | 3 |
| CoГТ* | |||||
| 35 | 950 (40 мин) | 28 | 47 | 29 | 22 |
| 36 | 920 | 27 | 42 | 28 | 18 |
| 37 | 900 | 24 | 40 | 23 | 22 |
| 38 | 850 | 13 | 26 | 13 | 12 |
* Данные работы [27].
Как и в опытах по ККМ, соотношение никеля и кобальта в составе катализатора существенно влияет на результаты УКМ. Не содержащий кобальт катализатор NiГТ нагревали в потоке реагентов УКМ до 800°С, затем температуру пошагово повышали до 950°С, затем снижали до 850°С. При 800 и 850°С катализатор был неактивен, но резко улучшил результаты УКМ по достижении 900°С (опыты 1, 2 табл. 2). С дальнейшим ростом температуры результаты УКМ улучшались. Значения конверсии метана (95%) и СО2 (99%), выходов СО и водорода (соответственно 97 и 95%) при 950°С (опыт 4), незначительно отличались от результатов, полученных при 900 и 920°С (опыты 2, 3 табл. 2).
Последующее снижение температуры УКМ до 850°С (опыт 5 табл. 2) не вызвало резкого уменьшения конверсии реагентов и выхода синтез–газа, составивших 89%, что значительно превосходит результаты, полученные при той же температуре при разогреве катализатора. Видимо, с нагревом катализатора NiГТ в потоке реагентов до 850°С не происходило заметного формирования активных металлических центров, а образовавшиеся при более высокой температуре активные центры УКМ эффективно функционировали и при последующем охлаждении.
С учетом этих результатов, допированный кобальтом (Ni/Co = 7) катализатор Ni0.035Co0.005ГТ, содержавший 1.75% Ni и 0.25% Co, разогревали в метан-углекислотной смеси сразу до 900°С и уже через 30 мин зафиксировали образование синтез-газа (опыт 6 табл. 2). А через 50 мин значения конверсии метана и СО2 достигли 94 и 97%, выходы водорода и CO 92% (опыт 7 табл. 2). С дальнейшим повышением температуры (опыты 8, 9 табл. 2) конверсии метана и СО2, выходы водорода и CO возрастали и при 950°С достигли значений, близких к 100%. Последующее снижение температуры (опыты 10 и 11 табл. 2) привело к некоторому уменьшению достигнутых показателей; однако даже при 850°С сохранялись высокие значения конверсии метана (96%), СО2 (93%), выхода водорода (85%) и CO (93%). Таким образом, катализатор, суммарно содержавший 2 мас. % никеля и кобальта в соотношении Ni/Co = 7, показал результаты УКМ, не уступающие достигнутым на аналоге, не содержавшем кобальт.
Уменьшение соотношения Ni/Co до 3 (катализатор Ni0.03Co0.01ГТ) не привело к значительному уменьшению конверсии метана и СО2, выходов водорода и CO (опыты 12–17 табл. 1).
Однако при соотношении Ni/Co = 1 (опыты 18–23 табл. 2) значимые результаты УКМ достигались лишь при 950°С (опыт 22 табл. 2) и почти не менялись со снижением температуры до 850°С (опыт 22 табл. 2). То есть Ni0.02Co0.02ГТ, практически не катализировавший реакцию ККМ, оказался заметно более эффективным катализатором УКМ, хотя и уступал катализаторам с меньшим содержанием кобальта. Вероятно, при отсутствии кислорода в исходной газовой смеси металлические активные центры катализаторов более стабильны, несмотря на высокое содержание кобальта, способного поставлять активный решеточный кислород.
С дальнейшим снижением содержания никеля в катализаторе Ni0.01Co0.03ГТ (Ni/Co = 0.33) даже при 950°С не удавалось достичь высоких значений конверсии реагентов и выхода синтез-газа (опыты 24–28 табл. 2) Но и при меньших соотношениях Ni/Co = 0.17 и 0 реакция УКМ при 900–950°С все-же протекала в заметной степени (опыты 25–34 табл. 2). Выходы СО были заметно выше, чем при использовании этих же катализаторов в ККМ. Таким образом, высокое содержание кобальта (Ni/Co < 1) и даже полное отсутствие никеля затрудняет, но не подавляет формирование металлических активных центров катализаторов УКМ.
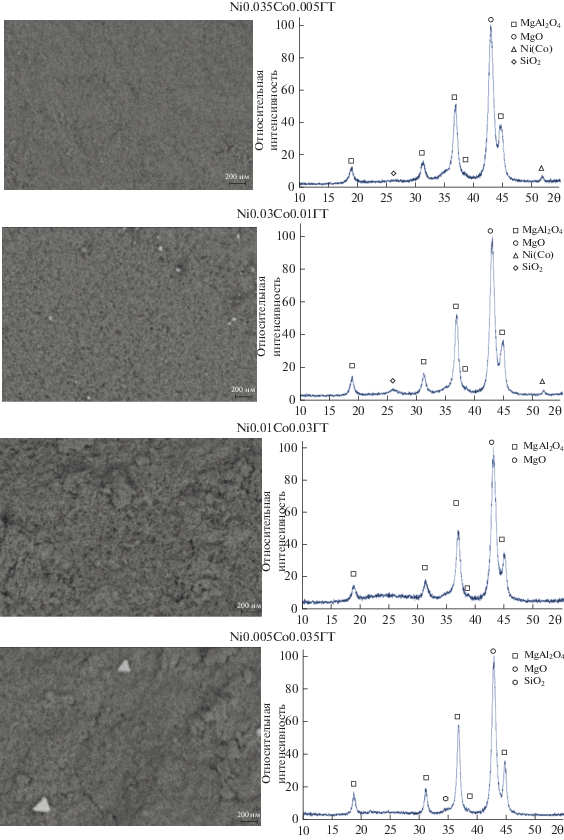
На поверхности содержавших кобальт катализаторов после использования в УКМ по данным РЭМ и РФА углеродные нанотрубки не формировались (рис. 4), тогда как на катализаторе NiГТ после проведения УКМ обнаружено небольшое количество углеродных нанотрубок в местах локализации никельсодержащих частиц [28]. На микрофотографиях катализаторов фиксировали фрагменты, соотносимые с присутствием на поверхности катализаторов частиц никеля и кобальта. По данным РФА, в структуре всех катализаторов после УКМ присутствует шпинель MgAl2O4. Катализаторы с малым содержанием кобальта после УКМ содержали фазы металлических частиц с размерами 14 нм в случае Ni0.035Co0.005ГТ и 12 нм в случае Ni0.03Co0.01ГТ (размеры частиц оценены с использованием уравнения Шеррера). Малоактивные катализаторы УКМ не содержат фиксируемых методами РЭМ и РФА металлических частиц. На поверхности катализатора Ni0.005Co0.035ГТ наблюдаются кристаллы треугольной формы оксидов кобальта.
Таким образом, активные в УКМ допированные небольшим количеством кобальта катализаторы не склонны к образованию поверхностного углерода и содержат металлические активные центры размером менее 15 нм, которые не подвергаются закоксовыванию [17]. Эти катализаторы могут оказаться более стабильными в УКМ и ККМ, чем не содержавший кобальта катализатор NiГТ, показавший стабильные результаты в ККМ и УКМ, но на поверхности которого после проведения УКМ образовалось небольшое количество углеродных нанотрубок [28].
ЗАКЛЮЧЕНИЕ
Синтезированы и исследованы в реакциях кислородной и углекислотной конверсии метана в синтез–газ катализаторы, приготовленные на основе гидроксосолей [AlMg2NixCoy(OH)6.08][(NO3)nH2O], где x, y = 0.005, 0.01, 0.03, 0.035, имеющих гидроталькитоподобную структуру. Суммарное содержание Ni и Co в катализаторах (2 мас. %) меньше, чем у большинства описанных аналогов. Показано, что Ni−Co-катализаторы с x = 0.03–0.035, y = 0.005–0.01 (соотношение Ni/Co = 3–7) позволяют достичь выход синтез-газа 97–99% и в кислородной, и в углекислотной конверсии метана. Полученные результаты ККМ и УКМ превосходят показатели, достигнутые на аналогичном катализаторе, не содержащем кобальта, изученном ранее [27, 28]. Созданные катализаторы ККМ и УКМ практически не образуют углеродных нанотрубок и других углеродных отложений.
Список литературы
Liu K., Song C., Subramani V. Hydrogen and Syngas Production and Purification Technologies. Wiley-Interscience, 2009. 533 p.
Holmen A. // Catal. Today. 2009. V. 142. P. 2.
Enger B.C., Lødeng R., Holmen A. // Appl. Cat. A. 2008. V. 346. P. 1.
Zeng S., Zhang X., Fu X., Zhang L., Su H., Pan H. // Appl. Cat. B. 2013. V. 136–137. P. 308.
Dedov A.G., Loktev A.S., Komissarenko D.A., Parkhomenko K.V., Roger A.-C., Shlyakhtin O.A., Mazo G.N., Moiseev I.I. // Fuel Processing Technology. 2016. V. 148. P. 128.
Усачев Н.Я., Харламов В.В., Беланова Е.П., Казаков А.В., Старостина Т.С., Канаев С.А. // Нефтехимия. 2011. Т. 51. № 2. С. 107.
Zhenghong B., Fei Y. // Advances in Bioenergy. 2018. V. 3. P. 43.
Дедов А.Г., Локтев А.С., Иванов В.К., Быков М.А., Мухин И.Е., Лиджиев М.М., Рогалева Е.В., Моисеев И.И. // ДАН. 2015. Т. 461. № 4. С. 426 [Doklady Physical Chemistry. 2015. V. 461. Part 2. P. 73].
Rostrup-Nielsen, J.R., Bak Hansen, J.H. // J. of Catalysis. 1993. V. 144. № 1. P. 38.
Basile F., Basini L., D’Amore M., Fornasari G., Guarinoni A., Matteuzzi D., Del Piero G., Trifiro F., Vaccari A. // J. of Catalysis. 1998. V. 173. P. 247.
Yejun Q, Jixiang C, Zhang J. // J. of Fuel Chemistry and Technology. 2006. V. 34. № 4. P. 450.
Lee K.M., Lee W.Y. // Catal. Lett. 2002. V. 83. № 1–2. P. 65.
Takehira K., Shishido T, Wan P., Kosaka T., Takaki K. // J. of Catalysis. 2004. V. 221. P. 43.
Maniecki T.P., Bawolak-Olczak K., Mierczyński P., Maniukiewicz W., Józwiak W.K. // Chemical Engineering J. 2009. V. 154. P. 142.
Guo J., Lou H., Zhao H., Chai D., Zheng X. // Applied Catalysis A: General. 2004. V. 273. P. 75.
Bhattacharyya A, Chang V. W., Schumacher D.J. // Applied Clay Science. 1998. V. 13 . P. 317.
Shishido T., Sukenobu M., Morioka H., Furukawa R., Shirahase H., Takehira K. // Catalysis Letters. 2001. V. 73. № 1. P. 21.
Tsyganok A.I., Tsunoda T., Hamakawa S., Suzuki K., Takehira K., Hayakawa T. // J. of Catalysis. 2003. V. 213. P. 191.
Hou Z., Yashima T. // Applied Catalysis A: General. 2004. V. 261. P. 205.
Perez-Lopez O.W., Senger A., Marcilio N.R., Lansarin M.A. // Applied Catalysis A: General. 2006. V. 303. P. 234.
Serrano-Lotina A., Rodriguez L., Muñoz G., Daza L. // J. of Power Sources. 2011. V. 196. P. 4404.
Serrano-Lotina A., Martin A.J., Folgado M.A., Daza L. // International J. of Hydrogen Energy. 2012. V. 37. P. 12342.
Serrano-Lotina A., Daza L. // J. of Power Sources. 2013. V. 238. P. 81.
Serrano-Lotina A., Daza L. // Applied Catalysis A: General. 2014. V. 474. P. 107.
De Souza G., Ruoso C., Marcilio N.R., Perez-Lopez O.W. // Chemical Engineering Communications. 2016. V. 203. P. 783.
Tanios C., Bsaibes S., Gennequin C., Labaki M., Cazier F., Billet S., Tidahy H.L., Nsouli B., Aboukaïs A., Abi-Aad E. // International J. of Hydrogen Energy. 2017. V. 42. Issue 17. P. 12818.
Dedov A.G., Loktev A.S., Danilov V.P., Krasnobaeva O.N., Nosova T.A., Mukhin I.E., Tyumenova S.I., Baranchikov A.E., Ivanov V.K., Bykov M.A., Moiseev I.I. // Petrol-. Chemistry. 2018. V. 58. № 5. P. 418.
A.G. Dedov, A.S. Loktev, I.E. Mukhin, A.E. Baranchikov, V.K. Ivanov, M.A. Bykov, E.V. Solodova, I.I. Moiseev. // Petrol. Chemistry. 2019. V. 59. № 4. P. 385.
Краснобаева О.Н., Беломестных И.П., Исагулянц Г.В. и др. // Журн. неорган. химии. 2007. Т. 52. № 2. С. 181 [Russ. J. Inorg. Chem. 2007. V. 52. № 2. P. 141].
Дополнительные материалы отсутствуют.