Неорганические материалы, 2019, T. 55, № 2, стр. 182-186
Теплоемкость апатитов Pb10 – xLax(GeO4)2 + x(VO4)4 – x (x = 0, 1, 2, 3) в области 320–1000 K
Л. Т. Денисова 1, *, Ю. Ф. Каргин 2, Е. О. Голубева 1, Н. В. Белоусова 1, В. М. Денисов 1
1 Институт цветных металлов и материаловедения Сибирского федерального университета
660041 Красноярск, пр. Свободный, 79, Россия
2 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119991 Москва, Ленинский пр., 49, Россия
* E-mail: antluba@mail.ru
Поступила в редакцию 21.05.2018
Аннотация
Cоединения со структурой апатита состава Pb10 –xLax(GeO4)2 +x(VO4)4 –x (x = 0, 1, 3) получены методом твердофазного синтеза многоступенчатым обжигом на воздухе в интервале температур 773–1073 K с использованием в качестве исходных компонентов соответствующих оксидов. Методом дифференциальной сканирующей калориметрии измерена теплоемкость синтезированных поликристаллических образцов. По экспериментальным значениям зависимостей Cp = f(T) рассчитаны термодинамические свойства ванадатогерманатов свинца-лантана: изменения энтальпии, энтропии и приведенной энергии Гиббса.
ВВЕДЕНИЕ
Устойчивый интерес исследователей к соединениям со структурой апатита M10(AO4)6X2 и, в частности, ванадатогерманатам свинца [1–8] связан с широким спектром областей их применения. Они используются в качестве лазерных и флуоресцентных материалов [9], в медицине (биосовместимые материалы), энергетике (ионные проводники), нефтепереработке (катализаторы), охране окружающей среды (сорбенты) [10]. Соединения со структурой апатита M10(AO4)6X2 характеризуются возможностью частичного гетеровалентного катионного и анионного замещения с возникновением вакансий и сохранением принадлежности к пр. гр. P63/m, что играет важную роль в создании новых материалов и позволяет расширить диапазон их практического применения [6, 7, 11]. Путем частичного замещения в структуре апатита ионов двухвалентных металлов на ионы редкоземельных элементов получены люминесцентные и лазерные материалы [6]. Так, например, замена свинца в соединении Pb5(GeO4)(VO4)2 [1–5] на лантаноиды позволяет получить соединения с общей формулой Pb10 –xLnx(GeO4)2 +x(VO4)4 –x (x = 0–3) [7]. Для соединений такого типа имеются данные о структуре Pb5(GeO4)(VO4)2 [1, 4, 7, 12], Pb8La2(GeO4)4(VO4)2 [6, 7] и оптическим свойствам Pb5(GeO4)(VO4)2 [2, 3]. В то же время сведения о теплофизических свойствах Pb10 – xLnx(GeO4)2 +x(VO4)4 –x практически отсутствуют (кроме данных для Pb8La2(GeO4)4(VO4)2 [13]). Данные по термодинамическим свойствам относятся к другим соединениям со структурой апатита [14, 15].
Целью настоящей работы является исследование высокотемпературной теплоемкости апатитов Pb10 –xLax(GeO4)2 +x(VO4)4 –x (x = 0, 1, 3) и определение их термодинамических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Фазы Pb10 –xLax(GeO4)2 +x(VO4)4 –x (x = 0, 1, 3) получали твердофазным синтезом. Для этого стехиометрические смеси из предварительно прокаленных оксидов (PbO, La2O3, V2O5 – “ос. ч.”, GeO2 – 99.999%) перетирали в агатовой ступке и прессовали в таблетки. Их последовательно обжигали на воздухе при 773, 873 и 973 K (по 10 ч) и при 1073 K (100 ч). Для достижения полноты твердофазного взаимодействия реагентов после каждого температурного шага образцы измельчали и снова прессовали.
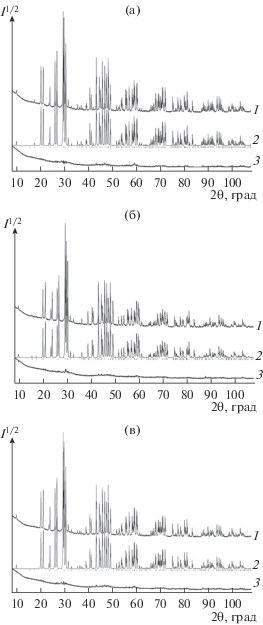
Контроль фазового состава полученных образцов осуществляли с использованием рентгенофазового анализа (дифрактометр X’Pert Pro MPD PANalytical, Нидерланды; CuKα-излучение). Регистрацию дифрактограмм выполняли высокоскоростным детектором PIXcel в угловом интервале 2θ = 8°–108°. Рентгенограммы синтезированных однофазных поликристаллических образцов Pb10 –xLax(GeO4)2 +x(VO4)4 –x (x = 0, 1, 3) приведены на рис. 1. Параметры элементарных ячеек полученных фаз определены путем полнопрофильного уточнения методом минимизации производной разности [16].
Рис. 1.
Экспериментальный (1), расчетный (2) и разностный (3) профили рентгенограмм образцов Pb10 –xLax(GeO4)2 +x(VO4)4 –xx = 0 (а), 1 (б), 3 (в) (штрихи указывают расчетные положения рефлексов).
Теплоемкость образцов со структурой типа апатита Pb10 – xLax(GeO4)2 + x(VO4)4 – x измеряли методом дифференциальной сканирующей калориметрии при помощи термоанализатора STA 449 C Jupiter (NETZSCH, Германия) в платиновых тиглях с крышкой. Погрешность измерений теплоемкости не превышала 2%. Методика измерений Cp описана ранее [17]. Экспериментальные результаты обрабатывали с помощью пакета анализа NETZSCH Proteus Thermal Analysis и лицензионного программного инструмента Systat Sigma Plot 12 (Systat Software Inc., США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Параметры решеток синтезированных апатитов в сравнении с данными других авторов приведены в табл. 1. Наблюдается их удовлетворительное согласие между собой.
Таблица 1.
Параметры элементарной ячейки Pb10 – xLax(GeO4)2 + x(VO4)4 – x
| a, Å | c, Å | V, Å3 | Источник |
|---|---|---|---|
| Pb10(GeO4)2(VO4)4 | |||
| 10.089 | 7.393 | [1] | |
| 10.099(3) | 7.400(2) | [4] | |
| 10.099(3) | 7.4000(20) | [7] | |
| 10.097 | 7.396(2) | [12] | |
| 10.0876(2) | 7.3927(1) | 651.49(2) | Настоящая работа |
| Pb9La(GeO4)3(VO4)3 | |||
| 10.0937(2) | 7.3850(2) | 651.60 | Настоящая работа |
| Pb8La2(GeO4)4(VO4)2 | |||
| 10.0957(3) | 7.3808(3) | 652.1(2) | [6] |
| 10.1080(13) | 7.3692(8) | [17] | |
| 10.1046(1) | 7.3764(1) | 652.25(1) | [13] |
| Pb7La3(GeO4)5(VO4) | |||
| 10.1116(3) | 7.3700(3) | 652.59(4) | Настоящая работа |
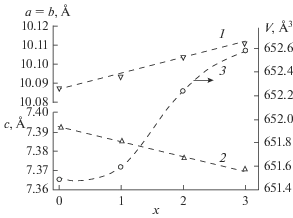
На рис. 2 показано влияние состава апатитов Pb10 –xLax(GeO4)2 +x(VO4)4 –x (х = 0, 1, 2, 3) на параметры их элементарной ячейки. Видно, что параметры a и V с ростом содержания лантана увеличиваются, тогда как значения c при этом уменьшаются. Для параметров a и c полученные данные по влиянию замещения свинца на лантан могут быть описаны линейными уравнениями
с коэффициентами корреляции 0.9942 и 0.9985 соответственно. В то же время объем элементарной ячейки исследованных апатитов в зависимости от состава меняется сложным образом. Связано это, по-видимому, с тем, что a и b увеличиваются с ростом содержания в них лантана, а c – уменьшается.Рис. 2.
Влияние состава апатитов Pb10 –xLax(GeO4)2 +x-(VO4)4 ‒x на параметры их элементарной ячейки: a = b (1), c (2), V (3).
Следует отметить следующее: согласно [6], при замещении свинца лантаном в соединении состава Pb8La2(GeO4)4(VO4)2 атомы РЗЭ располагаются в основном в позиции Pb(1), несмотря на то что эффективный заряд La3+ больше, чем эффективный заряд Pb2+. Подобное наблюдалось для Sr10 – xEux(VO4)6(OH)2 – xOx при замещении стронция европием (Eu3+ преимущественно занимает позиции Sr(1)) [18]. В то же время известно, что в гидроксиапатите кальция в случае большого эффективного заряда у замещающего иона он преимущественно замещает меньшую по размерам позицию Ca(2) [19].
По данным [6], среднее расстояние Pb(1)–O(1, 2, 3) близко к среднему расстоянию Pb(2)–O(1, 2, 3) для соединения Pb8La2(GeO4)4(VO4)2. Высказано предположение, что это связано с тем, что атомы La преимущественно размещаются в позиции Pb(1). Однако для апатита Pb8Pr2(GeO4)4(VO4)2 среднее расстояние Pb(1)–O(1, 2, 3) превышает среднее расстояние Pb(2)–O(1, 2, 3) [20].
На рис. 3 показана температурная зависимость теплоемкости апатитов Pb10 – xLax(GeO4)2 + x(VO4)4 – x (при x = 0 (1), 1 (2), 2 (3), 3 (4)). Чтобы не учитывать различие молярных масс, на графиках приведены значения удельной теплоемкости. Видно, что с ростом температуры теплоемкость исследованных апатитов закономерно увеличивается, а на зависимостях $c_{p}^{^\circ }$ = f(T) экстремумов не наблюдается. Это, по-видимому, свидетельствует об отсутствии полиморфных превращений у анализируемых апатитов в области 350–1000 K. Полученные данные для молярной теплоемкости могут быть описаны уравнением Майера–Келли:
при x = 0
(3)
$\begin{gathered} {{C}_{p}} = \left( {861.86 \pm 1.62} \right) + \left( {136.4 \pm 1.7} \right) \times {{10}^{{--3}}}T-- \\ - \,\,\left( {24.29 \pm 1.74} \right) \times {{10}^{5}}{{Т }^{--}}^{2}, \\ \end{gathered} $(4)
$\begin{gathered} {{C}_{p}} = \left( {900.91 \pm 1.81} \right) + \left( {110.0 \pm 1.9} \right) \times {{10}^{{--3}}}Т \quad-- \\ - \,\,\left( {48.62 \pm 1.99} \right) \times {{10}^{5}}{{Т }^{--}}^{2}, \\ \end{gathered} $(5)
$\begin{gathered} {{C}_{p}} = \left( {874.20 \pm 2.03} \right) + \left( {197.2 \pm 2.2} \right) \times {{10}^{{ - 3}}}Т -- \\ - \,\,\left( {27.90 \pm 2.10} \right) \times {{10}^{5}}{{Т }^{--}}^{2}. \\ \end{gathered} $Рис. 3.
Влияние температуры на удельную теплоемкость Pb10 –xLax(GeO4)2 +x(VO4)4 –x с x = 0 (1), 1 (2), 2 (3), 3 (4).
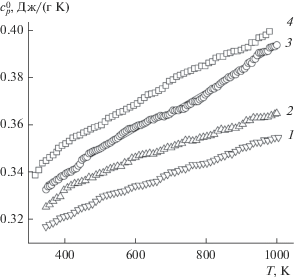
Теплоемкость апатита при x = 2 исследована нами ранее [13]. Эти результаты для сравнения также приведены на рис. 3. Коэффициенты корреляции для уравнений (3)–(5) равны соответственно 0.9989, 0.9986 и 0.9989.
Установлено, что при 298 K значения $c_{p}^{^\circ }$ закономерно увеличиваются для исследованных апатитов по мере роста содержания в них лантана от 0.31 до 0.34 Дж/(г К).
С использованием экспериментальных значений молярной теплоемкости по известным термодинамическим соотношениям рассчитаны основные термодинамические функции апатитов: изменения энтальпии, энтропии и приведенной энергии Гиббса. Эти результаты приведены в табл. 2.
Таблица 2.
Термодинамические свойства апатитов Pb10 –xLax(GeO4)2 +x(VO4)4 –x (пр. гр. P63/m)
| T, K | Cp, Дж/(моль К) |
H°(T)–H°(350 K), кДж/моль |
S°(T)–So(350 K), Дж/(моль К) |
Фо(Т)–Фо(350 К), Дж/(моль К) |
|---|---|---|---|---|
| Pb10(GeO4)2(VO4)4 | ||||
| 350 | 889.8 | – | – | – |
| 400 | 901.2 | 44.78 | 119.6 | 7.72 |
| 450 | 911.3 | 90.10 | 226.3 | 26.10 |
| 500 | 920.3 | 135.9 | 322.8 | 51.02 |
| 550 | 928.9 | 182.1 | 410.9 | 79.79 |
| 600 | 937.0 | 228.8 | 492.1 | 110.8 |
| 650 | 944.8 | 275.8 | 567.4 | 143.1 |
| 700 | 952.4 | 323.2 | 637.7 | 175.9 |
| 750 | 959.8 | 371.1 | 703.7 | 208.9 |
| 800 | 967.2 | 419.2 | 765.8 | 241.8 |
| 850 | 974.4 | 467.8 | 824.7 | 274.4 |
| 900 | 981.6 | 516.7 | 880.6 | 306.5 |
| 950 | 988.8 | 565.9 | 933.9 | 338.2 |
| 1000 | 995.8 | 615.5 | 984.8 | 369.2 |
| Pb9La(GeO4)3(VO4)3 | ||||
| 350 | 899.7 | – | – | – |
| 400 | 914.5 | 45.37 | 121.1 | 7.72 |
| 450 | 926.4 | 91.40 | 229.6 | 26.45 |
| 500 | 936.5 | 138.0 | 327.7 | 51.75 |
| 550 | 945.3 | 185.0 | 417.4 | 80.97 |
| 600 | 953.4 | 232.5 | 500.0 | 112.5 |
| 650 | 960.9 | 280.4 | 576.6 | 145.3 |
| 700 | 968.0 | 328.6 | 648.1 | 178.7 |
| 750 | 974.8 | 377.2 | 715.1 | 212.2 |
| 800 | 981.3 | 426.1 | 778.2 | 245.6 |
| 850 | 987.7 | 475.3 | 837.9 | 278.7 |
| 900 | 993.9 | 524.8 | 894.5 | 311.4 |
| 950 | 1000 | 574.7 | 948.4 | 343.5 |
| 1000 | 1006 | 624.8 | 999.9 | 375.1 |
| Pb7La3(GeO4)5(VO4) | ||||
| 350 | 920.5 | – | – | – |
| 400 | 935.7 | 46.41 | 123.9 | 7.90 |
| 450 | 949.2 | 93.54 | 234.9 | 27.06 |
| 500 | 961.7 | 141.3 | 335.6 | 52.96 |
| 550 | 973.4 | 189.7 | 427.8 | 82.90 |
| 600 | 984.8 | 238.6 | 512.9 | 115.2 |
| 650 | 995.8 | 288.2 | 592.2 | 148.9 |
| 700 | 1006 | 338.2 | 666.4 | 183.2 |
| 750 | 1017 | 388.8 | 737.2 | 217.8 |
| 800 | 1027 | 439.9 | 802.2 | 252.3 |
| 850 | 1037 | 491.6 | 864.8 | 286.5 |
| 900 | 1048 | 543.7 | 924.5 | 320.3 |
| 950 | 1058 | 596.4 | 981.4 | 353.6 |
| 1000 | 1068 | 649.6 | 1035 | 386.4 |
ЗАКЛЮЧЕНИЕ
С использованием исходных оксидов PbO, La2O3, GeO2 и V2O5 твердофазным синтезом при 773–1073 K получены поликристаллические образцы со структурой апатита ${\text{P}}{{{\text{b}}}_{{10 - x}}}$Lax(GeO4)2 +x(VO4)4 –x (x = 0, 1, 3). В интервале температур 350–1000 K методом дифференциальной сканирующей калориметрии измерена их теплоемкость. Установлено, что зависимости Cp = f(T) в исследованном интервале температур могут быть описаны уравнением Майера–Келли. По экспериментальным значениям Cp = f(T) рассчитаны основные термодинамические функции ванадатогерманатов свинца-лантана: изменения энтальпии, энтропии и приведенной энергии Гиббса.
БЛАГОДАРНОСТЬ
Работа выполнена при финансовой поддержке работ, выполняемых в рамках Государственного задания Министерства образования и науки Российской Федерации Сибирскому федеральному университету на 2017–2019 годы (проект 4.8083.2017/8.9 Формирование банка данных термодинамических характеристик сложнооксидных полифункциональных материалов, содержащих редкие и рассеянные элементы).
Список литературы
Yano T., Nabeta Y., Watanabe A. A New Crystal Pb5(GeO4)(VO4)2 for Acousto-Optic Device Applications // Appl. Phys. Lett. 1971. V. 18. № 12. P. 570–571.
Anachkova E., Gospodinov M., Svestarov P. et al. Raman Study of Pb5(GeO4)(VO4)2 crystals // J. Mol. Struct. 1990. V. 219. P. 31–36.
Anachkova E., Gospodinov M., Nikolov A. et al. Fundamental Vibration in Pb5(GeO4)(VO4)2 Crystals // Phys. Status. Solidi (A). 1990. V. 161. P. 575–581.
Иванов А. Уточнение кристаллической структуры Pb5(GeO4)(VO4)2 по профилю порошковых рентгенограмм // Журн. структур. химии. 1990. Т. 31. № 4. С. 80–84.
Gospodinov M., Petrova D., Sveshtarov P. et al. Optical Absorption Properties of Pb5(GeO4)(VO4)2 Single Crystals // Mater. Res. Bull. 1996. V. 31. № 8. P. 1001–1005.
Гетьман Е.И., Яблочкова Н.В., Лобода С.Н. и др. Уточнение кристаллической структуры соединения состава Pb8La2(GeO4)2(VO4)2 // Вестн. Дон. нац. ун-та. Сер. А. Естеств. науки. 2013. № 1. С. 129–131.
Журавлев В.Д., Великодный Ю.А. Ванадатогерманаты свинца-лантана и стронция-лантана со структурой апатита и оксоапатита // Журн. неорган. химии. 2009. Т. 54. № 10. С. 1626–1627.
Kovács L., Péter Á., Gospodinov M. et al. Hydroxyl Ions in Acousto-Optic Pb5(GeO4)(VO4)2 and Bi2(MoO4)3 Single Crystals // Phys. Status. Solidi (C). 2005. V. 2. № 1. P. 689–692.
Каназава Т. Неорганические фосфатные материалы. Киев: Наук. думка, 1998. 298 с.
Добрыднев С.В., Молодцова М.Ю. Получение кальций-фосфатных материалов со структурой апатита // Изв. ТулГУ. Естеств. науки. 2014. В. 1. Ч. 2. С. 212–215.
Игнатов А.В., Савинкова Т.М., Дидоренко Е.Г. и др. Изоморфные замещения в системе Pb(8 – x)Gdx-Na2(VO4)6O(x/2) // Вестн. Дон. нац. ун-та. Сер. А. Естеств. науки. 2014. № 1. С. 152–156.
Иванов С.А., Заводник В.Е. Особенности кристаллической структуры Pb5GeV2O12 // Кристаллография. 1989. Т. 34. № 4. С. 824–828.
Денисова Л.Т., Каргин Ю.Ф., Белоусова Н.В. и др. Синтез и исследование высокотемпературной теплоемкости Pb8La2(GeO4)4(VO4)2 со структурой апатита // Неорган. материалы. 2018. Т. 54. № 2. С. 178–181.
Богач В.В., Добрыднев С.В., Бесков В.С. Расчет термодинамических свойств апатитов // Журн. неорган. химии. 2001. Т. 46. № 7. С. 1127–1131.
Каржавин В.К. Термодинамические величины химических элементов и соединений. Апатиты: Изд-во Кольск. науч. центра РАН, 2011. 160 с.
Solovyov L.A. Full-Profile Refinement by Derivative Difference Minimization // J. Appl. Crystallogr. 2004. V. 37. P. 743–749.
Денисов В.М., Денисова Л.Т., Иртюго Л.А. и др. Теплофизические свойства монокристаллов Bi4Ge3O12 // Физика твердого тела. 2010. Т. 52. № 7. С. 1274–1277.
Get’man E.I., Yablochkova N.V., Loboda S.N. et al. Isomorphous Substitution of Europium for Strontium in the Structure of Synthetic Hidroxovanadate // J. Solid State Chem. 2008. V. 181. P. 2386–2392.
Урусов В.С., Худоложкин В.О. Энергетический анализ упорядочения катионов в структуре апатита // Геохимия. 1974. № 10. С. 1509–1512.
Яблочкова Н.В. Синтез и уточнение кристаллической структуры Pb8Pr2(GeO4)4(VO4)2 // Журн. неорган. химии. 2013. Т. 58. № 7. С. 871–874.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


