Неорганические материалы, 2019, T. 55, № 9, стр. 989-993
Полиэдр граната в изобарно-изотермическом тетраэдре Y2O3–Bi2O3–Fe2O3–Ga2O3
Г. Д. Нипан 1, *, М. Н. Смирнова 1, Г. Е. Никифирова 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Россия, Ленинский пр., 31, Москва
* E-mail: nipan@igic.ras.ru
Поступила в редакцию 28.01.2019
После доработки 04.03.2019
Принята к публикации 22.04.2019
Аннотация
На основании данных рентгенофазового анализа построен полиэдр граната (Y,Bi)3(Fe,Ga)5O12 (18-вершинный 11-гранник) в изобарно-изотермическом концентрационном тетраэдре Y2O3–Bi2O3–Fe2O3–Ga2O3. Установлены 9 кристаллических фаз, с которыми гранат участвует в многофазных равновесиях. Особое внимание уделено равновесиям граната и перовскита.
ВВЕДЕНИЕ
Идея двойного замещения в иттриевом феррит–гранате Y3Fe5O12 связана с созданием монокристаллических пленок, содержащих магнитооптически активный катион Bi3+, который обладает большим радиусом. Для компенсации разрушающего действия большого катиона на гранатовую структуру и сохранения однофазности пленки одновременно с Bi3+ вводится Ga3+ – катион с малым радиусом [1]. Несмотря на то что существующие физические и химические методы позволяют получать метастабильные гранатовые пленки с различными соотношениями Y : Bi : Fe : Ga [2], возникает проблема их температурной, барической и временной стабильности и, в конечном итоге, возможности их использования в магнитооптических устройствах.
Систематические исследования стабильных поликристаллов (Y,Bi)3(Fe,Ga)5O12 со структурой граната в рамках сечения Y3Fe5O12–Y3Ga5O12–Bi3Ga5O12–Bi3Fe5O12 (диаграмма Йенеке) показывают, что предельное содержание Bi по отношению ко всем катионам ~18.75% достигается, если соотношение Fe : Ga находится в интервале 0.43–1.0 [3, 4]. При анализе образцов из гексагона Ga2O3–(Y,Bi)3(Fe,Ga)5O12–Fe2O3 определена область гомогенности граната в системе Y2O3–Ga2O3–Fe2O3 и на секущей плоскости 6.25 мол. % Bi2O3 [5]. В равновесии с гранатом, в отсутствие расплава, находятся девять кристаллических фаз на основе Y2O3, Ga2O3, Fe2O3, YxBi1 – xO3 [6], Ga2 – xFexO3 [7], Bi25(Fe,Ga)O40, Bi2(Fe,Ga)4O9 [8], орторомбического YFeO3 [9] и ромбоэдрического BiFeO3 [10–13], которые определяют пограничные составы граната, и, соответственно, оказывают влияние на его свойства.
В настоящей работе исследованы равновесия гранат–перовскит в системе YFeO3–BiFeO3 и построен фазовый объем граната в концентрационном тетраэдре Y2O3–Bi2O3–Fe2O3–Ga2O3 при давлении кислорода 21 кПа и температуре 760°C. Выбор такого режима термической обработки обусловлен значительным увеличением летучести Bi2O3 при плавлении [14].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза образцов использовался метод сжигания геля – эффективный способ получения сложных металл-оксидов [15]. Исходные водные растворы нитратов иттрия, висмута, железа и галлия для синтеза порошкообразных замещенных гранатов готовили растворением стехиометрических количеств 3-водного карбоната иттрия (“х. ч.”), оксида висмута (“ч.”), карбонильного железа (“ос. ч.”), металлического галлия (“х. ч.”) в разбавленной (1 : 3) азотной кислоте. К полученному раствору добавляли PVA в расчете 0.12/n моля (CH2CHOH)n на 0.01 моля феррита, а также нитрат аммония (NH4NO3 квалификации “ч. д. а.”) в количестве 0.12 моля на 0.01 моля феррита.
Реакционные смеси упаривали в открытой фарфоровой чаше (80–100°С) при постоянном перемешивании до состояния гелей. При дальнейшем увеличении температуры происходило плавное беспламенное горение геля в самоподдерживающемся режиме (“тление”) с образованием порошкообразных ксерогелей. Такой характер горения обусловлен оптимальным соотношением PVA и NH4NO3 и безопасен при его использовании в лабораторных условиях.
После охлаждения ксерогели перетирались с помощью шаровой мельницы и отжигались при температуре 760°С (6 ч) в муфельной лабораторной печи.
Рентгенофазовый анализ полученных порошков выполняли на дифрактометре Bruker Advance D8 (излучение CuKα) в интервале углов 2θ = 10°–70° с шагом сканирования 0.0133°. Обработка результатов проводилась с помощью программного пакета для анализа рентгеновских данных DIFFRAC.EVA. Средний диаметр кристаллитов рассчитывался с использованием формулы Селякова–Шеррера и составил ~25–30 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
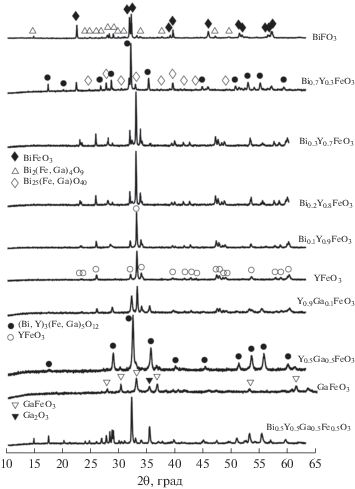
Изменение фазовых составов системы Y2O3–Bi2O3–Fe2O3–Ga2O3 при сохранении номинального перовскитного состава MFeO3 представлено с помощью дифрактограмм на рис. 1. Беспримесный стехиометрический BiFeO3 с ромбоэдрической структурой сложно получить [10, 12], и в нашем случае образовались примеси муллита Bi2(Fe,Ga)4O9 и силленита Bi25(Fe,Ga)O40. При замещении висмута на иттрий до Bi0.7Y0.3FeO3, наряду с BiFeO3, образуется гранат, увеличивается содержание силленита, а муллит исчезает. Дальнейшее введение иттрия – Bi0.3Y0.7FeO3, Bi0.2Y0.8FeO3 и Bi0.1Y0.9FeO3 – приводит к образованию YFeO3 с орторомбической структурой, содержание граната, сосуществующего с силленитом, значительно снижается, муллит не образуeтся. При незначительном замещении в YFeO3 иттрия на галлий – Y0.9Ga0.1FeO3, кроме орторомбического перовскита, образуется гранат, а для состава Y0.5Ga0.5FeO3 гранат становится основной фазой с небольшим включением GaFeO3. Кристаллизация GaFeO3 при температуре 760°C происходит медленно, и дифрактограмма на рис. 1 приведена для образца, отожженного при 900°C. Образец с перовскитным номинальным составом Bi0.5Y0.5Ga0.5Fe0.5O3 содержит преимущественно гранат.
Приведенный результат в сочетании с результатами, полученными ранее [3–5], позволили построить концентрационный полиэдр граната в тетраэдре составов Y2O3–Bi2O3–Fe2O3–Ga2O3 (рис. 2). Полиэдр представляет собой 18-вершинный 11-гранник (рис. 2), его основание принадлежит треугольнику составов системы Y2O3–Fe2O3–Ga2O3 [16].
Рис. 2.
Полиэдр граната в концентрационном изобарно-изотермическом тетраэдре Y2O3–Bi2O3–Fe2O3–Ga2O3. Условные обозначения: Bi25(Fe,Ga)O40 – S, Bi2(Fe,Ga)4O9 – M, YxBi1 – xO3 – YB, GaxFe1 – xO3 – GF, Ga2O3 – G, Fe2O3 – F, YFeO3 – P и BiFeO3 – B.
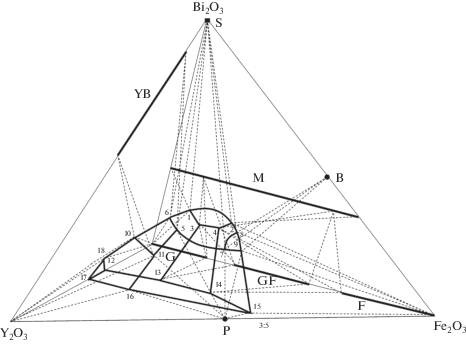
Одиннадцать вершин (1–11) (рис. 2) отвечают составам граната (Y,Bi)3(Fe,Ga)5O12 в четырехфазных равновесиях (табл. 1), а еще семь вершин (12–18) являются результатом пересечения полиэдра с гранями Y2O3–Fe2O3–Ga2O3 и Y2O3–Bi2O3–Ga2O3. Из 27 ребер трехфазные равновесия представляют 19 (табл. 1), 8 ребер – результат пересечения полиэдра с гранями тетраэдра. Гранат участвует в девяти двухфазных равновесиях (табл. 1), чему соответствуют 9 граней, а еще 2 грани – результат пересечения полиэдра с тетраэдром. В равновесиях с гранатом (Gr) участвует оксид иттрия Y2O3 (Y) и твердые растворы на основе: силленита Bi25(Fe,Ga)O40 (S), муллита Bi2(Fe,Ga)4O9 (M), висмутата иттрия YxBi1 – xO3 (YB), феррита галлия GaxFe1 –xO3 (GF), оксида галлия Ga2O3 (G), оксида железа Fe2O3 (F), феррита иттрия YFeO3 (P) и феррита висмута BiFeO3 (B). Два последних феррита часто рассматривают в рамках единого твердого раствора Y1 – xBixFeO3 с перовскитоподобной структурой, который претерпевает полиморфные превращения (тетрагональный, орторомбический, ромбоэдрический) [17].
Таблица 1.
Фазовые равновесия с участием граната (Gr) (рис. 2)
| Вершина | Четырехфазное равновесие |
| 1 | Gr – S – M – G |
| 2 | Gr – S – M – F |
| 3 | Gr – M – GF – G |
| 4 | Gr – M – GF – F |
| 5 | Gr – S – YB – P |
| 6 | Gr – S – YB – G |
| 7 | Gr – S – P – B |
| 8 | Gr – S– B – F |
| 9 | Gr – P – B – F |
| 10 | Gr – YB – G – Y |
| 11 | Gr – YB – P – Y |
| Ребро | Трехфазное равновесие |
| 1–2 | Gr – S – M |
| 1–3 | Gr – M – G |
| 1–6 | Gr – S – G |
| 2–4 | Gr – M – F |
| 2–8 | Gr – S – F |
| 3–4 | Gr – M – GF |
| 3–13 | Gr – GF – G |
| 4–14 | Gr – GF – F |
| 5–6 | Gr – S – YB |
| 5–7 | Gr – S – P |
| 5-11 | Gr – YB – P |
| 6-10 | Gr – YB – G |
| 7–9 | Gr – P – B |
| 7–8 | Gr – S – B |
| 8–9 | Gr – P – F |
| 9–15 | Gr – P – F |
| 10-11 | Gr – YB –Y |
| 10–18 | Gr – G – Y |
| 11–16 | Gr – P – Y |
| Грань | Двухфазное равновесие |
| 1–2–8–7–5–6 | Gr – S |
| 7–8–9 | Gr – B |
| 1–2–4–3 | Gr – M |
| 5–6–10–11 | Gr –YB |
| 1–3–13–12–18–10–6 | Gr – G |
| 3–4–14–13 | Gr – GF |
| 2–4–14–15–9–8 | Gr – F |
| 10–11–16–17–18 | Gr – Y |
| 5–7–9–15–16–11 | Gr – P |
Полиэдр гомогенности граната на рис. 2 представляет возможные вариации катионных соотношений Y : Bi : Fe : Ga для температуры 760°C и парциального давления кислорода 21 кПа. Фазовый объем граната, пересекаясь с гранью Y2O3–Bi2O3–Fe2O3, изменяется в зависимости от температуры отжига при твердофазном синтезе, и содержание висмута в феррит–гранатах Y3 – xBixFe5O12 достигает величин: x = 1.0 при 950°C [18], x = = 1.2 при 900°C [19] или ~960°C [20, 21] и x = 1.5 при 775°C [22]. В отсутствие галлия гранаты Y3 – xBixFe5O12 являются метастабильными фазами [23] с неконтролируемым катионным составом из-за летучести оксида висмута при высоких температурах.
ЗАКЛЮЧЕНИЕ
Систематическое исследование фазовых равновесий в системе Y2O3–Bi2O3–Fe2O3–Ga2O3 позволило установить соотношения катионов Y : Bi : : Fe : Ga, при которых висмутсодержащие феррит-гранаты сохраняют стабильность, как, например, поликристаллиты состава Y1.5Bi1.5Fe2.5Ga2.5O12 [24]. Полученный результат может быть использован для получения стабильных магнитооптических пленок с воспроизводимыми функциональными свойствами.
Список литературы
Kumar P., Maydykovskiy A.I., Levy M., Dubrovina N.V., Aktsipetrov O.A. Second Harmonic Generation Study of Internally-Generated Strain in Bismuth-Substituted Iron Garnet Films // Opt. Express. 2010. V. 18. № 2. P. 1076–1084. https://doi.org/10.1364/OE.18.001076
Рандошкин В.В., Червоненкис А.Я. Прикладная магнитооптика. М.: Энергоатомиздат, 1990. С. 320.
Смирнова М.Е., Нипан Г.Д., Никифорова Г.Е. Область твердого раствора (Y1 – xBix)3(Fe1 – yGay)O12 на диаграмме Йенеке // Неорган. материалы. 2018. Т. 54. № 7. С. 721–726. https://doi.org/10.7868/S0002337X18070114
Смирнова М.Е., Нипан Г.Д., Никифорова Г.Е. Твердый раствор со структурой граната (Y1 – xBix)3Fe2.5Ga2.5O12 // ДАН. 2018. Т. 478. № 2. С. 172–174. https://doi.org/10.7868/S0869565218020111
Смирнова М.Е., Нипан Г.Д., Никифорова Г.Е. Концентрационный объем гомогенности граната в системе Ga2O3–(Y,Bi)3(Fe,Ga)5O12–Fe2O3 // ДАН. 2018. Т. 480. № 3. С. 303–307. https://doi.org/10.7868/S0869565218150094
Ekhilikar S., Bichile G.K. Synthesis and Structural Characterization of (Bi2O3)1 – x(Y2O3)x and (Bi2O3)1 – x(Gd2O3)x Solid Solutions// Bull. Mater. Sci. 2004. V. 27. № 1. P. 19–22.
Roulland F., Lefevre C., Thomasson A., Viart N. Study of Ga(2 – x)FexO3 Solid Solution: Optimisation of the Ceramic Processing // J. Eur. Ceram. Soc. 2013. V. 33. № 5. P. 1029–1035. https://doi.org/10.1016/j.jeurceramsoc.2012.11.014
Giaquinta D.M., Papaefthymiou G.C., Davis W.M., Zur Loye H.-C. Synthesis, Structure, and Magnetic Properties of the Layered Bismuth Transition Metal Oxide Solid Solution Bi2Fe4 – xGaxO9 // J. Solid State Chem. 1992. V. 99. № 1. P. 120–133. https://doi.org/10.1016/0022-4596(92)90296-8
Zhang Y., Yang J., Xu J., Gao Q., Hong Z. Controllable Synthesis of Hexagonal and Orthorhombic YFeO3 and Their Visible-Light Photocatalytic Activities // Mater. Lett. 2012. V. 81. P. 1–4. https://doi.org/10.1016/j.matlet.2012.04.080
Denisov V.M., Belousova N.V., Zhereb V.P., Denisova L.T., Skorikov V.M. Oxide Compounds of Bi2O3−Fe2O3 System I. The Obtaining and Phase Equilibriums // J. Siberian Federal University. Chem. 2012. V. 5. № 2. P. 146–167.
Mishra R.K., Pradhan D.K., Choudhary R.N.P., Banerjee A. Effect of Yttrium on Improvement of Dielectric Properties and Magnetic Switching Behavior in BiFeO3 // J. Phys.: Condens. Matter. 2008. V. 20. 045218 (6 p). https://doi.org/10.1088/0953-8984/20/04/045218
Lu J., Qiao L.J., Fu P.Z., Wu Y.C. Phase Equilibrium of Bi2O3–Fe2O3 Pseudo-Binary System and Growth of BiFeO3 Single Crystal // J. Cryst. Growth. 2011. V. 318. № 1. P. 936–941. https://doi.org/10.1016/j.jcrysgro.2010.10.181
Meera A.V., Ganesan R., Gnanakeran T. Partial phase diagram of Bi–Fe–O system and the standard molar Gibbs energy of formation of Bi2Fe4O9 // J. Alloys Compd. 2017. V. 692. P. 841–847. https://doi.org/10.1016/j.jallcom.2016.09.070
Казенас Е.К., Цветков Ю.В. Термодинамика испарения оксидов. М.: Изд-во ЛКИ, 2008. 480 с.
Mukasyan A.S., Epstein P., Dinka P. Solution Combustion Synthesis of Nanomaterials // Proc. Combust. Inst. 2007. V. 31. № 2. P. 1789–1795.
Zhuang N., Chen W., Shi L., Nie J., Hu X., Zhao B., Lin S., Chen J. A New Technique to Grow Incongruent Melting Ga:YIG Crystals: the Edge-Defined Film-Fed Growth Method // Appl. Crystallogr. 2013. V. 46. № 2. P. 746–751. https://doi.org/10.1107/S002188981301025X
Lee H., Yoon Y., Yoo H., Choi S.A., Kim K., Choi Y., Melikyan H., Ishibashi T., Friedman B., Lee K. Magnetic and FTIR Studies of BixY3 – xFe5O12 (x = 0, 1, 2) Powders Prepared by the Metal Organic Decomposition Method // J. Alloys Compd. 2011. V. 509. P. 9434–9440. https://doi.org/10.1016/j.jallcom.2011.07.005
Pigošová J., Cigáň A., Maňka J. Thermal Synthesis of Bismuth-Doped Yttrium Iron Garnet for Magneto-Optical Imaging // Measur. Sci. Rev. 2008. V. 8. Sec. 3. № 5. P. 126–128. https://doi.org/10.2478/v10048-008-0030-y
Zhao H., Zhou J., Bai Y., Gui Z., Li L. Effect of Bi-Substitution on the Dielectric Properties of Polycrystalline Yttrium Iron Garnet // J. Magn. Magn. Mater. 2004. V. 280. P. 208–213. https://doi.org/10.1016/j.jmmm.2004.03.014
Jia N., Huaiwu Z., Li J., Liao Y., Jin L., Liu C., Harris V.C. Polycrystalline Bi Substituted YIG Ferrite Processed via Low Temperature Sintering // J. Alloys. Compd. 2017. V. 695. P. 931–936. https://doi.org/10.1016/j.jallcom.2016.10.201
Li H., Guo Y. Synthesis and Characterization of YIG Nanoparticles by Low Temperature Sintering // J. Mater. Sci.: Mater. Electron. 2018. V. 29. № 11. P. 9369–9374. https://doi.org/10.1007/s10854-018-8968-5
Amighian J., Hasanpour A., Mozaffari M. The Effect of Bi Mole Ratio on Phase Formation in BixY3 – xFe5O12 Nanoparticles // Phys. Status Solidi C. 2004. V. 1. № 7. P. 1769–1771. https://doi.org/10.1002/pssc.200304396
Rehspringer J.-L., Bursik J., Niznansky D., Klarikova A. Characterisation of Bismuth-Doped Yttrium Iron Garnet Layers Prepared by Sol-Gel Process // J. Magn. Magn. Mater. 2000. V. 211. P. 291–295. https://doi.org/10.1016/S0304-8853(99)00749-0
Smirnova M.N., Nikiforova G.E., Goeva L.V., Simonenko N.P. One-Stage Synthesis of (Y0.5Bi0.5)3(Fe0.5Ga0.5)5O12 Garnet Using the Organometallic Gel Auto-Combustion Approach // Ceram. Int. 2019. V. 45. P. 4509–4513.https://doi.org/10.1016/j.ceramint.2018.11.133
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы