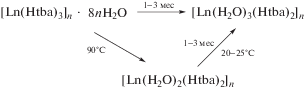Журнал неорганической химии, 2020, T. 65, № 7, стр. 915-921
Гидраты 2-тиобарбитуратов лантаноидов(III): синтез, структура и термическое разложение
Н. Н. Головнев a, *, М. С. Молокеев a, b, c, М. К. Лесников a, А. С. Самойло a
a Сибирский федеральный университет
660041 Красноярск, пр-т Свободный, 79, Россия
b Институт физики им. Л.В. Киренского, ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, 50, стр. 38, Россия
c Дальневосточный государственный университет путей сообщения
680021 Хабаровск, ул. Серышева, 47, Россия
* E-mail: ngolovnev@sfu-kras.ru
Поступила в редакцию 24.12.2019
После доработки 17.02.2020
Принята к публикации 27.02.2020
Аннотация
Кристаллизацией из водных растворов получены гидраты состава Ln(Htba)3 ∙ 3H2O (Ln = Yb (I), Er (II), Ho (III); Н2tba = 2-тиобарбитуровая кислота), Ln(Htba)3 ∙ 2H2O и Ln(Htba)3 ∙ 8H2O. По данным монокристального рентгеноструктурного анализа, моноклинные кристаллы изоструктурных соединений I–III имеют строение [Ln2(H2O)6(μ2-Htba-О,O')4(Htba-О)2]n. Образование изоструктурных соединений Ln(Htba) ∙ 2H2O (Ln = La, Ce, Eu, Yb, Lu), Ln(Htba)3 ∙ 8H2O (Ln = Eu, Tb, Ho, Yb) и Y(Htba)3 ∙ nH2O (n = 2, 8) подтверждено сравнением соответствующих порошковых рентгенограмм, а состав установлен методами элементного и термического анализа. Изучена устойчивость кристаллических гидратов при нагревании в воздушной атмосфере и в контакте с их насыщенными растворами.
ВВЕДЕНИЕ
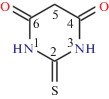
Тиобарбитуровая кислота (H2tba) как полифункциональный N,N',O,O',S-донорный лиганд с расходящимися центрами связывания (рис. 1) образует с ионами металлов координационные полимеры различного строения [1, 2]. Заслуживают внимания нейтральные однородные комплексы (НОК), содержащие только лиганды одного сорта и молекулы воды, так как в них нет противоионов, которые часто заполняют потенциально полезные каналы или полости в кристаллической решетке. С учетом различных способов координации ионов Htba‒ и молекул H2O (табл. S1 ) [3] при кристаллизации НОК из водной среды можно получить несколько соединений, содержащих разное число координированных молекул воды. Так, нами получены гидраты НОК тиобарбитуровой, барбитуровой (H2ba) и 1,3-диэтил-2-тиобарбитуровой (HDetba) кислот с ионами s-, p- и d-металлов (табл. S1 ) [2, 3]. Представляет интерес изучить структурное и гидратное разнообразие соединений этого класса для практически значимых редкоземельных элементов (РЗЭ) [4–7]. Сведения о синтезе, строении и свойствах тиобарбитуратных комплексов РЗЭ, которые могут обладать люминесцентными свойствами и служить прекурсорами для получения оксисульфатов [8] и оксидов [9], ограничены пятью изоструктурными соединениями состава Ln(Htba)3 ∙ 3H2O [9]. В настоящей работе получены гидраты состава Ln(Htba)3 ∙ 3H2O, Ln(Htba)3 ∙ 2H2O, Ln(Htba)3 ∙ 8H2O и Y(Htba)3 ∙ nH2O (n = 2, 8). Они исследованы методами порошковой рентгенографии и термического анализа. Структуры Ln(Htba)3 ∙ 3H2O (Ln = = Yb (I), Er (II), Ho (III)) определены методом РСА. Следует отметить, что для каждого НОК охарактеризовано только по одной кристаллической структуре [10].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В синтезах использовали LuCl3 · 6H2O, YbCl3 · 6H2O, Er2O3, Ho2O3, YCl3 · 6H2O, Eu(CH3COO)3 · 4H2O, TbCl3 ∙ 6H2O, GdCl3 ∙ 6H2O, CeCl3 · 7H2O, La(NO3)3 · 6H2O, H2tba, HCl и NaOH (все марки “х. ч.”) без дополнительной очистки. Оксиды Er2O3 и Ho2O3 растворяли в концентрированной HCl, затем осторожно выпаривали досуха до хлоридных солей.
Синтез Ln(Htba)3 ∙ 3H2O (Ln = Yb (I), Er (II), Ho (III)). Гидраты солей лантанидов (0.11 ммоль) растворяли в 10 мл воды и добавляли 0.05 г (0.35 ммоль) твердой H2tba, затем смесь нейтрализовали 1 М раствором NaOH до рН 4. Образовавшиеся мелкокристаллические осадки, состоящие, по данным РФА, преимущественно из соответствующих октагидратов, растворяли при нагревании в большом избытке дистиллированной воды (200–300 мл) и оставляли испаряться в течение нескольких недель при комнатной температуре до образования пригодных для РСА кристаллов. Выход соединений I–III увеличивался по мере испарения воды и при объеме воды 100–150 мл составлял 20–30%. Результаты элементного анализа соединений I–III представлены в табл. 1.
Таблица 1.
Результаты элементного анализа синтезированных соединений
| Сокращенная формула | Брутто-формула | Содержание элементов найдено/вычислено, мас. % | |||
|---|---|---|---|---|---|
| С | H | N | S | ||
| Yb(Htba)3 ∙ 3H2O | C12H15N6O9S3Yb | 22.42/21.95 | 2.17/2.30 | 13.04/12.80 | 14.90/14.65 |
| Er(Htba)3 ∙ 3H2O | C12H15ErN6O9S3 | 22.29/22.15 | 2.12/2.32 | 13.20/12.91 | 15.01/14.78 |
| Ho(Htba)3 ∙ 3H2O | C12H15HoN6O9S3 | 22.48/22.23 | 2.20/2.33 | 13.35/12.96 | 15.12/14.84 |
| La(Htba)3 ∙ 2H2O | C12H13LaN6O8S3 | 23.53/23.85 | 1.90/2.17 | 13.78/13.90 | 15.43/15.92 |
| Ce(Htba)3 ∙ 2H2O | C12H13CeN6O8S3 | 24.01/23.80 | 2.06/2.16 | 14.16/13.88 | 16.11/15.89 |
| Eu(Htba)3 ∙ 2H2O | C12H13EuN6O8S3 | 22.94/23.34 | 2.30/2.12 | 13.39/13.61 | 15.42/15.58 |
| Yb(Htba)3 ∙ 2H2O | C12H13N6O8S3Yb | 23.06/22.57 | 1.87/2.05 | 13.45/13.16 | 15.44/15.07 |
| Lu(Htba)3 ∙ 2H2O | C12H13LuN6O8S3 | 22.22/22.51 | 2.01/2.05 | 12.76/13.12 | 14.63/15.02 |
| Y(Htba)3 ∙ 2H2O | C12H13N6O8S3Y | 25.84/26.00 | 2.17/2.36 | 15.56/15.16 | 17.67/17.35 |
| Eu(Htba)3 ∙ 8H2O | C12H25EuN6O14S3 | 20.15/19.87 | 3.30/3.47 | 11.69/11.58 | 13.56/13.26 |
| Tb(Htba)3 ∙ 8H2O | C12H25N6O14S3Tb | 19.97/19.68 | 3.56/3.44 | 11.32/11.47 | 13.10/13.13 |
| Ho(Htba)3 ∙ 8H2O | C12H25HoN6O14S3 | 19.32/19.52 | 3.63/3.41 | 11.16/11.38 | 12.74/13.03 |
| Yb(Htba)3 ∙ 8H2O | C12H25N6O14S3Yb | 19.66/19.31 | 3.21/3.38 | 11.67/11.26 | 13.28/12.89 |
| Y(Htba)3 ∙ 8H2O | C12H25N6O14S3Y | 22.33/21.76 | 3.57/3.80 | 12.89/12.67 | 14.76/14.52 |
Основным фактором, влияющим на состав синтезированных изоструктурных гидратов M(Htba)3 ∙ 2H2O и M(Htba)3 ∙ 8H2O (M = Ln, Y), является температура. Как правило, при взаимодействии соли РЗЭ c нейтрализованным NaOH раствором H2tba (рН 4–5) при комнатной температуре образуются бесцветные октагидраты M(Htba)3 ∙ 8H2O, а при 90°С – бледно-желтые дигидраты M(Htba)3 ∙ 2H2O. В общем виде методики их получения представлены ниже.
Синтез M(Htba)3 ∙ 2H2O (M = La, Ce, Eu, Yb, Lu, Y). К 0.20 г (1.4 ммоль) H2tba в 5 мл воды добавляли 0.056 г (1.4 ммоль) NaOH, затем смесь выдерживали при 90°С в течение 5 мин до полного растворения тиобарбитуровой кислоты. К горячему желто-оранжевому раствору при перемешивании добавляли 1 мл водного раствора, содержащего 0.46 ммоль соли M(III). Образовавшийся вначале белый объемный осадок (M(Htba)3 ∙ 8H2O) становился более компактным и окрашивался в желтый цвет. Его отфильтровывали, промывали 2 мл ацетона и сушили на воздухе до постоянной массы. Выход соединений составил 40–50%. Результаты их элементного анализа согласуются с предложенным составом (табл. 1).
Синтез M(Htba)3 ∙ 8H2O (M = Eu, Tb, Ho, Yb, Y). Методики синтеза этих изоструктурных соединений отличались от предыдущей тем, что синтез проводили при комнатной температуре и для более быстрого растворения 2-тиобарбитуровой кислоты использовали небольшой избыток NaOH (1.6 ммоль). Выход соединений составил 50–60%. Их состав подтвержден данными химического анализа (табл. 1).
РСА. Исследованы желтые кристаллы I (Ln = Yb) размером 0.3 × 0.3 × 0.2 мм, II (Ln = Er) размером 0.35 × 0.35 × 0.3 мм и III (Ln = Ho) размером 0.3 × × 0.2 × 0.2 мм при 296 K. Интенсивности отражений измерены на монокристальном дифрактометре SMART APEX II c CCD-детектором (Bruker AXS, MoKα-излучение). Экспериментальные поправки на поглощение введены с помощью программы SADABS [11] методом мультисканирования. Модель структуры установлена прямыми методами и уточнена с помощью комплекса программ SHELXTL [12]. Из разностных синтезов электронной плотности определены положения атомов водорода, которые затем были идеализированы и уточнены в связанной с основными атомами форме. В табл. 2 приведены параметры экспериментов и результаты уточнения структур. Структуры I–III депонированы в Кембриджском банке структурных данных (№ 1 971 780–1 971 782; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Таблица 2.
Параметры эксперимента и результаты уточнения структур I–III
| Параметр | Значение | ||
|---|---|---|---|
| Кристалл | I | II | III |
| Брутто-формула | C24H30N12O18S6Yb2 | C24H30Er2N12O18S6 | C24H30Ho2N12O18S6 |
| M | 1313.04 | 1301.48 | 1296.82 |
| Пр. гр., Z | P2/n, 2 | P2/n, 2 | P2/n, 2 |
| a, Å | 13.9302 (4) | 13.9848 (6) | 13.9917 (9) |
| b, Å | 9.9688 (3) | 10.0106 (4) | 10.0182 (7) |
| c, Å | 15.4215 (5) | 15.4161 (6) | 15.3907 (10) |
| β, град | 109.4421 (7) | 109.541 (1) | 109.6202 (16) |
| V, Å3 | 2019.43 (11) | 2033.89 (14) | 2032.1 (2) |
| ρвыч, г/см3 | 2.159 | 2.125 | 2.119 |
| μ, мм–1 | 5.002 | 4.495 | 4.262 |
| Всего отражений | 29917 | 44856 | 20957 |
| 2θmax, град | 61.938 | 78.088 | 53.004 |
| Независимых отражений N1 (Rint) | 6426 (0.0638) | 11253 (0.0410) | 4205 (0.0989) |
| Число отражений с F > 4σ(F), N2 | 5006 | 9307 | 2964 |
| Диапазон индексов h, k, l | –20 ≤ h ≤ 20, –14 ≤ k ≤ 14, –22 ≤ l ≤ 22 |
–24 ≤ h ≤ 24, –17 ≤ k ≤ 17, –26 ≤ l ≤ 26 |
–17 ≤ h ≤ 17, –12 ≤ k ≤ 12, –19 ≤ l ≤ 19 |
| Весовая схема по F 2 | w = 1/[σ2($F_{{\text{o}}}^{2}$) + + (0.0167P)2 + 5.348P] | w = 1/[σ2($F_{{\text{o}}}^{2}$) + (0.0162P)2 + + 2.9638P] | w = 1/[σ2($F_{{\text{o}}}^{2}$) + + (0.0205P)2 + 8.8779P] |
| P = max($F_{{\text{o}}}^{2}$ + 2$F_{{\text{c}}}^{2}$)/3 | |||
| Число уточняемых параметров | 299 | 299 | 299 |
| R (по N1 рефлексам) | 0.0532 | 0.0506 | 0.0732 |
| R (по N2 рефлексам) | 0.0318 | 0.0368 | 0.0394 |
| wR(F 2) (по N1 рефлексам) | 0.0741 | 0.0654 | 0.0903 |
| wR(F 2) (по N2 рефлексам) | 0.0625 | 0.0618 | 0.0732 |
| GOOF | 1.068 | 1.011 | 1.033 |
| Коэффициент экстинкции | Не уточнялся | ||
| (∆/σ)max | <0.001 | <0.001 | <0.001 |
| ∆ρmax/∆ρmin, e/Å3 | 1.580/–2.535 | 1.196/–2.980 | 1.598/–1.308 |
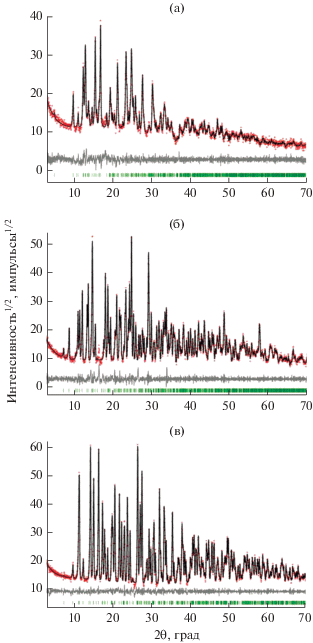
Порошковые рентгенограммы соединений отсняты при комнатной температуре на дифрактометре D8 Advance фирмы Bruker с использованием линейного детектора Vantec и CuKα-излучения. Для подтверждения фазовой чистоты порошков комплексов I–III использовали параметры ячеек из монокристального эксперимента, для подгонки профиля уточнения параметров ячеек – метод Ле Бэйла при помощи программы TOPAS 4.2 [13]. Уточнение шло стабильно и дало хорошие разностные рентгенограммы (рис. 2).
Рис. 2.
Экспериментальные, теоретические и разностные рентгенограммы кристаллов: а – Y(Htba)3 ∙ ∙ 8H2O; б – Ho(Htba)3 ∙ 3H2O; в – Yb(Htba)3 ∙ 2H2O.
Термический анализ соединений проводили на приборе SDT-Q600 (TA Instruments, USA) в токе воздуха (50 мл/мин) в интервале 22–850°C при скорости нагревания 10 град/мин. Состав газообразных продуктов определяли с помощью совмещенного с термическим анализатором ИК-спектрометра Nicolet380 (Thermo Scientific, USA).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Образование трех групп гидратов состава M(Htba)3 ∙ 8H2O, M(Htba)3 ∙ 3H2O и M(Htba)3 ∙ 2H2O согласуется с результатами химического и термического анализа. Изоструктурность гидратов одного химического состава подтверждается совпадением соответствующих рентгенограмм порошков и вычисленных кристаллографических параметров (табл. 2–4). Для сравнения на рис. 2 приведены экспериментальные рентгенограммы трех гидратов тиобарбитуратов РЗЭ разного состава, которые существенно отличаются друг от друга.
Таблица 3.
Кристаллографические параметры Ln(Htba)3. 8H2O (пр. гр.P1)
| Металл | a, Å | b, Å | c, Å | α, β, γ, град | V, Å3 |
|---|---|---|---|---|---|
| Eu | 7.794(1) | 9.169(1) | 18.448(2) | 97.25(1), 91.72(1), 112.18(1) | 1206.8(2) |
| Tb | 7.789(3) | 9.152(4) | 18.458(7) | 97.14(2), 91.76(2), 112.15(3) | 1205.0(8) |
| Ho | 7.769(1) | 9.128(1) | 18.434(2) | 97.07(1), 91.78(1), 112.21(2) | 1169.9(3) |
| Yb | 7.781(1) | 9.152(1) | 18.458(2) | 97.14(1), 91.76(1), 112.15(2) | 1204.0(2) |
| Y | 7.764(3) | 9.120(4) | 18.411(8) | 97.08(2), 91.69(2), 112.27(3) | 1193.1(9) |
Таблица 4.
Кристаллографические параметры Ln(Htba)3. 2H2O (пр. гр. P212121)
| Металл | a, Å | b, Å | с, Å | V, Å3 |
|---|---|---|---|---|
| La | 6.813(1) | 15.064(1) | 18.326(2) | 1880.9(2) |
| Ce | 6.813(2) | 15.025(2) | 18.253(2) | 1868.9(3) |
| Eu | 6.742(1) | 15.418(2) | 18.125(2) | 1883.9(3) |
| Yb | 6.709(1) | 15.325(2) | 17.884(2) | 1838.8(3) |
| Lu | 6.711(1) | 15.338(1) | 17.882(1) | 1840.7(1) |
| Y | 6.721(1) | 15.378(1) | 17.982(1) | 1858.5(2) |
В первую очередь при комнатной температуре из водного раствора кристаллизуются белые объемные гидраты M(Htba)3 ∙ 8H2O, которые в течение 1–3 мес при комнатной температуре превращаются в M(Htba)3 ∙ 3H2O. При 90°С M(Htba)3 ∙ 8H2O, как правило, переходят в более компактные желтые мелкокристаллические осадки M(Htba)3 ∙ 2H2O. Такие превращения согласуются с эмпирическим правилом, согласно которому при более высокой температуре кристаллизуются соединения, содержащие меньшее число молекул воды. Все наши попытки получить эти комплексы в виде кристаллов, пригодных для монокристального РСА, оказались безуспешными. При контакте кристаллов M(Htba)3 ∙ 2H2O с маточным раствором в течение 1–3 мес при комнатной температуре они частично переходили в более термодинамически устойчивые в водном растворе гидраты M(Htba)3 ∙ 3H2O.
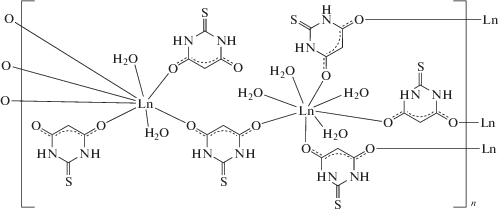
В независимой части ячеек изоструктурных комплексов Ln(Htba)3 ∙ 3H2O (Ln = Yb, Er, Ho) содержатся два иона Ln3+, три иона Htba– и три молекулы воды в общих позициях. Координация ионов Htba– к ионам Ln3+ осуществляется только через атомы O. Один из ионов Ln3+ связан с шестью ионами Htba– (двумя терминальными и четырьмя мостиковыми) и двумя молекулами воды, другой – с четырьмя мостиковыми ионами Htba– и четырьмя молекулами воды (рис. 3). Полиэдры Ln(1)O8 и Ln(2)O8 – квадратные антипризмы, связанные друг с другом мостиковыми ионами Нtba– с формированием бесконечного слоя в плоскости, перпендикулярной направлению a + c (рис. S1 ). С учетом разного координационного окружения двух независимых ионов Ln3+ и наличия в структуре как μ2-мостикового, так и концевого лиганда Htba– строение рассматриваемых комплексов лучше передается формулой [Ln2(H2O)6(Htba-О,O')4(Htba-О)2]n (рис. 3) или просто Ln2(H2O)6(Htba)6. Они изоструктурны ранее охарактеризованным соединениям Eu2(Htba)6(H2O)6 [8], Sm2(Htba)6(H2O)6, Ln2(Htba)6(H2O)6 (Ln = Tb, Gd, Nd) [9]. Длины связей Ln–O (табл. S2 ) в соединениях I–III (2.263(3)–2.406(3) Å) имеют типичные значения [10] и закономерно увеличиваются от соединения I к III. В структуре представлены три независимых иона Htba–, один концевой (C) и два мостиковых (А и B). Их соответствующие геометрические параметры удовлетворительно согласуются с литературными данными [11–19] и практически совпадают для соединений I–III, например, длины связей С–О 1.250(8)–1.274(8) Å, C(4)–C(5) и C(5)–C(6) 1.382(10)–1.402(6) Å, C–S 1.664(4)–1.697(7) Å.
Анализ структуры показал наличие в I–III двенадцати водородных связей (ВС) N–H∙∙∙O, N–H∙∙∙S, O–H∙∙∙O и O–H∙∙∙S (табл. S3 ), в которых участвуют все ионы Htba– и все молекулы воды. ВС образуют трехмерный каркас, в котором можно выделить супрамолекулярные мотивы ${\text{R}}_{2}^{2}\left( 8 \right),$ S(6), ${\text{R}}_{2}^{2}\left( {28} \right)$ и ${\text{R}}_{4}^{4}\left( {26} \right)$ [20], как и в других изоструктурных тиобарбитуратах Ln(III) [8, 9]. π–π-Взаимодействия [21] между ионами Нtba– (табл. S4 ) типа “голова‑к-хвосту” дополнительно стабилизируют структуру соединений.
В начале термического разложения всех синтезированных гидратов происходит их полная дегидратация, что подтверждается результатами ИК-спектроскопического анализа газообразных продуктов. Нам не удалось идентифицировать методом РФА кристаллические фазы, образующиеся при полном обезвоживании синтезированных веществ. Состав промежуточных и конечных продуктов термолиза в работе не изучали. Дегидратация Y(Htba)3 ∙ 8H2O протекает в две стадии: первая начинается при ~80°C, а вторая – при ~100°C (рис. 4а). Они сопровождаются эндотермическими эффектами при 85 и 129°C соответственно. Потеря массы веществом (Δmэксп) при ~200°C близка к теоретически вычисленной (Δmвыч) в предположении полной дегидратации (Δmэксп = = 20.9%, Δmвыч = 21.7%, –8Н2О). При t > 370°C происходит окислительное разложение образца, которому соответствуют два экзотермических эффекта на кривой ДСК при 422 и 598°C. По результатам ИК-спектроскопического анализа газообразных продуктов, ниже 370°C единственным газообразным продуктом является вода, а среди продуктов термолиза в интервале 380–800°C обнаружены СО2, CS2 и NН3.
Рис. 4.
Кривые ТГ и ДСК при окислительной деградации соединений: а – Y(Htba)3 ∙ 8H2O; б – Ho(Htba)3 ∙ · 3H2O, в – Yb(Htba)3 ∙ 2H2O.
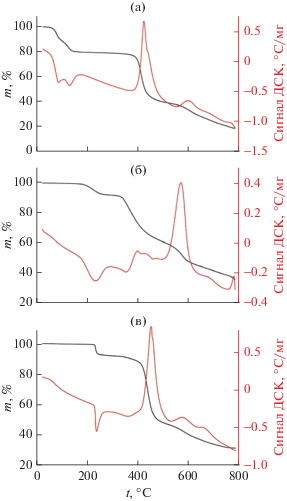
Как следует из рис. 4б, дегидратация Ho(Ht ba)3 ∙ 3H2O (III) начинается при 180°C и заканчивается при 270–280°C. Экспериментальная потеря массы веществ близка к вычисленной в предположении удаления всех молекул Н2О (Δmэксп = 7.97%, Δmвыч = 8.33%, –3Н2О). Дегидратация сопровождается эндотермическим эффектом при 234°С. При t > 320°C происходит окислительное разложение образца, которому на кривой ДСК соответствует экзотермический эффект при 570°C. Ниже 320°C единственным газообразным продуктом является вода, а среди продуктов термолиза в интервале 380–800°C обнаружены CS2, NН3, SO2 и СО2.
Дегидратация Yb(Htba)3 ∙ 2H2O начинается при 230°С и практически заканчивается при 300°С (рис. 4в). Ей соответствует эндотермический эффект при 237°С. Потеря массы при 250°С больше теоретически вычисленной в предположении полной дегидратации соединения (Δmэксп = 6.48%, Δmвыч = 5.64%, –2Н2О). Наблюдаемое различие связано, по-видимому, с гигроскопичностью вещества. При t > 370°C происходит окисление органического лиганда, которому на кривой ДСК соответствует сильный экзотермический эффект при 451°C. При t < 370°C единственным газообразным продуктом является вода, а среди продуктов термолиза в интервале 380–800°C обнаружены CS2, NН3, SO2 и СО2.
Удаление всех молекул воды из соединения Y(Htba)3 ∙ 8H2O уже при t < 150°C позволяет их отнести к кристаллизационным. В отличие от них, молекулы воды в Ho(Htba)3 ∙ 3H2O и Yb(Htba)3 ∙ 2H2O, скорее всего, являются координированными, так как их дегидратация начинается при более высоких температурах по сравнению с Y(Htba)3 ∙ 8H2O. Как “жесткие” кислоты ионы Ln3+ не склонны образовывать связи с лигандами через атом серы, что косвенно подтверждает кристаллизация их немногочисленных комплексов с S-координированными лигандами только из неполярных растворителей [4]. Поэтому при рассмотрении возможной структуры гидратов Ln(Htba)3 ∙ 2H2O и Ln(Htba)3 ∙ 8H2O можно принимать во внимание только связи Ln–OHtba и Ln–Ow. Поскольку обычно КЧ(Ln(III)) ≥ 8, а ионы Нtba– не образуют O,O′-координированные хелаты [1, 2, 10], Yb(Htba)3 ∙ 2H2O и изоструктурные ему гидраты являются координационными полимерами. Учитывая сравнительно низкую температуру полной дегидратации, характерную для некоординированных молекул воды, можно также предположить полимерное строение Y(Htba)3 ∙ 8H2O и изоструктурных ему комплексов. Тогда с учетом ранее отмеченной наибольшей термодинамической устойчивости в растворе кристаллов M(Htba)3 ∙ 3H2O взаимные превращения полимерных гидратов Ln(III) в их насыщенных водных растворах можно представить схемой:
ЗАКЛЮЧЕНИЕ
Кристаллизацией из водного раствора в различных условиях получены три типа гидратов тиобарбитуратных комплексов РЗЭ M(Htba)3 ∙ ∙ nH2O (n = 2, 3, 8), различающихся кристаллическим строением и термической устойчивостью в процессах дегидратации. Окислительное разложение координированных лигандов Htba– начинается при более высокой температуре, чем свободной H2tba, которая плавится с разложением уже при ~250°C [22].
Как уже отмечалось, гидраты различного состава и строения получены ранее для нейтральных однородных комплексов, образованных H2tba и HDetba с s-, p- и d-металлами (табл. S1 ) [3]. Существование нескольких гидратов наряду с возможностью образования полифункциональными лигандами связевых изомеров делает богатой координационную химию комплексов металлов c барбитуровыми кислотами [2]. Выделение дигидратов, тригидратов и октагидратов 2-тиобарбитуратов РЗЭ является примером проявления структурного и гидратного разнообразия соединений этого класса.
Список литературы
Mahmudov K.T., Kopylovich M.N., Maharramov A.M. et al. // Coord. Chem. Rev. 2014. V. 265. P. 1. https://doi.org/10.1016/j.ccr.2014.01.002
Головнев Н.Н., Молокеев М.С. 2-Тиобарбитуровая кислота и ее комплексы с металлами: синтез, структура и свойства. Красноярск: Сиб. федер. ун-т, 2014. 252 с.
Головнев Н.Н., Молокеев М.С., Лесников М.К. // Журн. Сибирского федерального университета. Химия. 2017. № 10. С. 401. https://doi.org/10.17516/1998-2836-0036
Cotton S. Lanthanide and Actinide Chemistry. UK, Uppingham, Rutland: Wiley, 2006. 263 p.
Heffern M.C., Matosziuk L.M., Meade T.J. // Chem. Rev. 2014. V. 114. P. 4496. https://doi.org/10.1021/cr400477t
Yang Y., Zhao Q., Feng W., Li F. // Chem. Rev. 2013. V. 113. P. 192. https://doi.org/10.1021/cr2004103
Binnemans K. // Chem. Rev. 2009. V. 109. P. 4283. https://doi.org/10.1021/cr8003983
Головнев Н.Н., Молокеев М.С. // Коорд. химия. 2014. Т. 40. № 9. С. 564. [Golovnev N.N., Molokeev M.S. // Russ. J. Coord. Chem. 2014. V. 40. № 9. P. 648.] https://doi.org/10.1134/S1070328414090036
Головнев Н.Н., Молокеев М.С., Стерхова И.В. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 965. https://doi.org/10.1134/S0044457X19090137
Cambridge Structural Database, Version 5.37. Cambridge, UK: Univ. of Cambridge, 2015.
Sheldrick G.M. SADABS. Version 2.01. Madison (WI, USA): Bruker AXS Inc., 2004.
Sheldrick G.M. SHELXTL. Version 6.10. Madison (WI, USA): Bruker AXS Inc., 2004.
Bruker AXS TOPAS V4: General Profile and Structure Analysis Software for Powder Diffraction Data. User’s Manual, Bruker AXS, Karlsruhe, 2008.
Balas V.I., Verginadis I.I., Geromichalos G.D. et al. // Eur. J. Med. Chem. 2011. V. 46. № 7. P. 2835. https://doi.org/10.5517/ccv3tc3
Kubicki M., Owczarzak A., Balas V.I., Hadjikakou S.K. // J. Coord. Chem. 2012. V. 65. P. 1107. https://doi.org/10.1080/00958972.2012.660148
Gong Y., Hao Z., Li J. et al. // Dalton Trans. 2013. V. 42. P. 6489. https://doi.org/10.1039/C3DT32380C
Hützler W.M., Egert E., Bolte M. // Acta Crystallogr. C. 2016. V. 72. P. 705. https://doi.org/10.1107/S205322961601336X
Gomathi S., Nirmalram J.S., Muthiah P.T. // Acta Crystallogr. B. 2015. V. 71. P. 144. https://doi.org/10.1107/S2052520615001729
Wang C., Zhou M-S., Yang L.-J. et al. // Jiegou Huaxue. 2017. V. 36. P. 1210. https://doi.org/10.14102/j.cnki.0254-5861.2011-1494
Стид Дж.В., Этвуд Дж.Л. Супрамолекулярная химия. М.: Академкнига, 2007. 480 с.
PLATON – A Multipurpose Crystallographic Tool. Utrecht University, Utrecht, The Netherlands. 2008.
Roux M.V., Notario R., Segura M., Chickos J.S. // J. Chem. Eng. Data. 2011. V. 57. P. 249. https://doi.org/10.1021/je200420u
Дополнительные материалы
- скачать ESM.docx
- Дополнительные материалы
Инструменты
Журнал неорганической химии