Журнал неорганической химии, 2023, T. 68, № 5, стр. 638-650
Термодинамические характеристики пивалатов щелочных металлов (CH3)3CCOOM (M = Li, Na, K, Rb, Cs)
И. П. Малкерова a, Е. В. Белова b, Д. Б. Каюмова a, А. С. Алиханян a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: alikhan@igic.ras.ru
Поступила в редакцию 19.12.2022
После доработки 15.02.2023
Принята к публикации 15.02.2023
- EDN: SNMBME
- DOI: 10.31857/S0044457X22602255
Аннотация
Методами масс-спектрометрии, термогравиметрии и дифференциальной сканирующей калориметрии исследованы термодинамические свойства пивалатов щелочных металлов (СН3)3ССOOM, где M = Li, Na, K, Rb, Cs. Установлен конгруэнтный характер сублимации соединений. Насыщенный пар содержит олигомерные формы MnPivn (n = 1–6) с преобладанием димерных и тетрамерных молекул в случае пивалатов Na и K, в случае пивалатов Rb и Cs доминируют мономерные и димерные молекулы. Рассчитано парциальное давление основных компонентов газовой фазы, их зависимость от температуры и стандартные энтальпии сублимации. Определены значения энтальпий диссоциации димерных и тетрамерных молекул. Оценены стандартные энтальпии образования MPiv(тв) и MPiv(г).
ВВЕДЕНИE
Легколетучие комплексные соединения металлов с органическими лигандами, например β-дикетонаты и карбоксилаты [1, 2], – перспективные прекурсоры, используемые в CVD-технологиях для получения функциональных материалов высокой чистоты и однородных металлических, оксидных, карбидных покрытий. К их числу относятся и соли триметилуксусной (пивалиновой) кислоты HPiv. Комплексы щелочных металлов играют важную роль в биологических системах [3], а также могут использоваться при синтезе тонких пленок ниобатов, танталатов, манганатов щелочных элементов, проявляющих электрооптические, пьезоэлектрические, акустические и магнитные свойства [4–6]. В частности, материалы на основе соединений (K,Na)TaO3 представляют интерес для современной электроники в качестве ферроэлектриков и пьезокерамических материалов [7, 8]. Возможность применения новых прекурсоров в методах парофазного осаждения требует знания термодинамических характеристик процессов парообразования. До этой работы достаточно подробно были исследованы термодинамические характеристики пивалата лития [9], что касается пивалатов других щелочных металлов, то в литературе есть несколько публикаций [10–16], в которых приведены термодинамические характеристики процессов парообразования этих соединений. Однако, с нашей точки зрения, данные, представленные в указанных работах, не полные, например, в них отсутствует описание термодинамических характеристик тетрамерных молекул насыщенного пара и недостаточно подробно исследован процесс парообразования пивалата калия [17]. В связи с этим целью настоящей работы было изучение летучести, состава газовой фазы, температурного интервала термической стабильности, определение термодинамических характеристик пивалатов натрия, калия, рубидия, цезия в газовой и конденсированной фазах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Комплексы пивалатов щелочных металлов синтезировали по описанной ранее методике [9] путем взаимодействия карбонатов, растворенных в дистиллированной воде, со стехиометрическим количеством кристаллической триметилуксусной (пивалиновой) кислоты (99% AcrosOrganic) при 80°С до ее полного растворения и прекращения выделения газа. Медленное упаривание раствора приводило к образованию осадка, который сушили на воздухе до постоянной массы. Отметим, что в работе [18] при получении пивалата лития получаемое соединение имело полимерное строение, а исследование таких соединений затруднено из-за их разложения [19]. В результате проведенного синтеза получали препараты пивалатов натрия, калия, рубидия и цезия в виде белого порошка с выходом 75–90% от теоретического. Состав конечных продуктов подтвержден данными элементного анализа (CHN-анализатор Евровектор 300, ЦКП ИОНХ РАН) и соответствует брутто-формулам KPiv · · Н2О, NaPiv ⋅ 0.3H2O, RbPiv · H2O, CsPiv · H2O.
| C, мас. % | H, мас. % | |
| Найдено KPiv: | 37.97 | 7.33 |
| Вычислено KPiv · Н2О: | 37.95 | 6.96 |
| Найдено NaPiv: | 47.17 | 7.46 |
| Вычислено NaPiv ⋅ 0.3H2О: | 46.37 | 7.42 |
| Найдено RbPiv: | 29.19 | 5.69 |
| Вычислено RbPiv · H2O: | 29.34 | 5.38 |
| Найдено CsPiv: | 23.69 | 4.70 |
| Вычислено CsPiv · H2O: | 23.82 | 4.37 |
Термогравиметрия. Термогравиметрические исследования выполняли на термовесах TG 209 F1 Libra производства фирмы Netzsch со скоростью нагрева 10 град/мин в динамической атмосфере азота (поток газа 30 мл/мин) при защитном потоке инертного газа 10 мл/мин в алундовых тиглях без крышки. Максимальные температуры (Tmax) в программах изначально подбирали исходя из температуры начала разложения, полученной из кривой ТГ, корректируя их по мере регистрации пика плавления на термограмме.
Дифференциальная сканирующая калориметрия. ДСК-исследования проводили на дифференциальном сканирующем калориметре DSC 204 F1 Phoenix производства фирмы Netzsch. Калибровку по температуре и чувствительности выполняли при атмосферном давлении в температурном диапазоне от 100 до 500°C по параметрам фазовых переходов высокочистых стандартов Hg, In, Sn, Zn, Bi, Pb, CsCl (Netszch) и C6H5COOH (99.99%), скорости нагрева 2, 5 и 10 град/мин согласно стандартам ASTM E967-08 (2014) и ASTM E968-02 (2014) соответственно. Калибровку прибора и все измерения осуществляли в динамической атмосфере азота (поток газа 40 мл/мин) при защитном потоке инертного газа 70 мл/мин в алюминиевых тиглях с проколотой крышкой.
После пробоподготовки первое измерение выполняли в интервале температур от комнатной до Tmax при скорости нагрева 10 град/мин. Для проверки воспроизводимости эффектов печь прибора охлаждали в ручном режиме газообразным азотом до температуры на 20–30°С ниже температуры начала первого эффекта, не связанного с потерей массы, после чего регистрировали кривую ДСК два раза при скоростях сканирования 5 и 2 град/мин. Для снижения времени измерения при выходе сигнала на базовую линию после первого обратимого эффекта скорость нагрева повышали до 15 град/мин вплоть до температуры, которая была на 10–20°С ниже температуры второго воспроизводимого эффекта. После достижения этой температуры скорость нагрева составляла 2 град/мин.
Масс-спектральные исследования. Изучение процессов парообразования комплексов выполняли на приборе МС 1301 эффузионным методом Кнудсена с масс-спектральным анализом состава газовой фазы в интервале температур 513–584 K (NaPiv), 500–585 K (KPiv, RbPiv) и 500–575 K (CsPiv). Подробное описание методики и аппаратуры приведено в [20]. В работе использовали молибденовые эффузионные ячейки Кнудсена с отношением площади испарения к площади эффузии ~600. Температуру измеряли Pt/Pt–Rh-термопарой и поддерживали постоянной с точностью ±1°C. Температурный интервал исследования выбирали с учетом температур плавления соединений, полученных в этой работе методами ТГ и ДСК.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты ТГ- и ДСК-исследований подробно представлены в приложении. Из полученных данных можно сделать вывод, что разложение всех синтезированных соединений протекает в две стадии: после первоначальной дегидратации следует разложение самих пивалатов. Полученные результаты по температурам и энтальпиям (кДж/моль) фазовых переходов суммированы в табл. 1.
Пивалат лития. Это соединение на первом этапе в диапазоне температур 50–150°С теряет 5.4 мас. %, что соответствует его первоначальному составу LiPiv · 0.35H2O, далее при 320°С происходит разложение бессольватного пивалата лития до оксида лития с потерей массы 80.3 мас. %. На кривой ДСК присутствуют три эндотермических эффекта. Первый эффект, с плечом, в диапазоне 50–150°С связан с дегидратацией и соответствует первой ступени на кривой ТГ. Следующие два эффекта с началом при 152.2 и 230°С связаны, предположительно, с обратимыми фазовыми переходами, возможно, с твердотельным фазовым переходом и плавлением чистого вещества. Для проверки этой гипотезы было проведено термоциклирование. Начало первого пика и его площадь составили 151.8°С и 8.9 Дж/г11 при нагреве со скоростью 2 град/мин, 152.0°С и 8.0 Дж/г при нагреве со скоростью 5 град/мин, 152.2°С и 9.5 Дж/г при нагреве со скоростью 10 град/мин. Поскольку температура начала эффекта и его площадь хорошо воспроизводятся, можно предположить, что наблюдается обратимый фазовый переход. Начало второго пика и его площадь составили 229.1°С и 40.8 Дж/г при нагреве со скоростью 2 град/мин, 230.4°С и 42.4 Дж/г при нагреве со скоростью 5 град/мин и 230.0°С и 43.1 Дж/г при нагреве со скоростью 10 град/мин. Поскольку площадь эффекта хорошо воспроизводится и нет потери массы, можно утверждать, что происходит плавление без разложения.
Пивалат натрия. Первоначальная потеря массы этого комплекса за счет дегидратации в диапазоне температур 30–100°С составила 4.3%, что соответствует составу NaPiv · 0.3H2O. Далее на кривой ТГ вплоть до 375°С не наблюдается заметной потери массы бессольватным пивалатом натрия. Выше 375°С начинается разложение. На кривой ДСК, полученной при нагреве образца до Tmax = = 375°C со скоростью 10 град/мин, отчетливо фиксируются два эндоэффекта: первый связан с удалением сольватной воды до 100°С, второй – с фазовым переходом, который воспроизводится при термоциклировании. По всей видимости, это плавление, а не твердофазный переход, поскольку выше этого явления начинается плавное снижение массы навески и ее разложение. Теплота фиксированного фазового превращения хорошо воспроизводится и составляет в первом случае 75.4 Дж/г, во втором – 75.2 Дж/г. При скорости нагрева 10 град/мин температура начала пика равна 355.4°С, а при скорости нагрева 2 град/мин – 355.8°С.
Пивалат калия. Потеря массы (11.08%) образцом KPiv · H2O в диапазоне температур 30–130°С обусловлена удалением сольватной воды. Далее бессольватное соединение устойчиво вплоть до 350°С. Съемку кривых ДСК проводили от 180 до 350°С после удаления сольватных молекул со скоростью 10 и 2 град/мин. На кривых ДСК наблюдается целая серия эндоэффектов, плохо и лучше разрешенных при скорости 10 и 2 град/мин соответственно. Первые два эффекта достаточно низкоэнергетичные и хорошо воспроизводятся (начало первого эффекта при 323.3 и 322.5°С при нагреве со скоростью 2 и 10 град/мин соответственно; начало второго эффекта при 327.2°С при скорости 2 град/мин). Поглощается 2.7 и 1.2 Дж/г при нагреве со скоростью 2 град/мин и 4.6 Дж/г при нагреве со скоростью 10 град/мин. Вторые два эффекта не разрешаются и при нагреве со скоростью 2 град/мин; начало 340.1 и 339.1°С при первом (10 град/мин) и втором нагреве (2 град/мин) соответственно. Общая площадь эффектов 74 и 76 Дж/г при первом (10 град/мин) и втором нагреве (2 град/мин) соответственно. Можно предположить, что эти два эффекта относятся к единовременному плавлению и частичному разложению.
Пивалат рубидия. Потеря массы пивалатом рубидия RbPiv · H2O в диапазоне температур 30–130°С составила 8.22%, что соответствует отщеплению воды. При первом нагреве со скоростью 10 град/мин на кривой ДСК в интервале 50–170°С присутствуют два эндоэффекта, связанные, по-видимому, с плавлением кристаллогидрата и испарением воды. При повторном нагреве до 330°С со скоростью 10 град/мин эти эффекты не наблюдались. На кривой ДСК вплоть до температуры разложения был зафиксирован один эффект, который воспроизводился при третьем нагреве со скоростью 2 град/мин. При скорости сканирования 10 град/мин температура фазового перехода составляла 319°С, теплота – 56.9 Дж/г; эти величины воспроизводились и при нагреве со скоростью 2 град/мин – температура составила 319.3°С, теплота – 56.4 Дж/г. Фазовый переход, скорее всего, следует отнести к плавлению.
Пивалат цезия. При исследовании пивалата цезия потеря массы за счет дегидратации в диапазоне температур 50–200°С составила 7.6 мас. %, при 380°С происходило разложение бессольватного пивалата цезия (потерю массы не регистрировали до конца процесса). На кривой ДСК наблюдается неразрешимый эндотермический эффект, связанный с десольватацией в образце. Регистрация сегмента 300–370°С при 10 град/мин была проведена отдельно. Следующие два эффекта с началом при 327.5 и 346.6°С связаны, предположительно, с обратимыми фазовыми переходами (фазовым переходом и плавлением чистого вещества или эвтектическим плавлением и плавлением основного компонента). Для проверки этой гипотезы было проведено термоциклирование. Начало первого пика и его площадь составили 327.3°С и 30.0 Дж/г при нагреве со скоростью 2 град/мин, 327.3°С и 31.5 Дж/г при нагреве со скоростью 5 град/мин, 327.5°С и 28.7 Дж/г при нагреве со скоростью 10 град/мин. Поскольку температура начала эффекта и его площадь хорошо воспроизводятся, можно утверждать, что действительно наблюдается обратимый фазовый переход (фазовый переход чистого вещества или же эвтектическое плавление). Начало второго пика и его площадь составили 345.2°С и 39.5 Дж/г при нагреве со скоростью 2 град/мин, 344.7°С и 39.9 Дж/г при нагреве со скоростью 5 град/мин, 346.6°С и 39.4 Дж/г при нагреве со скоростью 10 град/мин. Поскольку площадь эффекта хорошо воспроизводится и нет потери массы, можно утверждать, что происходит плавление без разложения.
Масс-спектры газовой фазы над пивалатами щелочных металлов приведены в табл. 2. Как видно из этой таблицы, все масс-спектры содержат олигомерные ионы, что свидетельствует о существенной олигомеризации насыщенного пара, которая заметно уменьшается с увеличением ионного радиуса щелочного металла. Ионизация олигомерных молекул насыщенного пара сопровождается процессами диссоциации с отщеплением частиц в виде кислотного остатка Piv или М2Piv. Полученные в этой работе результаты по масс-спектрам насыщенного пара пивалатов щелочных металлов удовлетворительно согласуются с данными работ [10, 14, 16], но существенно отличаются от результатов исследования [11]. Расхождения легко объясняются тем, что использованная в работе [11] аппаратура не предназначена для термодинамических исследований и полученные с ее помощью масс-спектры (масс-спектрометр Finnigan 1015) соответствуют ненасыщенному пару и поэтому содержат чрезвычайно малое количество олигомерных ионов.
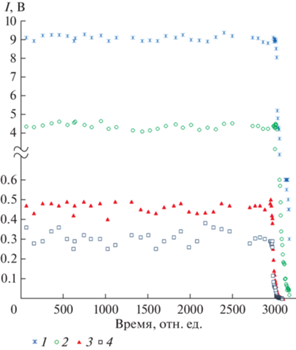
Для определения молекулярного состава газовой фазы и характера сублимации были проведены эксперименты по полному изотермическому испарению известных навесок исследованных веществ. Во всех опытах вид изотерм носил принципиально одинаковый характер: постоянство интенсивностей ионных токов (величин, пропорциональных парциальным давлениям) на протяжении всего времени испарения вплоть до полного “выгорания” навесок и отсутствие нелетучего остатка в эффузионных ячейках по окончании экспериментов. Рис. 1 иллюстрирует вид изотермы полного испарения одного из комплексов – пивалата калия KPiv. Анализ экспериментальных данных позволил сделать вывод о конгруэнтном протекании процессов сублимации пивалатов щелочных металлов в изученном температурном интервале по реакции:
(1)
$n({\text{MPiv}})\left( {{\text{тв}}} \right) = {{({\text{MPiv}})}_{n}}\left( {\text{г}} \right),\,\,\,n = 1--9,$Рис. 1.
Изотерма полного испарения пивалата калия (Т = 585 K): 1 – [K]+/KPiv; 2 – [K2Piv]+/(KPiv)2; 3 – [K3Piv2]+/(KPiv)4; 4 – [K4Piv3]+/(KPiv)4.
Эти же эксперименты позволили выполнить расшифровку масс-спектров, необходимую для расчета абсолютных величин парциальных давлений компонентов насыщенного пара. Расшифровка масс-спектров была выполнена методом, основанным на независимости констант равновесия газофазных реакций типа (1) от давления при постоянной температуре [21] и предположении, что суммарные измеряемые ионные токи образованы при диссоциативной ионизации мономерных, димерных, тримерных и тетрамерных молекул:
(2)
$\begin{gathered} {{I}_{{{{{\text{M}}}^{ + }}}}} = {{I}_{{{{{\text{M}}}^{ + }}{\text{(MPiv)}}}}}_{{}} + {{I}_{{{{{\text{M}}}^{ + }}{\text{(}}{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}_{{\text{2}}}}{\text{)}}}}} + \\ + \,\,{{I}_{{{{{\text{M}}}^{ + }}{\text{(}}{{{\text{M}}}_{{\text{3}}}}{\text{Pi}}{{{\text{v}}}_{{\text{3}}}}{\text{)}}}}} + {{I}_{{{{{\text{M}}}^{ + }}{\text{(}}{{{\text{M}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}}{\text{)}}}}}{\text{,}} \\ \end{gathered} $(3)
$\begin{gathered} {{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}} = {{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}{\text{(}}{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}_{{\text{2}}}}{\text{)}}}}} + \\ + \,\,{{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}{\text{(}}{{{\text{M}}}_{{\text{3}}}}{\text{Pi}}{{{\text{v}}}_{{\text{3}}}}{\text{)}}}}} + {{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}{\text{(}}{{{\text{M}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}}{\text{)}}}}}{\text{,}} \\ \end{gathered} $(4)
${{I}_{{{{{\text{M}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }}}} = {{I}_{{{{{\text{M}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }{\text{(}}{{{\text{M}}}_{{\text{3}}}}{\text{Pi}}{{{\text{v}}}_{{\text{3}}}}{\text{)}}}}} + {{I}_{{{{{\text{M}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }{\text{(}}{{{\text{M}}}_{4}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}}{\text{)}}}}}{\text{,}}$(5)
${{I}_{{{{{\text{M}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }}}} = {{I}_{{{{{\text{M}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }{\text{(}}{{{\text{M}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}}{\text{)}}}}}{\text{.}}$В расчетах использовали экспериментальные данные по полной изотермической сублимации пивалатов металлов в период “выгорания” навесок, когда происходит изменение состава газовой фазы [21, 22]. Ниже в качестве примера приведена расшифровка ионного тока ${{I}_{{{{{\text{K}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }}}},$ обязанного своим происхождением диссоциативной ионизации тримерных и тетрамерных молекул. Выражение (4) можно представить в виде уравнения:
(6)
${{{{I}_{{{{{\text{K}}}_{{\text{3}}}}{\text{Piv}}_{{\text{2}}}^{ + }}}}} \mathord{\left/ {\vphantom {{{{I}_{{{{{\text{K}}}_{{\text{3}}}}{\text{Piv}}_{{\text{2}}}^{ + }}}}} {{{I}_{{{{{\text{K}}}_{{\text{4}}}}{\text{Piv}}_{{\text{3}}}^{ + }}}}}}} \right. \kern-0em} {{{I}_{{{{{\text{K}}}_{{\text{4}}}}{\text{Piv}}_{{\text{3}}}^{ + }}}}}} = \,\,{{^{{\text{4}}}\surd {{k}_{{\left( {\text{7}} \right)}}}} \mathord{\left/ {\vphantom {{^{{\text{4}}}\surd {{k}_{{\left( {\text{7}} \right)}}}} {^{{\text{4}}}\surd {{I}_{{{{{\text{K}}}_{{\text{4}}}}{\text{Piv}}_{{\text{3}}}^{ + }}}}}}} \right. \kern-0em} {^{{\text{4}}}\surd {{I}_{{{{{\text{K}}}_{{\text{4}}}}{\text{Piv}}_{{\text{3}}}^{ + }}}}}} + {{a}_{{34}}}{\text{,}}$(7)
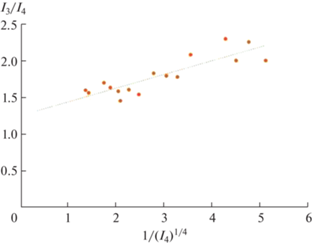
${\text{3}}{{{\text{M}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}} = {\text{4}}{{{\text{M}}}_{{\text{3}}}}{\text{Pi}}{{{\text{v}}}_{{\text{3}}}}$Методом наименьших квадратов было решено уравнение (6) и найден коэффициент масс-спектра a34, показывающий, какая часть измеряемого ионного тока ${{I}_{{{{{\text{M}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }}}}$ образована при диссоциативной ионизации молекул K4Piv4, т.е. выполнена расшифровка линии (4) – ${{I}_{{{{{\text{M}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }}}}.$ На рис. 2 в качестве примера приведена графическая зависимость уравнения (6), позволяющая найти коэффициент а34 линии (ионного тока) ${{I}_{{{{{\text{K}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }}}}.$ Аналогичным образом была выполнена расшифровка ионного тока ${{I}_{{{\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }}}}.$
Рис. 2.
График функции $\frac{{{{I}_{{{{{\text{K}}}_{{\text{3}}}}{\text{Pi}}{{{\text{v}}}_{{\text{2}}}}}}}}}{{{{I}_{{{{{\text{K}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{3}}}}}}}}} = ~f\left( {\sqrt[4]{{\left( {\frac{{{{{\text{K}}}_{{\left( {\text{7}} \right)}}}}}{{{{I}_{{{{{\text{K}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{3}}}}}}}}}} \right)}} + {{a}_{{34}}}} \right).$
Рассчитанные таким образом значения коэффициентов а34 приведены в табл. 3. Анализ масс-спектров и значения коэффициентов а34 показали, что содержание в насыщенном паре тримерных молекул мало, поэтому можно принять, что линии ${{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}$ обязаны своим происхождением главным образом диссоциативной ионизации только двух молекул:
(8)
${{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}} = {{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}{\text{(}}{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}_{{\text{2}}}}{\text{)}}}}} + {{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}{\text{(}}{{{\text{M}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}}{\text{)}}}}}.$Как и в случае расшифровки линии (4), выражение (8) может быть представлено в виде уравнения:
(9)
${{{{I}_{{{{{\text{М}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}} \mathord{\left/ {\vphantom {{{{I}_{{{{{\text{М}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}} {{{I}_{{{{{\text{М}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }}}}}}} \right. \kern-0em} {{{I}_{{{{{\text{М}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }}}}}}{\text{ = }}\,\,{{^{{\text{2}}}\surd {{k}_{{{\text{(10)}}}}}} \mathord{\left/ {\vphantom {{^{{\text{2}}}\surd {{k}_{{{\text{(10)}}}}}} {^{{\text{2}}}\surd {{I}_{{{{{\text{М}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }}}}}}} \right. \kern-0em} {^{{\text{2}}}\surd {{I}_{{{{{\text{М}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }}}}}} + {{a}_{{{\text{24}}}}},$(10)
${{{\text{M}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}} = {\text{2}}{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}_{{\text{2}}}},$Методом наименьших квадратов было решено уравнение (9) и найдены коэффициенты масс-спектра a24, показывающие, какая часть измеряемого ионного тока ${{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}$ образована при диссоциативной ионизации молекул М4Piv4 (табл. 3).
Наиболее сложной представляется расшифровка ионного тока М+, который, строго говоря, образован в основном при диссоциативной ионизации четырех молекул: МPiv, М2Piv2, М3Piv3 и М4Piv4. Строгая расшифровка измеряемого ионного тока М+ (выражение (2)) методом [21] возможна при решении уравнения, аналогичного уравнениям (6), (9), но содержащего четыре неизвестных – масс-спектральные константы равновесия и коэффициенты масс-спектра. Однако точность решения подобных экспериментальных уравнений всегда оказывается очень низкой и полученные значения коэффициентов масс-спектра часто не имеют физического смысла. Поэтому расшифровка четверной линии М+ может быть выполнена только в рамках определенных допущений и приближений. Так, малые интенсивности полимерных ионов ${\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }$ и ${\text{N}}{{{\text{a}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }$ в масс-спектре насыщенного пара пивалата натрия и симбатное падение ионных токов ${{I}_{{{\text{N}}{{{\text{a}}}^{ + }}}}}$ и ${{I}_{{{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}$ позволяют принять, что молекулярным предшественником ионов Na+ являются только молекулы Na2Piv2, а малое содержание в масс-спектрах паров пивалатов калия, рубидия и цезия ионов ${{{\text{М}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }$ и ${{{\text{М}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }$ позволяет принять, что ионный ток М+ образован при диссоциативной ионизации молекул MPiv, M2Piv2:
(11)
${{I}_{{{{{\text{M}}}^{{\text{ + }}}}}}} = {{I}_{{{{{\text{M}}}^{{\text{ + }}}}{\text{(MPiv)}}}}} + {{I}_{{{{{\text{M}}}^{{\text{ + }}}}{\text{(}}{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}_{{\text{2}}}}{\text{)}}}}}{\text{.}}$Это выражение может быть представлено, как и в предыдущих случаях, в виде уравнения:
(12)
${{{{I}_{{{{{\text{M}}}^{{\text{ + }}}}}}}} \mathord{\left/ {\vphantom {{{{I}_{{{{{\text{M}}}^{{\text{ + }}}}}}}} {{{I}_{{{{{\text{М}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}}}} \right. \kern-0em} {{{I}_{{{{{\text{М}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}}} = \,\,{{^{{\text{2}}}\surd {{k}_{{{\text{(13)}}}}}} \mathord{\left/ {\vphantom {{^{{\text{2}}}\surd {{k}_{{{\text{(13)}}}}}} {^{{\text{2}}}\surd {{I}_{{{{{\text{М}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}}}} \right. \kern-0em} {^{{\text{2}}}\surd {{I}_{{{{{\text{М}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}}}} + {{a}_{{{\text{12}}}}}{\text{,}}$Экспериментальные данные по полной изотермической сублимации навесок и результаты расшифровок масс-спектров позволили по уравнению Герца–Кнудсена, записанному для сложного молекулярного состава газовой фазы (14), и основному уравнению масс-спектрометрии (15):
(14)
$\begin{gathered} {{q}_{{{\text{MPiv}}}}}\left( g \right) = ~{{S}_{{{\text{эф}}}}}k \times \\ \times \,\,\left\{ {{{{\left( {\frac{{{{M}_{1}}T}}{{2\pi R}}} \right)}}^{{0.5}}}\frac{1}{{{{\sigma }_{1}}}}\int\limits_0^t {\left( {{{I}_{1}} + {{{\left( {\frac{{{{M}_{2}}}}{{{{M}_{1}}}}} \right)}}^{{0.5}}}\frac{{{{\sigma }_{1}}}}{{{{\sigma }_{2}}}}{{I}_{2}} + {{{\left( {\frac{{{{M}_{3}}}}{{{{M}_{1}}}}} \right)}}^{{0.5}}}\frac{{{{\sigma }_{1}}}}{{{{\sigma }_{3}}}}{{I}_{3}}~ + {{{\left( {\frac{{{{M}_{4}}}}{{{{M}_{1}}}}} \right)}}^{{0.5}}}\frac{{{{\sigma }_{1}}}}{{{{\sigma }_{4}}}}{{I}_{4}}} \right)} dt} \right\}, \\ \end{gathered} $(15)
$p = \left( {{k \mathord{\left/ {\vphantom {k \sigma }} \right. \kern-0em} \sigma }} \right)IT,$Таблица 1.
Результаты ДСК-исследований: температура и энтальпия (кДж/моль) фазового перехода
| Соединение | Tф, °С | ΔфН$_{T}^{^\circ }$ | Tф, °С | ΔфН$_{T}^{^\circ }$ | Tпл, °С | ΔплН$_{T}^{^\circ }$ |
|---|---|---|---|---|---|---|
| LiPiv | 152.0 ± 0.2 | 1.00 ± 0.04 | – | – | 229.8 ± 0.5 Разложение [10] |
4.8 ± 0.1 |
| NaPiv | – | – | – | – | 355.6 ± 0.2 315 [10] |
9.7 ± 0.1 |
| KPiv | 322.9 ± 0.4 | 0.43 ± 0.05 | 327.2 ± 0.5 | 0.19 ± 0.02 | 339.6 ± 0.5 320 [10] |
*11.9 ± 0.2 |
| RbPiv | – | – | – | – | 319.2 ± 0.1 327 [10] |
11.6 ± 0.1 |
| CsPiv | **327.4 ± 0.1 | **7.57 ± 0.21 | – | – | 345.5 ± 0.9 346 [10] |
10.0 ± 0.1 |
Таблица 2.
Относительные интенсивности металлсодержащих ионов в масс-спектрах газовой фазы над пивалатами щелочных металлов с учетом изотопного состава (Uиониз = 70 В)
| Ион | Интенсивность, отн. ед. | ||||
|---|---|---|---|---|---|
| LiPiv [9] (Т = 543 K) | NaPiv (T = 584 K) |
KPiv (Т = 565 K) |
RbPiv (Т = 565 K) | CsPiv (Т = 565 K) | |
| [M]+ | 5.6 | 85 | 200 | 290 | 1000 |
| [M2]+ | – | – | – | 6 | 8 |
| [M2Piv]+ | 100 | 100 | 100 | 100 | 100 |
| [M3Piv2]+ | 17.3 | 6.6 | 10 | 8 | 7 |
| [M4Piv3]+ | 56.1 | 6.6 | 7.5 | 4 | 2 |
| [M5Piv4]+ | 7.2 | 0.8 | 0.3 | – | – |
| [M6Piv5]+ | 8.2 | 0.3 | – | – | – |
| [M7Piv6]+ | 4.4 | – | – | – | – |
| [M8Piv7]+ | 0.5 | – | – | – | – |
| [M9Piv8]+ | 0.5 | – | – | – | |
Таблица 3.
Коэффициенты масс-спектров пивалатов щелочных металлов
| Элемент | a12 | a24 | a34 |
|---|---|---|---|
| Na | – | 1.6 ±1.5 | 0.8 ± 0.3 |
| K | 0.6 ± 0.4 | 2.3 ± 1.2 | 1.3 ± 0.1 |
| Rb | 0.3 ± 0.3 | – | – |
| Cs | 7.8 ± 3.5 | – | – |
Таблица 4.
Относительные интенсивности металлсодержащих ионов в индивидуальных масс-спектрах молекул пивалатов щелочных металлов (Uиониз = 70 В)
| Компонент | Форма | Li [9] | Na | K | Rb | Cs |
|---|---|---|---|---|---|---|
| MPiv | M+ | – | – | 100 | 100 | 100 |
| (MPiv)2 | M+ M2L+ |
5 100 |
63 100 |
63 100 |
28 (Rb$_{2}^{ + }$ 37) 100 |
100 10 |
| (MPiv)4 | M+ M2L+ M3L$_{2}^{ + }$ M4L$_{3}^{ + }$ |
5 93 30 100 |
100 53 – 83 |
100 80 45 35 |
– | – |
Таблица 5.
Абсолютные величины парциальных давлений компонентов молекулярных форм в насыщенном паре [Па]
| Компонент | Li [9] (T = 543 K) | Na (T = 584 K) |
K (Т = 565 K) |
Rb (Т = 565 K) |
Cs (Т = 565 K) |
|---|---|---|---|---|---|
| Mpiv | <2 ×10–5 * | 5.0 × 10–5* | 1.6 × 10–2 | 2.8 × 10–2 | 1.1 × 10–1 |
| M2Piv2 | 4.1 × 10–2 | 1.6 × 10–2 | 1.4 × 10–2 | 1.0 × 10–2 | 3.1 × 10–2 |
| M3Piv3 | – | 5.0 × 10–4* | 1.0 × 10–4* | 5.0 × 10–5* | 1.0 × 10–5* |
| M4Piv4 | 9.3 × 10–2 | 3.3 × 10–3 | 3.9 × 10–3 | 4.9 × 10–4 * | 3.0 × 10–4 * |
| M5Piv5 | – | 5.0 × 10–5* | 1.0 × 10–5* | – | – |
| M6Piv6 | – | 1.5 × 10–5* | – | – | – |
| Общее | 13.4 × 10–2 | 1.9 × 10–2 | 3.4 × 10–2 | 3.8 × 10–2 | 14.1 × 10–2 |
Из табл. 5 видно, что парообразование пивалата лития сильно отличается от остальных пивалатов щелочных металлов: в газовой фазе преобладают тетрамерные и практически отсутствуют мономерные молекулы. Кроме того, обращает на себя внимание низкое общее давление над пивалатом натрия.
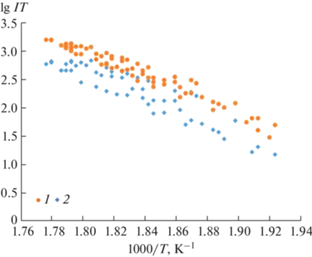
В результате исследования температурных зависимостей интенсивностей расшифрованных ионных токов ${{I}_{{{{{\text{M}}}^{ + }}}}},$ ${{I}_{{{{{\text{M}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}^{ + }}}}},$ ${{I}_{{{{{\text{М}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }}}}$ и ${{I}_{{{{{\text{M}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }}}}$ в интервале температур 503–584 K по уравнению Клаузиуса–Клапейрона методом наименьших квадратов были рассчитаны энтальпии сублимации молекул пивалатов щелочных металлов (табл. 6–9). В табл. 6, 7 приведены значения энтальпий сублимации молекул NaPiv и KPiv, полученные по нерасшифрованным и расшифрованным ионным токам М+ (для примера см. рис. 3), которые однозначно показывают, что измеряемые суммарные ионные токи Na+ и K+ в значительной степени образованы за счет диссоциативной ионизации олигомерных молекул. Расшифровка позволила избежать определенной неточности в энтальпиях сублимации мономерных молекул.
Таблица 6.
Значения энтальпий сублимации молекулярных форм пивалата натрия в интервале температур 513–584 K (кДж/моль)
| № | ∆sH°(MPiv) | ∆sH°(MPiv)2 | ∆sH°(MPiv)4 | |
|---|---|---|---|---|
| по иону Na+ нерасшифрованному | по иону Na2Piv+ |
по иону Na3Piv$_{2}^{ + }$ |
по иону Na4Piv$_{3}^{ + }$ |
|
| 1 | 207.6 ± 5.5 | 201.4 ± 2.8 | 238.7 ± 5.9 | 246.6 ± 5.1 |
| 2 | 200.2 ± 2.3 | 194.9 ± 3.1 | 230.8 ± 4.3 | 232.7 ± 3.2 |
| 3 | 206.4 ± 2.5 | 196.4 ± 1.3 | 235.3 ± 4.4 | 235.4 ± 2.7 |
| 4 | 203.1 ± 2.9 | 198.5 ± 2.8 | 244.7 ± 8.9 | 244.2 ± 1.9 |
| Среднее | 204.3 ± 3.4 | 197.8 ± 2.8 | 238.6 ± 7.5 | |
Таблица 7.
Значения энтальпий сублимации молекулярных форм пивалата калия в интервале температур 500–585 K (кДж/моль)
| № | ∆sH°(MPiv) | ∆sH°(MPiv) | ∆sH°(MPiv)2 | ∆sH°(MPiv)4 | |
|---|---|---|---|---|---|
| по иону K+ нерасшифрованному |
по иону K+ расшифрованному | K2Piv+ | K3Piv$_{2}^{ + }$ | K4Piv$_{3}^{ + }$ | |
| 1 | 214.0 ± 4.2 | 169 ± 9 | 181.5 ± 3.9 | 227.7 ± 3.8 | 229.0 ± 4.5 |
| 2 | 212.2 ± 6.3 | 195 ± 7 | 187.0 ± 3.0 | 212.9 ± 3.2 | 219.7 ± 2.2 |
| 3 | 225.6 ± 3.2 | 210 ± 6 | 193.6 ± 4.1 | 217.4 ± 7.8 | 226.5 ± 6.0 |
| Среднее | 217.2 ± 7.3 | 192 ± 21 | 187.4 ± 6.1 | 222.3 ± 8.0 | |
Таблица 8.
Значения энтальпий сублимации молекулярных форм пивалата рубидия в интервале температур 500–585 K (кДж/моль)
| № | ∆sH°(MPiv) | ∆sH°(MPiv)2 | ∆sH°(MPiv)4 | |||
|---|---|---|---|---|---|---|
| по иону Rb+ |
по иону Rb$_{2}^{ + }$ |
по иону Rb2CO$_{2}^{ + }$ | по иону Rb2Piv+ | по иону Rb3Piv$_{2}^{ + }$ | по иону Rb4Piv$_{3}^{ + }$ | |
| 1 | 149.3 ± 1.6 | 170.0 ± 5.4 | 157.5 ± 8.1 | 168.5 ± 3.1 | 169.3 ± 7.8 | 166.1 ± 3.9 |
| 2 | 170.8 ± 1.3 | 164.3 ± 3.3 | 178.6 ± 8.2 | 163.0 ± 6.3 | 164.5 ± 4.2 | 166.6 ± 15.9 |
| 3 | 155.3 ± 1.7 | 174.2 ± 3.4 | 173.3 ± 3.1 | 163.9 ± 4.1 | 175.7 ± 8.4 | 165.3 ± 8.0 |
| 4 | 175.6 ± 1.2 | 160.8 ± 8.3 | 172.5 ± 3.4 | 177.9 ± 3.0 | 164.7 ± 4.8 | 157.9 ± 11.5 |
| 5 | 170.8 ± 1.1 | 173.9 ± 5.1 | 166.7 ± 5.6 | 172.7 ± 2.3 | – | – |
| Среднее | 164.4 ± 11.4 | 169.2 ± 8.2 | 166.3 ± 8.4 | |||
Таблица 9.
Значения энтальпий сублимации молекулярных форм пивалата цезия в интервале температур 500–575 K (кДж/моль)
| № | ∆sH°(MPiv) | ∆sH°(MPiv)2 | ∆sH°(MPiv)4 | ||
|---|---|---|---|---|---|
| по иону Cs+ | по иону Cs$_{2}^{ + }$ | по иону Cs2Piv+ | по иону Cs3Piv$_{2}^{ + }$ | по иону Cs4Piv$_{3}^{ + }$ | |
| 1 | 163.6 ± 0.9 | 187.5 ± 5.4 | 183.8 ± 2.3 | 180.5 ± 4.0 | 185.4 ± 4.7 |
| 2 | 158.3 ± 1.1 | 185.0 ± 2.7 | 184.6 ± 1.6 | 184.5 ± 2.5 | 185.0 ± 3.4 |
| 3 | 160.7 ± 0.6 | 183.7 ± 2.4 | 180.4 ± 1.1 | 187.3 ± 2.9 | 177.7 ± 3.2 |
| 4 | 163.0 ± 0.7 | 183.3 ± 2.7 | 186.6 ± 1.3 | 185.3 ± 5.5 | 179.4 ± 2.5 |
| Среднее | 161.4 ± 2.4 | 184.4 ± 3.3 | 183.2 ± 5.4 | ||
Рис. 3.
Температурные зависимости интенсивностей ионных токов K+: 1 – полученные в эксперименте, 2 – после расшифровки.
Определить энтальпии сублимации тримерных молекул по 2-му закону термодинамики не удалось из-за их малого количества в насыщенном паре и точности расчета коэффициентов масс-спектров а34. Однако наш вывод о малом содержании в насыщенном паре молекул M3Piv3 полностью подтверждается совпадением (в пределах погрешности) значений энтальпий сублимации молекул M4Piv4, полученных по ионным токам ${{I}_{{{{{\text{M}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }}}}$ и ${{I}_{{{{{\text{M}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }}}}.$
В качестве рекомендованных величин энтальпий сублимации тетрамерных молекул приняты среднеарифметические значения, полученные при исследовании температурных зависимостей интенсивностей ионных токов ${{{\text{М}}}_{{\text{3}}}}{\text{Piv}}_{2}^{ + }$ и ${{{\text{М}}}_{{\text{4}}}}{\text{Piv}}_{3}^{ + }$ (табл. 6–9).
Данные по энтальпиям сублимации позволили рассчитать некоторые энтальпии диссоциации полимерных молекул пивалатов щелочных металлов по 2-му закону термодинамики (табл. 10):
(18)
${{{\text{(MPiv)}}}_{{\text{4}}}}{\text{(г)}} = {\text{2(MPiv}}{{{\text{)}}}_{{\text{2}}}}{\text{(г)}}{\text{.}}$Таблица 10.
Энтальпии (кДж/моль) реакции диссоциации олигомерных молекул пивалатов щелочных металлов
| Реакция | ∆DH$_{T}^{^\circ }$ найденное значение |
∆DH$_{T}^{^\circ }$ рекомендованное значение |
∆DH$_{{298}}^{^\circ }$ |
|---|---|---|---|
| Na2Piv2 = 2NaPiv | 186.6 (3 закон) | 186.6 ± 22.5 | 189.3 ± 23.0 |
| Na4Piv4 = 4NaPiv | 513.4 (3 закон) | 513.4 ± 45.0 | 523.3 ± 46.0 |
| Na4Piv4 = 2Na2Piv2 | 147.9 (3 закон) 155.9 (2 закон) |
152.0 ± 6.0 | 157.2 ± 6.5 |
| 3Na4Piv4 = 4Na3Piv3 | 211.6 (3 закон) | 212.0 ± 25.0 | 219.9 ± 26.0 |
| К2Piv2 = 2КPiv | 155.5 (3 закон) 199.3 (2 закон) |
178.0 ± 25.0 | 180.7 ± 25.5 |
| К4Piv4 = 4КPiv | 463.0 (3 закон) 551.1 (2 закон) |
507.0 ± 45.0 | 516.8 ± 46.0 |
| К4Piv4 = 2К2Piv2 | 151.1 (3 закон) 152.5 (2 закон) |
152.0 ± 5.0 | 157.2 ± 6.0 |
| 3К4Piv4 = 4К3Piv3 | 231.7 (3 закон) | 232.0 ± 20.0 | 239.9 ± 21.0 |
| Rb2Piv2 = 2RbPiv | 149.1 (3 закон) 161.9 (2 закон) |
155.5 ± 6.5 | 158.2 ± 7.0 |
| Rb4Piv4 = 4RbPiv | 466.9 (3 закон) 492.9 (2 закон) |
480.0 ± 20.0 | 489.8 ± 21.0 |
| Rb4Piv4 = 2Rb2Piv2 | 144.3 (3 закон) 169.1 (2 закон) |
157.0 ± 15.0 | 162.2 ± 15.5 |
| 3Rb4Piv4 = 4Rb3Piv3 | 215.0 (3 закон) | 215.0 ± 22.0 | 222.9 ± 23.0 |
| Cs2Piv2 = 2CsPiv | 138.4 (2 закон) 141.8 (3 закон) |
142.0 ± 10.0 | 144.7 ± 11.0 |
| Cs4Piv4 = 4CsPiv | 437.2 (3 закон) 466.0 (2 закон) |
451.5 ± 20.0 | 459.4 ± 21.0 |
| Cs4Piv4 = 2Cs2Piv2 | 130.8 (3 закон) 185.6 (2 закон) |
157.0 ± 25.0 | 162.2 ± 25.5 |
| 3Cs4Piv4 = 4Cs3Piv3 | 239.0 (3 закон) | 239.0 ± 25.0 | 246.8 ± 26.0 |
Эти же характеристики, а также энтальпии диссоциации тримерных и тетрамерных молекул:
(20)
${\text{3(MPiv}}{{{\text{)}}}_{{\text{4}}}}{\text{(г)}} = {\text{4(MPiv}}{{{\text{)}}}_{{\text{3}}}}{\text{(г)}}$Полученные разными способами величины ${{\Delta }_{{\text{D}}}}H_{T}^{^\circ }$ хорошо согласуются между собой для полимерных молекул пивалатов натрия, рубидия и цезия, за исключением реакции диссоциации тетрамерных молекул Cs4Piv4. Хорошее согласие в значениях энтальпий диссоциации связано с относительно простой и, как следствие, более точной расшифровкой масс-спектров паров этих веществ. В случае пивалата калия из-за определенных допущений точность расшифровки масс-спектров оказалась недостаточной для определения энтальпий сублимации молекул KPiv и диссоциации полимерных молекул KnPivn по 2-му закону термодинамики. Малое содержание в насыщенном паре молекул Cs4Piv4 также не дает возможность использовать 2-й закон термодинамики для точного определения энтальпий сублимации и диссоциации этих молекул. Поэтому результаты, полученные по 3-му закону, даже с учетом ошибки расшифровки представляются более точными и выбраны нами как рекомендованные. В табл. 11 приведены рекомендованные значения энтальпий сублимации молекул пивалатов, найденные по 2-му закону и рассчитанные по величинам энтальпий диссоциации полимерных молекул (отмечены звездочками), оцененные только по 3-му закону. Пересчет энтальпий сублимации к Т = = 298 K (табл. 11) осуществляли в предположении равенства изменения теплоемкостей при сублимации молекул пивалатов щелочных металлов и оксидов вольфрама [26].
Таблица 11.
Рекомендованные значения энтальпий сублимации молекулярных форм пивалатов щелочных металлов ∆sH°((MPiv)n, 298.15 K)
| Компонент газовой фазы |
Конденсированная фаза | ||||
|---|---|---|---|---|---|
| LiPiv [9] | NaPiv | КPiv | RbPiv | CsPiv | |
| MPiv | 176.7 ± 13.5* | 194* | 184.4 ± 25.0 | 168.5 ± 12.0 | 164.3 ± 3.0 |
| M2Piv2 | 177.5 ± 7.0 | 197.8 ± 2.8 | 190.7 ± 13.5 | 172.5 ± 5.0 | 187.2 ± 3.0 |
| M3Piv3 | – | 233* | 230* | 186* | 205* |
| M4Piv4 | 198.2 ± 5.0 | 239.7 ± 6.7 | 228.9 ± 5.0 | 175.9 ± 5.3 | 190.8 ± 6.0 |
Найденная в данном исследовании и в работах [27, 28] картина изменения термодинамических характеристик пивалатов щелочных металлов (энтальпии сублимации, состав газовой фазы, абсолютные величины парциальных давлений) в ряду Li–Cs напоминает изменение этих свойств у галогенидов, метаборатов щелочных металлов. Если принять, что энтальпии реакций диссоциации:
(20)
${\text{M}}{{{\text{L}}}_{{\left( {{\text{тв}}} \right)}}} = {{{\text{M}}}_{{\left( {{\text{тв}}} \right)}}} + {{{\text{L}}}^{\centerdot }}_{{\left( {\text{г}} \right)}}$Таблица 12.
Стандартные энтальпии образования (кДж/моль) пивалатов щелочных металлов в газовой и конденсированной фазах
| Соединение | Фаза | $ - {{\Delta }_{f}}H_{{298}}^{^\circ }$ |
|---|---|---|
| NaPiv | Кристалл | 760 |
| Газ | 566 | |
| KPiv | Кристалл | 771 |
| Газ | 587 | |
| RbPiv | Кристалл | 771 |
| Газ | 603 | |
| CsPiv | Кристалл | 775 |
| Газ | 611 |
До настоящей работы исследования пивалатов щелочных металлов методами термогравиметрии и ДСК не проводились, за исключением определения температур их плавления [10], которые устанавливали методом плавления вещества в капилляре. Подобная методика вряд ли может претендовать на удовлетворительную точность. Этим, с нашей точки зрения, можно объяснить существенные расхождения в величинах температур плавления, найденных в настоящей работе и в исследовании [10] (табл. 1). Результаты дифференциальной сканирующей калориметрии и их точность, к сожалению, сравнить не с чем. Можно только отметить, что в литературе имеется большое количество работ по исследованию других карбоксилатов щелочных металлов, которые характеризуются наличием большого количества твердофазных переходов. Достаточно подробный обзор работ по твердофазным переходам ацетатов лития, калия и цезия можно найти в работе Гбасси и Робелина [32], в которой, например, показано существование трех твердых фаз ацетата калия. Существование трех полиморфных форм ацетата натрия отмечено в работе [33]. В исследовании [34] описано термическое поведение алканоатов С1–С12 калия и показано, что практически все соли с длиной углеродной цепочки больше четырех характеризуются фазовыми переходами твердая фаза–твердая фаза и твердая фаза–жидкий кристалл. Можно отметить, что найденные в нашем исследовании термические свойства пивалатов щелочных металлов находятся в согласии с общей картиной термических свойств алканоатов этих металлов.
Масс-спектральные исследования, выполненные в данной работе, удовлетворительно согласуются с результатами, представленными в [10, 14, 15, 17], главным образом это касается состава газовой фазы и значений энтальпий сублимации и диссоциации молекул мономерных МPiv и димерных М2Piv2. К сожалению, в этих работах не приведены термодинамические характеристики других полимерных молекул. Следует отметить, что наблюдаются существенные расхождения в абсолютных величинах парциальных и общих давлений пивалатов щелочных металлов, найденных в настоящей работе и работах [10, 17]. Рассчитанные нами величины оказались в 5–10 раз ниже литературных значений. Объяснить столь значительные расхождения трудно, так как в работах [10, 14] не указано, какие из многочисленных методик были использованы при определении и расчете величин парциальных давлений; скорее всего, в используемой методике была допущена систематическая ошибка. Однако можно отметить, что изменение летучести в ряду пивалатов Na–Cs в рассматриваемых работах одинаковое, оно монотонно увеличивается от соли натрия к соли цезия.
Список литературы
Сыркин В.Г. CVD-метод. Химическая парофазная металлизация. М.: Наука, 2000. 496 с.
Fromm K.M., Gueneau E.D. // Polyhedron. 2004. V. 23. P. 1479. https://doi.org/10.1016/j.poly.2004.04.014
Fromm K.M. // Coord. Chem. Rev. 2008. V. 252. P. 856. https://doi.org/10.1016/j.ccr.2007.10.032
Romanov M., Korsakov I., Kaul A. et al. // Chem. Vap. Deposition. 2004. V. 10. № 6. P. 318. https://doi.org/10.1002/cvde.200306302
Murzina T., Savinov S., Ezhov A. et al. // Appl. Phys. Lett. 2006. V. 89. № 6. P. 2907. https://doi.org/10.1063/1.2336743
Tsymbarenko D.M., Korsakov I.E., Mankevich A.S. et al. // ECS Trans. 2009. V. 25. № 8. P. 633. https://doi.org/10.1149/1.3207650
Matsubara M., Kikuta K., Hirano S. // J. Appl. Phys. 2005. V. 97. P. 114105. https://doi.org/10.1063/1.1926396
Saito Y., Takao H., Tani T. et al. // Nature. 2004. V. 432. P. 84. https://doi.org/10.1038/nature03028
Каюмова Д.Б., Малкерова И.П., Кискин М.А. и др. // Журн. неорган. химии. 2021. Т. 66. № 6. С. 767. https://doi.org/10.31857/S0044457X2106012X
Хоретоненко Н.М. Структурные и термодинамические исследования пивалатов некоторых непереходных металлов. Автореф. … канд. хим. наук. М., 1998. 22 с.
White E. // Org. Mass Spectrom. 1978. V. 13. № 9. P. 495. https://doi.org/10.1002./oms.121010903
Matsumoto K., Kosugi Y., Yanagisawa M. et al. // Org. Mass Spectrom. 1980. V. 15. № 12. P. 606. https://doi.org/10.1002./oms.1210151203
Cao Y., Busch K.L. // J. Inorg. Chem. 1994. V. 33. P. 3970. https://doi.org/10.1002/ic0006a022
Троянов С.И., Киселева Е.А., Рыков А.Н. и др. // Журн. неорган. химии. 2002. Т. 47. № 10. P. 1661.
Киселева Е.А., Беседин Д.В., Коренев Ю.М. // Журн. физ. химии. 2005. Т. 79. № 9. С. 1658.
Хоретоненко Н.М., Рыков А.Н., Коренев Ю.М. // Журн. неорган. химии. 1998. Т. 43. № 4. С. 584.
Цымбаренко Д.М., Бухтоярова Е.А., Корсаков Е.А. и др. // Коорд. химия. 2011. Т. 37. № 11. С. 828. https://doi.org/10.1134/S1070328411100125
Zorina-Tikhonova E.N., Yambulatov D.S., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 2. P. 75. http://doi.org./10.1134/S1070328420020104
Kayumova D.B., Malkerova I.P., Shmelev M.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 125. http://doi.org./10.1134/S003602361901012
Gribchenkova N.A., Alikhanyan A.S. // J. Alloys. Compd. 2019. V. 778. P. 77. https://doi.org/10.1016/j.jallcom.2018.11.136
Горохов Л.Н. // Вестн. Моск. ун-та. Сер. матем., мех., физ. химия. 1958. С. 231.
Сидоров Л.Н., Коробов М.В. Современные проблемы физической химии. М.: Изд-во Моск. ун-та, 1972. Т. 9. С. 48.
Otvose J.W., Stevenson D.P. // J. Am. Chem. Soc. 1956. V. 78. P. 546. https://doi.org/10.1021/ja01584a009
Guido M., Gigli M. // High Temp. Sci. 1975. V. 7. № 2. P. 122.
Meyer R.T., Lynch A.W. // High. Temp. Sci. 1973. V. 5. № 3. P. 192.
Термодинамические свойства индивидуальных веществ / Под ред. Глушко В.П. М.: Наука, 1982. Т. 4. Кн. 2. 559 с.
Макаров А.В. Масс-спектральное изучение испарения метаборотов щелочных металлов. Автореф. дис. … канд. хим. наук. М., 1987. 16 с.
Верхотуров Е.А. Масс-спектрометрическое исследование испарения и процессов ионизации нитритов щелочных металлов. Автореф. дис. …канд. хим. наук. М., 1977. 16 с.
Lukyanova V.A., Papina T.S., Didenko K.V. et al. // J. Therm. Anal. Calorim. 2008. V. 92. P. 743. https://doi.org/10.1016/j.jssc.2020.121842
Gray P., Thynne J.C.J. // Nature (Engl). 1961. № 191. P. 1357. http://doi.org.//10.1038/1911357a0
Термические константы веществ. Справочник в 10 выпусках / Под ред. Глушко В.П. М.: ВИНИТИ, 1974. Т. 10. Ч. 1, 2.
Gbassi G.K., Robelin C. // Fluid Phase Equilib. 2015. V. 406. P. 134. https://doi.org/10.1016/j.fluid.2015.06.044
Xu M., Harris K.D.M. // Cryst. Growth Des. 2008. V. 8. № 1. P. 6. https://doi.org/10.1021/cg701077p
Bui L.H., De Klerk A. // J. Chem. Eng. Data. 2014. V. 59. № 1. P. 400. https://doi.org/10.1021/je400874d
Дополнительные материалы
- скачать ESM_1.jpg
- Приложение 1.
- скачать ESM_2.jpg
- Приложение 2.
- скачать ESM_3.jpg
- Приложение 3.
- скачать ESM_4.jpg
- Приложение 4.
- скачать ESM_5.jpg
- Приложение 5.
- скачать ESM_6.jpg
- Приложение 6.
- скачать ESM_7.jpg
- Приложение 7.
Инструменты
Журнал неорганической химии


