Океанология, 2023, T. 63, № 4, стр. 643-652
Пространственная изменчивость макро- и мезозоопланктона в проливе Брансфилда в январе 2020 г.
К. М. Горбатенко 1, В. А. Яковенко 2, *
1 Тихоокеанский филиал ФГБНУ ВНИРО (ТИНРО)
Владивосток, Россия
2 Институт Биологии южных морей им. А.О. Ковалевского РАН
Севастополь, Россия
* E-mail: yakovenko_vla@mail.ru
Поступила в редакцию 28.07.2022
После доработки 22.08.2022
Принята к публикации 12.09.2022
- EDN: YKDRPI
- DOI: 10.31857/S0030157423040044
Аннотация
Исследовано пространственное распределение биомассы видов макро- и мезозоопанктона, а также размерная и половая структура криля Euphausia superba и сальп Salpa thompsoni и Ihlea racovitzai в проливе Брансфилда в течение антарктического лета 2020 г. Пробы зоопланктона отбирались сетью Бонго. На всех исследованных станциях основу биомассы зоопланктона составляли сальпы S. thompsoni и I. racovitzai, а третье место занимали E. superba, их биомасса составляла от 6.3 до 96.3 мг/м3, причем криль встречался лишь в Северо-Западной глубоководной части пролива, куда он проникал из моря Беллинсгаузена. Это объясняется пищевой конкуренцией между сальпами и крилем. Биомасса других видов зоопланктона во всех районах пролива была незначительной по сравнению с сальпами и крилем и распределялась равномерно. При сравнении полученных в экспедиции данных с данными 90-х и 2000-х годов, прослеживается явный тренд увеличения биомассы сальп и снижения биомассы E. superba, что может быть связано с увеличением температуры воды Антарктической акватории. На примере пролива Брансфилда четко видна отрицательная корреляция между биомассой сальп и криля.
ВВЕДЕНИЕ
Со второй половины XX века криль, ракообразные отряда Euphausiacea, стал одним из основных биоресурсов, добываемых в морях Антарктиды. Биомасса эвфаузиид в проливе Брансфилда традиционно была одной из наибольших в Антарктике наряду с периферией моря Уэдделла, морем Скотия и водами к северо-западу от Антарктического полуострова и над шельфом о. Южного Георгия [8]. Мюррей в 90-х годах на основании акустических исследований рассчитал, что величина биомассы криля в бассейнах Антарктики варьировала от 17 до 160 г/м2, с наибольшими величинами именно в проливе Брансфилда [22].
Одновременно в последние десятилетия фиксировалось стабильное увеличение биомассы сальп Salpa thompsoni Foxton, 1961 в районе Антарктического полуострова, особенно в проливе Брансфилда и вблизи острова Элефант [19, 23]. Сальпы обладают способностью к интенсивному размножению, превосходя в этом другие виды зоопланктона, и при этом существенно влияют на биомассу других компонентов планктонных сообществ и трансформируют потоки энергии в антарктических пелагических пищевых цепях [17, 18]. Так, например, Нишикавой был зафиксирован существенный размах значений биомассы криля в разных участках пролива (от 0 до 151.4 мг Cм–2), данная разница была обусловлена выеданием сальпами криля, между численностью сальп и криля отмечена достоверная отрицательная корреляция [23]. В других исследованиях в разных частях Антарктического региона [19, 20, 23, 28] изучали взаимодействие между крилем (Euphausia superba Dana, 1850) и сальпами (S. thompsoni, Ihlea racovitzai (Van Beneden and Selys Longchamp, 1913)), которые являются основными видами в пищевых сетях вод Антарктики. В результате была установлена некоторая негативная связь между ними.
Гидрологические факторы также влияют на пространственное распределение вышеуказанных видов [2, 15, 30], при этом влияние определенных водных масс нараспределение количественных показателей криля в проливе Брансфилда иногда оказывается наиболее весомым [10]. Однако, несмотря на то, что имеется довольно много исследований влияния океанографических факторов на распределение мезо- и макрозоопланктона в проливе Брансфилда [10, 16, 31], все же, к настоящему времени не сформировалось достаточного понимания закономерностей их влияния на распределение популяции криля и всего зоопланктона в проливе, что определяет необходимость продолжения многолетних исследований.
Целью данного исследования было изучение пространственной вариабельности структуры и количественных показателей зоопланктона в проливе Брансфилд в январе (антарктическое лето) 2020 г.
МАТЕРИАЛ И МЕТОДЫ
Район исследований
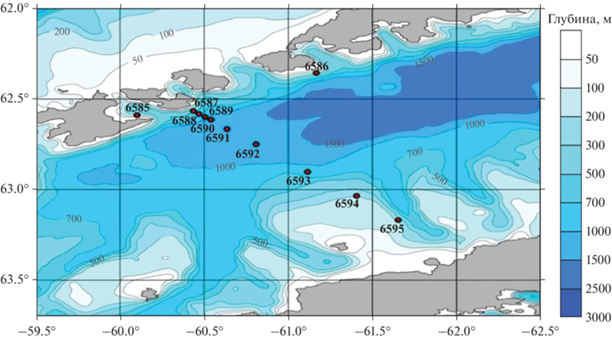
Пролив Брансфилда лежит между Антарктическим полуостровом и Южными Шетландскими островами, от острова Кинг-Джордж на северо-востоке пролива до острова Анверс на юго-западе, длина пролива составляет 112 км при максимальной глубине 2 км. Океанографические особенности пролива обусловлены его расположением между морем Беллинсгаузена на западе и морем Уэдделла на востоке [31, 32]. В летний период акватория пролива заполнена двумя главными водными массами, впадающими из этих морей, что определяет высокую изменчивость гидрофизических показателей во временном и пространственном аспектах. Течения из моря Беллинсгаузена несут северные воды, относительно теплые и пресные по сравнению с течениями моря Уэдделла, которые формируют южные водные массы в проливе [11].
Методы
Исследования в проливе Брансфилда проводили в январе 2020 года на разрезе в центральной части на 2‑м этапе 79‑й экспедиции НИС “Академик Мстислав Келдыш”.
Пробы макропланктона были отобраны сетью Бонго (диаметр входного отверстия 60 см, ячея 500 мкм). Сеть была оснащена muhuCTD-зондом и датчиком пройденного пути. Облов проводился при правой циркуляции судна (радиус циркуляции – 1.1 кабельтов) на скорости 2 узла до расчетной глубины 200 м. Необходимую длину вытравленного троса (L) определяли по формуле: L = 200/cos а, где а – угол отклонения троса от вертикали. Скорость подъема сети составляла 1 м/с.
Отобранные пробы фиксировали 6% формалином. Биологический анализ проб криля включал определение количества экземпляров в пробе, их индивидуальной длины и массы, пола и стадии зрелости (степени развития внешних и внутренних гениталий). Измерение длины рачков производили с точностью до 1 мм от внешнего края глазной орбиты до конца тельсона. Индивидуальная масса криля определялась взвешиванием рачка, подсушенного фильтровальной бумагой, на торсионных весах (WT-1000). Если улов составлял менее 200 особей, он весь подвергался анализу. В случае больших уловов выборка составляла не менее 200 особей, кроме того, еще 100 рачков промеряли и взвешивали для уточнения размерно-весового состава. Стадии зрелости криля определяли по шкале, разработанной Р.Р. Макаровым [21]. Работы по мониторингу уловов и биологии криля выполнялись по единым методикам [3, 29].
Также производилось видовая идентификация и измерение размеров и массы сальп.
Степень доминирования видов зоопланктона рассчитывалась с помощью индекса ценотической значимости (ИЦЗ) по формуле
где р – встречаемость вида, %, b – средняя биомасса вида, г/м3 [5].Параллельно со сбором зоопланктона проводились измерения абиотических параметров – температуры, солености, концентрации кислорода и направления течений. Средние значения и коэффициенты корреляции рассчитывали в программе Microsoft Excel.
РЕЗУЛЬТАТЫ
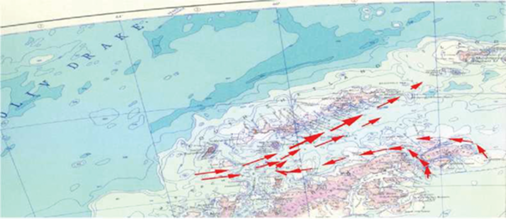
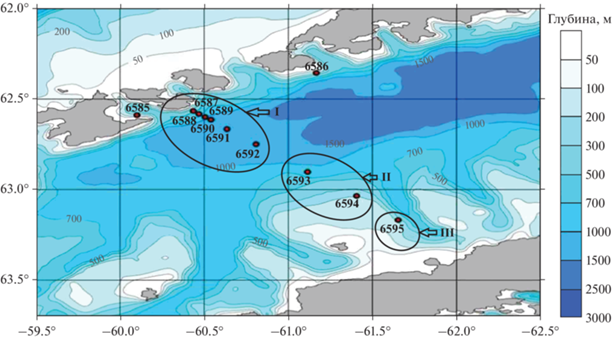
Согласно гидрологическим данным, общая схема течений в проливе Брансфилда соответствовала ранее полученным данным [1, 6] (рис. 2).
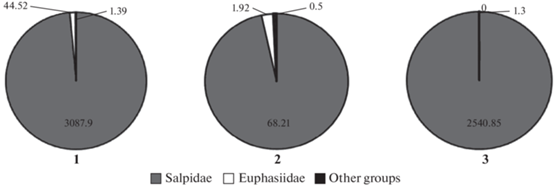
Наибольшие величины биомассы криля и сальп были характерны для северо-западной глубоководной области, а в юго-западной шельфовой области были отмечены лишь сальпы. В центральной зоне – зоне свала глубин – криль отсутствовал, из эвфаузиид наблюдались виды Thysanoessa macrura G.O. Sars, 1883 и T. vicina Hansen, 1911. Повсеместно основу зоопланктона составляли сальпы S. thompsoni и I. racovitzai, доля которых по биомассе в данных районах колебалась от 96.6 до 99.6% (рис. 3), при этом их биомасса была минимальной в центральной части пролива.
Рис. 3.
Соотношение биомассы сальп, эфваузиид и видов мезозоопланктона в проливе Брансфилда в январе 2020 г. 1 – глубоководная часть, 2 – материковый склон, 3 – шельф.
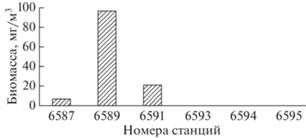
Особи Euphausia superba были отмечены только в глубоководном северо-западном районе пролива Брансфилда (станции 6587–6591), где величина их биомассы колебалась от 6.3 до 96.3 мг/м3 (рис. 4).
В центральной части района, в области свала глубин, количество эвфаузиид понизилось более чем на порядок (средняя биомасса 1.92 мг/м3), за счет отсутствия в пробах E. superba. В южной части исследованного района не были обнаружены не только E. superba, но и другие виды эвфаузиид.
Общая биомасса сальп варьировала от 68.2 мг/м3 в области свала глубин до 3087.9 мг/м3 в северной глубоководной части района исследований. Повсеместно доминировал вид S. thompsoni, представленный особями размером от 5 до 120 мм (табл. 1). В северной глубоководной зоне, где биомасса S. thompsoni была наибольшей, преобладали относительно мелкие особи размером 40–50 мм. В области свала глубин при средней величине биомассы 67.2 мг/м3 модальная группа была представлена особями с размерами 40–60 мм. В южной шельфовой зоне доминировали крупные особи длиной 60–70 мм (табл. 1).
Таблица 1.
Биомасса (мг/м3) сетного зоопланктона в проливе Брансфилда летом 2020г. Облавливаемый слой – от 0 м до 227 м
| Район | пр. Брансфилда (северная часть) | пр. Брансфилда (центральная часть) | пр. Брансфилда (южная часть) | |
|---|---|---|---|---|
| Биотоп | Глубоководная часть | Материковый склон | Шельф | |
| Глубина, м | 919 | 472 | 165 | |
| Слой, м | 227 | 164 | 54 | |
| Размер, мм | Биомасса, мг/м3 | |||
| Сумма | 3133.86 | 70.62 | 2542.16 | |
| Эвфаузииды | 44.52 | 1.92 | – | |
| Euphausia superba | 15–20 | 0.03 | – | – |
| Euphausia superba | 20.1–30 | 2.34 | – | – |
| Euphausia superba | 30.1–40 | 5.32 | – | – |
| Euphausia superba | 40.1–50 | 18.77 | – | – |
| Euphausia superba | 50.1–55 | 14.74 | – | – |
| Thysanoessa macrura | <10 | 0.04 | 0.01 | – |
| Thysanoessa macrura | 10.1–15 | 1.98 | 1.14 | – |
| Thysanoessa macrura | 15–20 | 1.22 | 0.74 | – |
| Thysanoessa macrura | 20–25 | 0.05 | – | – |
| Thysanoessa vicina | 10.1–15 | 0.04 | 0.03 | – |
| Сальпы | 3087.89 | 68.21 | 2540.85 | |
| Salpa thompsoni | 5–120 | 3087.89 | 67.32 | 2528.07 |
| Salpa thompsoni | 5.1–10 | 10.80 | 0.89 | 15.32 |
| Salpa thompsoni | 10.1–20 | 31.79 | 1.13 | 146.40 |
| Salpa thompsoni | 20.1–30 | 136.78 | 1.92 | 256.22 |
| Salpa thompsoni | 30.1–40 | 472.37 | 7.04 | 238.57 |
| Salpa thompsoni | 40.1–50 | 934.88 | 23.39 | 64.70 |
| Salpa thompsoni | 50.1–60 | 764.34 | 22.27 | 300.52 |
| Salpa thompsoni | 60.1–70 | 320.47 | 4.95 | 1235.48 |
| Salpa thompsoni | 70.1–80 | 239.34 | 5.73 | 270.87 |
| Salpa thompsoni | 80.1–100 | 140.35 | – | – |
| Salpa thompsoni | >100 | 36.77 | – | – |
| Ihlea racovitzai | 10–20 | 0.00 | 0.89 | 12.78 |
| Копеподы | 0.19 | 0.07 | 0.11 | |
| Rhincalanus gigas | 3.6–5.5 | 0.1 | 0.01 | 0.06 |
| Calanoides acutus | 2.5–3.8 | 0.01 | 0.01 | 0.02 |
| Calanus propinguus | 3.1–3.8 | 0.01 | 0.04 | 0.03 |
| Calanus simillimus | 2.5–3.0 | – | 0.01 | – |
| Metridia gerlachei | 2.4–4.0 | 0.05 | – | – |
| Pareuchaeta antarctica | 4.0–6.0 | 0.02 | – | – |
| Pareuchaeta sp. | 4.0–4.5 | 0.01 | – | – |
| Гиперииды | 0.68 | 0.08 | 0.93 | |
| Themisto gaudichaudii | 2.1–5 | 0.02 | 0.01 | – |
| Primno macropa | 2.5–3 | 0.01 | – | 0.01 |
| Primno macropa | 3.1–10 | – | – | – |
| Primno macropa | 10.1–15.0 | 0.16 | – | – |
| Cyllopus magellanicus | 8–10 | 0.02 | – | – |
| Cyllopus magellanicus | 10.1–14 | 0.10 | 0.07 | – |
| Hyperia medusarum | 10–15 | 0.19 | 0.00 | 0.92 |
| Scina antarctica | 5–10 | 0.19 | – | – |
| Хетогнаты | 0.03 | – | 0.03 | |
| Pseudosagitta maxima | 10–15 | – | – | 0.02 |
| Eukrohnia hamata | 10–15 | 0.03 | – | 0.01 |
| Птероподы | 0.41 | 0.31 | – | |
| Clio pyramidata | >10 | 0.41 | 0.17 | – |
| Spongiobranchea austalis | 2–4 | – | 0.02 | – |
| Spongiobranchea austalis | 4.1–6 | – | 0.04 | – |
| Limacina helicina | 2.1–6 | – | 0.01 | – |
| Limacina helicina | 6.1–10 | – | 0.08 | – |
| Прочие | 0.08 | 0.04 | 0.23 | |
| Mysidacea | 2–10 | – | – | 0.03 |
| Mysidacea | 10.1–20 | – | – | 0.21 |
| Tomopteris pacifica | 12–15 | – | 0.04 | – |
| Conchoecia sp. | 2.6–3.0 | 0.01 | – | – |
| Dimophyes antarctica | 3 | 0.01 | – | – |
| Dimophyes antarctica | 4–8 | 0.02 | – | – |
| Dimophyes antarctica | 8–10 | 0.03 | – | – |
| Larvae Pisces | 2–10 | 0.01 | – | – |
Сальпы I. racovitzai имели размеры от 10 до 20 мм и концентрировались, в основном, в южном шельфовом районе, где их средняя биомасса составляла всего 12.8 мг/м3.
Как общая биомасса сальп и криля, так и биомасса их отдельных видов, не показала достоверной корреляции с температурой и соленостью. Сравнение измеренной нами биомассы криля с данными, полученными в этом районе предыдущими исследователями, демонстрирует ее снижение [8, 24, 27].
В период исследования преобладали ветра западных румбов, что вызвало занос крупноразмерных особей криля из моря Беллинсгаузена. Согласно литературным данным [9, 13, 16, 25, 26], именно в подрайоне 48.1 (пролив Брансфилда) наиболее крупные особи E. Superba перемещаются летом вдоль шельфового склона Антарктического полуострова в восточном направлениис водами Антарктического циркумполярного течения.
Распределение видов мезозоопланктона между исследованными районами оказалось равномерным. Копеподы повсеместно имели низкую биомассу – от 0.07 до 0.19 мг/м3, а их доля в общей биомассе зоопланктона составила от 0.01 до 0.1% (табл. 1).
Среди 6 видов копепод, которые были нами встречены, преобладали Rhincalanus gigas Brady, 1883 и Metridia gerlachei Giesbrecht, 1902. Среди гипериид доминировал вид Hyperia medusarum, их общая биомасса была незначительна (0.08–0.93 мг/м3). Сагитты были представлены 2 видами: Pseudosagitta maxima (Conant, 1896) и Eukrohnia hamata (Mobius, 1875) и имели минимальные суммарные биомассы. 3 вида птеропод, обнаруженных в пробах – Clio pyramidata Linnaeus, 1767, Spongiobranchaea australis d’Orbigny, 1836 и Limacina helicina (Phipps, 1774), формировали низкую суммарную биомассу – до 0.41 мг/м3. Среди других представителей зоопланктона были обнаружены мизиды, пелагические личинки полихет, сифонофоры и личинки рыб, основные концентрации которых были сосредоточены в южном мелководном районе.
В целом, в исследуемом районе, зоопланктон был представлен 11 таксономическими группами и 27 видами: Euphausiacea (3 вида), Salpidae (2 вида), Calanidae (7 видов), Hyperiidae (5 видов), Sagittidae (2 вида), Cliidae (3 вида), прочие (5 видов).
ОБСУЖДЕНИЕ
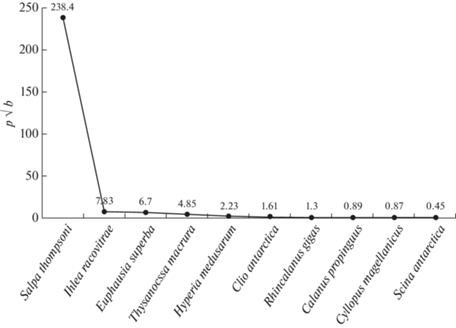
В структуре зоопланктоценоза по индексу ИЦЗ, доминировали 2 вида сальп – S. thompsoni и I. racovitzai.
Вид S. thompsoni был явным доминантом, индекс ценотической значимости вида составил 238.4, тогда как ИЦЗ вида I. racovitzai составил лишь 7.83. ИЦЗ E. superba был сопоставим с таковым сальпы I. racovitzai. ИЦЗ другого вида эвфаузиид Thysanoessa macrura (4,85) оказался также сравним и немного ниже такового E. superba за счет встречаемости T. macrura на большем количестве станций. Другие виды, ранжированные по индексу ИЦЗ, имели незначительный вес в видовой структуре зоопланктона. Популяция вида E. superba в проливе Брансфилда была представлена особями размером от 10 до 55 мм. Молодь (от 10 до 35 мм) составила 31.5% общей численности популяции (рис. 6).
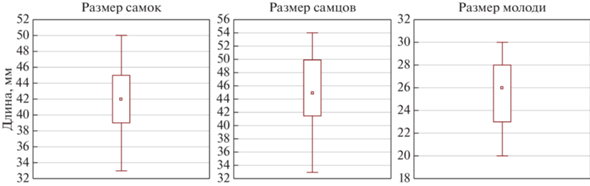
Половозрелые особи в размерном диапазоне от 35 до 55 мм формировали 68.5%. Среди половозрелых особей криля, 36.5% составили самки, а 63.5% – самцы. Длина самок изменялась от 37 до 50 мм, в среднем 42 ± 3.9 мм, самцов – от 33 до 54, в среднем 44.8 ± 5.5 мм. Длина молоди криля варьировала в пределах от 20 до 30 мм, в среднем 25.9 ±3.0 мм. Таким образом, среди взрослых особей криля установлено преобладание размерной группы 42–45 мм.
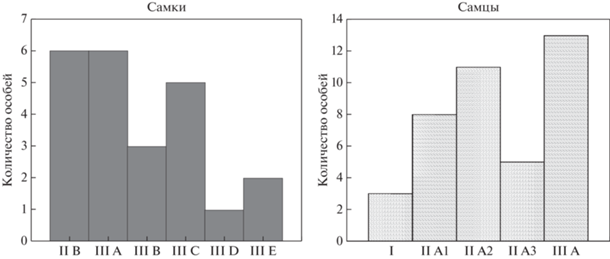
В возрастной структуре E. superba, среди самок преобладали особи ранних стадий развития IIB и IIIA, – по 26.1% каждая (рис. 7). Доля преднерестовых особей рачков (четвертая стадия развития IIIC) составляла 21.7%. Среди самцов доминировали более поздние стадии развития –IIA2 и IIIA, формировавшие 27.5 и 32.5% от общей численности самцов соответственно.
Полученный материал демонстрирует, преобладание в возрастной структуре популяции E. superba половозрелых особей, причем среди самок – преобладали более ранние стадии по сравнению с самцами, среди которых больше было преднерестовых и нерестовых особей.
В соответствии с полученными значениями биомасс сальп, криля и мезозоопланктона, были выделены районы с разной структурой зоопланктона (рис. 8 ).
Одна из весомых причин уменьшения биомассы криля связана с тем, что сальпы, являясь пищевыми конкурентами криля, активно выедают фитопланктон, являющийся для них общей пищей, что не дает возможности растительноядным ракообразным формировть высокие концентрации в местах их скопления [4, 12, 14]. Необходимо отметить, что сальпы приурочены к верхнему 200-м слою воды [7], и наличие там их скоплений приводит к вытеснению криля, также обитающего в поверхностном слое водной толщи. В то же время, авторами не найдено достоверной корреляции между биомассами криля и сальп, что, вероятно, объясняется влиянием течений на их распределение в данном районе.
В целом, северо-западная область района исследований характеризовалась интенсивным развитием сальп и умеренным развитием криля, заносимого из моря Беллинсгаузена при преобладании ветров западных румбов. В более южных районах криль полностью отсутствовал, при этом в самом южном районе были встречены лишь сальпы.
ЗАКЛЮЧЕНИЕ
В северной глубоководной части пролива Брансфилда, биомасса зоопланктона составляла 3087.9 мг/м3, в центральной зоне материкового склона – 70.6 мг/м3, в шельфовой зоне – 2542.2 мг/м3. Повсеместно основу зоопланктона составляли сальпы (S. thompsoni, I. racovitzai), доля которых по биомассе в различных районах пролива Брансфилд варьировала от 96.6% до 99.6%. Криль (E. superba) встречался только в глубоководном районе пролива, где его средняя биомасса составляла от 6.3 до 96.3 мг/м3. Согласно индексу ИЦЗ, виды S. thompsoni и I. racovitzai преобладали в зоопланктоне, следующим по значению компонентом был криль E. superba, доля других видов была незначительной. Сравнение полученных нами данных побиомасссальп и криля с данными 1990-х и 2000-х годов, демонстрирует динамику возрастанияроли сальп в планктонных сообществах по отношению к E. superba, что определяется пищевой конкуренцией. Среди взрослых особей E. superba установлено преобладание размерной группы 42–45 мм, доля молоди составляла 31.5% общей численности вида. Биомасса мезозоопланктона во всех районах пролива распределялась равномерно и была относительно низкой. Не было выявлено достоверной корреляции между биомассойсальп и криля и биомассой отдельных видов зоопланктона с одной стороны, и температурой и соленостью – с другой. Отсутствие достоверной корреляции между биомассой криля и сальп, вероятно, объясняется определяющим влиянием течений в данном районе на распределение этих компонентов пелагического сообщества. В период исследования преобладали ветра западных румбов, что и вызвало занос крупноразмерных особей криля из моря Беллинсгаузена.
Источники финансирования. Исследование проведено в рамках государственного задания ФИЦ Институт биологии южных морей РАН им. А.О. Ковалевского “Комплексные исследования современного состояния экосистемы Атлантического сектора Антарктики” (Номер гос. Регистрации АААА-А19-119100290162-0), темы государственного задания 0128-2019-0008 и договора о сотрудничестве между ИО РАН и ВНИРО.
Благодарности. Выражаем искреннюю признательность капитану Сазонову Л.В. и экипажу НИС “Академик Мстислав Келдыш” за помощь и слаженную работу в рейсе, к. ф.-м. н. Фрею Д.И. за предоставление данных по гидрологическим показателям.
Список литературы
Артамонов Ю.В., Романов А.С., Внуков Ю.Л., Перов А.А., Степура И.И. Результаты океанографических исследований в западной части пролива Брансфилда в марте 2002 г. // Украинский антарктический журнал, 2003. №1. С. 7–16.
Жук Н.Н., Корзун Ю.В. Размерный состав антарктического криля Euphausia superb (Euphausiacea, Euphausiidae) и гидрометеорологические факторы в проливе Брансфилд (подрайон 48,1 антарктический полуостров) в сезоны 2014–2017 гг. // Вестник Керченского государственного морского технологического университета. 2018. С. 28–38.
Методические указания по сбору и первичной обработке в полевых условиях по биологии и распределению криля. М.: ВНИРО. 1982, 48 с.
Минкина Н.И., Самышев Э.З. Энергетический метаболизм антарктической сальпы (Salpa thompsoni Foxton) в гетерогенном океанографическом поле // Мониторинг состояния природной среды Антарктики и обеспечение деятельности национальных экспедиций: материалы I Межд. научн.-практ. конф. (26–29 мая 2014 г., к.п. Нарочь, Беларусь). Минск: Экоперспектива, 2014. С. 159–164.
Мордухай-Болтовской Ф.Д. Методика изучения биоценозов внутренних водоемов. Москва : Наука, 1975. 240 с.
Морозов Е. Г. Течения в проливе Брансфилд // Доклады Академии наук. 2007. Т. 415. Вып. 6. С. 823–825.
Пахомов Е.А. Вертикальное распределение и суточные миграции Антарктического макропланктона. В кн.: Воронина Н. М. (ред.) Пелагические экосистемы Южного океана. М.: Наука, 1993. С. 146–150.
Самышев Э.З. Антарктический криль и структура планктонного сообщества в его ареале. М.: Наука, 1991. 168 с.
Спиридонов В.А. Исследования возрастной структуры популяции Euphausia superba Dana на примере района Антарктического полуострова и сопредельных вод // Биологические ресурсы Арктики и Антарктики. М.: Наука, 1987. С. 391–414.
Catalan I.A., Morales-Nin B., Company J.B. et al. Environmental influences on zooplankton and micronekton distribution in the Bransfield Strait and adjacent waters // Polar Biology. 2008. V. 31. No. 6. P. 691–707. https://doi.org/10.1007/s00300-008-0408-1
Garcia M.A., Castro C.G., Rfos A.F. et al. Water masses and distribution of physicochemical properties in the Western Bransfield Strait and Gerlache Strait during Austral summer 1995/96 // Deep-sea Research II. 2002. V. 49. P. 585–602. doi.org/10.1016/S0967-0645(01)00113-8
Dubischar C., Bathmann U.V. Grazing impact of copepods and salps on phytoplankton in the Atlantic sector of the Southern Ocean // Deep-sea Research II. 1997. V. 44. P. 415–433. https://doi.org/10.1016/S0967-0645(96)00064-1
Hofmann E.E., Klinck J.M., Locarninii R.A. et al. Krill transport in the Scotia Sea and environs // Antarctic Science.1998. V. 10. No 4. P. 406–415. https://doi.org/10.1017/S0954102098000492
Huntley M.E., Sykes P.F., Marin V. Biometry and trophodynamics of Salpathompsoni Foxton (Tunicata: Thaliacea) near the Antarctic Peninsula in austral summer, 1983-1984 // Polar Biology. 1989. Vol. 10. P. 59–70. https://doi.org/10.1007/BF00238291
Hernandez-Leon S, Torres S, Gomez M.et al. Biomass and metabolism of zooplankton in the Bransfield Strait (Antarctic Peninsula) during austral spring // Polar Biology. 1999. V. 21. No 4. P. 214–219. https://doi.org/10.1007/s003000050355
Ichii T., Naganobu M. Surface water circulation in krill fishing areas near the South Shetland Islands // CCAMLR Science. 1996. V. 3. P. 125–136.
Loeb V., Siegel V., Holm-Hansen O.et al. Effects of sea-ice extent and krill or salp dominance on the Antarctic food web // Nature. 1997. V. 387. P. 897–900. https://doi.org/10.1038/43174
Pakhomov E.A., Dubischar C.D., Hunt B.P.V. et al. Biology and life cycles of pelagic tunicates in the Lazarev Sea, Southern Ocean // Deep-sea Research II. 2011. V. 58. P. 1677–1689. https://doi.org/10.1016/j.dsr2.2010.11.014
Pakhomov E.A., Froneman P.W., Perissinotto R. Salp/ krill interactions in the Southern Ocean: spatial segregation and implications for the carbon flux // Deep-sea Research II. 2002. V. 49. P. 1881–1907. https://doi.org/10.1155/2010/410129
Piatkowski U. Macroplankton communities in Antarctic surface waters: spatial changes related to hydrography.//Marine Ecology Progress Series. 1989. V. 55. P. 251–259. https://doi.org/10.3354/meps055251
Makarov R.R., Denys C.J. Stages of sexual maturity of Euphausiasuperba Dana // BIOMASS Handbook. 1980. Iss. no 11. 11 p.
Murray A.W.A., Watkins J.L., Bone D.G. A biological acoustic survey in the marginal iceedge zone of the Bellingshausen Sea // Deep-sea Research II. 1995. V. 42. P. 1159–1175. doi.org/1021016/0967-0645(95)00059-Y
Nishikawa J., Naganobu M., Ichii T. et al. Distribution of salps near the South Shetland Islands during austral summer, 1990-1991 with special reference to krill distribution // PolarBiology. 1995. V. 15, pp. P. 31–39. https://doi.org/10.1007/BF00236121
Santora J.A., Reiss C.S., Loeb V.J., Veit R.R. Spatial association between hotspots of baleen whales and demographic patterns of Antarctic krill Euphausiasuperba suggests size-dependentpredation // Marine Ecology Progress Series. 2010. V. 405. P. 255–269. https://doi.org/10.3354/meps08513
Siegel V.A.Concept of seasonal variation of krill (Euphausia superba) distribution and abundance west of the Antarctic Peninsula. In: Antarctic ocean and resources variability. D. Sahrhage (Ed.), 1988. P. 219–230. doi.org/10.1007/978-3-642-73724-4 19
Siegel V. Biology and ecology of Antarctic krill // Advances in Polar Ecology. 2016. 458 p. https://doi.org/10.1007/978-3-319-29279-3
Siegel V. Distribution and population dynamics of Euphausia superba: summary of recent findings // Polar Biololy. 2005. V. 29. P. 1–22. https://doi.org/10.10077s00300-005-0058-5
Siegel V., Harm U. The composition, abundance, biomass and diversity of the epipelagic zooplankton communities of the southern Bellingshausen Sea (Antarctic) with special reference to krill and salps // Archive of fishery and marine research. 1996. V. 44. P. 115–139.
Standard measurements for krill, fish, crabs and squid in: Scientific Observers Manual: CCAMLR, 2006, pp. 33–45.
Vazquez E., Ameneiro J., Putzeys S. et al. Distribution of meroplankton communities in the Bransfield Strait, Antarctica // Marine Ecology Progress Series. 2007. V. 338. P. 119–129. https://doi.org/10.3354/meps338119
Zhou M., Niiler P.P., Hu J-H. Surface currents in the Bransfield and Gerlache Straits, Antarctica // Deep-sea Research I. 2002. V. 49. P. 267–280. https://doi.org/10.1016/s0967-0637(01)00062-0
Zhou M., Niiler P.P., Zhu Y., Dorland R.D. The western boundary current in the Bransfield Strait, Antarctica // Deep-sea Research I. 2006. V. 53. P. 1244–1252.https://doi.org/1021016/j.dsr.20062042003
Дополнительные материалы отсутствуют.