Приборы и техника эксперимента, 2022, № 3, стр. 121-125
Техника регистрации спектров флуоресценции биоактивных препаратов и их математическая обработка
А. Д. Кудрявцева a, *, М. Ф. Умаров b, **
a Физический институт им. П.Н. Лебедева РАН
119991 Москва, Ленинский просп., 53, Россия
b Вологодский государственный университет
160001 Вологда, ул. Ленина, 15, Россия
* E-mail: kudryavcevaad@lebedev.ru
** E-mail: umma54@rambler.ru
Поступила в редакцию 27.12.2021
После доработки 06.01.2022
Принята к публикации 09.01.2022
- EDN: YJYEBW
- DOI: 10.31857/S0032816222030119
Аннотация
Разработана техника регистрации спектров флуоресценции биоактивных препаратов, позволяющая проводить экспресс-анализ молекулярных структур различных классов. Предложен программный пакет для анализа и обработки получаемых спектров. Построены корреляционные функции для идентификации лекарственных препаратов различных производителей. Показано, что рассчитанные корреляционные функции позволяют с высокой точностью получить информацию о соответствии испытуемого образца эталону.
ВВЕДЕНИЕ
На сегодняшний день наблюдается явная тенденция исследования спектров вторичного излучения сложных молекулярных соединений. Во многих лабораториях проводятся эксперименты, целью которых является использование методов вторичного излучения для анализа веществ. В большинстве случаев исследователи рассматривают непосредственные приложения своих исследований к интересующей их отрасли, например: биомедицине, фармакологии и промышленному производству. Так, в работах [1, 2] из лаборатории Эдинбургской инженерной школы сравниваются несколько методов анализа веществ (биологических препаратов) с использованием как оптоволоконной технологии, так и пробирки и микроскопа. Отмечено, что спектроскопия комбинационного рассеяния является мощным орудием для изучения состава сложных объектов, в том числе взрывчатых веществ [3]. В работе [4] было предложено для проведения экспресс-сканирования веществ использовать зонды с различным торцевым покрытием для улучшения передачи излучения фемтосекундного лазера. В работах [5, 6] предлагается использовать схемы с оптоволоконным зондированием для получения спектров вторичного излучения и представлен расчет эффективности методики. В отличие от предложенной нами методики регистрации спектров вторичного излучения, в вышеприведенных работах используются сложные экспериментальные устройства больших габаритов.
Целью данной работы являлось получение, анализ и математическая обработка спектров анализируемых и номинальных биоактивных препаратов на примере коммерческих фармацевтических препаратов от различных производителей. Поставленные задачи решались на основе использования волоконно-оптической методики [7, 8], развиваемой в лаборатории “Комбинационное рассеяние” Физического института им. П.Н. Лебедева РАН. Математическая обработка и анализ флуоресцентных спектров осуществлялись с помощью программного пакета “FSD Soft”.
МЕТОДИКА ЭКСПЕРИМЕНТА
В качестве объектов исследования были выбраны типичные фармацевтические препараты: цитрамон, анальгин, аспирин и парацетамол. В структуре всех исследованных веществ присутствуют ароматические кольца, что приводит к фундаментальному электронному поглощению в среднем ультрафиолетовом диапазоне. Соответственно в этих веществах наблюдается флуоресценция в фиолетово-красном диапазоне при возбуждении коротковолновым (266 нм) электромагнитным излучением [9]. Нами был использован способ регистрации флуоресцентных спектров с применением схем “на отражение” (рис. 1). В данной схеме полезный сигнал от образца собирается практически в той же точке, из которой выходит возбуждающее излучение из смежного световода. Преимуществом данного способа регистрации является сильное ослабление возбуждающего излучения, проходящего “вперед”, в то время как вторичное излучение собирается вторым световодом “назад”.
Рис. 1.
Схема “на отражение” с одноканальным зондом для регистрации спектров вторичного излучения биоактивных соединений. 1, 2, 7 – зеркала; 3 – активный элемент; 4 – “накачка”; 5 – нелинейный кристалл; 6 – линза; 8 – конденсор; 9 – фиксатор световода; 10, 11 – световоды; 12 – спектрограф; 13 – зонд; 14 – анализируемый образец; 15 – компьютер.
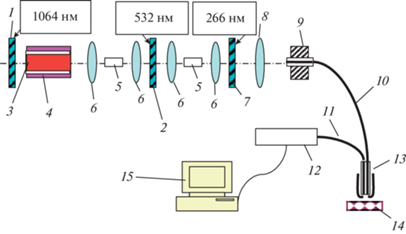
В качестве источника возбуждающего ультрафиолетового излучения использовалась четвертая гармоника (266 нм) лазера на алюмоиттриевом гранате, генерирующего импульсно-периодическое излучение с длиной волны 1064 нм. Средняя мощность возбуждающего ультрафиолетового излучения на поверхности анализируемого препарата составляла 10 мВт, что позволяло осуществлять анализ объекта без какой-либо его деструкции.
Небольшое количество анализируемого вещества в виде таблетки помещалось в кювету 14 (см. рис. 1). Кварцевые световоды 10, 11 использовались соответственно для подведения ультрафиолетового излучения к веществу и для отведения возникающего в анализируемой пробе вторичного излучения к малогабаритному спектральному прибору 12. При этом пространственное разрешение на поверхности анализируемой пробы составляло 0.1 мм.
В качестве спектрального прибора использовался миниспектрометр FSD-8. Прилагаемое к нему программное обеспечение “FSD Soft” предназначено для реализации совместной работы миниспектрометра с компьютером в среде WindowsXP, Windows 2000. Данное программное обеспечение позволяет непосредственно из окна программы выбрать режим сканирования (дискретный или непрерывный); установить время засветки оптического датчика, что определяет чувствительность прибора; а также усреднить измеренный спектр в случае сильного зашумления измеряемого излучения.
Внешний вид окна программы с подключенным прибором FSD-8 показан на рис. 2. Программа имеет два рабочих окна: первое – для отображения графиков спектра, второе – для вывода графиков интегральных составляющих спектральной характеристики. В самой верхней части окна расположено меню программы, а ниже – панель инструментов, имеющая стандартные кнопки управления. Перемещение мышки по рабочей области окна указывает на соответствующие координаты внутри графической информации. Горизонтальная ось в верхней рабочей части окна отображения графиков спектра – это ось длины волны (W), проградуированная в нанометрах; слева вертикальная ось – ось интенсивности (I) исследуемого излучения. В нижней части окна расположен монитор перемещений и оперативный контроль цветов исследуемых графиков.
В правой части окна размещена панель управления процессом измерений, имеющая несколько органов управления. В самой верхней части панели находится индикатор подключенного устройства. Ниже на панели расположены закладки “Измерение” и “Обработка”.
В процессе измерений есть вероятность появления сильно зашумленного сигнала. Например, это может иметь место при очень слабом сигнале и большом времени экспозиции. Для сглаживания характеристики отображаемого графика спектра исследуемого сигнала введена опция динамического осреднения измеренных значений, осреднение происходит в момент считывания информации с датчика. Следует отметить, что осреднение проводится по заданному числу точек графика. Кроме того, в программе присутствует инструмент, который работает исключительно с последним статическим графиком.
В программе также предусмотрено выполнение таких действий, как вычитание и деление между двумя графиками.
Программа обеспечивает сохранение полученных результатов в графических, текстовых и табличных форматах.
В программе “FSD Soft” все графические и математические операции предусмотрены только в формате базы данных EXCEL.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Нами были получены нормированные спектры флуоресценции четырех указанных выше фармацевтических препаратов [10]: аспирина (рис. 3a), цитрамона (рис. 3б), анальгина (рис. 3в) и парацетамола (рис. 3г). Согласно рис. 3, у всех анализируемых фармацевтических препаратов в фиолетово-красной области спектра наблюдаются структурированные полосы флуоресценции, форма которых несущественно различается, по крайней мере, для цитрамона и аспирина, а также для анальгина и парацетамола.
Рис. 3.
Нормированные спектры вторичного излучения: аспирина (a), цитрамона (б), анальгина (в) и парацетамола (г), полученные при возбуждении ультрафиолетовым излучением четвертой гармоники (266 нм) импульсно-периодического лазера на алюмоиттриевом гранате.

Для установления количественного различия спектров, полученных для различных фармацевтических препаратов, нами были построены корреляционные функции $K_{X}^{A}$(λ) (рис. 4) с использованием следующего соотношения [11]:
(1)
$K_{X}^{A}({{\lambda }}) = 1 - \left| {{{i}_{X}}({{\lambda }}) - {{i}_{A}}({{\lambda }})} \right|,$Кроме того, были вычислены соответствующие коэффициенты корреляции $K_{X}^{A}$ (см. рис. 4) анализируемых препаратов по отношению к аспирину по формуле:
(2)
$K_{X}^{A} = \frac{1}{N}\sum\limits_{i = 1}^{i = N} {K_{X}^{A}} \left( {{{{{\lambda }}}_{i}}} \right),$Рис. 4.
Корреляционные спектры: цитрамона (а), анальгина (б) и парацетамола (в) – при их сравнении со спектром флуоресценции аспирина.

Как видно из рис. 4, корреляционные спектры дают количественную информацию о различиях в спектрах флуоресценции, что позволяет однозначно отнести анализируемый препарат к заданному виду, а также осуществлять контроль качества коммерческих фармацевтических препаратов. Кроме того, разработанная методика хорошо апробирована для анализа спектров фотолюминесценции и комбинационного рассеяния ароматических аминокислот [12, 13].
ЗАКЛЮЧЕНИЕ
Таким образом, в данной работе на примере близких по структуре фармацевтических препаратов (цитрамона, аспирина, анальгина и парацетамола) показано, что для количественного неразрушающего контроля молекулярного состава и структуры биоактивных препаратов, содержащих ароматические кольца, может быть эффективно использован метод флуоресцентного анализа, дополненный построением соответствующих корреляционных функций. Разработанный метод корреляционной флуоресцентной спектроскопии может быть использован также для количественного контроля степени соответствия эталону диэлектрических объектов, люминесцирующих при ультрафиолетовом возбуждении, спектральные характеристики которых в цифровом виде введены в базу данных. Для математической обработки и анализа флуоресцентных спектров биоактивных препаратов необходим программный пакет “FSD Soft”.
Список литературы
Downes A., Elfick A. // Journal Sensors. 2010. V. 10. № 3. P. 1871. https://doi.org/10.3390/s100301871
Sikirzhytski V., Virkler K., Lednev I.K. // Journal Sensors. 2010. V. 10. № 4. P. 2869. https://doi.org/10.3390/s100402869
Holthoff E.L., Stratis-Cullum D.N., Hankus M.E. // Journal Sensors. 2011. V. 11. № 3. P. 2700. https://doi.org/10.3390/s110302700
Xiaodong M., Huo H., Wang W., Tian Y., Wu N., Guthy C., Shen M., Wang X. // Journal Sensors. 2010. V. 10. № 12. P. 11064. https://doi.org/10.3390/s101211064
Notingher I. // Journal Sensors. 2007. V. 7. № 8. P. 1343. https://doi.org/10.3390/s7081343
Bao X., Chen L. // Journal Sensors. 2012. V. 12. № 7. P. 8601. https://doi.org/10.3390/s120708601
Бортников К.С., Горелик В.С., Есаков А.А. // Неорганические материалы. 2007. Т. 43. № 12. С. 1458.
Gorelik V.S., Ivicheva S.N., Kargin Yu.F., Filatov V.V. // Inorganic Materials. 2013. V. 49. № 7. P. 685. https://doi.org/10.1134/S0020168513060046
Войнов Ю.П., Горелик В.С., Умаров М.Ф., Юрин М.Е. Патент на изобретение № 2488097 РФ // Опубл. 20.07.2013. Бюл. № 20.
Voinov Y.P., Gorelik V.S., Pyatyshev A.Y., Umarov M.F. // Bulletin of the Lebedev Physics Institute. 2012. V. 39. № 12. P. 341. https://doi.org/10.3103/S1068335612120044
Voinov Y.P., Gorelik V.S., Umarov M.F., Morozova S.V. // Bulletin of the Lebedev Physics Institute. 2011. V. 38. № 11. P. 323. https://doi.org/10.3103/S1068335611110029
Gorelik V.S., Umarov M.F. // Opt. Spectrosc. 2018. V. 125. № 1. P. 144. https://doi.org/10.1134/S0030400X18070111
Gorelik V.S., Voinov Y.P., Umarov M.F. // Opt. Spectrosc. 2019. V. 127. № 4. P. 596. https://doi.org/10.1134/S0030400X19100096
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента



