Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 151-157
Антимикробные пептиды алкалофильных грибов Emericellopsis alkalina: биосинтез и биологическая активность в отношении патогенных грибов с множественной резистентностью
А. А. Баранова 1, Е. А. Рогожин 1, 3, М. Л. Георгиева 1, 2, Е. Н. Биланенко 2, А. Б. Кулько 4, А. В. Якушев 2, В. А. Алфёрова 1, В. С. Садыкова 1, *
1 “Научно-исследовательский институт по изысканию новых антибиотиков имени Г.Ф. Гаузе”
119021 Москва, Россия
2 Московский государственный университет имени М.В. Ломоносова
119234 Москва, Россия
3 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
117997 Москва, Россия
4 Московский городской научно-практический центр борьбы с туберкулезом Департамента
здравоохранения города Москвы
107076 Москва, Россия
* E-mail: sadykova_09@mail.ru
Поступила в редакцию 27.04.2018
После доработки 17.09.2018
Принята к публикации 25.09.2018
Аннотация
Изучена способность 22 штаммов вида Emericellopsis alkalina к синтезу антимикробных пептаиболов А118-35, А118-36 и А118-37, обладающих антифунгальной активностью. Способность синтезировать пептаиболы характерна для 72% исследованных штаммов вида. Установлено, что продукция пептаиболов является штаммоспецифичным признаком и зависит от условий культивирования и концентрации источников углерода – сахаров. Выделенный пептаибол А118-37 обладал активностью в отношении условно-патогенных дрожжей Candida albicans и плесневого гриба Apergillus niger, а также клинических изолятов грибов – возбудителей микозов с множественной резистентностью.
Несмотря на очевидные успехи в области разработки методов диагностики и лечения, инфекционные заболевания, по данным Всемирной организации здравоохранения, остаются в числе основных причин смертности населения. В последнее время наблюдается значительный рост различных форм оппортунистических глубоких и поверхностных микозов с хроническим течением, особенно среди иммунокомпрометированных больных. К настоящему времени имеются сведения уже о более чем 400 видах патогенных для человека плесневых и дрожжевых грибов, и ежегодно этот список увеличивается, а клинически значимые изоляты способны приобретать резистентность к уже известным антимикотикам [1, 2].
Природные антимикробные пептиды были и остаются одними из важнейших эффективных соединений за счет широкого спектра действия в отношении условно-патогенных и патогенных бактерий и грибов, низкой токсичности и отсутствия формирования резистентности. Среди этой группы соединений с антибиотическими свойствами, наибольший интерес представляют пептаиболы (липопептаиболы, липоаминопептаиболы, липоаминопептиды) – семейство мембранно-активных пептидных антибиотиков, содержащих ряд нестандартных аминокислотных остатков (например, альфа-аминоизомасляная кислота), без дисульфидных связей, имеющих преимущественно спиральную конформацию (при интеграции в мембрану) и содержащих диалкиламинокислоты и аминоспирты [3]. Особо перспективен поиск этой группы веществ среди мицелиальных грибов, выделенных из морских и пресноводных местообитаний, эндофитов, ассоциантов беспозвоночных животных, водорослей [4–6].
Экстремальные биотопы, подобные содовым солончакам, являются местом активного поиска грибов, обладающих высокой биологической активностью. Видовое разнообразие мицелиальных грибов в содовых солончаках небольшое, однако те из них, которые приспособились к подобным экстремальным условиям, развиваются массово. Среди доминирующих таксонов преобладают облигатный алкалофил Sodiomyces alkalinus, приуроченный к почвам с содовым засолением и факультативный алкалофил Emericellopsis alkalina, развивающийся, помимо содовых солончаков, в засоленных почвах [7, 8].
Грибы рода Emericellopsis давно известны как продуценты антимикробных пептидов группы пептаиболов, наиболее изученными являются 4 гомолога зервамицина, бергофунгины и эмеримицины [5, 6]. Новый вид Emericellopsis alkalina был впервые описан в 2013 г., его изоляты выделены из содовых солончаков Кулундинской степи и Забайкалья (Россия) [7]. Проведенный первичный скрининг среди изолятов этого вида выявил наличие антимикробной активности у 10 штаммов, три из которых показали антифунгальное действие в отношении условно-патогенных микромицетов. Один из них (E. alkalina штамм А118) продуцировал три антимикробных соединения, которые, по результатам первичной структурной характеристики, были отнесены к группе нерибосомальных мембранно-активных пептидов: А118-35, А118-36, А118-37. Среди них А118-37 обладал высокой фунгицидной активностью к плесневым условно-патогенным грибам – Candida а-lbicans, Aspergillus niger и А. fumigatus [6]. Выделенная группа пептаиболов при этом не оказывала выраженного бактерицидного действия в отношении грамположительных бактерий.
Цель работы – оценка способности к синтезу активного вещества – пептаибола А118-37 у штаммов алкалофильного аскомицета Emericellopsis alkalina, выделенных из разных географических регионов, подбор условий культивирования для максимального выхода целевого продукта и оценка его перспективности как нового антимикотика, активного в отношении патогенных грибов со множественной резистентностью.
МЕТОДИКА
Работу проводили с 22 штаммами Emericellopsis alkalina из коллекции “Грибы экстремальных местообитаний” кафедры микологии и альгологии биологического факультета МГУ им. М.В. Ломоносова (Россия). Часть изолятов была депонирована во Всероссийской коллекции микроорганизмов (ВКМ, Пущино, Россия) и Центре биоразнообразия грибов (CBS, Fungal Biodiversity Centre, Утрехт, Нидерланды). Определение таксономического статуса штаммов, сделанное при описании вида [7], подтвердило, что все штаммы, используемые в данной работе, принадлежали виду Emericellopsis alkalina Bilanenko & Georgieva.
Способность к синтезу активного пептаибола А118-37 оценивали при выращивании на специализированной щелочной среде, которая, по полученным ранее данным, обеспечивала максимальный выход целевого вещества [6].
Для двух отобранных штаммов исследовали образование активного вещества А118-37 при культивировании тремя различными способами. Культуры выращивали глубинным способом (на качалке 10 и 14 сут при 110 об./мин), комбинированным (7 сут на качалке, затем 7 сут в стационарных условиях) и поверхностным способом в течение 14 сут при 26°С. Культуральную жидкость (КЖ) отделяли фильтрацией через мембранные фильтры на воронке Зейца под вакуумом.
Для выделения антибиотических веществ КЖ продуцентов экстрагировали этилацетатом в соотношении органический растворитель : КЖ 1 : 5 3 раза. Полученные экстракты упаривали в вакууме на роторном испарителе “Rotavapor‑RBüchi” (Швейцария) при 42°C досуха, остаток растворяли в водном 70%-ном этаноле и получали спиртовые концентраты. Антимикробную активность определяли в исходной КЖ, в спиртовых экстрактах КЖ и экстрактах мицелия с помощью стерильных бумажных дисков (“НИИ Пастера”, Россия), смоченных в экстрактах и высушенных в стерильных условиях. В качестве контроля использовали стандартные диски с амфотерицином В для грибов (80 мкг/мл, “НИИ Пастера”, Россия) и ампициллином для бактерий (10 мкг/мл, “НИИ Пастера”, Россия) [9].
Спектр антимикробной активности гидрофобных и гидрофильных фракций определяли на тест-культурах микроскопических грибов и грамположительных бактериях из коллекции культур НИИ по изысканию новых антибиотиков: A. niger INA 00760, Candida albicans АТСС 2091 и Bacillus subtilis АТСС 6633.
Дальнейшее разделение экстрактов проводили методом аналитической обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) с использованием колонки XBridge 5 мкм 130 Å размером 250 × 4.6 мм (“Waters”, Ирландия). Элюент А − 0.1%-ная трифторуксусная кислота (ТФУ), в воде MQ; элюент В – 80%-ный ацетонитрил c 0.1%-ным водным раствором ТФУ при скорости потока 950 мкл/мин.
Для ОФ-ВЭЖХ использовали ультраградиентный ацетонитрил фирмы “Panreac” (Испания) и ТФУ производства “Sigma-Aldrich” (США). Детектирование разделяемых веществ осуществляли при длине волны 214 нм в градиенте концентрации элюента В: 16–28% – за 12 мин; 28–55% – за 27 мин; 55–75% – за 20 мин и 75–85% – за 10 мин, с последующим изократическим элюированием в течение 25 мин. Полученные в ходе ОФ-ВЭЖХ фракции, соответствующие отдельным пикам, собирали вручную, затем избыток органического растворителя (ацетонитрила) удаляли упариванием на вакуумной центрифуге SpeedVac (“Savant”, США). Спектр антимикробного действия веществ, содержащихся во фракциях, определяли диско-диффузионным методом, как описано выше.
Спектр антимикотического действия пептаибола А118-37 также оценивали на клинических изолятах мицелиальных и дрожжевых грибов − возбудителей оппортунистических пневмомикозов бронхов и легких у больных туберкулезом, обладающих мультирезистентностью по отношению к применяемым в клинической практике антибиотикам-азолам, из коллекции микологической лаборатории Московского городского научно-практического центра борьбы с туберкулезом (Россия): C. albicans 1582 м, C. glabrata 1402 м, C. tropicalis 1402 м, C. krusei 1447 м, Saccharomyces cerevisiae 77 м, Cryptococcus laurentii 801м, Aspergillus fumigatus 163 м, A. flavus 905 м, A. terreus 1133 м, A. ochraceus 497 м, A. niger 219, Curvularia hawaiiensis (syn. Bipolaris hawaiiensis) 988 м.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При сравнительном анализе 22 штаммов было обнаружено, что способность к синтезу пептаибола А118-37 на специализированной щелочной среде в следовых количествах наблюдалась у 72% штаммов (16 из 22), а у двух из них (А118 и М20) вещество накапливалось в количестве от 16 до 22% в расчете на сухую массу экстракта.
Культуры E. alkalina были выделены из проб, взятых в различных регионах, из различных субстратов (растения, почвы разного типа засоления) [7]. Скрининг штаммов на присутствие пептида А118-37 и его гомологов подтвердил, что способность продуцировать искомое соединение является штаммоспецифичным признаком. Например, оба штамма из Монголии его не имели и были неактивны в отношении всех исследованных тест-организмов. Среди активной группы культур из Кулундинской степи (Россия) были обнаружены штаммы с выраженной фунгицидной активностью, способные к продукции данного вещества и его гомологов в количествах, в несколько раз меньших, чем у штамма А118. Причем некоторые из изученных штаммов (Е101, А116 и М14) продуцировали только гомологи, а некоторые только основное вещество (А103, А114, А120, А121) (табл. 1).
Таблица 1.
Присутствие пептаиболов А118-35/36/37 и проявление антифунгальной активности в отношении условно-патогенных грибов штаммами E. alkalina
| Регион выделения | № изолята | № в ВКМ/ CBS | Присутствие А118-37 | Присутствие гомологов А118-35 и А118-36 |
Диаметр зон подавления, мм | |
|---|---|---|---|---|---|---|
| A.niger INA 00760 | C.albicans АТСС 2091 |
|||||
| Кулундинская степь | Е101 | BKM F-4108; CBS 127350 | – | + | 10 ± 0.2 | 0 |
| А103 | + | – | 18 ± 0.1 | 15 ± 0.1 | ||
| А114 | BKM FW-1473 | + | – | 25 ± 0.6 | 12 ± 0.6 | |
| А115 | BKM FW-1474 | – | – | 0 | 0 | |
| А116 | – | + | 10 ± 0.4 | 0 | ||
| А117 | BKM FW-1471 | – | – | 0 | 0 | |
| А118 | + | + | 26 ± 0.1 | 28 ± 0.6 | ||
| А119 | – | – | 0 | 0 | ||
| А120 | + | – | 12 ± 0.1 | 0 | ||
| А121 | BKM FW-1475 | + | – | 13 ± 0.4 | 9 ± 0.1 | |
| А122 | – | – | 0 | 0 | ||
| А123 | – | – | 0 | 0 | ||
| А124 | – | – | 0 | 0 | ||
| М14 | BKM F-3905; CBS 120043 |
– | + | 0 | 0 | |
| М20 | BKM FW-3040; CBS 120044 |
+ | + | 26 ± 0.1 | 28 ± 0.6 | |
| Забайкалье | А125 | – | – | 0 | 0 | |
| А126 | BKM FW-1472 | + | + | 12 ± 0.1 | 0 | |
| А127 | – | – | 0 | 0 | ||
| А128 | + | + | 14 ± 0.1 | 10 ± 0.1 | ||
| М71 | BKM F-3907; CBS 120049 |
– | – | 0 | 0 | |
| Монголия | А112 | – | – | 0 | 0 | |
| А113 | BKM FW-1476 | – | – | 0 | 0 | |
В процессе исследования было установлено, что антибиотическая активность оставалась у КЖ и после проведения экстракции этилацетатом у 59% штаммов (13 из 22). Если для целевого вещества и гомологов детектировалась преимущественно антифунгальная активность [6], то гидрофильные постэкстракционные фракции ингибировали, в основном, рост грамположительных бактерий B. subtilis (табл. 2). Для трех штаммов (А125 из Забайкалья и А115, А117 из Кулундинской степи), у которых в экстракционных фракциях отсутствовали пептаиболы, водорастворимые постэкстракционные фракции оказались активны в отношении бактериальных тест-организмов.
Таблица 2.
Количество штаммов, синтезирующих пептаиболы и водорастворимые антибиотики, активных в отношении условно-патогенных грибов и бактерий
| Регион выделения | ∑ | Штаммы, синтезирующие А118-37 | Штаммы, имеющие активную гидрофильную фракцию | Количество штаммов, подавляющих тест-организм | |||||
|---|---|---|---|---|---|---|---|---|---|
| гидрофильная фракция | пептаиболы А118-37 и гомологи | ||||||||
| A. niger INA 00760 |
B. subtilis АТСС 6633 |
C. albicans АТСС 2091 |
A. niger INA 00760 |
B. subtilis АТСС 6633 |
C. albicans АТСС 2091 |
||||
| Кулундинская степь | 15 | 6 | 9 | 4 | 9 | 4 | 6 | 2 | 6 |
| Забайкалье | 5 | 3 | 4 | 0 | 4 | 0 | 3 | 0 | 3 |
| Монголия | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| ∑ | 22 | 8 | 13 | 4 | 13 | 4 | 8 | 14 | 8 |
При сравнительном анализе антифунгальной активности штаммов из образцов солончаков разных географических зон была установлена корреляция между повышенным содержанием солей в образце и способностью штамма к синтезу вещества А118-37 и его гомологов. Так, штаммы, выделенные из экотопов с большей соленостью (содержание солей от 100 до 350 г/кг), обладали средней или высокой антимикотической активностью, и все они синтезировали искомые пептаиболы. Для штаммов, выделенных из почв с содержанием солей ниже 53 г/кг почвы, антифунгальная активность отсутствовала во фракциях органических растворителей, и не было выявлено целевых соединений. Схожие результаты о влиянии солевого стресса на изменение в биосинтезе вторичных метаболитов у мицелиальных грибов – продуцентов антибиотиков, были недавно получены большой группой исследователей из шести разных лабораторий [10]. Сравнительный анализ морских и почвенных штаммов гриба-продуцента A-spergillus aculeatus в условиях физиологического стресса (повышенной солености среды), показал его влияние на количество и состав вторичных метаболитов. Синтез ряда биологически активных веществ (акулины, аспергиллуол, секалоновая кислота) активируется у штаммов, выделенных и культивируемых в условиях повышенной солености [10–12].
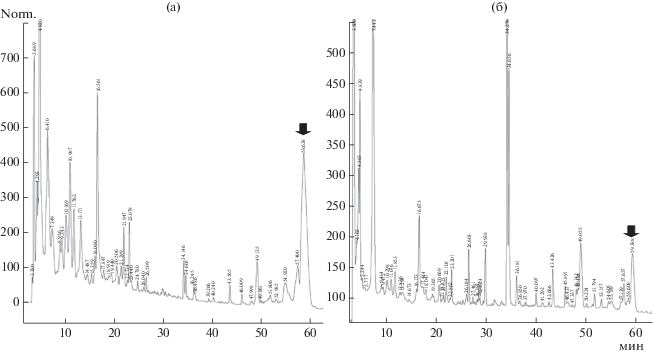
Самыми продуктивными по количеству пептаибола А118-37 и его гомологов оказались два штамма (А118 и М20), изолированные из почв содово-хлоридного типа засоления побережья озера Желтырь (Кулундинская степь, Россия). Эти штаммы различались между собой некоторыми культурально-морфологическими признаками (количество воздушного мицелия, его окраска), но имели практически идентичный спектр антибиотической активности и профиль гидрофобных компонентов при хроматографии методом ВЭЖХ (рис. 1).
Рис. 1.
Сравнение профилей этилацетатных экстрактов E. alkalina штаммов A118 (а) и М20 (б). Стрелкой отмечено вещество А118-11/37.
С целью дальнейшей разработки технологии получения пептаиболов и оптимизации их биосинтеза проводили подбор способов культивирования для этих двух штаммов. Выращивание продуцентов осуществляли поверхностным, глубинным и комбинированным способами с разным содержанием источника редуцирующих сахаров в щелочной среде (количество мальтакса-10 составляло – 10, 20 и 40 г/л).
При глубинном способе выращивания пептаиболы не синтезировались вне зависимости от штамма. При комбинированном способе культивирования пептаибол А118-37 синтезировался в следовых количествах на 12–14 сут.
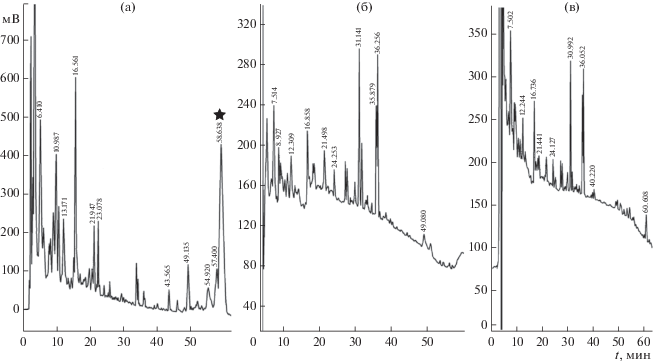
Оптимальным способом культивирования для обоих штаммов, обеспечивающим стабильный синтез пептаибола А118-37 в среде, был поверхностный, при добавлении мальтакса-10 в количестве 40 г/л (рис. 2). При этом штамм А118 синтезировал максимальное количество этого вещества, его продуктивность по пептаиболу А118-37 составляла 20 мг/л.
Рис. 2.
Сравнение профилей выделения этилацетатных экстрактов E. alkalina штамм A118 в зависимости от способа культивирования: поверхностный (а), глубинный (б), комбинированный (в). Звездочкой отмечено вещество А118-11/37.
Таким образом, было установлено, что способность к синтезу пептаибола А118-37 является штаммоспецифичным признаком. При выращивании продуцента поверхностным способом на щелочной среде с содержанием мальтакса-10 40 г/л достигалась наибольшая продуктивность по пептаиболу. На примере ряда мицелиальных грибов ранее было показано, что воздействие условий выращивания и даже незначительных изменений в составе среды (соотношения С : N), а также физико-химических факторов (растворенный кислород, температура), может модулировать биосинтез вторичного метаболита [13, 14].
В дальнейшем была проведена оценка пептаибола А118-37 как потенциального нового антимикотика медицинского назначения на клинических изолятах грибов – возбудителях пневмомикозов с множественной резистентностью к азолам. Показано, что пептаибол А118-37 ингибировал рост всех патогенных штаммов грибов, но особенно был активен в отношении Aspergillus terreus 1133м, A. fumigatus 163м, A. ochraceus 497м, Saccharomyces cerevisiae 77м и Cr. laurentii 801м, которые, по нашим данным, не только обладают устойчивостью к препарату флуконазолу из класса азолов, но оказались и нечувствительными к амфотерицину В (табл. 3). Следует отметить, что ранее у штаммов этих возбудителей была установлена вариативная или сниженная чувствительность к ряду препаратов из различных групп лекарственных средств, широко применяющихся в лечении больных микозами [15].
Таблица 3.
Фунгицидная активность пептаибола А118-37 в отношении клинических патогенных грибов со множественной резистентностью
| Тест-организм | Диаметр зоны подавления, мм | ||
|---|---|---|---|
| А118-37 | амфотерицин В | флуконазол | |
| A. fumigatus 163 м | 18 ± 0.6 | 0 | 0 |
| A. flavus 905 м | 22 ± 0.6 | 11 ± 0.6 | 0 |
| A. terreus 1133 м | 30 ± 0.6 | 0 | 0 |
| A. ochraceus 497 м | 26 ± 0.6 | 0 | 0 |
| A. niger 219 | 25 ± 0.6 | 12 ± 0.6 | 0 |
| C. hawaiiensis 988 м | 26 ± 0.6 | 15 ± 0.6 | 0 |
| S. cerevisiae 77 м | 12.5 ± 0.8 | 0 | 0 |
| C. laurentii 801 м | 12 ± 0.6 | 0 | 0 |
| C. glabrata 1402 м | 27 ± 0.6 | 18 ± 0.6 | 0 |
| С.albicans 1582 | 30 ± 0.6 | 18 ± 0.6 | 0 |
| C. tropicalis 1402 м | 21 ± 0.6 | 12 ± 0.6 | 0 |
| C. krusei 1447 м | 16 ± 0.6 | 10 ± 0.6 | 0 |
Известна также способность антимикробных пептидов из семейства растительных тионинов, выделенных из семян черного тмина (Nigella sativa L.), подавлять рост и формирование колоний данных патогенов [16]. Интересно, что для пептидных “токсинов” из данной группы может быть характерна преимущественная специфичность антимикробного действия как на клеточном, так и на молекулярном уровне, направленная главным образом на эукариотические организмы. При этом показано, что пептаиболам, выделенным из различных живых организмов (грибы, беспозвоночные) свойственен мембранно-активный способ взаимодействия с клетками-мишенями, приводящий к их деструкции [17]. Однако не исключен и альтернативный способ воздействия за счет объединения элементов первичной и вторичной структур пептаиболов, что позволяет молекуле проникать через клеточную стенку в клетку [18]. Таким образом, возможно перспективное применение продуцируемых штаммом соединений пептаиболов для лечения оппортунистических пневмомикозов у больных туберкулезом.
Разделы работы, посвященные ВЭЖХ анализу концентратов штаммов E. alkalina и определению антифунгальной активности, выполнены при финансовой поддержке Российского научного фонда (грант № 18-74-10073) Работа по формированию и хранению коллекции алкалофильных грибов проведена в рамках Государственного задания, части 2 п. 01 10 (тема № АААА-А16-116021660088-9) и гранта РФФИ № 17-53-53130.
Список литературы
Klimko N., Kozlova Y., Khostelidi S., Shadrivova O., Borzov Y., Burygina E., Vasilieva N., Denning D.W. // Mycoses. 2015. V. 58. (Suppl. S5). P. 58–62.
Pegorie M., Denning D.W., Welfare W. // J. Infect. 2017. V. 74. № 1. P. 60–71.
Gessmann R., Axford D., Brückner H., Berg A., Petratos K. // Acta Cryst. 2017. V. 73. № 2. P. 95–100.
Overy D.P., Bayman P., Kerr R.G., Bills G.F. // Mycology. 2014. V. 5. № 3. P. 145–167.
Георгиева М.Л., Толстых И.В., Биланенко Е.Н., Катруха Г.С. // Микология и фитопатология. 2009. Т. 4. № 6. С. 84–91.
Baranova A.A., Georgieva M.L., Bilanenko E.N., Andreev Ya.A., Rogozhin E.A., Sadykova V.S. // Appl. Biochemistry and Microbiology. 2017. V. 53. № 6. P. 703–710.
Grum-Grzhimaylo A.A., Georgieva M.L., Debets A.J.M., Bilanenko E.N. // IMA Fungus. 2013. V. 4. № 2. P. 211–226.
Grum-Grzhimaylo A.A., Georgieva M.L., Bondarenko S.A., Debets A.J.M., Bilanenko E.N. // Fungal Diversity. 2016. V. 76. № 1. P. 27–74.
Balouiri M., Sadiki M., Ibnsouda S.K. // J. Pharm. Anal. 2016. V. 6. № 2. P. 71–79.
Overy D., Correa H., Roullier C., Chi W.-C., Pang K.-L., Rateb M., Ebel R., Shang Z., Capon R., Bills G., Kerr R. // Mar. Drugs. 2017. V. 15. № 254. P. 1–18.
Imhoff J.F. // Mar. Drugs. 2016 V. 14 № 19. P. 1–19.
De Vries R., Riley R., Wiebenga A., Aguilar-Osorio G., Amillis S., Uchima C., Anderluh G., Asadollahi M., Askin M., Barry K. // Genome Biol. 2017. V. 18. № 1(28). P. 2–45.
Santos I.M., Abrunhosa L., Venancio A., Lima N. // Lett. Appl. Microbiol. 2002. V. 35. № 4. P. 272–275.
Yue Q., Chen L., Zhang X., Li K., Sun J., Liu X., An Z., Bills G.F. // Eukaryot. Cell. 2015. V. 14. № 7. P. 698–718.
Kulko A.B. // Oncohematology. 2012. V. 7. № 3. P. 55–61.
Кулько А.Б., Кисиль О.В., Садыкова В.С. Михайлов В.Ф., Васильева И.М., Шуленина Л.В., Засухина Г.Д., Рогожин Е.А. // Антибиотики и химиотерапия. 2016. Т. 61. № 9–10. С. 8–16.
Duclohier H. // Chem Biodivers. 2007. V. 4. № 6. P. 1023–1026.
Leitgeb B., Szekeres A., Manczinger L., Vágvölgyi C., Kredics L. // Chem Biodivers. 2007. V. 4. № 6. P. 1027–1051.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


