Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 144-150
Особенности конверсии 4-хлорфеноксиуксусной кислоты у штамма Pseudomonas sp. 36DCP
Н. В. Жарикова 1, *, Е. Ю. Журенко 1, Т. Р. Ясаков 1, В. В. Коробов 1, А. С. Ерастов 2, Т. В. Маркушева 1
1 Уфимский институт биологии, УФИЦ РАН
450054 Уфа, Россия
2 Уфимский институт химии, УФИЦ РАН
450054 Уфа, Россия
* E-mail: puzzle111@yandex.ru
Поступила в редакцию 15.03.2018
После доработки 03.09.2018
Принята к публикации 25.09.2018
Аннотация
Охарактеризован новый природный штамм 36DCP, способный использовать 4-хлорфеноксиуксусную кислоту (4-ХФУК) в качестве единственного источника углерода и энергии. Изолят, выделенный из образца почвы, загрязненной отходами химического производства, был идентифицирован согласно физиолого-биохимическим, культурально-морфологическим признакам и анализу последовательности гена 16S pPHK как принадлежащий к роду Pseudomonas. В периодической культуре Pseudomonas sp. 36DCP утилизировал 45% 4-ХФУК от начальной концентрации к 5 сут инкубации. На основании идентифицированных промежуточных метаболитов в среде культивирования (пара-бензохинон и гидрохинон) установлено, что конверсия 4-ХФУК у Pseudomonas sp. 36DCP идет по пути гидрохинона. Ранее такой путь деградации монохлорированных феноксиуксусных кислот у бактерий описан не был.
4-Хлорфеноксиуксусная кислота (4-ХФУК) относится к группе хлорфеноксигербицидов, широко используемых в качестве регуляторов роста растений, чаще всего для обработки томатов. В эту же группу входят 2,4,5-трихлорфеноксиуксусная (2,4,5-Т), 2,4-дихлорфеноксиуксусная (2,4-Д) и 2-метил-4-хлорфеноксиуксусная (2М-4Х) кислоты, нашедшие свое применение в качестве селективных гербицидов еще в конце второй мировой войны. Масштабное использование в течение всего этого времени хлорфеноксиуксусных кислот в качестве агрохимикатов привело к значительному загрязнению ими почвы и грунтовых вод [1]. Несмотря на то, что хлорфеноксигербициды устойчивы к воздействию окружающей среды и могут длительное время сохраняться в почве, описаны бактерии, способные к их аэробной биодеградации [2–6].
Известно, что микробная конверсия таких простых (хлор)ароматических соединений может происходить двумя путями через образование разных ключевых метаболитов и, как правило, зависит от степени галогенирования субстрата. Обычно бактерии, катализирующие аэробную деградацию фенолов, а также их моно- и дихлорпроизводных, трансформируют их до (хлор)катехолов, которые далее метаболизируются через орто- или модифицированные пути орто-расщепления [7]. Штаммы, способные к конверсии более высоко галогенированных фенолов, осуществляют гидроксилирование бензольного кольца в две стадии с получением промежуточных продуктов – (хлор)гидрохинонов [8].
По первому пути трансформируются в основном моно- и дихлорированные феноксиуксусные кислоты, в том числе 2,4-Д. Штамм Cupriavidus necator (ранее Alcaligenes eutrophus, Ralstonia eutropha и Wauteria eutropha) JMP134 конвертирует вышеуказанное соединение через 3,5-дихлоркатехол, ароматическое кольцо которого затем подвергается орто-расщеплению [2]. Данный путь свойственен большинству известных к настоящему времени деструкторов 2,4-Д [4, 5, 9, 10]. По второму метаболическому варианту идет конверсия более высокохлорированных феноксиуксусных кислот. Например, ключевыми метаболитами пути деградации 2,4,5-Т штаммом Burkholderia phenoliruptrix (ранее Pseudomonas cepacia, Burkholderia cepacia) АС1100 являются хлорпроизводные гидрохинона и гидроксихинона [11, 12].
Цель работы – исследование особенностей конверсии 4-ХФУК новым штаммом, выделенным из почвы, загрязненной хлорароматическими соединениями.
МЕТОДИКА
Объектом исследований служил природный бактериальный штамм 36DCP, выделенный из образца почвы, загрязненной отходами химического производства (Уфа, Россия).
Накопительные и чистые культуры получали с использованием минимальной солевой среды М9 [13], следующего состава (г/л): Na2HPO4 – 6.0; KH2PO4 – 3.0; NaCl – 0.5; NH4Cl – 1.0, содержащей в качестве единственного источника углерода 4-ХФУК (100 мг/л). После автоклавирования в среду добавляли стерильные растворы CaCl2 и MgSO4 до конечных концентраций 1.0 и 2.0 мM соответственно.
Культивирование проводили в конических колбах (250 мл) при температуре 28°С в термостатируемой установке УВМТ-12-250 (“Элион”, Россия) при 120 об./мин. Интенсивность роста культуры оценивали по оптической плотности (OП590) клеточной суспензии с использованием фотоколориметра КФК-2 (ЗОМЗ, Россия).
Морфометрические характеристики были получены с помощью просвечивающей электронной микроскопии на микроскопе Н-300 (“Hitachi”, Япония) при увеличении 18 000 (75 кВ).
Культуральные и физиолого-биохимические свойства изолята определяли согласно методическому руководству [14].
Выделение геномной ДНК, амплификацию частичной последовательности гена 16S рРНК и секвенирование проводили, как описано в статье [15]. При анализе последовательностей множественное выравнивание и дальнейшее построение филогенетического древа было выполнено как указано ранее [16]. Последовательность длиной 1488 пар нуклеотидов депонирована в международную базу данных GenBank под номером MK072948.
Определение количества 4-ХФУК в среде культивирования и экстракцию метаболитов проводили по методике, описанной в работе [17]. Продукты катаболизма 4-ХФУК в метилированных экстрактах устанавливали с помощью хроматомасс-спектрометра “Хроматэк-Кристалл 5000” (СКБ "Хроматэк”, Россия) на базе квадрупольного масс-спектрометрического детектора Finnigan DSQ II (“ThermoFinnigan”, США). Условия анализа: капиллярная колонка НР-5MS 30 м × 0.2 мм, растворитель – гексан, температура инжектора и интерфейса 250°С, начальная температура колонки 50°С, скорость нагрева 20 град/мин, конечная температура колонки 250°С. Полученные соединения идентифицировали путем сравнения их масс-спектров с библиотекой спектров NIST05. Обработка результатов проводилась с использованием программного комплекса Xcalibur.
Ингибирование диоксигеназы, расщепляющей ароматическое кольцо, осуществляли согласно методике, описанной в работе [18], с небольшими модификациями. Клетки штамма 36DCP (1.0 г) в середине лаг-фазы роста собирали центрифугированием (3630 g, 10 мин), ресуспендировали в 100 мл 0.1 М фосфатного буфера (pH 7.0) и добавляли 200 мкл среды LB, 100 мкл 4-ХФУК и 2,2'-дипиридил до конечной концентрации 10 мМ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Грамотрицательные клетки штамма 36DCP имели форму прямых или слегка изогнутых палочек размером 0.4 × 1.6 мкм, способных двигаться за счет полярных жгутиков. На МПА после 48 ч инкубации при 28°С изолят образовывал прозрачные, гладкие колонии с более плотным возвышающимся центром. Культура продуцировала внеклеточные флюоресцирующие пигменты желто-зеленого, а на ломтике картофеля – синего цвета. Для штамма был характерен аэробный рост с использованием кислорода в качестве конечного акцептора электронов в диапазоне температур от 22°С до 45°С и значениях pH, близких к нейтральным (6.8–7.2).
В качестве единственного источника углерода культура использовала D-глюкозу, цитрат, этанол и глицерин, проявляла каталазную, лецитиназную и аргининдегидролазную активность, осуществляла восстановление NO3.
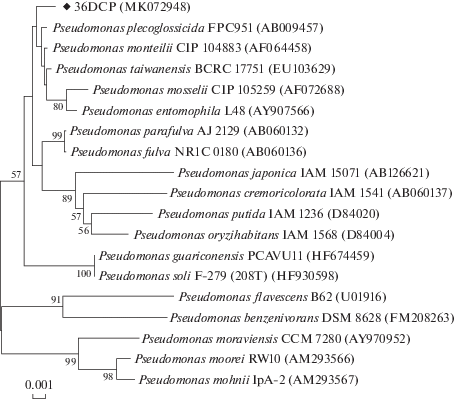
Для изолята была определена практически полная последовательность (1488 п. н.) амплификата гена, кодирующего 16S pРНК. Сходство с исследуемой культурой показали бактерии рода Pseudomonas (уровень идентичности 97.3–99.7%), а филогенетически наиболее близким (уровень идентичности 99.7%) оказался типовой представитель вида – P. plecoglossicida FPC951 (AB009457). Однако штамм 36DCP кластрировался отдельно от клады, образованной типовыми штаммами видов P. plecoglossicida, P. monteilii, P. taiwanensis, P. mosselii и P. entomophila, хотя и имел с ними общего предка. При этом достоверность ветвления внутри этого кластера оказалась ниже необходимого 50%-ного порога (рис. 1). Эти результаты позволили идентифицировать исследуемый штамм как Pseudomonas sp. 36DCP и предположить, что он, возможно, является представителем нового вида бактерий.
Рис. 1.
Филогенетическое древо 16S рРНК штамма 36DCP и гомологичных ему последовательностей типовых видов бактерий рода Pseudomonas, построенное методом “neighbor-joining”. Цифрами показана достоверность ветвления, рассчитанная с помощью “bootstrap"-анализа (значимыми признаются величины больше 50). Масштаб отражает эволюционное расстояние, соответствующее 1 нуклеотидной замене на каждые 1000 нуклеотидов. В скобках указаны номера последовательностей в базе данных (GenBank).
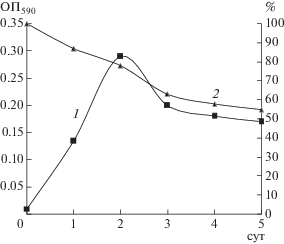
В периодической культуре штамм Pseudomonas sp. 36DCP использовал 4-ХФУК в качестве единственного источника углерода и энергии (рис. 2). Значение оптической плотности (ОП) клеточной суспензии достигало максимальной величины (0.3 ед.) на 2 сут культивирования, при этом потребление субстрата составляло 10–15% в сут. Далее, после невыраженной стационарной фазы, наблюдалось снижение ОП клеточной суспензии и, соответственно, потребления субстрата до 3–5%.
Рис. 2.
Зависимость значений ОП590 культуральной жидкости (1) и концентрации 4-ХФУК (2) от времени культивирования Pseudomonas sp. 36DCP в периодической культуре.
К настоящему времени данные по бактериальной деструкции 4-ХФУК ограничены немногочисленными исследованиями. Так, молодые культуры штаммов Flavobacterium peregrinum и Achromobacter sp., выращенные на 2М-4Х, полностью окисляли 2 мкM 4-ХФУК за 1.5 ч, тогда как более старые культуры даже через 4 ч показали менее 50% окисления субстрата [19].
Изучаемый штамм Pseudomonas sp. 36DCP был способен к разложению 4-ХФУК в довольно высокой концентрации, кроме того он показал активность в отношении других более хлорированных феноксиуксусных кислот, а именно: 2,4-Д и 2,4,5-Т, а также фенола и 2,4-дихлорфенола (неопубликованные данные). Таким образом, полисубстратная активность штамма Pseudomonas sp. 36DCP может быть использована для разработки технологий очистки территорий, загрязненных комплексом хлорароматических соединений.
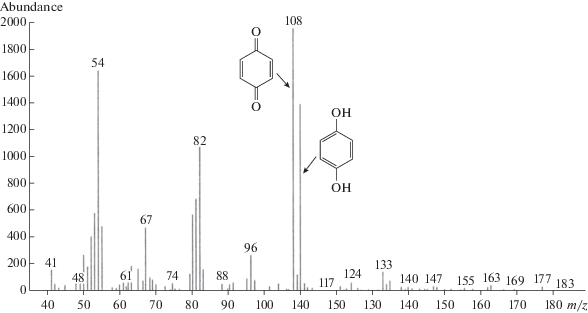
В среде культивирования штамма Pseudomonas sp. 36DCP было определено присутствие двух соединений, вероятно являющихся интермедиатами пути деградации 4-ХФУК. Масс-спектр представлял собой сумму масс-спектров двух соединений, идентифицированных как пара-бензохинон и гидрохинон. Суммарный масс-спектр включал в себя пики молекулярных ионов (М+) с m/z 108 и 110 а. е. м. и характерные для обоих соединений пики осколочных ионов (рис. 3).
Рис. 3.
Суммарный масс-спектр интермедиатов при конверсии 4-ХФУК штаммом Pseudomonas sp. 36DCP, идентифицированных как пара-бензохинон (М+ 108) и гидрохинон (М+ 110).
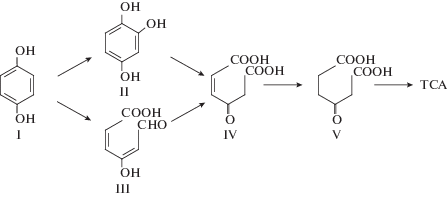
На примере штамма Cupriavidus necator JMP134 показано, что после отщепления остатка уксусной кислоты и образования соответствующего хлорфенола аэробная деградация моно- и дихлорированных феноксиуксусных кислот протекает по классическому хлоркатехольному пути (рис. 4) [2].
Рис. 4.
Пути аэробной деградации хлорированных феноксиуксусных кислот у бактерий: а – 2,4-Д штамма C. necator JMP134 [2], б – 2,4,5-Т штамма B. phenoliruptrix АС1100 [11, 12]. I – 2,4-Д, II – 2,4-дихлорфенол, III – 2,4-дихлоркатехол, IV – 2,4-дихлор-цис, цис-муконат, V – транс-2-хлордиенлактон, VI – цис-2-хлордиенлактон, VII – 2-хлормалеилуксусная кислота, VIII – 2,4,5-Т, IX – 2,4,5-трихлорфенол, X – 2,5-дихлоргидрохинон, XI – 5-хлоргидроксигидрохинон, XII – 2-гидрокси-1,4-бензохинон, XIII – гидроксигидрохинон, XIV – малеилуксусная кислота, XV – β-кето-адипиновая кислота, TCA – цикл трикарбоновых кислот.
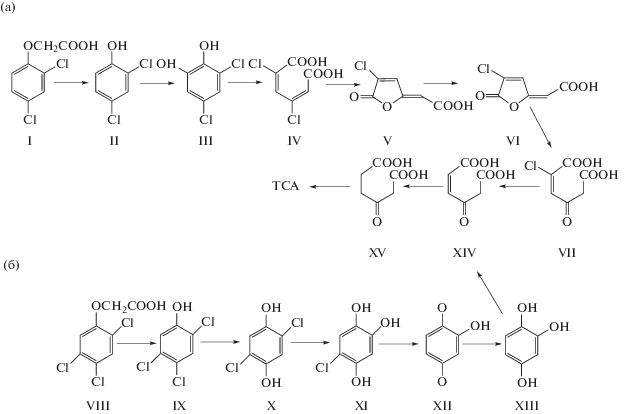
В то время как образование производных гидрохинона характерно для метаболизма более хлорированных субстратов, в частности 2,4,5-Т у штамма B. phenoliruptrix АС1100 (рис. 4.). Инициация конверсии происходит в результате монооксигеназной активности 2,4,5-Т-оксигеназы, которая превращает 2,4,5-Т в 2,4,5-трихлорфенол [20]. На второй и третьей стадии монооксигеназа катализирует два гидроксилирования, продуктом которых является 5‑хлоргидроксигидрохинон. Далее происходят последовательные реакции окисления и восстановления субстрата, в результате чего отщепляется последний атом хлора и образуется гидроксигидрохинон, являющийся субстратом для орто-расщепления ароматического кольца [11, 12]. Необходимо отметить, что штамм B. phenoliruptrix АС1100 был получен методом так называемого плазмид-ассоциированного молекулярного бридинга [21], вследствие чего вышеописанный путь деградации 2,4,5-Т может носить несколько избыточный характер и отличаться от природных метаболических путей таких соединений.
Таким образом, продуктами стадий инициации деградации хлорфеноксиуксусных кислот во всех исследованных путях их метаболизма являются хлорфенолы. Проведенный сравнительный анализ позволяет предположить, что в результате деградации 4-ХФУК штаммом Pseudomonas sp. 36DCP также первоначально образуется хлорфенол, у которого галогензаместитель находится в пара-положении по отношению к гидроксильной группе. В то время как наличие гидрохинона в среде культивирования показывает, что дальнейшая конверсия 4-ХФУК у исследуемого штамма проходит по одноименному пути.
Известно, что по пути гидрохинона бактерии могут конвертировать как поли-, так и монозамещенные фенолы. Так, через образование производных гидрохинона разной степени галогенированности, идет метаболизм полихлорфенолов, в частности 2,4,6-трихлорфенола (2,4,6-ТХФ) у вышеупомянутого деструктора 2,4-Д штамма C. necator JMP134 [22], а также три-, четыре- и пентохлорфенолов у культур Rhodococcus chlorophenolicus PCP-I, Rhodococcus sp. CP-2, Rhodococcus sp. CG-1 и Mycobacterium sp. CG-2 [23, 24]. Характерно, что во всех случаях первые два атома хлора элиминируются путем гидроксилирования сначала в пара-, а затем в орто-положении по отношению к фенольной гидроксильной группе субстрата с образованием соответствующих хлорпроизводных гидрохинона и гидроксигидрохинона.
В путях деградации пара-замещенных фенолов первоначальная реакция также включает замену пара-заместителя на гидроксильную группу, однако продуктом является незамещенный гидрохинон. При этом в результате монооксигеназной активности сначала образуется промежуточный интермедиат – пара-бензохинон, который затем восстанавливается до гидрохинона. Такой механизм установлен для деструкторов пара-нитрофенола штаммов Moraxella sp., Pseudomonas sp. WBC-3, Pseudomonas sp. 1–7, Arthrobacter protophormiae RKJ100 [25–28], 4-аминофенола штамма Burkholderia sp. АК-5 [29] и 4-фторфенола штамма Arthrobacter sp. IF1 [30].
Таким образом, в пути деградации 4-ХФУК штамма Pseudomonas sp. 36DCP наиболее вероятно монооксигеназное превращение предполагаемого метаболита – пара-хлорфенола в пара-бензохинон, который затем восстанавливается до гидрохинона, обнаруженного в среде культивирования.
Известно, что в аэробных условиях у бактерий гидрохинон может далее направляться по β-кетоадипатному пути через две различные метаболические ветви (рис. 5). Первый путь включает первоначальное гидроксилирование гидрохинона с образованием гидроксигидрохинона (1,2,4-тригидроксибензол) и последующую реакцию расщепления кольца, катализируемую 1,2-диоксигеназой. Второй путь деградации гидрохинона носит менее распространенный характер. В этом случае ароматическое кольцо гидрохинона непосредственно расщепляется с помощью специфической гидрохинон-1,2-диоксигеназы, а образующийся при этом 4-гидроксимуконовый полуальдегид окисляется до малеилуксусной кислоты [31].
Рис. 5.
Две ветви пути аэробной деградации гидрохинона [31]. I – гидрохинон, II – гидроксигидрохинон, III – 4-гидроксимуконовый полуальдегид, IV – малеилуксусная кислота, V – β-кето-адипиновая кислота, TCA – цикл трикарбоновых кислот.
Для того чтобы определить по какой из двух возможных ветвей пути гидрохинона протекает конверсия 4-ХФУК у исследуемого штамма был использован хелатор железа 2,2-дипиридил. Известно, что данное соединение ингибирует активность многих диоксигеназ, расщепляющих ароматическое кольцо [32]. К культуре, находящейся в лаг-фазе и активно наращивающей биомассу на 4-ХФУК в качестве единственного источника углерода и энергии, добавляли 2,2-дипиридил. Метаболиты были идентифицированы после 1 ч культивирования в прежних условиях. Хроматомасс-спектрометрический анализ показал наличие в пробе только пара-бензохинона и гидрохинона. Таким образом, отсутствие гидроксигидрохинона в среде культивирования свидетельствует о том, что вероятно гидрохинон является субстратом диоксигеназы, расщепляющей ароматическое кольцо.
Непосредственное расщепление ароматического кольца гидрохинона с образованием 4-гидроксимуконового полуальдегида известно для конверсии многих экологически значимых соединений, а именно: пара-замещенных фенолов (4-хлор-, 4-фтор-, 4-бром-, 4-йод- и 4-нитрофенола) у Arthrobacter ureafaciens CPR706 [33], линдана (γ-гексахлорциклогексан) у Sphingomonas (ранее Pseudomonas) paucimobilis UT26 [34], 4‑нитрофенола штаммами Moraxella sp., Pseudomonas sp.WBC-3 и Pseudomonas sp. 1–7 [25–27], 4-гидроксиацетофенона у Pseudomonas fluorescens ACB [35] и алкилфенолов у Sphingomonas sp. TTNP3 и Sphingobium xenophagum Bayram [36].
В проведенном исследовании на основании идентифицированных ключевых метаболитов в среде культивирования (пара-бензохинона и гидрохинона) и по аналогии с другими рассмотренными известными системами биодеградации был предложен метаболический путь конверсии 4-ХФУК у Pseudomonas sp. 36DCP (рис. 6).
Рис. 6.
Возможный путь деградации 4-ХФУК у Pseudomonas sp. 36DCP. I – 4-ХФУК, II – пара-хлорфенол, III – пара-бензохинон, IV – гидрохинон, V – малеилуксусная кислота, TCA – цикл трикарбоновых кислот. В скобки взяты предполагаемые метаболиты.
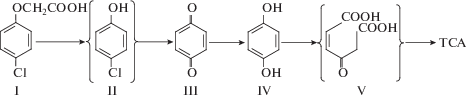
Таким образом, полученные результаты позволяют предположить, что деградация 4-ХФУК у Pseudomonas sp. 36DCP начинается с трансформации первоначального субстрата до 4-хлорфенола, который затем направляется по пути пара-замещенных фенолов. При этом наиболее вероятно монооксигеназное превращение 4-хлорфенола в пара-бензохинон, который затем восстанавливается до гидрохинона. Последний, вероятно, является субстратом дальнейшего расщепления кольца. Необходимо отметить, что ранее такого пути конверсии монохлорированных феноксиуксусных кислот у бактерий описано не было.
В работе было использовано оборудование центра коллективного пользования “Агидель” УФИЦ РАН.
Список литературы
Мельников Н.Н., Белан С.Р. // Агрохимия. 1998. № 10. С. 83–93.
Don R.H., Weightman A.J., Knackmuss H.J, Timmis K.N. // J. Bacteriol. 1985. V. 161. P. 85–90.
Tonso N.L., Matheson V.G., Holben W.E. // Microb. Ecol. 1995. V. 30. P. 3–24.
Sakai Y., Ogawa N., Fujii T., Sugahara K., Miyashita K., Hasebe A. // Microbes Environ. 2007. V. 22. P.145–156.
Baelum J., Jacobsen C.S., Holben W.E. // Syst. Appl. Microbiol. 2010. V. 33. P. 67–70.
Жарикова Н.В., Ясаков Т.Р., Журенко Е.Ю., Коробов В.В., Маркушева Т.В. // Успехи современной биологии. 2017. Т. 137. № 5. С. 514–528.
van der Meer J.R., de Vos W.M., Harayama S., Zehnder A.J. // Microbiol. Rev. 1992. V. 56. P. 677–694.
Haggblom M.M. // FEMS Microbiol. Rev. 1992. V. 103. P. 29–72.
Fulthorpe R.R., McGowan C., Maltseva O.V., Holben W.E., Tiedje J.M. // Appl. Environ. Microbiol. 1995. V. 61. P. 3274–3281.
McGowan C., Fulthorpe R., Wright A., Tiedje J.M. // Appl. Environ. Microbiol. 1998. V. 64. № 10. P. 4089–4092.
Daubaras D.L., Saido K., Chakrabarty A.M. // Appl. Environ. Microbiol. 1996. V. 62. № 11. P. 4276–4279.
Zaborina O., Daubaras D.L., Zago A., Xun L., Saido K., Klem T., Nikolic D., Chakrabarty A.M. // J. Bacteriol. 1998. V. 180. № 17. P. 4667–4675.
Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. Пер. с англ. М.: Мир, 1984. 480 с.
Практикум по микробиологии. Уч. пособие для вузов / Ред. Нетрусов А.И. М.: Академия, 2005. 608 с.
Zharikova N.V., Iasakov T.R., Bumazhkin B.K., Patutina E.O., Zhurenko E.I., Korobov V.V., Sagitova A.I., Kuznetsov B.B., Markusheva T.V. // Saudi J. Biol. Sci. 2018. V. 25. № 4. P. 660–671. doi 10.1016/ j.sjbs.2016.02.014
Коробов В.В., Журенко Е.Ю., Жарикова Н.В., Ясаков Т.Р., Маркушева Т.В. // Вестник Московского университета. Сер. 16. Биология. 2017. Т. 72. № 4. С. 235–240. doi 10.3103/S0096392517040083
Жарикова Н.В., Маркушева Т.В., Галкин Е.Г., Коробов В.В., Журенко Е.Ю., Ситдикова Л.Р., Колганова Т.В., Кузнецов Б.Б., Турова Т.П. // Прикл. биохимия и микробиология. 2006. Т. 42. № 3. С. 292–297.
Nordin K., Unell M., Jansson J.K. // Appl. Environ. M-icrobiol. 2005. V. 71. № 11. P. 6538–6544.
Steenson T.I., Walker N. // J. Gen. Microbial. 1957. V. 16. P. 146–155.
Xun L., Wagnon K.B. // Appl. Environ. Microbiol. 1995. V. 61. № 9. P. 3499–3502.
Kilbane J.J., Chatterjee D.K., Karns J.S., Kellogg S.T., Chakrabarty A.M. // Appl. Environ. Microbiol. 1982. V. 44. № 1. P. 72–78.
Matus V., Sánchez M.A., Martínez M., González B. // Appl. Environ. Microbiol. 2003. V. 69. № 12. P. 7108–7115.
Apajalahti J.H., Salkinoja-Salonen M.S. // J. Bacteriol. 1987. V. 169. № 11. P. 5125–5130.
Haggblom M.M., Nohynek L.J., Salkinoja-Salonen M.S. // Appl. Environ. Microbiol. 1988. V. 54. № 12. P. 3043–3052.
Spain J.C., Gibson D.T. // Appl. Environ. Microbiol. 1991. V. 57. № 3. P. 812–819.
Zhang J.J., Liu H., Xiao Y., Zhang X.E., Zhou N.Y. // J. Bacteriol. 2009. V. 191. № 8. P. 2703–2710. doi 10.1128/JB.01566-08
Zhang S., Sun W., Xu L., Zheng X., Chu X., Tian J., Wu N., Fan Y. // BMC Microbiology. 2012. V. 12. № 27. doi 10.1186/1471-2180-12-27
Chauhan A., Chakraborti A.K., Jain R.K. // Biochem. Biophys. Res. Commun. 2000. V. 270. № 3. P. 733–740. doi 10.1006/bbrc.2000.2500
Takenaka S., Okugawa S., Kadowaki M., Murakami S., Aoki K. // Appl. Environ. Microbiol. 2003. V. 69. № 9. P. 5410–5413.
Ferreira M.I.M., Marchesi J.R., Janssen D.B. // Appl. Microbiol. Biotechnol. 2008. V. 78. P. 709–717. doi 10.1007/s00253-008-1343-3
Enguita F.J., Leitão A.L. // Biomed Res. Int. 2013. V. 2013. doi 10.1155/2013/542168
Chapman P.J., Hopper D.J. // Biochem. J. 1968. V. 110. № 3. P. 491–498.
Bae H.S., Lee J.M., Lee S.T. // FEMS Microbiol. Lett. 1996. V. 145. P. 125–129.
Miyauchi K., Adachi Y., Nagata Y., Takagi M. // J. Bacteriol. 1999. V. 181. № 21. P. 6712–6719.
Moonen M.J., Kamerbeek N.M., Westphal A.H., Boeren S.A., Janssen D.B., Fraaije M.W., van Berkel W.J. // J. Bacteriol. 2008. V. 190. № 15. P. 5190–5198.
Kolvenbach B.A., Lenz M., Benndorf D., Rapp E., Fousek J., Vlcek C., Schäffer A., Gabriel F.L.P., Kohler H.P.E., Corvini P.F. // AMB Express. 2011. V. 1. doi 10.1186/2191-0855-1-8
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


