Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 158-165
Действие ресвератрола и дигидрокверцетина на физиолого-биохимические характеристики полиэкстремофильных дрожжей Yarrowia lipolytica в условиях температурного стресса
Д. И. Дергачёва 1, А. А. Машкова 1, Е. П. Исакова 1, Н. Н. Гесслер 1, Ю. И. Дерябина 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: yul_der@mail.ru
Поступила в редакцию 04.07.2018
После доработки 24.09.2018
Принята к публикации 25.09.2018
Аннотация
Исследовано действие биологически активных полифенолов ресвератрола и дигидрокверцетина на морфо-физиологические характеристики и антиоксидантный статус полиэкстремофильных дрожжей Yarrowia lipolytica при оптимальной и повышенной температурах. Выращивание в присутствии 30 мкМ ресвератрола при оптимальной температуре вызывало увеличение активности супероксиддисмутазы в 2 раза. При повышенной температуре выращивания 300 мкМ концентрация дигидрокверцетина снижала долю альтернативного дыхания. Показано подавляющее действие высоких концентраций ресвератрола и низких концентраций дигидрокверцетина на выживаемость клеток дрожжей Y. lipolytica на фоне отсутствия видимого ингибирования роста культуры при оптимальной температуре. Установлено умеренное стимулирующее действие полифенола на скорость поглощения кислорода клетками дрожжей.
Полифенолы растительного происхождения являются одним из наиболее активно используемых в фармацевтике и парафармацевтике типов антиоксидантов [1, 2]. Эти соединения успешно применяются для лечения заболеваний, имеющих сложносоставную этиологию: нейродегенеративных расстройств различного происхождения, аутоиммунных, аллергических, онкологических и прионных [3]. Полифенолы используют для лечения трудно заживляемых ран и язв в сочетании с традиционными антибиотиками и противогрибковыми средствами [4]. Флавоноиды – один из самых многочисленных классов природных фенольных соединений, структурной основой которых служит флавоновое ядро, содержащее два ароматических кольца, соединенных СЗ-мостиком [5, 6]. В зависимости от структуры ядра выделяют катехины, лейкоантоцианы, антоцианы, флавононы, флавоны, флавонолы, халконы [5, 6]. Флавоноиды широко представлены у растений, содержатся – в овощах, фруктах, цветках, семенах, коре деревьев, и поэтому являются важной составной частью рациона питания животных и человека [6, 7]. Стильбены являются соединениями, структурно и функционально родственными флавоноидам и встречающимися в основном в древесине различных видов сосны, ели, эвкалиптов. Основные представители класса стильбенов – широко применяемые в современной фармацевтике, медицине и промышленных технологиях ресвератрол, птеростильбен, пиносильвин, рапонтицин [5, 6]. По функциональным свойствам стильбены и флавоноиды объединяют в большой класс фитоалексинов, представляющих собой натуральные растительные антибиотики, определяющие устойчивость растений к болезням и инактивирующие микробных возбудителей заболеваний.
Флавоноиды и стильбены обладают высокой антиоксидантной активностью, которая зависит от расположения функциональных групп относительно ядра в структуре молекул. Замещение и общее количество гидроксильных групп существенно влияют на некоторые свойства, такие как дезактивация радикальных частиц и способность хелатировать ионы металлов. Конфигурация гидроксильных групп В-кольца является наиболее значимым определяющим фактором защиты от активных форм кислорода (АФК), обеспечивая их стабилизацию за счет формирования относительно стабильного флавоноидного радикала [7]. Механизмы антиоксидантного действия этих классов полифенолов могут включать: подавление образования АФК либо за счет ингибирования специализированных ферментов, либо хелатирования микроэлементов, участвующих в генерации свободных радикалов; включение клеточной антиоксидантной защиты и непосредственную дезактивацию АФК, а также сочетание этих механизмов [6, 7].
Интерес исследователей к флавоноидам и стильбенам обусловлен уникальной биологической активностью, которую проявляют отдельные их представители. Природный стильбен ресвератрол (3,5,4'-тригидроксистильбен) занимает центральное место в исследованиях натуральных полифенолов, являясь фитоалексином, который синтезируется некоторыми растениями (растения хвойных пород, виноград, арахис) [5]. Лучшим источником ресвератрола принято считать красные вина [8]. Ресвератрол обладает способностью снижать тромбообразование, уровень холестерина и триглицеридов в крови, улучшать реологические свойства крови, расслаблять эндотелий сосудов, предупреждая таким образом развитие атеросклероза, проявлять антиоксидантную, антиканцерогенную и противовоспалительную активность [6]. Ресвератрол ингибирует перекисное окисление мембранных липидов. В исследованиях на экспериментальных животных было показано, что при перекисном окислении липидов концентрация ресвератрола, необходимая для 50%-ного ингибирования, была примерно в 3 раза ниже, чем у хорошо изученного кверцетина [9]. Ресвератрол снижает риск развития неоплазий, предотвращая развитие злокачественных новообразований [10 ] , выполняет роль нейропротекторного [11] и кардиопротекторного [12] соединения. Отмечено, что ресвератрол обладает также и антибактериальной, противовирусной и противогрибковой активностью. Согласно данным Чан с соавт. [13], ресвератрол в концентрации 171–342 мг/мл подавляет размножение in vivo возбудителей тяжелых госпитальных инфекций: Staphylococcus aureus, Enterococcus faecalis, Pseudomonas aeruginosa, а в концентрации 25–50 мг/мл – пяти штаммов грибков-дерматофитов. В концентрации 15 мг/мл ресвератрол снижал вирулентность Proteus mirabilis [14]. Имеются данные о способности ресвератрола in vitro подавлять рост 16 различных природных изолятов возбудителя язвы желудка Helicobacter pylori [15, 16]. В предельно низких концентрациях (1–10 мкмоль/л) ресвератрол усиливал фагоцитоз патогена Candida albicans макрофагами [17] и уменьшал фагоцитоз Escherihia coli и S. aureus, действуя как через TLR-2 рецепторы моноцитов, так и независимо от них.
Полифенол с высокой биологической активностью – дигидрокверцетин (ДГК, 1,3,5,7,3',4'-пентагидроксифлаванон), или таксифолин, в отличие от кверцетина не является потенциальным мутагеном, не обладает токсичностью, что определяет большой интерес к нему, как природному полифенольному антиоксиданту. ДГК был впервые выделен из коры пихты обыкновенной (Pseudotsuga taxifolia), содержится также в большом количестве в комлевой части хвойных растений, в частности, сибирской лиственницы (Larix sibirica), а также в красном луке, китайском тисе, семенах расторопши, цитрусовых [18]. Спектр биологической активности ДГК чрезвычайно широк – гепатопротекторная [19, 20], кардиопротекторная [21], антиканцерогенная [22] активности, антидиабетическое действие [23], противовирусный эффект в отношении вируса Коксаки В4 [24] и энтеровирусов [25], антифунгальное действие в отношении патогенного гриба Candida albicans [26].
В настоящее время существует большой массив данных о различных аспектах влияния природных полифенольных антиоксидантов в живых системах, однако, не существует точной картины механизмов реализации их действия как на организменном и тканевом, так и на клеточном и субклеточном уровнях.
Цель работы – исследование действия ресвератрола и ДГК на физиолого-биохимические характеристики полиэкстремофильных дрожжей Yarrowia lipolytica в условиях температурного стресса.
МЕТОДИКА
Объекты исследования. В работе использовали штаммы экстремофильного вида дрожжей Yarrowia lipolytica W 29, полученного из CIRM-Levures collection (Франция). Дрожжи Y. lipolytica культивировали на минимальной полусинтетической среде с глицерином (0.6–1.0%) в качестве основного источника углерода, при pH 4.0, 5.5 и 9.0, как описано в работе [27]. Биомассу дрожжей собирали на стадии стационарной фазы роста (24 ч), что соответствовало величине оптической плотности (ОП) суспензии клеток при 590 нм 9.0–10.0 ед. В работе использовалось два температурных режима культивирования клеток: 30 и 38°С.
Выживаемость клеток. Выживаемость клеток оценивали по окрашиванию с метиленовым синим. Клеточную суспензию (200 мкл) суспендировали в таком же объеме фосфатно-солевого буфера, содержащего 1%-ный водный раствор метиленового синего, выдерживали 5 мин при комнатной температуре, а затем помещали в камеру Горяева и подсчитывали живые, мертвые и почкующиеся клетки с использованием бинокулярного микроскопа Micros МС 50 X (Австрия) с цифровой камерой DCM 130 Е и программным обеспечением ScopePhoto (Австрия) при увеличении ×1000. В каждой повторности оценивали не менее 40 малых квадратов камеры Горяева, чтобы на каждую повторность приходилось не менее 1000 клеток. Клетки, окрашенные в синий цвет, считали мертвыми, неокрашенные клетки – живыми.
Дыхательная активность клеток. Потребление кислорода клетками измеряли полярографически in vitro при 25°С в ячейке с электродами, закрытыми фторопластовой пленкой, с постоянной разностью потенциалов 660 мВ. Среда инкубации клеток содержала 50 мМ К-фосфатный буфер (pH 5.5) и 1% глюкозы. Последующий анализ дыхательной активности проводили на многоканальной микроэлектродной установке с системой сбора информации и программой Record-4,, как описано ранее [28].
Получение клеточных гомогенатов. Клетки дрожжей отделяли от культуральной жидкости центрифугированием, дважды промывали охлажденной водой, суспендировали в соотношении 1 : 1 (г/мл) в среде следующего состава: 2-(N-морфолино)этансульфоновая кислота – 10 мМ, сорбит – 0.5 М, маннит – 0.5 М, ЭДТА – 5 мМ, фенил-метил сульфонил фторид – 0.5 мМ, pH 6.5. Клетки дрожжей разрушали на ультразвуковом дезинтеграторе (MSE, “Farmacia”, Швеция) в течение 2 мин (4 цикла по 30 с, 30 с перерыв) при 4–0°С. Полученный гомогенат центрифугировали при 20 000 g 30 мин. Для исследований использовали супернатант.
Определение активности СОД. Активность СОД определяли непрямым методом, измеряя ингибирование автоокисления кверцетина [29]. Кверцетин автоокисляется в щелочных условиях (pH 10.0) с выделением O2 в качестве побочного продукта реакции и разрушением хромофора с максимум поглощения при 406 нм. Исследование проводили в 20 мМ К-фосфатном буфере, содержащем 0.1 мМ ЭДТА, pH 7.8, добавляли тетраметилэтилендиамид до pH 10.0–10.2. Затем к реакционной смеси добавляли 10 мкл супернатанта, разведенного 1 : 10 или при высокой активности 1 : 100. Реакцию запускали добавлением кверцетина (0.36 мМ). За единицу ферментативной активности СОД принимали ингибирование на 50% автоокисления кверцетина.
Определение каталазной активности. Суммарную активность каталазы определяли по скорости расщепления пероксида водорода и выражали в микромолях расщепленного Н2О2 в мин на 1 мг белка [27].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
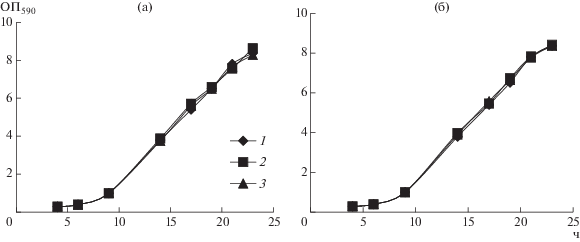
На первом этапе работы было проведено исследование влияния ресвератрола и ДГК в концентрациях 30 и 300 мкМ на рост культуры Y. lipolytica при оптимальной температуре (рис. 1). Из представленных кривых видно, что внесение полифенолов в середине логарифмической фазы (15 ч культивирования) роста культуры Y. lipolytica не оказывало значительного влияния на динамику роста. Культивирование дрожжей при повышенной температуре вызывало некоторое замедление роста и увеличение продолжительности логарифмической фазы до 17 ч (рис. 2), однако, внесение полифенолов также не оказывало существенного действия на рост культуры.
Рис. 1.
Динамика роста дрожжей Y. lipolytica W29 при 30°С в присутствии 30 и 300 мкМ ресвератрола (а) и ДГК (б). 1 – контроль; 2 – ресвератрол 30 мкМ (а), ДГК 30 мкМ (б); 3 – ресвератрол 300 мкМ (а), ДГК 300 мкМ (б).
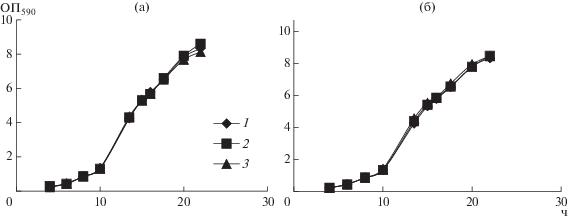
Рис. 2.
Динамика роста дрожжей Y. lipolytica W29 при 38°С с добавлением в среду 30 и 300 мкМ ресвератрола (а) и ДГК (б). 1 – контроль; 2 – ресвератрол 30 мкМ (а), ДГК 30 мкМ (б); 3 – ресвератрол 300 мкМ (а), ДГК 300 мкМ (б).
В дальнейшем исследовали влияние ресвератрола и ДГК (30 и 300 мкМ) на выживаемость дрожжей Y. lipolytica W29 (табл. 1). Ресвератрол в концентрации 300 мкМ уменьшал выживаемость клеток на 60 и 30% (табл. 1) при оптимальной и повышенной температурах соответственно. При добавлении 30 мкМ ресвератрола и 32°С наблюдалось даже небольшое увеличение выживаемости (примерно на 5%) по сравнению с контролем. ДГК в концентрации 300 мкМ не оказывал заметного влияния на выживаемость культуры при исследуемых температурах, в то время как при его концентрации 30 мкМ ДГК и 30°С (табл. 1) выживаемость снижалась на 25%, а при повышенной температуре значительного эффекта выявлено не было.
Таблица 1.
Выживаемость (%) клеток дрожжей Y. lipolytica W29, культивируемых при различных температурах после 30 мин экспозиции с полифенолами
| Вариант | Температура культивирования | |
|---|---|---|
| 30°С | 38°С | |
| Контроль | 86.2 ± 12.7 | 95.9 ± 2.5 |
| Ресвератрол 30 мкМ | 86.0 ± 15.7 | 89.0 ± 3.9 |
| Ресвератрол 300 мкМ | 31.0 ± 4.2 | 58.8 ± 9.8 |
| ДГК 30 мкМ | 62.1 ± 11.3 | 95.6 ± 9.1 |
| ДГК 300 мкМ | 79.7 ± 10.7 | 99.3 ± 6.0 |
Дрожжевые клетки характеризуются эффективно функционирующей антиоксидантной защитой, первая линия которой включает проявление активности каталазы и супероксиддисмутазы (СОД). Супероксидный анион-радикал является предшественником большинства АФК и медиатором цепи окислительных реакций. Дисмутацию этого свободного радикала катализируют СОД, продуцирующие Н2O2, который, в свою очередь, восстанавливается до Н2O рядом каталаз и пероксидаз. Исследование активности СОД показало, что добавление ресвератрола в среду к дрожжевым клеткам, культивируемым при оптимальной температуре, приводило к увеличению активности фермента по сравнению с контрольными образцами. При концентрации 30 мкМ наблюдался более выраженный эффект – увеличение активности СОД в 2 раза (табл. 2). Влияние ДГК в этих условиях характеризовалось 1.5- и 2-кратным уменьшением активности СОД при 30 и 300 мкМ полифенола соответственно (табл. 2). Увеличение температуры культивирования не оказывало существенного эффекта на активность СОД в контрольных условиях (табл. 2), при внесении ресвератрола 30 мкМ активность фермента увеличивалась на 50%, а при внесении ДГК снижалась вдвое (табл. 2), При этом ДГК в концентрации 300 мкМ при повышенной температуре увеличивал активность СОД на 30% (табл. 2). Активность каталазы также увеличивалась примерно на 46% под действием полифенолов при исследованных концентрациях и температурах (не показано).
Таблица 2.
Активность СОД (ед./мг белка клеточного экстракта) в экстрактах клеток Y. lipolytica W29, выращенных при различных температурах после 30 мин экспозиции с полифенолами
| Вариант | Температура культивирования | |
|---|---|---|
| 30°С | 38°С | |
| Контроль | 790.7 ± 80.1 | 885.3 ± 148.0 |
| Ресвератрол 30 мкМ | 1732.2 ± 259.8 | 1285.7 ± 90.7 |
| Ресвератрол 300 мкМ | 914.5 ± 155.4 | 1005.3 ± 31.5 |
| ДГК 30 мкМ | 555.6 ± 72.2 | 463.1 ± 92.5 |
| ДГК 300 мкМ | 388.7 ± 36.7 | 1164.0 ± 186.1 |
Изменение дыхательной активности является основным показателем энергетического статуса клетки. Известно, что в митохондриях большого числа видов растений, грибов и дрожжей имеет место альтернативный путь переноса электронов, который индуцируется в присутствии ингибиторов основного (цитохромного) пути – KCN, азида, антимицина А [30]. Переключение электронного потока происходит на уровне восстановленного убихинона и специфически ингибируется производными бензгидроксамовой кислоты. Принято считать, что альтернативная оксидаза содержится в митохондриях грибов и дрожжей в нормальных условиях, но в неактивном состоянии [30]. Активация этого фермента происходит под действием мононуклеотидов (АМФ, ГМФ). У различных организмов существует целая система регуляции экспрессии альтернативной оксидазы, как считают, через общий сигнал, включающий накопление АФК (в частности, супероксидного анион-радикала и пероксида водорода), влияние ряда кислот (цитрат, ацетат, салицилат), этанола, ц-АМФ, ионов Са2+ [30].
Поскольку полифенольные компоненты действуют на функции клеточных мембран и антиоксидантный статус клеток, важно было оценить их влияние на дыхательную активность и индукцию альтернативной оксидазы дрожжей. Анализ дыхательной активности и индукции альтернативной оксидазы в митохондриях дрожжей Y. lipolytica продемонстрировал, что в условиях температурного стресса скорость поглощения кислорода клетками дрожжей уменьшалась более чем на 38%, в то время как активность цианид-резистентного пути уменьшалась на 10% по отношению к оптимальным условиям (табл. 3). В оптимальных условиях культивирования и добавлении ресвератрола (30 мкМ) увеличивалась скорость дыхания клеток дрожжей на 37%, тогда как при большей концентрации 300 мкМ на 20% по сравнению с контролем (табл. 3). Внесение ресвератрола в концентрации и 30 и 300 мкМ стимулировало активацию цианид-резистентного пути переноса электронов (табл. 3). ДГК увеличивал скорость поглощения кислорода более, чем в 2.0 и 1.5 раза при 30 и 300 мкМ соответственно. Вклад альтернативной оксидазы в общее дыхание клеток в его присутствии несколько сокращался (табл. 3). При 38°С наблюдали стимуляцию скорости дыхания в 1.4 и 1.2 раза при добавлении 30 мкМ ресвератрола и ДГК соответственно, концентрация 300 мкМ либо не оказывала значительного эффекта, как при внесении ресвератрола, либо оказывали даже некоторое ингибирующее действие в случае ДГК (табл. 3).
Таблица 3.
Дыхательная активность клеток Y. lipolytica штамм W29
| Температура культивирования |
Вариант | V0, нг-атом О мин–1 г сухих клеток–1 | VKCN, нг-атом О мин–1 г сухих клеток–1 | Ингибирование KCN, % |
|---|---|---|---|---|
| 30°С | Контроль | 21.4 ± 5.2 | 5.0 ± 3.6 | 77.9 ± 5.1 |
| Ресвератрол 30 мкМ | 29.3 ± 1.3 | 7.0 ± 1.1 | 73.9 ± 0.7 | |
| Ресвератрол 300 мкМ | 25.8 ± 2.4 | 7.0 ± 1.0 | 72.8 ± 0.9 | |
| ДГК 30 мкМ | 43.4 ± 3.1 | 12.2 ± 1.7 | 71.8 ± 0.6 | |
| ДГК 300 мкМ | 32.5 ± 1.0 | 8.9 ± 1.2 | 70.8 ± 2.2 | |
| 38°С | Контроль | 13.2 ± 1.1 | 1.7 ± 1.4 | 87.0 ± 2.2 |
| Ресвератрол 30 мкМ | 18.3 ± 1.2 | 1.9 ± 0.9 | 88.6 ± 2.0 | |
| Ресвератрол 300 мкМ | 13.7 ± 2.2 | 1.9 ± 1.2 | 86.0 ± 2.2 | |
| ДГК 30 мкМ | 16.2 ± 0.8 | 2.1 ± 0.5 | 87.1 ± 2.5 | |
| ДГК 300 мкМ | 11.8 ± 1.9 | 0.9 ± 0.2 | 91.4 ± 2.7 |
Природные полифенолы, наряду с другими натуральными компонентами растений, являются мощными антиоксидантами. Молекулярные механизмы действия полифенолов, и в том числе, наиболее изученных их представителей, в настоящее время до конца не изучены. Исследователи сходятся во мнении, что, например, эффекты ресвератрола могут сильно варьировать и по-разному интерпретироваться в различных организмах, органах и тканях. В 2006 г. группой профессора Синклера [31] были опубликованы пионерские исследования, проведенные на дрожжах Saccharomyces cerevisiae, нематодах Caenorhabditis elegans и насекомых Drosophila melanogaster, которые достоверно показали увеличение под действием ресвератрола АМФ-активируемой протеин-киназы, кофактора PGC-la, чувствительности к инсулину на фоне уменьшения уровня инсулин- подобного ростового фактора IGF-I. Авторами было высказано предположение, что эффекты ресвератрола обусловлены активацией генов семейства сиртуинов, в частности, сиртуина – 2 (SIR-2), индуцирующего увеличение количества рибосом в клетке, отвечающих за синтез белка и митохондрий. При исследовании trans-ресвератрола было клинически подтверждено активирующее действие последнего на экспрессию гена SIRT1, что обусловливает образование его продуктов – деацетилаз гистоновых белков.
В последние годы появилась новая гипотеза, объясняющая комплексное положительное влияние природных полифенолов, в частности эпигаллокатехина галлата, гастродина, гингерола, лютеолина, ресвератрола, теафлавина и ряда других, на самые разные аспекты клеточной физиологии. Было высказано предположение, что растительные флавоноиды и стильбены могут модифицировать экспрессию микроРНК (microRNA) и таким образом влиять на экспрессию генов в целом, что и может потенцировать, в частности, их “общеукрепляющее” действие на здоровье человека – противовоспалительный, антиканцерогенный, кардиопротекторный и противоаутоиммуный эффекты [32, 33].
Альтернативная точка зрения была высказана российскими учеными, продемонстрировавшими, что действие ресвератрола в различных концентрациях оказывало стабилизирующий эффект на конформацию жирных кислот миелинового нервного волокна, снижало уровень протекания процессов перекисного окисления липидов и общую пероксидазную активность в экспериментах на крысах [34]. Было также установлено, что за счет полярных групп ресвератрол может взаимодействовать с заряженными группировками фосфолипидов на поверхности мембраны, однако большая его часть, более 90%, проникает в пространство бислоя и взаимодействует с неполярными ацильными цепями. Положительное влияние ресвератрола может быть опосредовано через его воздействие на обмен липидов в мембранах.
Защитное действие ДГК на редокс-статус клетки связывают с его антиоксидантными свойствами, не уступающими известному антиоксиданту α-токоферолу и проявляющимися в ингибировании продукции супероксидного анион-радикала, блокировании перекисного окисления липидов в митохондриях и активации НАДФН-зависимого цитохрома Р450 [18]. Уникальность его свойств связывают с особенностями химической структуры молекулы полифенола: присутствием о-дигидрокси-структуры в В-кольце, обеспечивающей стабильность молекулы; наличием 5- и 7-ОН групп с 4-оксо-функциями в А- и С-кольцах, которые отвечают за максимальный “радикал-улавливающий” потенциал [18].
В работе было обнаружено подавляющее действие высоких концентраций ресвератрола (табл. 1) на выживаемость клеток дрожжей Y. lipolytica на фоне отсутствия видимого ингибирования роста дрожжевой культуры (рис. 1) при оптимальной температуре роста. Ранее было показано уменьшение продолжительности жизни дрожжей S. cerevisiae на фоне митохондриальной дисфункции, вызванной ресвератролом (100 мкМ), а также падение выживаемости этой культуры при добавлении ресвератрола (100 мкМ) на фоне лимитации источника углерода глюкозы до 0.1% [35, 36]. В то же время, другими авторами выявлено увеличение продолжительности жизни S. cerevisiae на 70% при этой же концентрации ресвератрола [37].
На дрожжевых линиях Schizosaccharomyces ротbе 972 h– был показан дозозависимый эффект ресвератрола (100–900 мкМ) на ингибирование скорости роста и клеточного деления, а также индукции генов ответа на внешние стрессы [38]. Принимая во внимание найденное в работе возрастание активности СОД (табл. 2) и каталазы (не показано) при внесении ресвератрола, можно предположить, что в дрожжах Y. lipolytica также происходит обусловленная полифенолом индукция генов антистрессовой защиты. При этом индукция активности СОД осуществляется при действии низких (30 мкМ) концентраций ресвератрола, в то время как каталаза индуцируется как при низких, так и при высоких его уровнях. Аналогичные эффекты ресвератрола на активность СОД были получены у промышленного штамма Saccharomyces pastorianus в работе [39].
При исследовании эффектов ДГК стимуляции активности СОД отмечено не было (табл. 2), исключением является действие высоких концентраций полифенола при 38°С. Принимая во внимание доказанное в ряде исследований непосредственное воздействие ДГК на АФК в условиях клеточного гиперокисления, вызванного температурным воздействием, можно предположить, что при повышенных концентрациях ДГК оказывал эффект на кислородные радикалы. Этим можно объяснить уменьшение активности СОД при оптимальной температуре в присутствии ДГК.
Эффекты ресвератрола и ДГК на дыхание дрожжей Y. lipolytica практически не изучены. В работе показано умеренное стимулирующее действие ресвератрола и ДГК на скорость поглощения кислорода клетками дрожжей (табл. 3). Ранее было выявлено [35, 36] двукратное увеличение скорости дыхания клеток дрожжей S. cerevisiae, культивируемых на 5%-ной глюкозе, при внесении 1.0 мМ ресвератрола. В присутствии ресвератрола происходила незначительная, но достоверная активация альтернативной оксидазы (табл. 3), что может свидетельствовать о его прооксидантном действии [40]. На это указывает также активация антиоксидантных ферментов (СОД и каталазы). В работе [41 ] на патогенном штамме Candida albicans было продемонстрировано активное участие ресвератрола в апоптозе, индуцируемом генерацией гидроксильных радикалов, утечкой митохондриального мембранного потенциала и активацией метакаспаз, приводящих в совокупности к высвобождению цитохрома с. Принимая во внимание определенное систематическое сходство Y. lipolytica с патогенным штаммом С. albicans, а именно, способность к диморфному переходу и образованию мицелиальных и псевдомицелиальных форм, можно рассматривать этот объект в качестве тест-системы для скрининга потенциальных антимикотических препаратов природного происхождения, в том числе на основе природных фенольных соединений.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках Соглашения № 14.616.21.0083 от 17 июля 2017 г. Уникальный идентификатор соглашения RFMEFI61617X0083.
Список литературы
Simioni C., Zauli G., Martelli A.M., Vitale M., Sacchetti G., Gonelli A., Neri L.M. // Oncotarget. 2018. V. 30. № 9. P. 17181–17198.
Perez-Vizcaino F., Fraga C.G. // Arch. Biochem. Biophys. 2018. V. 646. P. 107–112.
Akinwumi B.C., Bordun K.M., Anderson H.D. // Int. J. Mol. Sci. 2018. V. 19. № 3. pii: E792.
Tsai H.-Y., Ho C.-T., Chen Y.-K. // J. Food Drug, Analysis. 2017. V. 25. № 1. P. 134–141.
Truong V.L., Jun M., Jeong W.S. // Biofactors. 2018. V. 44. № 1. P. 36–49.
Теплова В.В., Исакова Е.П., Кляйн О.И., Дергачева Д.И., Гесслер Н.Н., Дерябина Ю.И. // Прикл. биохимия и микробиология. 2018. Т. 54. № 3. С. 215–235.
Rimando A.M., Kalt W., Magee J.B., Dewey J., Ballington J.R. // J. Agric. Food Chem. 2004. V. 52. № 15. P. 4713–4719.
Renaud S., de Lorgeril M. // Lancet. 1992. V. 20. № 339(8808). P. 1523–1526.
Zhang Q., Bian Y., Shi Y., Zheng S., Gu X, Zhang D. et al. // Food Chem. 2015. V. 179. № l. P. 15–25.
Pereira T.M.C. Fabio Silva Pimenta F.S.P., Marcella Lima Porto M.L.P., Baldo M.P., Campagnaro B.P., Gava A.L. et al. // Int. J.Mol. Sci. 2016. V. 17. № 8e. 1273. doi 10.3390/ijmsl7081273
Caruana M., Cauchi R., Vassallo N. // Front Nutr. 2016. V. 3. e 31. doi 10.33 89/fnut.2016.00031
Frombaum M., Le Clanche S., Bonnefont-Rousselot D., Borderie D. // Biochimie. 2012. V. 94. № 2. P. 269–276.
Chan M.M. // Biochem. Pharmacol. 2002. V. 63. № 2. P. 99–104.
Wang W.B., Lai H.C, Hsueh P.R., Chiou R.Y., Lin S.B., Liaw S.J. // J. Med. Microbiol. 2006. V. 55. № 10. P. 1313–1321.
Mahady G.B., Pendland S.L. // Am. J. Gasteroenterol. 2000. № 95. P. 1849. 10.111 l/j.l572-0241.2000.02146.x
Mahady G.B., Pendland S.L., Chadwick L.R. // Am. J. Gastroenterol. 2003. № 98. P. 1440–1441. doi 10.1111/j.1572-0241.2003.07513.x
Bertelli A.A., Ferrara F., Diana G., Fulgenzi A., Corsi M., Ponti W. et al. // Int. J. Tissue React. 1999. V. 21. № 4. P. 93–104.
Weidmann A.E. // Eur. J. Pharmacol. 2012. V. 684. № 1–3. P. 19–22.
Akinmoladun A.C., Oladejo C.O., Josiah S.S., Famusiwa C.D., Ojo O.B., Olaleye M.T. // Pathophysiology. 2018. pii: S0928–4680(18)30063-4.
Chen J., Sun X, Xia T., Mao Q., Zhong L. // Food Funct. 2018. V. 9. № 4. P. 2341–2352.
Korystova A.F., Kublik L.N., Kim Y.A., Levitman M.K., Shaposhnikova V.V., Korystov Y.N. // Bull. Exp. Biol. Med. 2018. V. 165. № 3. P. 360–363. doi 10.1007/sl0517-018-4170-2
Haque M.W., Bose P., Siddique M.U.M., Sunita P., Lapenna A., Pattanayak S.P. // Biomed. Pharmacother. 2018. V. 105. P. 27–36.
Zhao Y., Huang W., Wang J., Chen Y., Huang W., Zhu Y. // Am. J. Transl. Res. 2018. V. 10. № 4. P. 1205–1210.
Галочкина A.B., Зарубаев B.B., Киселев О.И, Бабкин В.А., Остроухова Л.А. // Вопросы вирусологии. 2016. Т. 61. № 1. С. 27–31.
Wang H.Q., Meng S., Li Z.R., Peng Z.G., Han Y.X., Guo S.S. et al. // J. Asian Nat. Prod. Res. 2013. V. 15. № 4. P. 382–389.
Mishra S., Singh S., Misra K. // Mycopathologia. 2017. V. 182. № 11–12. P. 953–965.
Секова В.Ю., Гесслер H.H., Исакова E.П., Антипов А.Н., Дергачева Д.И., Дерябина Ю.И. и дp. // Прикл. биохимия и микробиология. 2015. Т. 51. № 6. С. 570–577.
Deryabina Y., Isakova E., Antipov A., Saris H.E. // J. Bioenerg. Biomembr. 2013. V. 45. № 5. P. 491–504.
Костюк В.А., Потапович А.И., Ковалева Ж.В. // Вопросы мед. химии. 1990. Т. 36. № 2. С. 88–91.
Medentsev A.G., Arinbasarova A.Y., Akimenko V.K. // Biochemistry (Moscow). 1999. V. 64. № 11. P. 1230–1243.
Baur J.A., Pearson K.J., Price N.L., Jamieson H.A., Lerin C., Kalra A. et al. // Nature. 2006. V. 444(7117). P. 337–342.
Tili E., Michaille J.J. // Molecules. 2016. V. 21. № 9. pii: E1263.
Gavrilas L.I., Ionescu C., Tudoran O., Lisencu C., Balacescu O., Miere D. // Nutrients. 2016. V. 8. № 10. pii: E590.
Пиняев С.И., Мельникова К.A. // Вестник ВГУ, Сер.: Химия. Биология. Фармация. 2016. № 2. С. 78–85.
Ramos-Gomez M., Olivares-Marin I.K., Canizal-Garcia M., Gonzalez- Hernandez J.C., Nava G.M., Madrigal-Perez L.A. // J. Bioenerg. Biomembr. 2017. V. 49. № 3. P. 241–251.
Madrigal-Perez L.A., Canizal-Garcia M., Gonzalez-Herndndez J.C., Reynoso-Camacho R., Nava G.M., Ramos-Gomez M. // Yeast. 2016. V. 33. № 6. P. 227–234.
Howitz K.T., Bitterman K.J., Cohen H.Y., Lamming D. W., Lavu S., Wood J.G. et al. // Nature. 2003. V. 425. № 6954. P. 191–196.
Wang Z., Gu Z., Shen Y., Wang Y., Li J., Lu H. et al. // PLoS One. 2016. V. 11. № 3. e0150156.
Gharwalova L., Sigler K., Dolezalova J., Masak J., Rezanka T., Kolouchova I. // World J. Microbiol. Biotechnol. 2017. V. 33. № 11. P. 205.
Alarcon de la Lastra C.A., Villegas L. // Biochem. Soc. Trans. 2007. V. 35 (Pt 5). P. 1156-60.
Lee J., Lee D.G. // Curr. Microbiol. 2015. V. 70. № 3. P. 383–389.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


